有机化学醚
青岛科技大学有机化学课件—第11章(2)醚

CH3OCH3
(二)甲醚
(二)乙醚
2
O
二苯醚
结构复杂的醚用系统命名法命名:
CH 3CH 2CH CH 3 CHOCH 3 CH 3
3-甲基-2-甲氧基戊烷 烃氧基的命名可在烃基名称之间加上“氧”字。
CH 2=CHCH 2O
烯丙氧基
3
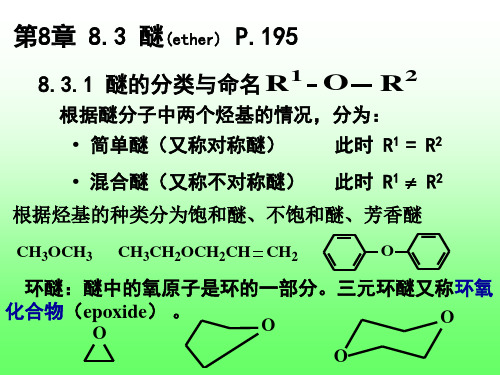
当氧原子是成环原子时,称为环氧化物。命名时 以“环氧”作词头,冠在母体烃名前面。
注:
格氏试剂与环氧化乙烷反应是制备增加两个碳的 伯醇的重要方法。
19
碱性开环是典型的SN2历程, 亲核试剂选择位阻较小 的碳原子进攻。开环方向发生在取代基较少的一端。
O CH3 CH CH2
CH3O-
OCH3CHCH2OCH3
CH3OH - CH3O-
OH CH3CHCH2OCH3
注意:不对称环氧化合物的开环方向取决于反应条件! 规律: 碱催化的开裂发生在取代基较少的一端。 (空间位阻)
酸催化的开裂发生在取代基较多的一端。( C+稳定性)
20
环氧化合物开环都是反式产物,具有典型的SN2特征。
H O
H2O
OH OH
H
从烯烃出发,用KMnO4氧化得到顺式邻二醇,
而经环氧化后再水解得到的是反式邻二醇。
21
11.8 醚的制备
1、威廉森合成法——卤烷与醇金属作用
RX + R`ONa ROR`
OH
OH2
+
H+
-H2O
+
+
H
-H+
26
作业: P255 11-5、 11-6、11-9、11-12 (4)、
有机化学第九章醚

四氢呋喃 tetrahydrofuran
四氢吡喃 tetrahydropyran
二噁烷(1,4-二氧六环) 1,4-dioxane
1,2-环氧丙烷(氧化丙烯) 1,2-epoxypropane
四氢吡喃的 椅式构象
有机化学 (第9版)
一、环氧化合物
(一)结构和命名
系统命名:三元环氧化合物以“氧杂环丙烷”(oxirane)为母体,四元环 氧化合物以“氧杂环丁烷”(oxetane)为母体。
第九章
醚
第一节 醚 第二节 环醚
重点难点
掌握 掌握醚的命名、结构和化学性质;掌握环氧化合物 的命名、结构和化学性质
熟悉 冠醚的结构和命名
了解 冠醚的性质
第一节
醚
有机化学 (第9版)
一、结构和命名
1.醚的结构
甲醚分子的结构
醚键中的氧原子为sp3杂化,其中两个sp3杂化轨道分别与两个烃基碳原子 形成σ键,键角约112°,未成键的两个sp3杂化轨道含两对孤对电子。
有机化学 (第9版)
二、冠醚
含有多个氧原子的大环多醚。通常分子中具有—OCH2CH2—重复单元。立体结构 状似王冠,故称冠醚。冠醚命名时称“m-冠-n”,m代表构成环的碳原子和氧原 子的总数,n代表环中氧原子数。 冠醚的结构特点是随环的大小不同而与不同金属离子形成络合物,从而可以选择
性地识别金属离子。如18-冠-6的空穴直径和K+的直径相近,所以它能与K+离子
(二)开环反应
1. 酸催化开环反应 酸性条件下为具有SN1性质的SN2反应,亲核试剂进攻取代基较多的环碳原 子,这个碳由于取代基的供电效应使正电荷分散而稳定。
更稳定
有机化学 (第9版)
一、环氧化合物
有机化学第8章第三节醚2013
二巯基丙醇(BAL)
CH2 CH CH2 SH SH SO3Na
二巯基丙磺酸钠
HS HC CO2Na HS HC CO2Na
二巯基丁二酸钠
上述解毒剂与金属离子的亲和力较强,它们不仅能 与进入体内的重金属离子结合成不易解离的无毒配合物 由尿排出体外,以保护酶系统,而且还能夺取已经与酶 结合的重金属离子,使酶的活性恢复,从而达到解毒的 目的。但若酶的巯基与重金属离子结合过久,酶的活性 则难以恢复,故重金属中毒需尽早用药抢救。
第8章 8.3 醚(ether) P.195
1 O R 8.3.1 醚的分类与命名
R2
根据醚分子中两个烃基的情况,分为:
• 简单醚(又称对称醚) 此时 R1 = R2
• 混合醚(又称不对称醚)
此时 R1 R2
根据烃基的种类分为饱和醚、不饱和醚、芳香醚
CH3OCH3 CH3CH2OCH2CH CH2 O
CH3CH2OCH2CH3 + O2
CH3CHOCH2CH3 O OH
形成的过氧化物遇热容易爆炸,所以储存时间长的醚在 使用前必须进行检查,若会使湿的KI-淀粉试纸变蓝或使 FeSO4-KCNS 混合液变红,则表明醚中含有过氧化物。 加铁粉或用FeSO4水溶液洗涤,可破坏其中的过氧化物。
8.3.3 醚的制备
1)酸性
RSH + NaOH
RSNa + H2O
C2H5SH > H2O >C2H5OH pKa 10.5 15.7 15.9
2).与重金属作用
与无机硫化物类似,硫醇可与 Pb、 Hg 、Cd、 Ag 、Cu 等重金属盐或氧化物作用生成不溶于水 的硫醇盐。
有机化学中的醚和过氧化物的反应

有机化学中的醚和过氧化物的反应醚是一类重要的有机化合物,其分子结构中含有一个或多个氧原子与两个有机基团连接。
醚的制备与反应在有机合成中扮演着重要的角色。
过氧化物则是一类化合物,其中的氧原子与氢原子连接,该类化合物具有较高的活性,常用于有机反应中的氧化反应。
本文将重点探讨有机化学中醚和过氧化物的反应及其应用。
一、醚的制备方法1. 醇脱水反应醇脱水反应是制备醚的常用方法。
通常将醇与酸催化剂加热,在一定条件下发生醇脱水反应,生成醚。
例如,乙醇与浓硫酸反应可制备乙醚。
2. 烷基卤化物与醇的傅-克反应烷基卤化物与醇进行傅-克反应也可制备醚。
该反应中,烷基卤化物与醇反应,通过傅-克反应生成醚。
例如,甲基溴与乙醇反应可制备乙醚。
二、醚的反应1. 醚的水解反应在酸性或碱性条件下,醚可以发生水解反应。
酸性条件下,醚会被酸催化分解成相应的醇;碱性条件下,醚会被强碱水解成相应的醇盐。
水解反应是醚分解的常见反应之一。
2. 醚的氧化反应醚在一定条件下可与氧气或强氧化剂发生氧化反应。
例如,过氧化氢(H2O2)可将醚氧化为相应的醛或酮。
在氧气存在下,醚也可在高温条件下氧化为醛或酮。
三、过氧化物的反应过氧化物是一类常用的氧化剂,具有较高的氧化能力。
在有机化学中,过氧化物常用于氧化反应和自由基反应等。
1. 过氧化物的氧化反应过氧化物可以氧化醇、醛、酮等有机化合物。
例如,过氧化氢(H2O2)可将醇氧化为相应的醛或酮。
2. 过氧化物的自由基反应过氧化物中的氧-氧键具有较弱的键能,容易发生断裂形成有机自由基。
这些自由基可参与各种自由基反应,如氧化反应、加成反应等。
过氧化物的自由基反应是一类重要的有机反应。
四、醚和过氧化物反应的应用醚和过氧化物的反应具有广泛的应用价值。
其中,过氧化物在工业上常被用作氧化剂,可用于有机合成中的氧化反应,如醇的氧化成醛或酮。
此外,醚的制备方法和反应特性也被广泛应用于药物合成、材料科学等领域。
总结:有机化学中的醚和过氧化物的反应包括醚的制备方法和醚、过氧化物的反应。
有机化学基础知识点整理醚的合成与反应

引言:有机化学是化学科学中的一个重要分支,研究有机物的结构、性质、合成和反应等方面。
有机化学基础知识是学习有机化学的基石,掌握基础知识对于深入理解有机化学的理论和实践具有重要意义。
本文将整理醚的合成与反应这一有机化学的基础知识点,通过5个大点和每个大点下的59个小点进行详细的阐述,旨在帮助读者全面了解和掌握醚的合成与反应的关键概念和实验操作。
概述:醚是一类重要的有机化合物,具有醚基(COC)结构,由于其独特的结构和性质,在有机合成、医药化学等领域具有广泛的应用。
醚的合成与反应是有机化学中的基础知识点之一,主要包括醚的合成方法、醚的物理性质、醚的化学性质以及醚的应用等方面。
下面将从这几个方面进行详细的阐述。
合成方法:1.醚的烷基化方法a.醇与酸催化剂反应:醇与酸催化剂反应能够实现醇的脱水,醚。
b.醇与卤代烷反应:醇与卤代烷反应能够发生亲核取代反应,醚。
c.醇与烃氧化物反应:醇与烃氧化物反应能够实现醇的脱水,醚。
2.醚的混合醚化方法a.醇与醚酸催化剂反应:醇与醚酸催化剂反应能够实现醇的脱水,醚。
b.醇与醚碱催化剂反应:醇与醚碱催化剂反应能够实现醇的脱水,醚。
3.醚的缩合反应a.醛、酮与醇缩合反应:醛、酮与醇缩合反应能够实现醛、酮的加成,醚。
b.酯与醇缩合反应:酯与醇缩合反应能够发生酯的酸解水解,醚。
物理性质:1.熔点和沸点:醚的熔点和沸点相对较低,与分子量和分子结构有关。
2.溶解性:醚具有较好的溶解性,尤其是与非极性溶剂的溶解性较好。
3.极性:醚具有一定的极性,但与醇和酮相比,极性较小。
化学性质:1.醚的酸碱性:醚是非常弱的碱,容易被强酸质子化。
2.醚的氧化性:醚的氧化性较弱,一般不容易被氧化剂氧化,但可以被氢氧化钠等强碱氧化成相应的醇。
3.醚的还原性:醚的还原性较弱,一般不容易被还原剂还原。
4.醚的裂解反应:醚可以通过酸性条件或高温条件发生裂解反应,醛、酮等。
应用:1.醚作为溶剂:由于醚具有较好的溶解性,可以作为有机合成中的溶剂使用。
【有机化学】第十一章 醚【配套胡宏纹教材】

O + H2O
H+
HOCH2CH2OH O
HOCH2CH2OCH2CH2OH
H+
一缩二乙二醇 (二甘醇)
H+ O + CH3OH or OH-
CH2CH2OCH3 OH
O H+
HOCH2CH2OCH2CH2OCH3
乙二醇单烷基醚
二聚乙二醇单烷基醚
n-C12H25OH + n O
OHn-C12H25O(CH2CH2O)nH
O
O
O
O
O
O
18-冠-6环中氧原Fra bibliotek数环的总原子数目
冠醚中心是一个空穴,可对某些金属离子进行络合。用作相转移催化剂(加速 水-油两相体系的化学反应)。
4. 环氧乙烷的制备
a, 直接氧化法:
CH2 CH2
O2 / Ag
220-280 oC
O
b, 氯乙醇法
CH2 CH2 + Cl2 + H2O HOCl
CH2CH2 Ca(OH)2
OH Cl
O
5、冠醚
模型的形状与王冠相似,故得名。
大环多元醚(含≥3个-OCH2CH2-重复单元),是乙二醇的环状聚合物。
2. 环氧乙烷的开环反应
O H2C CH2
NaOH HO H2C CH2 OH H2O HX HO H2C CH2 Cl
B-:OH-,RO-,NH3
RMgX
H2O
RCH2CH2 O MgX H+
RCH2CH2OH
特点:1)能形成含有两个官能团的化合物; 2)和RMgX反应,制备比RMgX多2个碳的伯醇
H2C CH2 H2C CH2 H2C CH2
有机化学基础知识点整理醚与酚的反应机制

有机化学基础知识点整理醚与酚的反应机制醚与酚的反应机制是有机化学中基础的知识点之一。
在本文中,我们将对醚与酚的基本概念进行介绍,并详细探讨它们的反应机制。
一、醚的基本概念醚是一类功能团R-O-R',其中R和R'可以是不同的有机基团。
醚可以由醇和酸催化剂反应生成,也可以由烷基卤化物和醇反应得到。
醚可以分为对称醚和非对称醚两种类型。
对称醚是指两个有机基团相同的醚,而非对称醚则是指两个有机基团不同的醚。
二、醚的反应机制1. 醚的生成反应:醚的生成反应通常是由醇与酸催化剂反应得到。
在反应中,酸催化剂起到了催化剂的作用,可以提高反应速率。
醇分子中的羟基与酸催化剂中的H+离子发生质子化反应,形成醠离子。
随后,醠离子与其他醇分子发生核酸的SN2取代反应,生成醚。
2. 醚的水解反应:醚可以通过与水反应发生水解反应。
水解反应是一个亲核取代反应,它涉及到酸性条件下的醚的断裂和水的加入。
在水解反应中,醚分子中的氧原子发生亲核进攻,将水分子的氢原子替换掉,形成相应的醇。
3. 醚的氧化反应:醚可以通过氧化反应转变为醛或酮。
这种氧化反应需要氧化剂的存在,常用的氧化剂有过氧化氢(H2O2)和过氧化苯甲酸(m-CPBA)等。
在反应过程中,醚分子中的一个碳原子氧化为羰基,形成醛或酮。
三、酚的基本概念酚是一类含有羟基(-OH)的有机化合物。
它具有芳香性和亲电性,并且可以通过氧化反应转变为醛、酮或羧酸等功能团。
四、酚的反应机制1. 酚的取代反应:酚可以通过芳香性的亲电取代反应发生取代反应。
在这类反应中,酚分子中的羟基发生亲电进攻,取代掉一个氯原子、溴原子或甲基等官能团。
2. 酚的氧化反应:由于酚分子中含有羟基,它可以被氧化剂氧化为醛、酮或羧酸。
常用的氧化剂包括酸性高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
在氧化反应中,羟基被氧化成羰基或羧基。
3. 酚的酰化反应:酚可以与酰化试剂反应,形成酯。
在反应中,酚分子中的羟基发生亲电进攻,与酰化试剂中的羰基形成酯键。
有机化学中的醇和醚

有机化学中的醇和醚醇和醚是有机化合物中常见的两类化合物,它们在化学性质和应用领域上具有一定的相似性和差别。
本文将对有机化学中的醇和醚进行详细的介绍和分析。
一、醇的概念和性质1.概念:醇是由一个或多个羟基(OH)取代碳原子而形成的有机化合物,通式一般为ROH,其中R代表烷基或芳基。
2.性质:醇具有以下几个特点:(1)醇分子中的羟基具有极性,导致醇具有较高的沸点、溶解度和比热容,同时也使醇能够与水分子形成氢键。
(2)醇可以和酸反应,形成醚、酯等化合物,这是醇的一个重要反应。
(3)醇可以进行氧化反应,形成醛、酮等化合物,这是醇的另一个重要反应。
二、醇的命名和分类1.命名:醇的命名遵循系统命名法,以确定主链和羟基的位置、取代基和官能团等因素,例如乙醇、异丙醇等。
2.分类:醇可以根据羟基所连接的碳原子个数进行分类,分为一元醇、二元醇等。
三、醇在有机合成中的应用1.醇的还原性:由于醇分子中含有极易离去的羟基,醇具有还原性,可以被氢化剂还原为饱和烃。
这一性质使得醇成为重要的还原试剂,在有机合成中用于还原醛、酮等化合物。
2.醇的亲核性:醇分子中的羟基具有较强的亲核性,可以与酰卤、烯烃等电子不足的化合物发生亲核取代反应,形成醚、酯等化合物。
这一反应在有机合成中十分常见。
3.醇的氧化性:醇可以通过氧化反应被氧化剂氧化为醛、酮等化合物,这一反应常用于有机合成中的氧化反应。
四、醚的概念和性质1.概念:醚是由两个有机基通过氧原子连接而成的化合物,通式一般为R-O-R'。
2.性质:醚具有以下特点:(1)醚是较稳定的化合物,具有较低的沸点和溶解度。
(2)醚分子中的氧原子不带电荷,因此醚没有和水分子形成氢键的能力。
(3)醚可以被酸催化下的水解反应,将醚分解为两个醇。
五、醚的命名和分类1.命名:醚的命名同样遵循系统命名法,以确定两个有机基的结构和官能团等因素,例如乙醚、二甲醚等。
2.分类:醚可以根据氧原子所连接的碳原子个数进行分类,分为二元醚、三元醚等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3oROH不能制得醚,而只能得到烯烃。
二、 Williamson 合成法(混醚)
RONa ArONa
+ +
R'X RX
SN2
ROR' Ar-O-R
+ +
NaX NaX
12
SN2
例:
CH3CH2CH2CH2O—Na + I—CH2CH3 CH3CH2CH2CH2OC2H5 71%
(CH3)2CHO—Na + Cl—CH2-C6H5
(CH3)2CH—O—CH2-C6H5 84%
(CH3)2SO4 ONa +
或
O—CH3
CH3—I
13
由于该反应是SN2反应,为尽量减少E2消除,卤代 烷部分尽可能避免采用仲卤代烷和叔卤代烷。例:
CH3 CH3—C—ONa + BrCH2CH3 SN2 CH3 CH3 CH3—C—O—C2H5 CH3
R R O + BF3
气态 bp:-1010C
R O + RMgX R X
R R O BF3
溶液
R R O Mg O R
R 2 R
如:格氏试剂在金属镁的表面生成,与醚形成络合物 后脱离金属镁的表面进入溶液,使得格氏试剂的制备 得以进行。
16
二、醚键断裂的反应
醚与浓的HCl、HBr、HI作用,醚键可发生断裂。 HX的反应活性:HI > HBr > HCl 醚键断裂的顺序:30烷基>20烷基>10烷基>芳烃基 1、 若两个是10烷基则发生SN2,小烃基生成碘代烷, 大烃基生成醇。若氢碘酸过量则均生成碘代烷。
OCH2CH3
间乙氧基苯酚
4
3、多元醚的命名:
多元醚是根据相应的多元醇来命名.
CH3CH2O—CH2CH2—OH
CH3O—CH2CH2—OCH3
乙二醇单乙醚
乙二醇二甲醚
石油醚不是含氧化合物醚,而是烷烃的混合物
主要是戊烷和己烷的混合物。有30号、60号
两种,沸程分别为30-60℃,60-90℃两种。
第二部分
第二节 醚的物理性质
第三节 醚的制备
醚
第一节 醚的分类、命名与结构
第四节 醚的化学性质
第五节 冠醚 第七节 环氧化合物
1
第一节
一、分类
醚的分类与命名
含有C—O—C键(叫做醚键)的化合物叫做醚。 单纯醚:氧原子连结的两个烃基相同 Ar-O-Ar R-O-R 混合醚:氧原子连结的两个烃基不相同
25
—CH3 + KMnO4/H2O
—COOH
很 慢
—CH3 + K
+
MnO4-/H2O
PTC(18-冠-6)
—COOH
很 快
相转移催化反应的特点: 1、操作简便不需要无水操作;2、条件温和: 3、反应速度快; 4、产率高。 冠醚作为相转移催化剂的缺点: 毒性大,价格高。 常用的相转移催化剂: 冠醚、季铵盐、季鏻盐以及聚乙烯醇 26
22
冠醚的结构特征:
[OCH2CH2—— ]n 结构单元数目不同环的半径不同; 1、——
2、分子中含有多个氧原子,有很强的络合性; 3、即可溶于水又可溶于有机溶剂。 由于冠醚具有这些结构特性,因而具有广泛的用途。 最典型的用途是用作萃取剂和相转移催化剂 ①、萃取剂:冠醚中氧原子上的孤对电子对阳离 [OCH2CH2—— ]n 的数 子具有很强的络合作用,改变 —— 目就可改变醚的孔穴半径,对于阳离子,半径小 者抓不牢,大者进不去。因此利用适当半径的冠 醚就可以从多种离子的混合液中有选择地将某一 种离子萃取出来。
过氧化物受热或震动会引起剧烈爆炸。因此在蒸馏 醚之前,一定要检查是否含有过氧化物。
19
R—O—O—R + KI + H2O
I2 + ROH + KOH 淀粉
蓝
Fe
2+
R—O—O—R
Fe
3+
KSCN
(血红色) Fe(SCN)3+ 6
若含有过氧化物可用硫酸亚铁溶液洗涤除去。
20
第五节 冠醚p261(自学)
醚中氧原子上的孤对电子可看作是路易斯碱,它可 以接受质子生成的物质叫 盐。
CH3CH2OCH2CH3 + 浓H2SO4 CH3CH2OCH2CH3 + -HSO4 H
盐
H2O CH3CH2OCH2CH3 + 稀H2SO4
15
由于醚是较弱的路易斯碱,所以只有与浓的强酸才 能生成 盐。该反应可用来分离、提纯醚或用以鉴 别醚。醚也可与路易斯酸形成络合物:
7
4. 波谱性质 IR: C―O 1200 ~ 1050cm-1
1H
NMR: δ 3.4 ~ 4.0
8
CH O
T /% T%
波数/cm-1
图 11.6 正丙醚的红外光谱图
9
(c) (b) (a) (CH3CH2CH2)2O
a 3.37 b 1.59 c 0.93
δ
图 11.7 正丙醚的核磁共振谱图
21
15 16 17 14 18 O 1 13 O O 2 12 11 O 10 9 O 8 7 6 O4 3 5
(对称)二苯并-18-冠-6 2,3,11,12-二苯并 —1,4,7, 10,13,16 —六氧杂环十八烷
冠醚是因其形得其名:
O O O
O O O
O O
O
O O
O
18 — 冠 — 6
CH3
b a
CH3—C—O—C2H5 CH3
CH3 CH3 CH3 CH3 = C-CH3 + HOC2H5 + NaCl
CH3—C—Cl + NaOCH2CH3
E2
叔卤代烷在醇钠作用下则发生消除反应。
14
第四节
醚的化学性质
醚的化学性质比较稳定,通常条件下与碱、稀酸、 氧化剂、还原剂不发生反应,但在一定条件下也可 进行一些反应: 一、 盐的生成p254
5
三、结构
CH3
0.142 nm 112° CH3
O
O: sp3 杂化
图11.5 乙醚分子的球棍模型
6
第二节
醚的物理性质p253
1、大多数醚为无色、易挥发、易燃烧的液体。如 在实验室里常用的溶剂乙醚 bp:34.50C,极易燃使用 时请注意安全。 2、醚分子间不能以氢键相互缔合,沸点与相应的 烷烃接近,比相应的醇、酚低的多。 3、醚分子中含有电负性较强的氧,可以与水形成 分子间的氢键,因此在水中有一定的溶解度。乙醚 在水中的溶解度与正丁醇相近~8g/100mL。 四氢呋喃和1,4-二氧六环因氧原子裸露在外面, 可以和水形成较强氢键,因而能与水无限混溶。
30
四、开环反应的立体化学
碱性开环
CH3 C2H5 O H CH3 + -OH 1. 开环 2. H2O CH3 C2H5 S HO S H CH3 OH
酸性开环
CH3 C2H5 O H H CH3 + H2O -H+ CH3 C2H5 R R OH HO H CH3
31
C2H5OH C2H5ONa OH H CH3 OC2H5 O CH3 C2H5OH H+ CH3 OH C2 H 5 O H
酸性开环:1、底物活性大,试剂活性小; 2、试剂优先进攻能形成稳定C+的环碳原子。
+C2H5OH CH3CH CH2 CH3 CH CH2 -C H O 2 5 O O- OCH3 典型的SN2反应 Na+-OC2H5 CH3CH CH2 OH OCH3
碱性开环:1、底物活性小,试剂活性大; 2、试剂优先进攻空间位阻小的环碳原子。
相转移催化剂 搅拌1.8小时
n—C8H17—CN 99%
24
对相转移催化反应的解释——Starks催化循环图:
Na CN
+ -+
Na Br
+
-
相转移催化剂
Na+ CN- + Na+ Br-
水 相 界面
Na+ CN- + R——Br
R—CN + Na+ Br-
有机相
体系中加入相转移催化剂后,它可以与阳离子形成 能进入有机相的络合物,同时以离子对的形式将阴 离子CN-引入有机相。 CN-在有机相是无溶剂化作 用的、裸露的、反应活性很大的阴离子。反应后生 成的NaBr又可进入水相,与NaCN进行阴离子交换, 生成NaCN络合离子对,使反应循环进行。
32
作业:p264
11-4,11-6(机理),11-8,11-9,11-10,1111(4),11-12(3),(4)
33
CH3OCH2CH3 + HI(1mol) SN2 CH3I + CH3CH2OH
+ I + CH3——O—CH2CH3 H
CH3CH2OH + HI
CH3CH2I + H2O
17
2、 若是30烷基和20烷基则发生SN1,30烷基生成 碘代烷,10烷基则生成醇。
CH3)3C OCH3 + HI(1mol) SN1 (CH3)3C—I + CH3OH
I- + (CH3)3C– OCH3 H
SN1
I- + (CH3)3C+ + CH3OH
3、 若是烷芳混合醚,则总是生成酚和碘代烷。
—OCH2CH3 + HI(过量) —OH + ICH2CH3
18
三、过氧化物的生成 在常温下,醚-位上的C-H可与空气中的氧自动地 发生氧化反应生成过氧化物。
