【公开课课件】《醇的性质和应用》课件
合集下载
醇的性质和应用上课ppt课件
饱和一元醇通式:
CnH2n+1OH或 CnH2n+2O
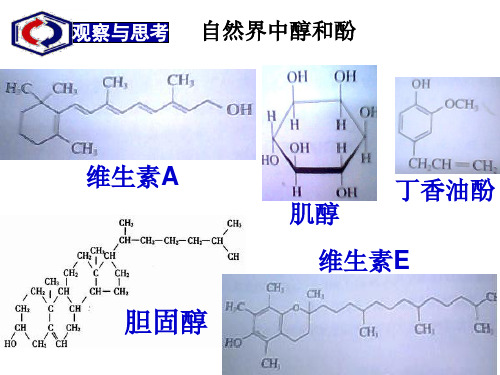
阅读教材第71页有关甲醇、乙二醇 和丙三醇的介绍,总结三种醇的 物理性质和常见用途。
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
新
知
可上网查看相 关危害新闻哦!
思考
⑴如何区分乙醇溶液和无水乙醇?
取少量酒精,加入无水硫酸铜, 若出现蓝色,则证明是工业酒精.
⑵如何实现由乙醇溶液向无水乙醇转化?
乙醇溶液 加CaO生成Ca(OH)2 无水乙醇
(96%)
蒸馏
(99.5%)
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
3CH3CH2OH+2K2Cr2O7+8H2SO4→
(橙红色)
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
(绿色)
= =
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
知识拓展
(1). 2R—CH2—OH + O2
认识乙醇与氢卤酸的反应。
1.组装如图所示装置。在试管I中依 次加入2 mL蒸馏水、4 mL浓硫酸、 2 mL 95%的乙醇和3 g 溴化钠粉末, 在试管II中注入蒸馏水,烧杯中注入 自来水。加热试管I至微沸状态数分 钟后,冷却,观察并描述实验现象。
2.在该反应中,采用蒸馏水、浓硫 酸和溴化钠固体的目的是获得与乙 醇作用的氢溴酸。根据上述实验现 象,你能判断出乙醇与氢溴酸反应 的产物吗?请设计实验证明试管II中 收集到的是卤代烃吗?
化学课件《醇的性质和应用》优秀ppt1 人教课标版

明
月
几 时 有 ?
把 酒 问 青
天
!
醇的性质和应用
1、定义
——烃分子中饱和碳原子上的H被羟 基取代而形成的化合物
1、定义
——烃分子中饱和碳原子上的H被羟 基取代而形成的化合物
2、存在及其作用
3、饱和一元醇的通式:
CnH2n+1OH 或 CnH2n+2O
乙醇俗称酒精,是人类最早制 备的有机物之一,也是大家相 当熟悉的一种醇!
2CH3CH2ONa+H2↑
回忆:
H-OH中羟基上的H比乙醇中羟基上的H活泼
钠的现象 声的现象
实验结论
钠与乙醇
沉在底部
无
Na的密度大于 乙醇。钠与乙 醇缓慢反应, 放出氢气。
钠与水
浮、熔
有“嘶嘶”声
Na的密度小于水, 熔点低。钠与水剧 烈反应,放出大量 热,生成氢气
课本
练习: 写出Mg与乙醇、钠与丙三醇反应的化学方程式
2CH3CH2OH+O2
Cu △
O 2CH3C H + 2H2O
HH
H
α C—C—H
两个H脱去与O结合成水
H O—H
***催化氧化基本原理: 脱去-OH上的H和αC上的H,形成C=O
***催化氧化基本原理: 脱去-OH上的H和αC上的H,形成C=O
下列醇能发生催化氧化吗?氧化后的产物是醛吗?
① CH3—CH2—α CH2
126.在寒冷中颤抖过的人倍觉太阳的温暖,经历过各种人生烦恼的人,才懂得生命的珍贵。――[怀特曼] 127.一般的伟人总是让身边的人感到渺小;但真正的伟人却能让身边的人认为自己很伟大。――[G.K.Chesteron]
月
几 时 有 ?
把 酒 问 青
天
!
醇的性质和应用
1、定义
——烃分子中饱和碳原子上的H被羟 基取代而形成的化合物
1、定义
——烃分子中饱和碳原子上的H被羟 基取代而形成的化合物
2、存在及其作用
3、饱和一元醇的通式:
CnH2n+1OH 或 CnH2n+2O
乙醇俗称酒精,是人类最早制 备的有机物之一,也是大家相 当熟悉的一种醇!
2CH3CH2ONa+H2↑
回忆:
H-OH中羟基上的H比乙醇中羟基上的H活泼
钠的现象 声的现象
实验结论
钠与乙醇
沉在底部
无
Na的密度大于 乙醇。钠与乙 醇缓慢反应, 放出氢气。
钠与水
浮、熔
有“嘶嘶”声
Na的密度小于水, 熔点低。钠与水剧 烈反应,放出大量 热,生成氢气
课本
练习: 写出Mg与乙醇、钠与丙三醇反应的化学方程式
2CH3CH2OH+O2
Cu △
O 2CH3C H + 2H2O
HH
H
α C—C—H
两个H脱去与O结合成水
H O—H
***催化氧化基本原理: 脱去-OH上的H和αC上的H,形成C=O
***催化氧化基本原理: 脱去-OH上的H和αC上的H,形成C=O
下列醇能发生催化氧化吗?氧化后的产物是醛吗?
① CH3—CH2—α CH2
126.在寒冷中颤抖过的人倍觉太阳的温暖,经历过各种人生烦恼的人,才懂得生命的珍贵。――[怀特曼] 127.一般的伟人总是让身边的人感到渺小;但真正的伟人却能让身边的人认为自己很伟大。――[G.K.Chesteron]
《醇的性质与应用》课件

醇中的互变异构
不含双键的单一醇分子 会出现结构互变,分子 中的氢原子可以在醇分 子的羟基之间移动,形 成不同的同分异构体。
醇的物理性质
1
溶解性
由于醇分子中含有羟基,与水分子
密度和熔点
2
之间有氢键作用,因此醇在水中非 常容易溶解。
较短的醇一般是无色液体,密度比
水轻,而较长的醇则为无色固体。
3
沸点
随着碳链长度的增加,醇的沸点也
黏度
4
逐渐升高。
由于醇分子间有氢键作用,因此醇 的黏度通常比烃类高,黏稠度也相
应增加。
醇的应用领域
消毒剂
醇常用于口腔消毒、医疗器械和生活用品消毒 等领域。
燃料和能源
乙醇是一种重要的替代燃料,可以替代剂等都是 以醇为原料制造的。
饮品工业
醇是酒精饮料的重要成分,如啤酒、葡萄酒等。
醇的生产方法
合成法
不同的醇可以通过醇醚 法、加氢还原法、合成 气法等多种方法生产。
自然法
一些天然植物和动物中 也含有少量的醇,如蜂 蜜中的甘油、水果中的 乙醇等。
蒸馏法
蒸馏是最基本的分离纯 化方法之一,可以用于 提取和纯化醇。
醇的安全使用注意事项
1 易燃易爆
醇是易燃易爆的化合物,携带、储存和使用过程中要非常小心。
是一种无色黏稠液体,在化妆品、香水、口香 糖和食品等众多领域有着广泛用途。
苯酚
是一种无色晶体,在合成树脂、染料、农药和 香料等方面有着广泛应用。
醇的化学性质
醇对酸的反应
当醇与酸反应时,醇分 子中的氢离子被酸分子 中的阴离子取代,生成 酯和水。
醇对卤素的反应
在醇的存在下,卤素可 以通过亲电取代反应与 醇发生反应,生成卤代 烷和水。
苏教版高中化学选修5《醇的性质和应用》名师课件

实验步骤:
1. 铜片弄成四周稍高,至于三脚架上, 用酒精灯持续加热; 2. 当铜片红热时,用胶头滴管滴一滴 无水乙醇,观察现象,待烧干再滴一 滴乙醇,观察现象。
2CH3CH2OH+O2
Cu △
2CH3CHO+H2O
有机化学中的氧化还原反应
氧化反应:有机物分子中加入氧原子或失去氢原子 还原反应:有机物分子中加入氢原子或失去氧原子
CH3CH2OH 氧化 CH3CHO 氧化 CH3COOH
乙醇
乙醛
乙酸
问题讨论
下列醇不能被铜催化氧化的是 ;能被催化氧
化为醛的是
。
A.CH3OH C.CH3CHCH3
OH
B. CH3CH2CH2OH D. OH
CH3CCH3
CH3
Q4:酒喝多了会醉酒,警察如何检验酒驾?
实验步骤:
往左侧的重铬酸 钾溶液中滴加 2ml无水乙醇, 振荡,再滴加 1ml稀硫酸,观 察现象。
往右侧的酸性高 锰酸钾溶液中滴 加2ml无水乙醇, 振荡,加热,观 察现象。
2K2Cr2O7 + 3C2H5OH+8H2SO4 → 2Cr2(SO4)3 +3CH3COOH +2K2SO4+11H2O (绿色)
5C2H5OH+4KMnO4+6H2SO4→5CH3COOH+4MnSO4+2K2SO4+11H2O 无色
清《中除药血大中辞毒典素》,亦对说受葛花损“的解肝酒脏醒细脾,胞治起伤修酒复发营热养烦的渴作,不用思。饮研食究,发欧现逆,吐灵酸,芝吐能血帮,助肠 人凤葛花下体中血快的”速皂。分角苷解(出gan乙),醇异脱黄氢酮类酶具和有乙氧醛化还脱原氢作酶用,,加可速以酒快精速氧分化解,人可使体乙内醇的失酒去精毒。性,
高中化学-4.2-醇的性质与应用课件-苏教版选修5

钠是否浮在液面上
浮在水面
先沉后浮
钠的形状是否变化
熔成小球
没有变化
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O= 2 NaOH +H2↑
三 、乙醇的化学性质
演示: 钠与无水酒精的反应:
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
①-③位断键
①
③
R2—C—O—H
R1
H
+ O—O
2
生成醛或酮
+ 2H2O
—C=O
R1
R2
2
Cu △
醇氧化小结 :
叔醇(连接-OH的叔碳上没有H)不能去氢氧化.
C OH,
R2
ቤተ መጻሕፍቲ ባይዱR1
R3
(3).
(2). 2 CH—OH + O2
R2
R1
Cu △
(1). 2R—CH2—OH + O2
△
乙 醛
乙 醇
2Cu + O2 2CuO 红色变为黑色
△
醇氧化机理:
练习:写出下列有机物氧化的反应方程式:
⑴. CH3CH2CH2OH ⑵. CH3CH(OH)CH2CH3 ⑶. 2-甲基-2-丙醇
H H
H H
②
②处C-O键断开
该取代反应能在碱性条件下进行吗?
问题:
问题:能不能用98%的浓硫酸?
R—OH + H—X R—X + H2O
△
浓硫酸有强氧化性和脱水性, 不仅能使Br- 离子氧化为红棕 色的Br2 ,而且还能使乙醇脱水
浮在水面
先沉后浮
钠的形状是否变化
熔成小球
没有变化
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O= 2 NaOH +H2↑
三 、乙醇的化学性质
演示: 钠与无水酒精的反应:
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
①-③位断键
①
③
R2—C—O—H
R1
H
+ O—O
2
生成醛或酮
+ 2H2O
—C=O
R1
R2
2
Cu △
醇氧化小结 :
叔醇(连接-OH的叔碳上没有H)不能去氢氧化.
C OH,
R2
ቤተ መጻሕፍቲ ባይዱR1
R3
(3).
(2). 2 CH—OH + O2
R2
R1
Cu △
(1). 2R—CH2—OH + O2
△
乙 醛
乙 醇
2Cu + O2 2CuO 红色变为黑色
△
醇氧化机理:
练习:写出下列有机物氧化的反应方程式:
⑴. CH3CH2CH2OH ⑵. CH3CH(OH)CH2CH3 ⑶. 2-甲基-2-丙醇
H H
H H
②
②处C-O键断开
该取代反应能在碱性条件下进行吗?
问题:
问题:能不能用98%的浓硫酸?
R—OH + H—X R—X + H2O
△
浓硫酸有强氧化性和脱水性, 不仅能使Br- 离子氧化为红棕 色的Br2 ,而且还能使乙醇脱水
新教材人教版高中化学选择性必修三 3.2.1 醇的性质及应用 教学课件

①根据醇分子中羟基的个数分类
一元醇
CH3OH 甲醇
(木精、木醇) 剧毒
二元醇
CH2CH2 OH OH 乙二醇
用于能源领域如汽车燃料
工业酒精有毒!
汽车用抗冻剂 汽车防冻剂
第四页,共二十一页。
三元醇 CH2CH CH2
OH OH OH 丙三醇(甘油)
乙二醇、丙三醇都是 无色、粘稠、有甜味 的液体,都易溶于水 和乙醇
(4)消去反应
实验3-2:在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3) 的混合液20mL,放入几片碎瓷片,以避免混合液在受热 时暴沸。加热混合液,使液体温度迅速升到170℃,将生成的 气体先通入氢氧化钠溶液除去杂质,再分别通入酸性髙锰酸钾 溶液和溴的四氯化碳溶液中,观察实验现象。
第十二页,共二十一页。
高温时浓硫酸会使乙醇脱水碳化形成碳单质。
4)装置中的氢氧化钠溶液的作用是什么? 因乙烯中混有的CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响乙烯 的检验,故必须用NaOH溶液先将其除去。
第十四页,共二十一页。
五. 醇的化学性质(以乙醇为例)
思考讨论
5)实验的关键是严格控制实验的温度,有哪些操作是保证控制实验温度?
第七页,共二十一页。
R
R
R
O
O
O
H
H
H
H
H
H
O
O
O
氢键
R
R
R
醇分子间形成氢键的示意图
第八页,共二十一页。
四. 醇的结构(以乙醇为例)
对比乙烷、溴乙烷、乙醇的结构式,分析乙醇的结构特点。
HH
HH
HH
H−C−C−H
H−C−C−Br
醇的性质和应用--上课41页PPT

谢谢!
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。—法而稳定的权力在使用得当时很 少遇到 抵抗。 ——塞 ·约翰 逊 2、权力会使人渐渐失去温厚善良的美 德。— —伯克
3、最大限度地行使权力总是令人反感 ;权力 不易确 定之处 始终存 在着危 险。— —塞·约翰逊 4、权力会奴化一切。——塔西佗
5、虽然权力是一头固执的熊,可是金 子可以 拉着它 的鼻子 走。— —莎士 比
高中化学苏教版选修五4-2-1 醇的性质和应用 课件(共44张PPT)

(2)注意事项 应先加 P2O5, 后加 95%乙醇溶液, 由于 P2O5 具有强烈吸水性, 产生大量白雾。
2.利用浓硫酸作催化剂 (1)实验装置
(2)注意事项 ①配制体积比为 1∶3 的乙醇与浓硫酸混合液时,要注意在烧 杯中先加入 95%乙醇,然后滴加浓硫酸,边滴加边搅拌,冷却 备用(相当于浓硫酸的稀释),浓硫酸起催化剂和脱水剂的作用。 ②加热混合液时,温度要迅速上升到并稳定于 170 ℃左右,因 为在 140 ℃时主要产物是乙醚。 ③由于反应物都是液体而无固体,所以要向烧瓶中加入碎瓷 片,以防液体受热时发生暴沸。 ④温度计的水银球要置于反应液的中央位置,因为需要测量的 是反应液的温度。
第二单元
醇
酚
第1课时 醇的性质和应用
1.写出溴乙烷在碱性条件下水解的化学方程式。 提示 H2 O CH3CH2Br+NaOH― ― → CH3CH2OH+NaBr。 △
2.通过必修模块的学习,你了解乙醇具有哪些性质? 提示 乙醇能发生催化氧化反应、能与活泼金属反应。
1.掌握乙醇的结构和性质。 2.掌握实验室由乙醇制乙烯的反应原理和实验方法。 3.了解醇类的官能团、结构特点、一般通性和几种典型醇的 用途。
(2)脱水反应 乙醇在浓硫酸的作用下加热到 170 ℃ 时,反应的化学方程式 浓硫酸 为 CH3CH2OH― ― ― ― ― →CH2==CH2↑+H2O,浓硫酸 170 ℃ 作 催化剂、脱水剂 。
(3)取代反应 ①乙醇与浓氢溴酸混合加热生成溴乙烷的化学方程式为 △ CH3CH2OH+HBr― ― →CH3CH2Br+H2O。 一般情况下,醇比较容易获得,卤代烷常用醇与 氢卤酸 反应 制得。
②酯化反应 乙醇与乙酸发生酯化反应的化学方程式为
浓硫酸作 催化剂、吸水剂 。 ③分子间脱水成醚 浓硫酸 2CH3CH2OH― ― ― ― ― →CH3CH2OCH2CH3+H2O。 140 ℃
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应现象比较
钠与水 浮 钠与乙醇 先下沉后上浮 先块状后熔成小球 先静止后游动 后来有响声 加酚酞变红色
熔
游 响 红 2Na+2H2O= 2 NaOH +H2↑
1、烷烃的C-H键上的氢原子不能被钠原子所取代; 2、乙醇和水的O-H键上的氢原子都能被钠原子所取 代,羟基决定乙醇能和钠生成H2; 3、氢原子的活泼性:烷烃<乙醇<水, H2O与钠的反应比乙醇与钠反应要剧烈得多。
C2H5OH+NaBr+H2SO4 →C2H5Br+NaHSO4+H2O
请结合课本P68[观察与思考],探究归纳以下问题:
(1)为什么实验中的硫酸不能使用98%的浓硫酸,而用蒸馏水稀释 过的浓硫酸? 提示:98%的浓硫酸具有强氧化性,而HBr有还原性,会发生副反
应生成溴单质。
(2)加入浓硫酸和溴化钠的作用是什么?试用化学方程式加以解 释。 提示:制HBr。方程式为2NaBr+H2SO4(浓) ==== Na2SO4+2HBr (3) 长导管、试管II和烧杯中的水起到了什么作用?
催化氧化
现象: 铜丝黑色又变为红色,液体产生特殊气味 练习写出下列有机物催化氧化的反应方程式 : O (乙醛的气味) Cu 2 CH3CH2CH2OH → 2CH3CH2C-H +2 H2O △ + O2 △ 2Cu + O2 2CuO O △ CH CH OH + CuO → CH CHO + Cu + H O
(二)乙醇与金属钠反应(取代反应)
2C2H5OH+2Na 2C2H5ONa+H2
乙醇钠
此反应中,乙醇哪 些键断裂?
⑤
三、乙醇的化学性质
实验探究四 乙醇与氢卤酸的反应
试管 I 试管 II 导管 a
在试管 I 中依次加入 2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g 溴化钠粉末, 在试管II中注入蒸馏水,烧杯 中注入自来水。加热试管 I 至 微沸状态数分钟后,冷却,观 察并描述实验现象。
实验现象:试管II中有油状物产生,溶液分层
【实验原理】
(三)乙醇与氢卤酸的反应(取代反应)
学生表演 H―C―C―B H―C―C―OH + H B
H H H H
― r
r
+ H―OH
H
H
H
H
NaBr + H2SO4 == NaHSO4 + HBr
说明:
⑴该反应与卤代烃的水解反应是相反的关系,碱性时易于卤代烃与 水的水解反应,酸性时易于醇与HX的取代。 ⑵常用醇、卤化钠、浓硫酸共热制RX。
乙醇分子的比例模型
醇的官能团--羟基 写作-OH
结构简式:CH3CH2OH 或C2H5OH
结构与性质分析
⑤
H H
-C原子 -C原子
H
④
C—C—O—H H
③
H② ①
官能团--羟基(-OH)
乙醇分子是由乙基(—C2H5)和羟基(— OH)组成的,羟基比较活泼,它决定着乙醇的主 要性质。
乙醇的结构式:
三、乙醇的化学性质
实验探究二 乙醇为什么可以使铜 器、银器变光亮?
取少量酒精于试管中,把光亮的细铜丝绕 成螺旋状,在酒精灯的外焰上加热烧红,然后 迅速插到盛有乙醇的试管底部,观察反应现象。 重复操作3-4次,闻试管内液体气味。
活动与探究二
实 验 步 骤 现 象 铜丝由 红色 变成 黑色 . 2、在试管中加入2mL 又由 黑色又变成 红色 ,反 乙醇,将加热后的铜丝 复多次,可闻到 刺激性 气 CH CHO 味, 这种物质是 . 3 插入乙醇中
【判断】下列有机化合物哪些属于醇类?
E.
F.
OH
G.
A C D E F
不是酒精是乙醇
长途客运汽车站,一个男子拎着一大桶东西 急匆匆地奔过来,正挤着人群想上车,售票 员问:“哎哎,这是什么东西?” 男子一边喘气一边往上挤说:“酒精”.
“不行,不行,这可是易燃物,不能带上车 的.”售票员反皱着眉头. 这男子又嚷道:“这是乙醇.”
乙醇在空气里能够燃烧,发出淡蓝色 的火焰,同时放出大量的热。
(一)、氧化反应
1. 燃烧 C2H5 OH + 3 O2
点燃
2CO2 +3H2O
乙醇燃烧时哪些化学键发生断裂呢?
⑤
银匠在焊接银器、铜器时,表面会生成发黑的 氧化膜,他们通常把铜、银在火上烧热,马上 13 蘸一下酒精,铜银会光亮如初!这是何原理?
紫色的酸性高锰酸钾溶液褪色 酸性重铬酸钾溶液由橙色变为绿色,判定司机饮酒超标。
思考: 为什么钠保存在煤油中,而不保存在水 与乙醇中。从这种做法你能得出什么结论?
根据上述结构分析:钠与二甲醚(CH3-O-CH3) 能反应吗? Na沉在二甲醚的底部,没有气体产生
三、乙醇的化学性质
实验探究三
钠能保存在煤油中,那钠能否保存在乙 醇中? 分别将一小块金属钠放入乙醇和水中,反应完成 后往烧杯中加入少量的酚酞,观察实验现象?
总结:醇可以和氢卤酸反应,反应中,醇分子 中的羟基被卤素原子取代生成卤代烃。 △ R一OH + HX → R一X + H2O
【注】通常,卤代烃就是用醇和氢卤酸反应制得。
三、乙醇的化学性质
实验探究五 (四) 乙醇的脱水反应
乙醇和浓硫酸混合加热 到170℃左右
H H C H H C H 1700C
浓H2SO4 用浓硫酸作催化剂应 反应注意事项: 1)反应温度170℃ 2)加碎瓷片 3)V乙醇:V浓硫=1:3
=
=
2CH3CH(OH)CH3 +
3
2
Cu是催化剂,但实际起氧化作用的是CuO。 Cu 总: 2CH3CH2OH + O2 2CH3CHO + 2H2O △ 醇被氧化的机理: ② ① ①-③位断键 R1 R1 Cu 2R2—C—O—H + O2 — C = O 2 R + 2H2 O 2 △ ③ 生成醛或酮 H
乙醇的脱水反应条件(例如温度)不同,脱水的 方式也不同,生成物也不同。如乙醇和浓硫酸共热 到140℃左右,每两个乙醇分子间会脱去一个水分 子而生成乙醚。
2CH3CH2OH
浓H2SO4
1400C
CH3CH2OCH3CH2 + H2O
书P69“信息提示” 启迪思考: 通过分子内脱水反应和分子间脱水反应, 试比较这两个反应的异同点,有什么心得?
是不是所有的醇都能发生消去反应?
CH3 CH3OH CH3一C一OH
CH3 CH3一C一CH2一OH
CH3
CH3
与乙醇同类的烃的衍生物,它们能否发生象乙醇那样 的消去反应?
结论:醇发生消去反应的条件:与-OH相连
的碳原子相邻的碳原子有氢原子。 (邻位)碳原子上要有氢原子
(2)乙醇的分子间脱水-----取代反应
CH2=CH2
+H2O
OH
羟基和氢脱去结合成水
请结合课本P69[活动与探究],归纳探究以下问题: (1)装置中广口瓶起什么作用?试管中有什么现象? 提示:广口瓶起安全瓶的作用,同时KOH溶液或水可除 去混合物中挥发出的乙醇和SO2(浓硫酸作催化剂)等气体。试 管中酸性KMnO4溶液褪色。
(2)如何设计探究方案,比较不同催化剂的催化效果。
提示:在其他条件相似的情况下,记录酸性KMnO4溶液褪色的 时间,时间越短,催化效果越好。 (3)用浓硫酸作催化剂,为什么反应温度要迅速升到170℃? 如果缓慢加热会有什么影响? 提示:要生成乙烯,温度必须在170 ℃,如果慢慢加热,会 增加副产品乙醚。
(1)乙醇的分子内脱水-----消去反应
H H H
Cu 3 O2 △ →
2CH3-C-CH3 + 2H2O
2
生活中,你的亲朋好友有没有喝酒的? 同学们有没有发现一个有趣的现象, 喝了酒之后,有的人容易脸红?你知 道是为什么吗?
喝酒脸红的原因
酒精(即乙醇)吸收后,绝大部分在肝脏被氧 化分解。在醇脱氢酶的作用下氧化成乙醛,又在 醛脱氢酶的作用下氧化成乙酸,乙酸进入血液, 在代谢过程中,最后生成CO2和H2O排出体外。 乙醛能使脸部毛细血管扩张而变红,所以喝酒 脸红的人意味着他们有高效的醇脱氢酶,但是缺 乏醛脱氢酶,所以体内迅速积聚大量乙醛而迟迟 不能代谢,出现中毒现象,比如会面红耳赤、头 疼、心率加快、严重可导致死亡。 长期喝酒,会使醛脱氢酶活性降低,使肝脏乙 醛浓度过高,损伤肝脏,引起疾病。
“干嘛不早说?呵呵,快上!”售票员笑着 抱怨.客车终于启动了.
一、乙醇的物理性质
颜 色: 气 味: 状 态: 挥发性: 无色透明 特殊香味 液体 易挥发 比水小
密 度:
溶解性: 跟水以任意比互溶 能够溶解多种无机物和有机物
二、乙 醇 结 构
分子式: C2H6O H H 结构式: H C—C—O—H H H
△
提示:对溴乙烷起到冷凝作用,试管II中的水还可以除去溴乙烷
中的乙醇。
(4)如何证明试管中的产物为溴乙烷? 提示:取产物少量于试管中,加入稀硝酸后再加入 AgNO3溶液,无明显变化;再取少量产物加入NaOH溶液
加热,加入过量的稀硝酸酸化,再加入适量AgNO3溶
液,如果有浅黄色沉淀,则证明为溴乙烷。
成乙烯;在140 ℃时分子间脱水生成乙醚。
(4)1,3-丁二烯与溴的加成反应,在-80 ℃时发生1,2-加成, 生成3,4-二溴-1-丁烯;在60 ℃时发生1,4-加成,生成1,
4-二溴-2-丁烯。
所以,我们可以根据物 质的化学性质,按照实际需 要,控制反应条件,使化学 反应朝着我们所需要的方向 进行。
1、铜丝在火焰上加热
分析 红色→黑色
2. 催化氧化反应
