钴
重金属---钴综述
一、重金属----钴钴,是钢灰色和金属光泽的硬质金属,钴(Co)原子序数为27,位于元素周期表第八族,原子量为58.93,它的主要物理、化学参数与铁、镍接近,属铁族元素。
钴是一种高熔点和稳定性良好的磁性硬金属。
它的居里点(失去磁性的临界温度点)为1150℃,具永磁性,熔点为1495℃,沸点为2900℃,具耐高温性。
它是制造耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,广泛用于航空、航天、电器、机械制造、化学和陶瓷工业。
因此,它是一种重要的战略物资。
二、钴资源状况国内外钴资源基本情况。
根据美国地质调查局数据,2006年世界钴储量为700万吨,主要集中在刚果(金)、澳大利亚、古巴、赞比亚、俄罗斯和新喀里多尼亚,它们合计储量约占世界钴总储量的93.6%。
中国基本没有单一的钴矿,钴资源主要伴生在镍矿中。
按照中国国土资源部2005年全国矿产资源储量通报,中国钴储量基础为7.33万吨,但具有开采经济价值的储量仅为4.09万吨,占世界可开采量的1.03%。
中国是钴资源贫乏的国家。
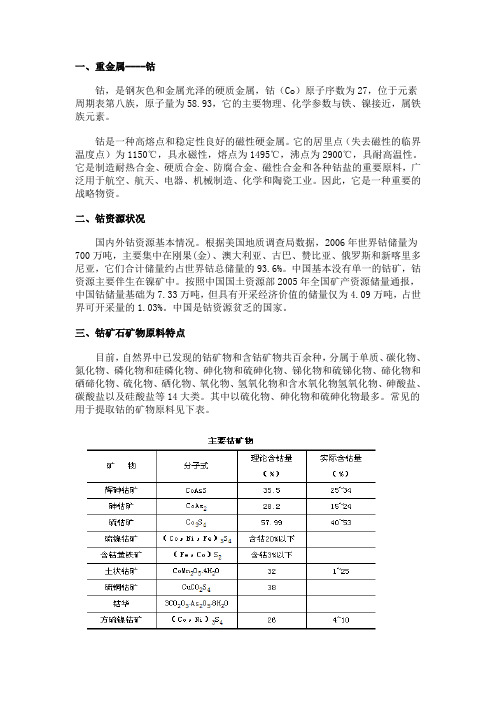
三、钴矿石矿物原料特点目前,自然界中已发现的钴矿物和含钴矿物共百余种,分属于单质、碳化物、氮化物、磷化物和硅磷化物、砷化物和硫砷化物、锑化物和硫锑化物、碲化物和硒碲化物、硫化物、硒化物、氧化物、氢氧化物和含水氧化物氢氧化物、砷酸盐、碳酸盐以及硅酸盐等14大类。
其中以硫化物、砷化物和硫砷化物最多。
常见的用于提取钴的矿物原料见下表。
自然界中钴的存在形式有三种:①独立钴矿物,②呈类质同象或包裹体存在于某一矿物中,③呈吸附形式存在于某些矿物表面,其中以第二种存在形式最为普遍。
以类质同象或显微包裹体存在于辉石、橄榄石、磁铁矿和铬铁矿中的钴不能利用,而赋存于黄铁矿和磁黄铁矿中者则可以利用。
铁矿石中以类质同象或显微包裹体存在于硫化物和硫砷化物矿物中的钴,需加设浮选流程才能加以回收,而在铜镍矿中则无需为它们加设另外的选矿流程,它们是和镍一同选出来并从冶炼镍的炉渣中回收的,所以从炉渣中提取钴的生产成本较低。
钴的概述.docx

钴的概述钴是中等活泼的金属元素,有二价和三价二种化合价。
钴可经消化道和呼吸道进入人体,一般成年人体内含钴量为1.1-1.5mg。
在血浆中无机钴附着在白蛋白上,它最初贮存于肝和肾,然后贮存于骨、脾、胰、小肠以及其它组织。
体内钴14%分布于骨骼,43%分布于肌肉组织,43%分布于其它软组织中。
经口摄入的钴在小肠上部被吸收,并部分地与铁共用一个运载通道,在血浆中是附着在白蛋白上。
吸收率可达到63%-93%,铁缺乏时可促进钴的吸收。
钴主要通过尿液排出,少部分由肠、汗、头发等途径排出,一般不在体内蓄积。
一、钴的生理功能钴是维生素B12组成部分,反刍动物可以在肠道内将摄入的钴合成为维生素B12,而人类与单胃动物不能将钴在体内合成B12。
现在还不能确定钴的其它的功能,但体内的钴仅有约10%是维生素的形式。
已观察到无机钴对刺激红细胞生成有重要的作用。
有种贫血用叶酸、铁、B12治疗皆无效,有人用大剂量的二氯化钴可治疗这类贫血。
然而,这么大剂量钴反复应用可引起中毒。
钴对红细胞生成作用的机制是影响肾释放促红细胞生成素,或者通过刺激胍循环。
还观察到供给钴后可使血管扩张和脸色发红,这是由于肾释放舒缓肌肽,钴对甲状腺的功能可能有作用,动物实验结果显示,甲状腺素的合成可能需要钴,钴能拮抗碘缺乏产生的影响。
二、钴的缺乏和过量表现过量经常注射钴或暴露于过量的钴环境中,可引起钴中毒。
儿童对钴的毒性敏感,应避免使用每千克体重超过1mg的剂量。
在缺乏维生素B12和蛋白质以及摄入酒精时,毒性会增加,这在酗酒者中常见。
缺乏目前尚无钴缺乏症的病例,从膳食汇中可能每天摄入钴5-20ug。
三、钴的日推荐量和食物来源成人适宜摄入量为60g/d,可耐受最高摄入量为350g/d。
食物中钴含量较高者有甜菜、卷心菜、洋葱、萝卜、菠菜、西红柿、无花果、荞麦和谷类等,蘑菇含量可达61ug/100g。
网址: 第 1 页,共 1 页。
钴

简介
钴矿物的赋存状态复杂,矿石品位低,所以提取方法很多而且工艺复杂,回收率较低。钴矿的选矿对一般是将钴矿石通过手选、重选、泡沫浮选可提取到含钴15-25%的钴精矿。钴的冶炼一般先用火法将钴精矿、砷钴精矿、含钴硫化镍精矿、铜钴矿、钴硫精矿中的钴富集或转化为可溶性状态,然后再用湿法冶炼方法制成氯化钴溶液或硫酸钴溶液,再用化学沉淀和萃取等方法进一步使钴富集和提纯,最后得到钴化合物或金属钴。
基本释义
● 钴 (钴) gǔㄍㄨˇ ◎ 一种金属元素。钴的放射性同位素钴60在机械、化工、冶金等方面都有广泛的应用,在医疗上可以代替镭治疗癌症。
编辑本段化学元素
在常温下不和水作用,在潮湿的空气中也很稳定。在空气中加热至300℃以上时氧化生成CoO,在白热时燃烧成Co3O4。氢还原法制成的细金属钴粉在空气中能自燃生成氧化钴。1735年瑞典化学家布兰特(G.Brandt)制出金属钴。1780年瑞典化学家伯格曼(T. Bergman)确定钴为元素。长期以来钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属,消费量逐年增加。中国于50年代开始从钴土矿、镍矿和含钴黄铁矿中提钴。 ■概述元素名称:钴 元素符号:Co 元素原子量:58.93 原子体积:(立方厘米/摩尔) 6.7 元素类型:金属元素 元素在太阳中的含量:(ppm) 4 元素在海水中的含量:(ppm) 太平洋表面 0.0000钴069 地壳中含量:(ppm)10 质子数:27 中子数:32 原子序数:27 所属周期:4 所属族数:VIII 电子层分布:2-8-15-2 氧化态: Main Co+2 Other Co-1, Co0, Co+1, Co+3, Co+4, Co+5 莫氏硬度:5
钴性质

钴cobalt一种化学元素,化学符号Co ,原子序数27 ,原子量58.9 332,属周期系Ⅷ族。
1735年瑞典G.布兰特从辉钴矿中还原出金属钴,其英文名称来源于德文Kobalt ,含义是妖魔,这是因为辉钴矿中含有砷,损害了矿工的健康。
钴在地壳中的含量为0.0023%,主要矿物有辉钴矿(CoAsS)、方钴矿(CoAs3)、砷钴矿(CoAs2)、钴土矿(CoO·2MnO2·4H2O)、菱钴矿(CoCO3)、钴华(3CoO·As2O5·8 H2O)、硫铜钴矿(CuCo2S4)、硫钴矿(Co3S4),海底的锰结核中钴的储量很大,是钴的重要远景资源。
钴有两种同位素:钴59 为稳定同位素,钴60为放射性同位素。
钴是银灰色有光泽的金属,熔点1495℃,沸点2870℃,相对密度8.9。
有延展性和铁磁性,常温下,致密的金属钴在空气中稳定,高于300℃时,钴被氧化,极细的粉末状钴会自燃。
室温下钴不和水作用,赤热的钴能分解水,并放出氢气。
钴溶于稀盐酸、稀硫酸和稀硝酸,在发烟硝酸中,金属钴的表面被钝化。
钴还能缓慢地与氢氟酸、氨水和氢氧化钠溶液作用。
在加热时,钴与硫、氯、溴发生剧烈反应。
钴的氧化态+1、+2、+3、+4 。
在简单化合物中以+2价最稳定,简单的+3价钴离子是强氧化剂,容易被还原。
钴有三种氧化物:CoO、Co2O3 、Co3O4 。
氢氧化钴〔Co(OH)2〕是两性氢氧化物,不溶于水,溶于酸,也溶于浓的强碱溶液。
钴也是一种成矾元素,硫酸钴(CoSO4) 能与碱金属硫酸盐形成矾[Co(SO4)2]·6H2O(M1为碱金属离子)。
+2和+3价钴离子都容易形成稳定的配位化合物,如en为乙二胺)、Coedta2 -(edta为乙二胺四乙酸)。
由于水合作用、溶剂化作用和配位作用,钴盐在水溶液中呈现多种颜色变化。
在加压下,金属钴粉与一氧化碳化合成八羰基二钴[Co2(CO)8],它也是一种配位化合物.钴矿物的存在状态较复杂,矿石品位也低,所以提取工艺也很烦琐。
钴

钴(Co)资料首先,告诉大家,金属钴(读音Gǔ)是一种金属,而钴60则是金属钴的一种同位素,具有放射性,可以用来治疗癌症等,不过使用时要注意保护,放射线对人伤害很大。
钴的性质:钴(Co),原子序数27,原子量58.9332。
元素名来源于德文,原意是妖魔。
1735年瑞典化学家布兰特发现并分离出钴。
钴在自然界分布很广,但在地壳中的含量仅为0.0023%,占第34位。
钴矿主要有辉钴矿、方钴矿等,海洋底的锰结核中钴的含量也很大,天然水、泥土和动植物中都有钴。
自然界存在的稳定同位素只有钴59。
cobalt-60钴-60(Co)是金属元素钴的放射性同位素之一,其半衰期为5.27年。
它会透过β衰变放出能量高达315 keV的高速电子成为镍-60,同时会放出两束伽马射线,其能量分别为1.17及1.33 MeV。
元素钴的一种放射性同位素(见放射性)。
符号□Co,简写为60Co。
钴60是β- 衰变核素,发射β- 和γ射线,β-射线的最大能量为0.315兆电子伏,γ射线的能量有1.173210和1.332470兆电子伏两种。
半衰期为5.272年。
3.7×10□贝可的钴60重8.85×10_□毫克。
3.7×10□贝可的钴60点源在1厘米远处的照射量率为13.2伦琴/时。
钴60属高毒性核素,对全身有影响,对人体的有效半减期为9.5天,在人体中的最大容许积存量为3.7×10□贝可。
钴60在放射性工作场所空气中和露天水源中的最大容许浓度分别为0.33和370贝可/升。
钴60的化学性质与元素钴相同。
产生钴60的核反应有以下各种:59Co(n,γ)60Co、59Co(d,p)60Co、62Ni(d,□)60Co、63Cu(n,□) 60Co和铋的散裂裂变反应等。
只有第一种核反应具有工业生产意义。
实际生产中,用天然金属钴(59Co 的丰度为100%)或含钴的其他合适材料制成靶子,在高中子注量率反应堆中辐照适当时间,即可获得比活度高的钴60,高的已达(2.59~2.96)×10□贝可/克,如加以放射化学分离,还可达到3.33×10□贝可/克或更高。
钴常见化合价-概述说明以及解释

钴常见化合价-概述说明以及解释1.引言1.1 概述概述部分的内容可以包括以下内容:钴是一种重要的过渡金属元素,具有广泛的应用前景。
它的化学符号为Co,原子序数为27,属于第9族元素。
钴具有灰白色的外观,具有良好的磁性和导电性能。
在自然界中,钴常以氧化物和硫化物的形式存在。
钴的化合价是指钴在化合物中所表现出的相对电荷数。
钴的化合价不是固定的,而是具有多变性。
钴的常见化合价主要有+2和+3两种。
其中,+2是钴的常见氧化态,通常以Co(II)表示,也称为二价钴。
而+3是钴的高氧化态,以Co(III)表示,也称为三价钴。
钴还可以表现出其他氧化态,如+4和+5,但相对较少见。
钴的化合价取决于周围环境中的化学物质和反应条件。
在不同的化学反应中,钴的电子可能会损失或获得,从而产生不同的化合价。
这种多变性使得钴具有广泛的应用领域,如电池材料、催化剂、磁性材料等。
本文将重点介绍钴的常见化合价及其相关化合物的性质和应用。
通过对钴化合价的深入研究,有助于我们更好地理解钴元素的化学性质和其在不同应用领域中的作用。
同时,也为钴相关研究和应用提供一定的理论基础和参考依据。
在接下来的章节中,我们将详细介绍钴的化合价及其相关化合物的具体情况,包括常见的+2和+3价化合物的结构、性质和制备方法。
同时,还将讨论钴化合价的变化规律及其对钴化合物性质的影响。
最后,我们将对钴的化合价进行总结,并展望钴化合价在未来的研究和应用方向。
通过对钴常见化合价的研究,有望为进一步探索钴的性质和应用提供新的思路和方法。
希望本文能够为读者对钴化合价的理解和应用提供一定的帮助和启示。
1.2 文章结构文章结构部分的内容可以按照以下方式编写:本文主要包括引言、正文和结论三个部分。
首先,引言部分会对钴的常见化合价进行概述,介绍钴的基本特性和其在化学中的重要性。
同时,会阐明本文的目的,即对钴的常见化合价进行详细探讨。
其次,正文部分会着重介绍钴的化合价的概念以及其在不同化学反应中的变化规律。
钴的性质及用途
书山有路勤为径,学海无涯苦作舟
钴的性质及用途
钴是具有钢灰色和金属光泽的硬质金属,钴(Co)原子序数为27,位于元素周期表第八族,原子量为58.93,它的主要物理、化学参数与铁、镍接近,属铁族元素。
钴是一种高熔点和稳定性良好的磁性硬金属。
它的居里点(失去磁性的临界温度点)为1150℃,具永磁性,熔点为1495℃,沸点为2900℃,具耐高温性。
它是制造耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,广泛用于航空、航天、电器、机械制造、化学和陶瓷工业。
因此,它是一种重要的战略物资。
我国钴金属资源量约为140 万t,绝大多数为伴生资源,单独的钴矿床极
少。
我国钴矿品位较低,均作为矿山副产品回收,生产过程中由于品位低、生产工艺复杂,因此金属回收率低、生产成本高。
1996 年我国钴金属产量(钴含量)229t,钴硫精矿产量(钴含量)192t,氧化钴638t。
近几年我国钴的年消费量稳定在1200t 左右,国内钴产量包括氧化钴折算为钴每年总计约600~700t,国内钴产量尚不能满足国内需求,每年约有半数需进口。
一、矿石矿物主要特点
目前,自然界中已发现的钴矿物和含钴矿物共百余种,分属于单质、碳化物、氮化物、磷化物和硅磷化物、砷化物和硫砷化物、锑化物和硫锑化物、碲化物和硒碲化物、硫化物、硒化物、氧化物、氢氧化物和含水氧化物氢氧化物、砷酸盐、碳酸盐以及硅酸盐等14 大类。
其中以硫化物、砷化物和硫砷化物最多。
自然界中钴的存在形式有三种:①独立钴矿物,②呈类质同象或包裹体存在于某一矿物中,③呈吸附形式存在于某些矿物表面,其中以第二种存在形式最。
钴的性质及钴矿石的分类知识点解说.
钴的性质及钴矿石的分类知识要点一、钴的性质1. 物理性质①钴(Co),原子序数是27,相对原子质量58.93,密度8.9g/cm3。
②熔点1495℃、沸点2930℃。
③钴有铁磁性,加热到1150℃时磁性消失。
具有钢灰色金属光泽的,硬而脆。
在硬度、抗拉强度、机械加工性能、热力学性质、电化学行为方面与铁和镍相类似,称为铁系元素。
2. 化学性质①钴的化合价为+2价和+3价。
②在常温下不和水作用,在潮湿的空气中也很稳定,但在空气中加热至300℃以上时氧化生成CoO,在白热时燃烧成Co3O4。
③一般情况下与氧、硫、氯等非金属不起作用,但在高温下与氧、硫、氯、溴等发生剧烈氧化作用,生成相应化合物。
氢还原法制成的细金属钴粉在空气中能自燃生成氧化钴。
④钴可溶于稀酸中,在发烟硝酸中因生成一层氧化膜而被钝化,在浓硝酸中反应激烈,在盐酸和硫酸中反应很缓慢。
⑤钴会缓慢地被氢氟酸、氨水和氢氧化钠侵蚀。
钴在碱溶液中比铁稳定,钴是两性金属。
二、钴元素在地壳中的分布、赋存状态及其钴矿石的分类1. 钴在地壳中含量为23×10-6,很少有较大的钴矿床,明显比铁少得多,而且钴和铁的熔点不相上下,是同一副族的元素,性质相近。
2. 钴(Ⅱ)的化合物有:氧化钴、氢氧化钴、氯化钴、硫酸钴、碳酸钴、草酸钴等。
3 . 钴(Ⅲ)的化合物有氧化高钴(Co3O4)4. 钴的配合物有氨配合物([Co(NH3)6]3+、氰配合物[Co(CN)6]4-、硫氰配合物[Co(SCN)4]2-、羰基配合物[Co(CO)4]-、硝基[Co(NO3)4]2-或亚硝基配合物[Co(NO2)6]3-。
5 . 钴在矿物中与砷和硫结合,主要矿物有硫钴矿Co3S4、砷钴矿CoAS2、辉砷钴矿CoAsS、硫铜钴矿CuCo2S4、钴黄铁矿(Fe,Co)S2、方钴矿CoAS3、钴土矿CoMn2O5·4H2O、钴华Co(AsO4)3·8H2O、菱钴矿CoCO3、赤矾CoSO4等。
钴的基本知识
钴的基本知识钴的性质:钴是一种银白色的铁磁性金属,是能增加铁的磁化的唯一元素。
其密度为8.9克/厘米3,熔点为1492℃。
钴有16种天然和人造的同位素。
其中,钴——60是广泛使用的γ射线源,其半衰期为5.23年。
在常温下,致密的金属钴在空气和水中稳定,当温度高于300℃时,钴在空气中开始氧化。
赤热的钴能分解水而放出氢。
细金属钴粉在空气中能自然生成氧化钴。
世界上已知的含钴矿物约100种,钴矿主要有铜钴矿、镍钴矿、砷钴矿和含钴黄铁矿四种类型这些钴矿含钴均较低。
海底锰结核将是钴的重要远景资源。
钴的用途钴的高温性能好,钴基合金和含钴合金钢用作燃气轮机叶片、叶轮、导管以及喷气发动机、火箭发动机、导弹等的部件和各种高负荷耐热零件。
钴可作耐酸合金的添加元素。
由于钴能提高铁基、铝镍基和稀土金属合金的磁饱和强度和居里点,使其具有高的矫顽磁力,是电气工业中良好的磁性材料。
钴可用作硬质合金的粘结剂。
钴的氧化物是陶瓷制品的脱色剂和颜料。
含钴釉料可使搪瓷与钢更好的结合。
钴的有机化合物在油漆中作催干剂。
同位素钴——60是廉价的γ射线源,在物理、化学生物研究和医疗部门已得到广泛应用。
钴与人体健康钴是人体内不可缺少的元素,以离子状态存在。
钴是维生素B12的成分之一,与造血功能有关。
正常人体每日摄入钴量约在5-45微克之间。
当摄入量过高时,会诱发肺炎,导致心肌损害,甲状腺损害和红细胞增多等症。
钴——60γ射线对治疗人体癌症有一定疗效。
钴矿之国——扎伊尔位于非洲中部的扎伊尔,矿物资源丰富,有“中非宝石”之称。
钴的储量占世界的50%,居首位,主要集中在沙巴区境内。
钴矿业在国民经济中占有重要地位。
钴产量也居世界首位,1979年产钴约15000吨,产量约占世界总产量的60%。
钴是具有钢灰色和金属光泽的硬质金属,钴(Co)原子序数为27,位于元素周期表第八族,原子量为58.93,它的主要物理、化学参数与铁、镍接近,属铁族元素。
钴是一种高熔点和稳定性良好的磁性硬金属。
钴金属
钴金属的基本知识一种化学元素,化学符号Co ,原子序数27 ,原子量58.9332,属周期系Ⅷ族。
1735年瑞典G.布兰特从辉钴矿中还原出金属钴,其英文名称来源于德文Kobalt ,含义是妖魔,这是因为辉钴矿中含有砷,损害了矿工的健康。
钴在地壳中的含量为0.0023%,主要矿物有辉钴矿(CoAsS)、方钴矿(CoAs3)、砷钴矿(CoAs2)、钴土矿(CoO•2MnO2•4H2O)、菱钴矿(CoCO3)、钴华(3CoO•As2O5•8H2O)、硫铜钴矿(CuCo2S4)、硫钴矿(Co3S4),海底的锰结核中钴的储量很大,是钴的重要远景资源。
钴有两种同位素:钴59 为稳定同位素,钴60为放射性同位素。
钴是银灰色有光泽的金属,熔点1495℃,沸点2870℃,相对密度8.9。
有延展性和铁磁性,常温下,致密的金属钴在空气中稳定,高于300℃时,钴被氧化,极细的粉末状钴会自燃。
室温下钴不和水作用,赤热的钴能分解水,并放出氢气。
钴溶于稀盐酸、稀硫酸和稀硝酸,在发烟硝酸中,金属钴的表面被钝化。
钴还能缓慢地与氢氟酸、氨水和氢氧化钠溶液作用。
在加热时,钴与硫、氯、溴发生剧烈反应。
钴的氧化态+1、+2、+3、+4 。
在简单化合物中以+2价最稳定,简单的+3价钴离子是强氧化剂,容易被还原。
钴有三种氧化物:CoO、Co2O3 、Co3O4 。
氢氧化钴〔Co(OH)2〕是两性氢氧化物,不溶于水,溶于酸,也溶于浓的强碱溶液。
钴也是一种成矾元素,硫酸钴(CoSO4) 能与碱金属硫酸盐形成矾[Co(SO4)2]•6H2O(M1为碱金属离子)。
+2和+3价钴离子都容易形成稳定的配位化合物,如en为乙二胺)、Coedta2-(edta为乙二胺四乙酸)。
由于水合作用、溶剂化作用和配位作用,钴盐在水溶液中呈现多种颜色变化。
在加压下,金属钴粉与一氧化碳化合成八羰基二钴[Co2(CO)8],它也是一种配位化合物.钴矿物的存在状态较复杂,矿石品位也低,所以提取工艺也很烦琐。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钴 钴元素符号Co ,银白色铁磁性金属,表面抛光后有淡蓝光泽,在周期表中位于第4周期、第Ⅷ族,原子序数27,原子量58.9332,密排六方晶体,常见化合价为+2、+3。
钴是具有光泽的钢灰色金属,比较硬而脆,有铁磁性,加热到1150℃时磁性消失。
钴的化合价为+2价和+3价。
在常温下不和水作用,在潮湿的空气中也很稳定。
在空气中加热至300℃以上时氧化生成CoO ,在白热时燃烧成Co3O4。
氢还原法制成的细金属钴粉在空气中能自燃生成氧化钴。
外围电子层排布:3d 7 4s 2 电子层分布:2-8-15-2 化合价:+2、+3 晶体结构:密排六方晶体 具有光泽的钢灰色金属,熔点1493℃、比重8.9,比较硬而脆,钴是铁磁性的,在硬度、抗拉强度、机械加工性能、热力学性质、的电化学行为方面与铁和镍相类似。
加热到1150℃时磁性消失。
钴的化合价为2价和3价。
在常温下不和水作用,在潮湿的空气中也很稳定。
在空气中加热至300℃以上时氧化生成CoO ,在白热时燃烧成Co 3O 4。
氢还原法制成的细金属钴粉在空气中能自燃生成氧化钴。
由电极电势看出,钴是中等活泼的金属。
其化学性质与铁,镍相似。
高温下发生氧化作用。
加热时,钴与氧,硫,氯,溴等发生剧烈反应,生成相应化合物。
钴可溶于稀酸中,在发烟硝酸中因生成一层氧化膜而被钝化。
钴会缓
慢地被氢氟酸,氨水和氢氧化钠浸蚀。
钴是两性金属。
化合物
氧化钴
黑灰色六方晶系粉末。
相对密度5.18。
溶于酸,不溶于水,醇,氨水。
易被一氧化碳还原成金属钴。
高温时易与二氧化硅、氧化铝或氧化锌反应生成多种颜料。
氧化钴(Co 2O 3)是钴的高价氧化物,理论含钴量为71.06%,含氧量为28.94%,密度为6.079/cm3。
它是一种黑色无定形粉末,加热时会生成四氧化三钴(Co304)。
氧化钴是一种不稳定,也不可能呈游离状态的化合物。
通常所指的氧化钴实际上仍含有一定数量的四氧化三钴。
Co 2O 3只有呈水化状态时才稳定,而这种水化物在265℃下会脱水转变成中间氧化物四氧化三钴(Co 3O 4)。
氧化钴在125℃下可被H 2还原成四氧化三钴(Co 3O 4),在200℃时被还原为CoO ,在250℃时则被还原为金属钴。
氧化钴不溶于水,可溶于酸而生成相应的盐。
制备:
金属钴法:将金属钴加入盐酸中,视溶解情况适当地加入硝酸,加热至80 ℃进行反应,
Co+2HCl ══ CoCl 2+H 2↑
在生成的氯化钴溶液中加入双氧水净化除铁,沉淀、过滤后,加入碳酸钠进行置换反应生成碳酸钴,经洗涤、离心分离,把净制的碳酸钴经灼烧、过筛制得氧化钴。
CoCl 2+Na 2CO 3 ══ CoCO 3↓+2NaCl
2、废料回收法:工艺与上述金属钴法基本相同,只是增加了用碳酸钠、烧碱除铁和用次氯酸钠除镍等元素名称
钴 英文名
Cobalt 元素符号
Co 原子序数
27 元素系类
过渡金属 CAS 号
7440-48-4 相对原子质量
58.93 熔点
1495℃ 沸点
2927℃ 密度
8.9/cm ³ 性状 银白色金属
除杂质工序。
3、Co3O4在温度高于900℃时即可分解生成CoO,将金属钴粉在空气中进行氧化焙烧,为了避免生成Co3O4,提高氧化温度为900℃以上,即可生成CoO。
2Co+O2══2CoO
或者将Co3O4在空气中加热至960℃,使其发生热分解,也可得到CoO。
反应完成后应在通入惰性气体的条件下降温冷却。
2Co3O4≜6CoO+O2↑
4、将硝酸钴、碳酸钴或氢氧化钴在真空或惰性气氛中焙烧使其发生热分解,分解的产物为CoO。
将硝酸钴在氩气流中焙烧后,再在含有湿HCl的氩气流中于950℃加热10h,然后在干燥的氩气流中进行热处理,得到的产物为深暗红色的CoO。
用氢氧化钴进行分解时,在真空或氮气流中的加热温度为200℃或在CO2气流中加热温度为900℃,其分解产物都是CoO。
碳酸钴比硝酸钴更容易分解,碳酸钴在真空中于900℃以下分解即得到CoO。
为了避免产物在冷却过程中发生氧化生成Co3O4,冷却过程要在惰性气氛中进行。
CoCO3≜CoO+CO2↑
5、由碳酸钴或硝酸钴在惰性气氛中加热分解而制得。
氢氧化钴
氢氧化钴,化学式为Co(OH)2,一般为玫瑰红色单斜或四方晶系结晶体,不溶于水,但能溶于酸和强碱及铵盐溶液。
密度约为3.6g/cm3。
熔点1100-1200℃,为两性氧化物。
主要用作玻璃和搪瓷的着色剂、制取其他钴化合物的原料,以及清漆和涂料的干燥剂。
制备
1、合成法:含钴废料法各种含钴废料经硝酸、盐酸溶解,所得氯化钴溶液用过氧化氢净化除铁,必要时加入碳酸钠或氨水,以保证净化完全。
净化后的氯化钴溶液加氢氧化钠生成氢氧化钴,再经洗涤、离心分离,制得氢氧化钴产品。
Co+2HCl→CoCl2+H2
CoCl2+2NaOH→Co(OH)2+Na2SO4
2、电解法:以钴为阳极,电解食盐溶液而得。
