第12章 二羰基化合物
合集下载
二羰基化合物

2 CH3(CH2)3CO2C2H5
NaOC2H5
CH3(CH2)3COCHCO2C2H5 CH2CH2CH3 O CH3CH2CHC CH3 CH3 C CO2C2H5 CH2CH3
2 CH3CH2CHCO2C2H5 CH3
Ph3C Na
?
①亲核试剂生成 ②亲核加成
③消除
结果
复习第13章的内容——酰基上的亲核取代
苯甲酰乙酸乙酯
分子内酯缩合——Dieckmann (狄克曼)反应
二元酸酯若分子中的酯基被四个以上的碳原子隔 开时,就发生分子中的酯缩合反应,形成五员环或更 大环的酯,这种环化酯缩合反应称为狄克曼酯缩合。
CH2CH2COOC2H5 CH2CH2COOC2H5 O
(1) NaOC2H5, C6H6, 80℃ (2) H3O+, 80%
OC2H5
取代丙酮 (甲基酮)
乙酰乙酸乙酯
(1) 稀OH (2) H ,
+
CH2 R
实验条件较温 和,产率较好.
应用 1:制备取代丙酮(甲基酮)类化合物
O OC2H5 O OC2H5 R O H3C R
O H3C
R X NaOEt H3C
O
(1) 稀 OH (2) H+,
互变异构
OH H3C C CH 76%
O C CH3
O C H O C C H
O C OC2H5
C CH2 C
分子内氢键
烯醇式的特征:IR: 有OH吸收峰,1H NMR: 有OH和烯质子信号, 化学试验:与FeCl3显色
但下面的烯醇式存在
为什么乙酰乙酸乙酯是由酮式和烯醇式两种互 变异构体组成的? 因为,其烯醇式结构有一定的稳定性:
12羰基化合物

入HCl气体来催化反应。有机化学 第十章
35
反应机理:
Hδ C
Oδ + H O R
快
R
H
H
R' 慢
C O +O
R
H
H
R' H O
HC OH
R' OH
R' O R'
H C O H +H O H
R
R
R' O
H
O
R' H
HC OH
R' O
HC
H O
H
H2O
H C
O
R
R'
R
R
R'
H
OH
CO
R
R'
R' H
O HC
甲醛分子的结构
在醛(Aldehydes)和酮(Ketones)分子中,都含有一 个共同的官能团—羰基,故统称为羰基化合物。
醛分子中,羰基至少要与一个氢原子直接相连,故
醛基一定位于链端。
有机化学 第十章
3
醛分子的结构
有机化学 第十章
4
(二)命名
1. 普通命名法
CH3CH2CHO
丙醛
CH2=CHCHO
应用:提纯醛酮 鉴别醛酮
C=O + H2N-Z
重结晶 稀酸
C=N-Z
C=O
H2N-OH 羟胺
(产物:肟)
H2N-NH2 肼
H2N-NH-C6H5 苯肼
(产有物机化:学 第腙十章)
(产物:苯腙) 33
H2N-NH-C6H3(NO2)2
O H2N NHCNH2
课堂_第十二章_醛和酮 (2)

H+ H2O
CH3CH2MgX
CH2CH3 CH3 C CH2CH3
OMgBr
CH2CH3 CH3 C OH CH 2CH 3
所有的格氏试剂均需自制。
空间位阻的影响
O (CH3)3CCC(CH3)3 =
OH (CH3)3CCC(CH3)3 80% C2H5
+ C2H5MgBr
= =
O (CH3)3CCC(CH3)3 + CH3CH2CH2MgBr O (CH3)3CCC(CH3)3 + (CH3)2CHMgBr
第十二章
醛和酮
本章提纲
一、 醛酮的定义和分类 二、 醛酮的结构 三、 醛酮的物理性质 四、 醛酮的反应 五、 醛酮的制备
第一节 醛酮的定义和分类
一、定义:羰基和烃基(或氢原子)相连的烃 的衍生物
羰基: 酮: 醛: 醛基:
O C
O R C R'
O R C H
O C H
(甲酰基)
对应的醛和酮是同分异构体
C=C C OH R
(CH3)2CHCH2MgX + CH2O 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用甲醛在分子中引入羟甲基
解二
O
(CH3)2CHMgX + 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
R C=O
+
R HC(OC2H5)3 C
OC2H5
+
R R
R
C=O
+
HC(OC2H5)3
OC2H5 R R OC2H5 + HCOOC2H5 C OC2H5 R
CH3CH2MgX
CH2CH3 CH3 C CH2CH3
OMgBr
CH2CH3 CH3 C OH CH 2CH 3
所有的格氏试剂均需自制。
空间位阻的影响
O (CH3)3CCC(CH3)3 =
OH (CH3)3CCC(CH3)3 80% C2H5
+ C2H5MgBr
= =
O (CH3)3CCC(CH3)3 + CH3CH2CH2MgBr O (CH3)3CCC(CH3)3 + (CH3)2CHMgBr
第十二章
醛和酮
本章提纲
一、 醛酮的定义和分类 二、 醛酮的结构 三、 醛酮的物理性质 四、 醛酮的反应 五、 醛酮的制备
第一节 醛酮的定义和分类
一、定义:羰基和烃基(或氢原子)相连的烃 的衍生物
羰基: 酮: 醛: 醛基:
O C
O R C R'
O R C H
O C H
(甲酰基)
对应的醛和酮是同分异构体
C=C C OH R
(CH3)2CHCH2MgX + CH2O 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用甲醛在分子中引入羟甲基
解二
O
(CH3)2CHMgX + 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
R C=O
+
R HC(OC2H5)3 C
OC2H5
+
R R
R
C=O
+
HC(OC2H5)3
OC2H5 R R OC2H5 + HCOOC2H5 C OC2H5 R
二羰基化合物详解演示文稿

CH3CH2 C OC2H5
草酸酯,无α-H
C H3 C H C O O C2H5 CO
- CO
C O O C2H5
CH3
(1)C2H5ONa
(2)
+
H
CH3CH
COOC2H5 COOC2H5
第22页,共53页。
④ 分子内的酯缩合反应 ——Dieckmann反应
C O O C 2H5
CH2CH2COOC2H5
烃基化反应;
(2)碳负离子与羰基化合物的反应,即羰基化合物和β-二羰 基化合物的缩合反应。当与酰卤或酸酐作用时可得酰基化产
物;
(3)碳负离子与α,β-不饱和羰基化合物的共轭加成(或
1,4-加成)。
第12页,共53页。
三、丙二酸二乙酯的合成及应用 1、丙二酸二乙酯的制法 2、丙二酸二乙酯在有机合成上的应用
四、乙酰乙酸乙酯的合成及应用
1、乙酰乙酸乙酯的合成——Claisen酯缩合反应
2、乙酰乙酸乙酯的性质
① 成酮分解 ② 成酸分解
OO CH3CCH2COC2H5
3、乙酰乙酸乙酯在合成上的应用
① 制备甲基酮
② 制备二元酮
第18页,共53页。
四、乙酰乙酸乙酯的合成及应用
1、乙酰乙酸乙酯的合成 ——Claisen酯缩合反应
O CH3C CH
O COC2H5
-
+
Na
O
O
RX CH3C CH COC2H5
一烃基乙酰乙酸乙酯
成酮
O
O
CH3C CH CO C2H5
5N % aO H
成酮分解
RO
+ + CH3C CH2 R
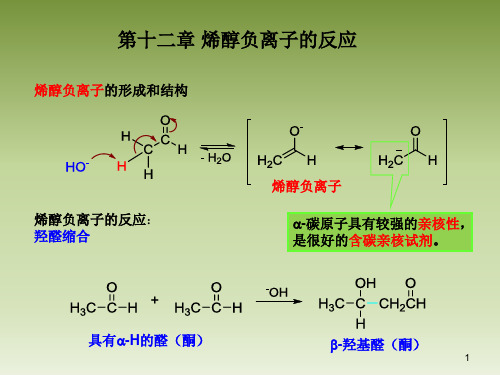
第十二章 烯醇负离子的反应(兼容)
甲基酮
甲基酮
1,3-二酮
22
可看作在丙酮的碳原子上连有一个 临时的吸电子酯基
1,4-二酮
23
二、丙二酸二乙酯 1. 制备
2. 丙二酸二乙酯合成法(the Malonic Ester Synthesis)及其应用
可看作在乙酸乙酯的 -碳原子上连有一个 临时的吸电子酯基
-单烷基 取代乙酸
24
-二烷基 取代乙酸 丙二酸酯法可有效合成3-6元环烷基羧酸!
亲电性 碳原子
1,2-加成
亲电性 碳原子
1,4-加成(共轭加成)
29
Michael加成:碳负离子对,-不饱和羰基化合物(或其它缺电子双键) 的共轭加成。
Michael受体(acceptor): ,-不饱和羰基化合物(亲电试剂) Michael给体(donor):碳负离子、烯醇负离子(亲核试剂)
Michael给体
Michael受体
-二酮
共轭醛
-酮酯
共轭酮
二烷基铜锂 烯胺
R2CuLi
共轭酯 共轭酰胺
-酮腈
共轭腈
-硝基酮
硝基乙烯
30
1,5-二羰基化合物 -酮酸
31
Robinson环化反应 共轭加成与分子内aldol反应的组合。
利用烯胺化学,可在酮的取代较少的-碳上发生反应。
32
The End
33
缩合反应(condensation reaction) 两个或多个有机分子在一定条件下(通常为酸或碱性条件)形成新的 较大的分子的反应。 通过缩合反应,形成了新的碳碳键。
能提供烯醇负离子的化合物包括: 醛、酮、酯、活泼亚甲基化合物等。
一、烯醇负离子与羰基的亲核加成反应
1. Knoevenagel反应
甲基酮
1,3-二酮
22
可看作在丙酮的碳原子上连有一个 临时的吸电子酯基
1,4-二酮
23
二、丙二酸二乙酯 1. 制备
2. 丙二酸二乙酯合成法(the Malonic Ester Synthesis)及其应用
可看作在乙酸乙酯的 -碳原子上连有一个 临时的吸电子酯基
-单烷基 取代乙酸
24
-二烷基 取代乙酸 丙二酸酯法可有效合成3-6元环烷基羧酸!
亲电性 碳原子
1,2-加成
亲电性 碳原子
1,4-加成(共轭加成)
29
Michael加成:碳负离子对,-不饱和羰基化合物(或其它缺电子双键) 的共轭加成。
Michael受体(acceptor): ,-不饱和羰基化合物(亲电试剂) Michael给体(donor):碳负离子、烯醇负离子(亲核试剂)
Michael给体
Michael受体
-二酮
共轭醛
-酮酯
共轭酮
二烷基铜锂 烯胺
R2CuLi
共轭酯 共轭酰胺
-酮腈
共轭腈
-硝基酮
硝基乙烯
30
1,5-二羰基化合物 -酮酸
31
Robinson环化反应 共轭加成与分子内aldol反应的组合。
利用烯胺化学,可在酮的取代较少的-碳上发生反应。
32
The End
33
缩合反应(condensation reaction) 两个或多个有机分子在一定条件下(通常为酸或碱性条件)形成新的 较大的分子的反应。 通过缩合反应,形成了新的碳碳键。
能提供烯醇负离子的化合物包括: 醛、酮、酯、活泼亚甲基化合物等。
一、烯醇负离子与羰基的亲核加成反应
1. Knoevenagel反应
有机化学:第十二章 醛和酮分析

第十二章 醛和酮
主要内容
1、掌握醛酮的分类和命名 2、理解醛酮的亲核加成反应机理 3、掌握醛酮的化学性质
醛、酮和醌的分子结构中都含有羰基,总称为羰基化合物。 羰基至少和一个氢原子结合的化合物叫醛 (-CHO 又叫醛 基 ,) ,羰基和两个烃基结合的化合物叫酮。醌是一类不饱 和环二酮,在分子中含有两个双键和两个羰基。
盖形成π 键。因此C=O双键是由一个σ 键和一个π 键组成的。
O
C
(a) sp2杂化的碳
(b)羰基的结构
C=O双键中氧原子的电负性比碳原子大,所以 π 电子云的分
布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳
原子上带部分正电荷。
C
O
π C O
δ C
δ O
电负性 C < O
π 电子云偏向氧原子
选含羰基的最长碳链为主链,从靠近羰基一端给主链编 号。醛基因处在链端,因此编号总为1。酮羰基的位置要标
出(个别例外)。
CH3 CHCH3
CH3 O CH3 CH C H H3C
O C CH2CH3 CH3CH2
O C
2-甲基丙醛
2—丁酮
2-甲基-3-戊酮
不饱和醛酮的命名是从靠近羰基一端给主链编号:
①电子效应
②空间效应。
醛常比酮活泼:
1 烷基有斥电子诱导效应 ,使羰基C正电性减少。
R1 R2 C O R O C H
2 烷基体积增大,空间位阻也增大。
1.与HCN的加成
C O + HCN C OH
HCN 是弱酸 不易电离, 可以提高溶 液 的 的 PH 值
CN α 羟基睛
反应范围:醛、脂肪族甲基酮、C8以下的环酮。ArCOR和ArCOAr 难反应。 芳香酮难与HCN反应的原因:
主要内容
1、掌握醛酮的分类和命名 2、理解醛酮的亲核加成反应机理 3、掌握醛酮的化学性质
醛、酮和醌的分子结构中都含有羰基,总称为羰基化合物。 羰基至少和一个氢原子结合的化合物叫醛 (-CHO 又叫醛 基 ,) ,羰基和两个烃基结合的化合物叫酮。醌是一类不饱 和环二酮,在分子中含有两个双键和两个羰基。
盖形成π 键。因此C=O双键是由一个σ 键和一个π 键组成的。
O
C
(a) sp2杂化的碳
(b)羰基的结构
C=O双键中氧原子的电负性比碳原子大,所以 π 电子云的分
布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳
原子上带部分正电荷。
C
O
π C O
δ C
δ O
电负性 C < O
π 电子云偏向氧原子
选含羰基的最长碳链为主链,从靠近羰基一端给主链编 号。醛基因处在链端,因此编号总为1。酮羰基的位置要标
出(个别例外)。
CH3 CHCH3
CH3 O CH3 CH C H H3C
O C CH2CH3 CH3CH2
O C
2-甲基丙醛
2—丁酮
2-甲基-3-戊酮
不饱和醛酮的命名是从靠近羰基一端给主链编号:
①电子效应
②空间效应。
醛常比酮活泼:
1 烷基有斥电子诱导效应 ,使羰基C正电性减少。
R1 R2 C O R O C H
2 烷基体积增大,空间位阻也增大。
1.与HCN的加成
C O + HCN C OH
HCN 是弱酸 不易电离, 可以提高溶 液 的 的 PH 值
CN α 羟基睛
反应范围:醛、脂肪族甲基酮、C8以下的环酮。ArCOR和ArCOAr 难反应。 芳香酮难与HCN反应的原因:
12.5β-二羰基化合物的烃化和酰化反应

12-05 β-二羰基化合物的烃化和酰化反应
2.酰基化反应
β-二羰基化合物的活性亚甲基在碱性条件下还能够发生酰基 化反应,能够用于酰基化反应的试剂是酯、酰卤、酸酐 如:
NaH CH3COCH2COOC2H5 CH3COOCOCH3 CH3COCHCOOC2H5 C CH3 O
CH3
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
在一般条件下, β-二羰基化合物的烃基化反应均发生在活性的亚甲基 上,但是在强碱条件下如有机锂、氨基钠等作用下, β-二羰基化合物 可以被转化为双负离子,在与1mol的卤代烃反应时,碱性更强的端基 碳负离子将优先发生γ-烃基化 如:
O CH3COCH2COCH3 2 NaNH2 / NH3(l) H2C C C H O C CH3 RX R O H2CC H2 C O CCH2 CH3
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
能够用于 β-二羰基化合物的烃化的烃基化试剂有磺酸酯、硫酸酯和卤
代烃,其中卤代烃最为普遍。不过,三级卤代烃由于在碱性条件下容易 发生消除反应,不宜被用于烃基化试剂 如:
CH3COCH2COOC2H5 C2H5ONa CH3I CH3COCHCOOC2H5
12-05 β-二羰基化合物的烃化和酰化反应
主讲人:王刚
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
β-二羰基化合物的烃基化反应是以醇钠为碱在醇溶液中进行
反应为SN2反应 β-二羰基化合物的烃基化反应是有机化学增长碳链的方法之一
X Y R'ONa X Y
RZ
+
H2C
R
CH
(X,Y=NLeabharlann 2, R''CO, R''OCO, CN 等)
12羰基化合物

O CH3CCH3
Ba(OH)2
OH O (CH3)2CCH2CCH3
O
-H2O
(CH3)2C=CHCCH3
(2)反应机理
酸催化下的反应机理
+
OH
O CH3CCH3
H+
+
OH
-H+
OH CH3C=CH2
CH3CCH3
CH3C-CH2-H
烯醇化
+
亲核加成
O OH
OH
OH
-H+
-H2O
CH3-C-CH2-C(CH3)2
所得加成产物在酸或碱存在下水解为原来的醛、酮,因此该 反应可用来分离提纯某些醛、酮。
这个反应也用来制备氰醇:
与氨的衍生物加成
Hydroxylamine
H2N OH
C N OH 肟
Oxime
H2N NH2
Hydrazine
C N NH2 腙 C O
Hydrazone
Phenylhydrazine
H2N NHPh O
1 + 2 = 791kJ / mol 4 + 3 = 728kJ / mol
在一般情况下,烯醇式在平衡体系中的含量是比 较少的,但随着-H活性 的增强,烯醇式也可能成为平 衡体系中的主要存在形式。
O CH3CCH3
O
O
O
C2H5OCCH 2COC 2H5
烯醇式含量 1.5 10-4
O
7.3
通过控制卤素的用量,可将卤化反应 控制在一元、二元、三元阶段。
卤化反应不能控制在一元卤化阶 段。
实例
O O
Cl
*1
+ Cl2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-OC H 2 5
HCOCH2COOC2H5 + CH3COCH2COOC2H5 + C2H5OH -OC H 2 5 COOC2H5 CH3COOC2H5 COOC H
2 5
COOC2H5 CH3COCH2COOC2H5 + C2H5OH COCH2COOC2H5
COOC2H5 COOC2H5
+ CH3CH2COOC2H5
CH3COCH2COOC2H5 5%NaOH CH3COCH2COO
-
H+
CH3COCH3
CO2
H CH2
CH3
O C
H CH2
O C
O
H CH2
O
CH3
C
O C
O
CH3
O C
O C
O
CH3COCH3
化学工业出版社
(乙)酸式分解
O CH3C CH2COOC2H5
40%NaOH
Δ
O 2CH3CONa + C2H5OH
CH3
O O C CH2 COEt + OC2H5
第四步 β–酮酸酯脱质子:
O O O O CH3 C CH COEt + OC2H5 H CH3 C CH COEt + C2H5OH
第五步 碳负离子的质子化(酸化):
O CH3C H O H CH COEt + H O O CH3C H O CH COEt + H2O
O O C CH2 C OC2H5 OH
酸式分解的机理:
CH3 O O C CH2 C OC2H5 OH CH3
-OH
O O CH3C + CH2C OC2H5 OH
O O CH3C O- + CH3C OC2H5
O 2 CH3C O + C2H5OH
化学工业出版社
乙酰乙酸乙酯与伯卤代烷的亲核取代反应:
(2) 乙酰乙酸乙酯实验室制法: 利用克莱森(Claisen)酯缩合反应制备
2 CH3COOC2H5
C2H5ONa
H+
- + [CH3COCHCOOC2H5] Na
CH3COCH2COOC2H5 (75%)
化学工业出版社
Claisen 酯缩合反应机理:
第一步 碱进攻α–H,产生烯醇负离子:
O CH2 COEt H O CH2 COEt O CH2 COEt
COCH3 Br(CH2)4Br + [CH3COCHCOOC2H5] Na Br(CH2)4CH COOC2H5
①稀OH -,②H+,③Δ 酮式分解
C2H5ONa
COCH3 COOC2H5
O C CH3
化学工业出版社
制备各种二酮:
CH3COCH2COOC2H5
+
NaH
[CH3COCHCOOC2H5]- Na+ + H2
反应特点: • 底物:含有两个α–氢的酯 • β–酮酸酯的去质子与酸化 • C―C键的生成 • 生成含两个官能团的产物分子
化学工业出版社
一般只含有一个α—氢的酯因α—H的酸性更加 弱而较难进行酯缩合反应。 需要比C2H5ONa更强的碱(如氢化钠,氨基钠或 三苯甲基钠等)作用下才能进行。
O
2 (CH3)2CHCOC2H5
+ H3 O
(C6H5)3CNa
O CH3 O (CH3)2CH C C C OC2H5 CH3
化学工业出版社
交叉Claisen酯缩合:
COOCH3
NaH
+
CH3CH2COOC2H5
O C
CH3 C COOC2H5 _
+ H
O C
CH3 CH COOC2H5
化学工业出版社
HCOOC2H5
CH3COOC2H5
化学工业出版社
往亚甲基上引酰基时,得到酰基化产物。为了避免 酰卤或酸酐被醇解,这个反应一般是用非质子极性 溶剂如DMF、DMSO而不用醇,强碱用NaH而不是 用醇钠。
O O CH3CCH2COC2H5
NaH DMF
O
O
+
CH3CCHCOC2H5 Na
O
RCCl
O
O
CH3CCHCOC2H5 R C O
0.04 13.50
化学工业出版社
某些化合物中烯醇式含量
酮式 烯醇式 烯醇式含量/%
CH3COC2H5 O CH3CH O CH3CCH3 O C2H5OCCH2COC2H5 O O CH3CCH2COC2H5 O O CH3CCH2CCH3 O O C6H5CCH2CCH3 O O
CH2 COC2H5 OH CH2 CH OH CH2 CCH3 OH C2H5OCCH COC2H5 O OH CH3C CHCOC2H5 OH O CH3C CHCCH3 OH O C6H5C CHCCH3 OH O
+
Br(CH2)nCOOC2H5
- + CH3COCHCOOC2H5 ①稀OH ,②H ,③Δ CH COCH (CH ) COOH 3 2 2 n (CH2)nCOOC2H5 酮式分解
注意,在制备酮酸时不可引入卤代酸,因为卤代酸中的 羧基是酸性基团,因其会分解乙酰乙酸乙酯的钠盐,使 反应难以进行。
CH2
COOC2H5 CH2 CH C O CH2 CH2
+
C2H5OH
化学工业出版社
COOC2H5 O
H2O
COOH O
H
+
O
COOC2H5 O
+
COOC2H5 O
CO2
H2O
H
+
O
+ CO
2
狄克曼缩合反应是合成五、六元碳环 的重要方法 化学工业出版社
12.3.2 乙酰乙酸乙酯的性质 (甲)酮式分解
CH3COCH2COOC2H5
RX
C2H5ONa
[CH3COCHCOOC2H5] - Na+
[CH3COCCOOC2H5] - Na+ R
CH3COCHCOOC2H5 R
R' CH3COCCOOC2H5 R
(CH3)3COK
R'X
上述反应为SN2反应,所以用伯卤代烷、苄基卤、烯丙基卤时 产率较高,仲卤代烷产率较低,叔卤代烷主要发生消除反应得 到烯烃。乙烯型和苯基型卤代烃由于卤素不活泼,也不发生上 述反应。
CH3 C CHCOOC2H5 OH
互变异构
共振杂化体与互变异构本质区别!
化学工业出版社
12.3 乙酰乙酸乙酯
12.3.1 合成
CH2 C CH2 O C O
(1)乙酰乙酸乙酯的工业制法
H2SO4
O
+ C2H5OH
[
O
重 排
CH2 CCH2COC2H5
OH
]
CH3 CCH2COC2H5
O
]
化学工业出版社
烯醇式含量
(%) 0.40 0.83 1.52 2.18
溶剂
烯醇式含量
(%)
丙酮 三氯甲烷 硝基苯 乙酸乙酯
7.3 8.2 10.1 12.9
甲醇
乙醇 丙醇
6.87
10.52 12.45
苯
乙醚 二硫化碳
16.2
27.1 32.4
戊醇
15.33
己烷
46.4 化学工业出版社
由上表可以看出,烯醇式的含量和溶剂的 极性密切相关。 非质子溶剂对烯醇式有利,因为在非质子 溶剂中有利于形成分子内氢键。 质子溶剂对酮式有利,这可能是由于质子 溶剂能与酮式的羰基氧原子形成氢键, 分子内氢键就难于形成,因而降低了烯醇 式的含量。 如乙酰乙酸乙酯的烯醇式含量 在己烷中为46.4%,而在乙醇中只有10.52%。
化学工业出版社
12.4 丙二酸二乙酯
12.4.1丙二酸二乙酯的合成
CH2COONa Cl
NaCN
CH2COONa CN
C2H5OH H2SO4
COOC2H5 CH2 COOC H 2 5
O CH 3C CH 2 O CCH 3
2,4-戊二酮(乙酰丙酮)
2,4-戊二酮 ( 乙酰丙 酮)
化学工业出版社
O β-酮酸及其酯 如:
O
CH3CCH2COC2H5
3-丁酮酸乙酯(乙酰乙酸乙酯) β-二元酸及其酯 如:
O C2H5OC CH2
O COC2H5
化学工业出版社
丙二酸二乙酯
12.2 烯醇式和酮式的互变异构形象
[CH3COCHCOOC2H5]- Na+
+
C6H5COCl
CH3COCHCOOC2H5 COC6H5
①稀OH -,②H+,③Δ 酮式分解
CH3COCH2COC6H5
1-苯基-1, 3-丁二酮
化学工业出版社
2[CH3COCHCOOC2H5] Na+
①稀OH -,②H+,③Δ 酮式分解
CH3COCHCOOC2H5 CH2Cl2 CH2 CH3COCHCOOC2H5
烯醇式
酮式
沸点:41℃(267Pa)
CH CH3 C O H C OC2H5 O
33℃(267Pa)
CH3 C CH COC2H5 OH O
分子内氢键
p-π共轭 使烯醇式稳定
化学工业出版社
乙酰乙酸乙酯烯醇式含量随溶剂、浓度、温度的不同而不同。
表12 1 乙酰乙酸乙酯烯醇式在各种溶剂中的含量
溶剂
水 25%乙醇 50%甲醇 50%乙醇
CH3 C CH2COOC2H5 O
