植物病原真菌的分离培养精选文档
02-鞭毛菌-菌物学-精选文档

游动孢子囊的形状有:球形、 卵形、洋梨 形、棍棒形、丝状、圆筒 状等多种,有的与 菌丝无显著区别。
(2)游动孢子为洋梨形或肾形,具一根或两根鞭 毛,可以在水中游动。游动孢子的鞭毛着生在游 动孢子的端、后端或侧端。 不同类型的真菌所产生游动孢子的鞭毛数目、
着生位置及鞭毛的形态结构不同。
一种游动孢子囊
进行交配的配子囊如形状、大小相似,称同型配子 囊。如差异很大称异型配子囊。通常把体积小的那 个叫雄器,大的称雌器。交配时 雄器中的核和原生 质进入雌器中。卵菌。
异形配子囊
(二)、生物学习性:
1、水生→两栖→陆生。 2、寄生、专性寄生、腐生、兼性寄生或腐生。 3、水生腐生菌常见于植物残体上,或见于鱼类、 昆虫的尸体残余上,水生寄生菌寄生在藻类或其它 水生菌上;陆生菌的腐生型生长在土壤或动物植物 的残骸上,寄生性陆生菌在土壤中的可以病如疫病、霜霉病等。 4、诱饵法搜集:果实、枝条、种子(如大麻籽)、 花粉、毛发、皮革、昆虫、玻璃纸等作为诱饵投入 塘水中,诱发水生鞭毛菌的生长。
有性结合方式
①游动配子配合(planogametic copulation):两个游动 配子的形状相似,有鞭毛,产生于配子囊内,进行交配的两 个配子,多半是同型的,也有异型的,交配时两个配子接合 在一起,形成一个双核的接合体,称作合子(或接合子)。 壶菌纲。
② 配子囊接触交配(gametangial contact) :
(三)、生活史:
(四)、分类
鞭毛菌亚门依据游动孢子鞭毛的数目、类型及着生位置,分4个纲。
1.壶菌纲:游动孢子后端具1根尾鞭。 2.丝壶菌纲:游动孢子前端具1根茸鞭。 3.根肿菌纲:游动孢子前端具2根长短不等尾鞭。 4. 卵菌纲:游动孢子具1根尾鞭和1根茸鞭。
植物免疫学试题精选文档

植物免疫学试题精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-一、名词解释1、单基因系:指一套具有相同遗传背景的品系,每个品系仅具有一个已知抗病基因。
2、基因对基因学说:指寄主植物与病原物双方一方某个基因是否存在取决于另一方相匹配基因的存续,双方基因的相互作用决定了特定的表现型,而由表现型的变化就可以判断任一方是否具有相匹配的基因。
3、诱导抗病性:由多种生物因子所激发的依赖植物化学或物理防卫屏障的主动抗病过程。
4、效应蛋白:指进入寄主细胞内改变寄主细胞结构和功能,有利于病原菌侵染的蛋白质。
5、简单基因座:基因在染色体上有多种排列方式,最简单的情况是一个座位仅有单个基因,称为简单基因座。
6、防卫反应基因:是指植物被病原物侵染后,在病原物激发子诱导下表达防卫反应功能的相关基因,其编码产物直接或间接地作用于病原物。
二、选择题1、基因对基因学说是由(B)提出的。
A、NelsonB、FlorC、ParlevlietD、Ross2、下列不属于商品化学诱抗剂的是(A)。
A、IAAB、INAC、BTHD、过敏素3、第一个克隆的无毒基因是(D)。
A、PtoB、LRRC、AvrD、Hm14、下列结构域代表核苷酸结合位点的是(C)。
A、TMB、LZC、NBSD、LRR5、下列不属于病原菌毒性变异体的来源的是(A)。
A、专化型B、突变C、有性重组D、准性生殖6、下列不属于病原菌生理小种鉴别程序的是(B)。
A、病叶标样采集B、遗传漂变C、菌种繁殖D、接种鉴别寄主7、下列不属于抗病基因的功能的是(A)。
A、鉴定小种B、典型R基因C、钝化病原菌毒素D、是病原菌的靶标8、下列抗病基因产物错误的是(C)。
A、TIR-NBS-LRRB、LZ-NBS-LRRC、LRR-NBSD、Pi-ta9、跨膜结构域的简称是(D)。
A、LRRB、NBSC、CCD、TM10、植物抗病性主要遗传特点是(A)。
植物组织培养的基本步骤精选文档

植物组织培养的基本步骤精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-植物组织培养的基本步骤成熟细胞离体——(脱分化)——分生细胞——(分裂)——愈伤组织——(再分化)——形态建成————完整植株。
培养基的主要成分【水分】【无机盐】1.大量元素:N,P,K,Ca,Mg,S(由相关的无机盐提供)2.微量元素:Fe,B,Cu,Mn,Mn,Zn,Co【有机营养成分】1.糖类 2.维生素 3.氨基酸 4.肌醇 5.天然有机物【植物生长调节剂】1.生长素 2.细胞分裂素 3.其他生长调节剂【凝固剂】琼脂【其他物质】1.活性炭 2.抗生素 3.抗氧化物质 4.硝酸银培养基和组织培养用具的灭菌方式【培养基,无菌水】高压蒸汽灭菌,灭菌15~30分钟【移栽基质】曝晒,甲醛熏蒸或高压蒸汽灭菌灭菌1~2h【接种室,缓冲室】紫外线灯照射30min,或气雾消毒剂【超净工作台】紫外线灯30min,之后打开风机过滤除菌【外植体】不同的化学消毒剂浸泡消毒【接种工具】70%乙醇浸泡或擦拭,之后用火焰灼烧灭菌【培养室】3%来苏尔喷雾,或甲醛,气雾消毒熏蒸【皮肤】先用肥皂洗手,接种前用70%乙醇擦拭【瓶口,管口】70%乙醇擦拭,用火焰封口【培养瓶表面】70%乙醇擦拭【台面,桌面】70%乙醇擦拭或喷雾消毒植物外植体的灭菌方式【茎尖,茎段,叶片】1. 用70%乙醇浸泡30秒,再用无菌水冲洗1次。
2.用2%次氯酸钠浸泡15min或%升汞浸泡5~10min。
3.若材料有绒毛,最好在消毒液中加入几滴吐温。
4.消毒时要不断震荡,使植物材料与消毒剂充分接触。
5.最后用无菌水冲洗3~5次。
【果实】1.用乙醇迅速漂洗一下,再用无菌水冲。
2.用2%次氯酸钠浸泡10min,用无菌水冲洗2~3次。
【种子】用10%次氯酸钠浸泡20~30min,或%升汞消毒5~10min,然后再用无菌水冲洗3~5次。
茎尖分生组织培养-精选文档

(3)培养
接种后材料置25+2℃ ,光照度1500-5000LX,每 日光照10-16h条件下培养。但一般光照培养比暗 培养效果好。其间应更换新鲜培养基。提高培养 基中BA的浓度可形成大量从生芽。
3.培养基与培养方式 : (1)培养基:常用MS, White等培养基。 (2)培养方式:茎尖培养一般采用半固体培 养基
三、无病毒苗的保存和繁殖
(一)无病毒苗的保存 无病毒植株并不是有额外的抗病性,它们有 可能很快又被重新感染。所以一旦培育得 到无病毒苗,就应很好保存,这些原原种 或原种材料保管得好可以保存利用5~10年。 1.隔离保存
• 通常无病毒苗应种植在隔虫网内,使用300目, 即网眼为0.4~0.5mm大小的网纱,也可用盆栽 钵,可以防止蚜虫、叶蝉、土壤线虫进入。栽培 用的土壤也应进行消毒,周围环境也要整洁,并 及时喷施农药防治虫害,以保证植物材料在与病 毒严密隔离的条件下栽培。•有条件的地方可以到 海岛或高冷山地种植保存,那里气候凉爽,虫害 少,有利于无病毒材料的生长,繁殖。另一种更 便宜的方法,是把由茎尖得到的并已经过脱毒检 验的植物通过离体培养进行繁殖和保存。
(二)热处理脱毒 1.原理 热处理脱毒又叫热温处理或热疗法。其基本 原理是一些病毒对热不稳定,在高于常温 的温度下(35-40度)既钝化失活。 2.热处理法有:温汤处理(热水浸泡)和热 风处理两种。
• 具体方法: • 第一,热水浸泡处理,适用于切下的材料, 在50度左右的温水中浸渍数分钟至数小时, 方法简便易行但材料易受伤。 • 第二,热风处理,将生长的盆栽植物移入 室内或生长箱内,处理温度因植物种类、 生理状况而异。一般为35~40度,短则几十 分钟,长达数月。
(三)茎尖培养脱毒 1.茎尖培养脱毒的原理
禽多杀性巴氏杆菌病病原的分离鉴定和药敏试验-最新年精选文档

禽多杀性巴氏杆菌病病原的分离鉴定和药敏试验1 巴氏杆菌属概述巴氏杆菌[1]属(Pasteurella )分类地位未定的1属,为无芽孢,不运动,兼性厌氧,菌体两端常染色浓重的革兰氏染色阴性小杆菌[2],因1880 年巴斯德氏首先自病鸡分离到本属中的多杀巴氏杆菌而得名。
[3]该属已确定的种有多杀巴氏杆菌、嗜肺巴氏杆菌、溶血巴氏杆菌、尿巴氏杆菌和鸭疫巴氏杆菌等。
属中的多杀巴氏杆菌危害畜、禽最严重,主要引起动物发生出血性败血症。
从发病动物体液或组织中培养分离到的菌落基本有两型:一为在过45°折光,低倍显微镜下,呈现鲜明的蓝绿色而带金光,边缘有狭窄的红黄色带的Fg 菌落型,相当于血清型乙型;另一为在45°折光下,低倍显微镜下,菌落呈现橘红色、边缘稍带狭窄的黄绿光的F0菌落型,相当于血清型甲型[4]。
在中国,牛、猪、驴和马的多杀巴氏杆菌病绝大多数为Fg型菌所致,家禽流行性巴氏杆菌病都是F0型菌所致[5]。
多杀巴氏杆菌菌体抗原有12个型,荚膜抗原有5 个型,前者以阿拉伯数字表示,后者以英文大写字母表示,如1:A,2; A,1:B等,已知组成的菌型有16个。
本菌血清型与宿主的分布有一定关系,其细胞壁含有明显的内毒素活性,但未发现外毒素。
本菌可引起家禽霍乱的暴发性流行,牛的出血性败血病、原发性或继发性肺炎等,国外免疫用的菌苗以加不同佐剂的灭活菌为主,也使用禽霍乱弱毒活菌,中国已于1959年使用弱毒活苗[6] 。
2 多杀性巴氏杆菌及其危害多杀性巴氏杆菌( Pasteurella multocida ,Pro )是一种重要的病原菌,对多种动物和人均有致病性,可以导致猪肺疫、禽霍乱、牛羊兔出血性败血症等危害严重的畜禽传染病。
多杀性巴氏杆菌正常存在于多种健康动物的肺和咽喉部黏膜,当动物处于应激状态、机体抵抗力低下时,细菌侵入体内,大量繁殖并致病,发生内源性传染。
此菌类在同种或不同种动物间可相互传染,蝉和蚤被认为是自体传播的媒介昆虫[7] 。
植物病理学 实验十四 植物病原菌物的分离和培养 图文
在10ml 培养基中加3滴25%的乳酸,可使大部分细菌受到 抑制。
培养环境; 分离材料; 病原物的类型
2.4 病原真菌的纯化
保证所用菌种是从单个细胞或单个孢子繁殖而来的纯种。
• 稀释法பைடு நூலகம்
A 水洋菜平板稀释法一 将纯净的水洋菜培养基,倒入培养皿中凝固,然后在灭
菌的载玻片上放入一滴水,加入孢子,配成浓度适当的悬 浮液,用三角涂抹玻棒,蘸上孢子悬浮液,涂抹于水洋菜 培养基表面,然后用低倍显微镜擦培养皿的反面检查孢子, 用蜡笔做一个记号,再用灭菌后的刀子或接菌针将这一块 培养基切下,移置在适宜的培养基上生长。 操作过程在接 菌台上,保持无菌状态。
水洋菜平板稀释法二
将菌种上产生的分生孢子用灭菌水洗下,稀释到每滴在低倍显微 镜下每视野大约有25个孢子左右。取灭过菌的试管,一支含有一毫 升无菌水,另一支含有9毫升WA培养基(大约45℃)。给无菌水的 试管加一滴孢子悬浮液(在低倍镜下,每滴孢子悬浮液在视野含有大 约25个孢子),然后把孢子悬浮液到入含有WA培养基的试管中,振荡 后倒入灭过菌的培养皿中,等凝固后,用低倍显微镜擦培养皿的反 面检查孢子,用蜡笔做一个记号,再用灭菌后的刀子或接菌针将这 一块培养基切下,移置在适宜的培养基上生长。
•干针挑取法: 干针挑取法:即用细缝衣针在低倍镜下直接挑取单个孢
子。此方法最适用于分离开的真菌孢子,如黑粉菌的厚坦 孢子、锈菌的夏孢子及一些担子菌的担子孢子。先将孩子 放在灭菌的载玻片上,用食指和大拇指握住缝衣针,在低 倍镜下检视,当针尖接触孢子时,孢子即离开载玻片而附 着于针尖上,然后移殖培养。
适合于分生孢子较大,颜色较深的孢子分离。
2.2 组织表面消毒 (surface sterilization) 和消毒剂
植物病原真菌的分离培养精编版
植物病原真菌的分离培养精编版MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】实验十三植物病原真菌的分离培养一、实验原理植物患病组织内的真菌菌丝体,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。
植物病原菌的分离就是指通过人工培养,从染病植物组织中将病原真菌与其它杂菌相分开,并从寄主植物中分离出来,再将分离到的病原菌于适宜环境内纯化,这个过程总称植物病菌的分离培养。
植物病原真菌的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。
二、实验目的:植物病原菌的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。
通过本实验,要求植物病原菌分离培养的一般原则和方法。
三、实验材料及准备:1.分离材料:梨黑斑病(Alternaria kikuchiana),柿树圆斑病(Pestnlotia sp)及杉木炭疽病(Glomerella cingolata)新发病的病叶;杨树烂皮病(Cytospora chrysosperma)国槐腐烂病(Dothiorella sp.)的带有新病斑的枝条;油松种子。
2.分离用具(每小组为单位)酒精灯4个,手术剪4把,眼科镊4把,PDA培养基3瓶,培养皿(Φ9cm)24套,小烧杯(5ml)4个,大烧杯1个,斜面培养基12管,灭菌水4瓶,75%酒精瓶1个(内放脱脂棉球)%升汞瓶1个,5%乳酸瓶(60ml)1个,火柴1盒,湿、干纱布各4张。
四、实验方法及步骤:(一)、分离前的准备工作:1.工作环境的清洁和消毒分离培养一般在无菌室、无菌箱或无菌工作台(超净工作台)上进行,无菌室和无菌箱要经过喷雾除尘,并用药物或紫外线照射消毒(常用消毒药物为70%酒精,2%煤酚皂液,5%石炭酸液等喷雾。
若用紫外线灯照射则需20-30分钟)。
一植物病原真菌的分离培养及纯化技术讲课文档
第1页,共60页。
2
第2页,共60页。
2)制作步骤
•马铃薯洗净,去皮称200g切块/条, •1000ml水煮沸30min, •用双层纱布滤去薯块, •加入15-20g琼脂,加热熔化,再加20g葡萄糖,
•待完全溶解后,趁热用双层纱布再过滤, •补水并定容到1000ml,分装于三角瓶或试管中,
28
第28页,共60页。
5)将吸干水分的病组织移到预先倒好的PDA平 板上,注意要用镊子轻压组织使其着靠在培养 基上。
29
第29页,共60页。
6)每皿5块,均匀摆放,倒置于25℃培养箱中培 养。4-5天后检查结果。写明日期、姓名等。
30
第30页,共60页。
各种真菌病害发生的部位和症状不同,其分离要根 据具体情况,采用不同的方法,下面介绍几种典型材 料的分离法。
分离烟草的根腐病菌(Thielaviopsis),用这种方法效果也很好,将烟草种
子播在培养皿中的吸水纸上,然后用田间采得的烟草病根切成小块,撒在种 间,幼苗染病后移到胡萝卜琼脂培养基平板上,病菌即生长而得到纯培养。
19
第19页,共60页。
3.组织的表面消毒剂
(1)酒精 用酒精(70%)消毒,只浸很短的时间(几秒钟到1分
32
第32页,共60页。
维管束组织内病原真菌的分离
33
第33页,共60页。
从根茎维管束组织分离 病菌,可先将寄主病部表 面用70%酒精擦拭消毒,
将表皮组织用灭菌的解剖刀 削去,然后切取其中小块变 色的维管束组织,用升汞或 漂白粉液消毒后,用灭菌水 冲洗几次,移置培养基面上 。
34
第34页,共60页。
比较安全的方法是不用药剂消毒,而以灭菌水洗8、9 次。
专题复习:病毒、细菌、真菌和传染病-精选文档
病原体 ,该 (1)引起人感染H7N9禽流感的病毒称为________ 寄生 病毒的营养方式(生活方式)为________ 。 不能 (2)健康人注射甲肝疫苗后,体内产生的抗体_______ (填“能"或“不能’’)对H7N9禽流感病毒产生作用。
(3)注意营养,加强锻炼属于传染病预防措施中的 保护易感人群 _________ 。
病毒离开 活细胞
五、病毒与人类的关系
有 害 方 面 有 利 方 面
1.部分病毒能使人动植物患病,如最常 见的感冒病毒、乙肝病毒、禽流感病毒、 烟草花叶病毒等。 2.一些细菌病毒会破坏人类使用微生物 进行生产的产业如味精业。
1.预防接种:制造病毒疫苗如:流感疫苗 2.利用病毒可制高效的生物农药
归
纳
几乎无处不在 细菌和真菌的分布:
。
细菌和真菌的培养; 1、配置培养基(含有营养物质) 2、高温灭菌 3、接种 4、恒温培养 细菌和真菌生活所必需的基本条件:一定的水分, 适宜的温度,充足的有机物。 最早发现细菌的科学家是列文虎克;被称为 “微生物学之父”的科学家是巴斯德。他还发现 了酵母菌(真菌),乳酸菌(细菌),以及保存 酒和牛奶的巴士消毒法和防止手术感染的方法。
杆状
球状
蝌蚪状
二、病毒的结构 ——无细胞结构
外壳:蛋白质 内部:遗传物质
三、营养方式—寄生
病毒的典型结构
病毒没有细胞结构,所以它们不能独立生活, 必须寄生在其他生物的细胞内(只能寄生在活细胞 里)。
三、病毒的种类
根据病毒寄生的细胞不同,将病毒分为三类:
动物病毒(狂犬病病毒,腺病毒)
植物病毒(烟草花叶病毒) 细菌病毒(又叫噬菌体)
病毒的寄主高度专一,一般来说病毒只能寄 生在特定的一种寄主身上,而对其他生物则 完全无害,如烟草花叶病毒仅仅危害烟草。
抑菌活性实验方案
精选文档八宝景天抑菌活性实验方案资料与仪器资料八宝景天(茎、叶、花),采摘于吉林农业大学校园,去离子水洗净,阴干,经粉碎机粉碎(过40~60目筛),所得植物粉用密封袋于遮光处保留备用。
微生物真菌:黄瓜枯败病菌(Fusariumoxysporum)、黄瓜黑星病菌(Cladosporiumcucumerinum)、辣椒炭疽病菌(Colletotrichumnigrum)由吉林省蔬菜花卉科学研究院供给。
番茄叶霉病菌(Fulviafulva)、番茄早疫病菌(Alternariasolani)、甜瓜茎腐病菌(Fusariumgramimearum)、水稻立枯病菌(RhizoctoniasolaniKuhn)、番茄灰霉病菌(Botrytiscinerea)、黄瓜菌核病菌(Sclerotiniasclerrotium)均由吉林农业大学农学院植物病理研究室供给。
试剂与仪器95%乙醇剖析纯国药企业化学试剂有限企业葡萄糖剖析纯国药企业化学试剂有限企业琼脂粉生化试剂天津科密欧化学试剂有限企业马铃薯JFSD-100粉碎机上海淀久中药机械制造有限企业JJ200型精细电子天平美国双杰兄弟有限企业常熟双杰测试仪器厂HH-S数显恒温水浴锅江苏省金坛市医疗仪器厂RE-2000旋转蒸发器上海亚荣生化仪器厂SHZ-III型循环水真空泵上海亚荣生化仪器厂TDL-5A低速大容量离心计上海悦丰仪器仪表有限企业生化培育箱SPX-250型上海跃进医疗器材厂ZKF035电热真空干燥箱上海实验仪器厂有限企业KQ5200B 型超声波冲洗器昆山市超声仪器有限企业不锈钢手提式灭菌器上海申安医疗器材厂超净工作台上海生物科技有限企业.精选文档培育基的制备真菌都用马铃薯葡萄糖琼脂培育基(PDA培育基)马铃薯(去皮) 200g葡萄糖20g琼脂20g水1000mLpH值自然培育基详细制作方法是:将200g马铃薯去皮,去芽眼,切成小条放入铝锅中,加入1000mL水,煮沸20~30分钟左右至马铃薯软而不烂时,用 6~8层纱布过滤,取滤汁于锅中,补水至1000mL,加入琼脂消融,再加入糖搅拌平均,趁热分装于试管或锥形瓶中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物病原真菌的分离培
养精选文档
TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
实验十三植物病原真菌的分离培养
一、实验原理
植物患病组织内的真菌菌丝体,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。
植物病原菌的分离就是指通过人工培养,从染病植物组织中将病原真菌与其它杂菌相分开,并从寄主植物中分离出来,再将分离到的病原菌于适宜环境内纯化,这个过程总称植物病菌的分离培养。
植物病原真菌的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。
二、实验目的:
植物病原菌的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。
通过本实验,要求植物病原菌分离培养的一般原则和方法。
三、实验材料及准备:
1.分离材料:梨黑斑病(Alternaria kikuchiana),柿树圆斑病(Pestnlotia sp)及杉木炭疽病(Glomerella cingolata)新发病的病叶;杨树烂皮病(Cytospora chrysosperma)国槐腐烂病(Dothiorella sp.)的带有新病斑的枝条;油松种子。
2.分离用具(每小组为单位)
酒精灯4个,手术剪4把,眼科镊4把,PDA培养基3瓶,培养皿
(Φ9cm)24套,小烧杯(5ml)4个,大烧杯1个,斜面培养基12管,灭菌水4瓶,75%酒精瓶1个(内放脱脂棉球)%升汞瓶1个,5%乳酸瓶(60ml)1个,火柴1盒,湿、干纱布各4张。
四、实验方法及步骤:
(一)、分离前的准备工作:
1.工作环境的清洁和消毒
分离培养一般在无菌室、无菌箱或无菌工作台(超净工作台)上进行,无菌室和无菌箱要经过喷雾除尘,并用药物或紫外线照射消毒(常用消毒药物为70%酒精,2%煤酚皂液,5%石炭酸液等喷雾。
若用紫外线灯照射则需20-30分钟)。
在没有上述设备条件时,在清洁房间里关闭门窗,避免空气流动,经过喷雾除去空气及地面灰尘后进行操作,也可获得较好的结果。
工作前擦净桌面,最好铺上湿纱布。
将所需用的物品按次序放在工作台上,避免工作时走动,工作人员最好穿上灭菌后的工作服,带上口罩,并用肥皂洗手,用70%酒精或%新洁尔灭擦手。
2.分离用具的消毒
凡是和分离材料接触的器皿(刀、剪、镊、针等)都要随时(至少在使用时)保持无菌,将这些用具浸于70%酒精中,使用时在灯焰上灭菌烧去酒精,如此2-3次(刀、剪、镊等不宜在灯焰上烧时过长,以防退火)。
再次使
用时必须重复灭菌。
培养皿、试验等要经过干热灭菌。
培养基及洗涤或稀释用蒸馏水都需要事先经过高压蒸气灭菌。
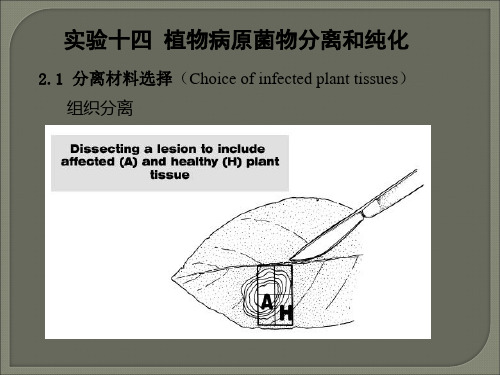
3.分离材料的选择
用新发病的植株、器官或组织做为分离材料,可以减少腐生菌的污染。
任何植物坏死部分的内部或表面,都可能有腐生微生物的孽生,所以一般斑点病害应从邻近健全组织,即从病、健组织交界处获得分离材料。
(二)、植物病原菌的分离
1.叶斑类和枝杆病斑类(非维管束侵染)病原菌分离:
首先选择具有典型症状的新鲜病叶作为分离材料,按下述步骤操作:
①培养基平板制备:将PDA培养基在微波炉中加热熔化验,以无菌操作法将溶化过的培养基倾注入灭过菌的培养基中,每皿经12毫升,可形成2-3毫米厚的平板。
(为防止细菌污染,倒碟前给每三角瓶内加6%乳酸4-6滴)。
②病叶或病枝经自来水冲洗,从病斑周转1-2毫米处的健组织部位剪下(若为枝干,则将带有病斑的皮层剥下,但)。
③取10毫升小烧杯经酒带消毒,放入分离材料,倒入%升汞液适量作表面消毒一分钟,或用1%漂白粉消毒均可。
④消毒后倾出消毒液,用无菌水冲洗2——3,最后一次无菌水不要倒掉。
⑤用灭菌镊,剪在无菌水中将分离材料剪成2——3毫米大小的方块,每块组织均应为病健相间组织。
用灭菌镊子夹取剪好的材料,放入培养基平板上,轻轻按压。
每皿4——5块,排放均匀。
⑥用蜡笔在培养皿上注明分离代号,日期、姓名,将培养皿翻转放置于23—25℃
⑦3——4日后挑选由分离材料上长出的典型而无杂菌的菌落,在菌落边缘用移菌针挑取带有菌丝的培养基一小块,转入试管斜面培养基中央,于25℃温箱中培养。
2.种子内病菌的分离:
将整粒种子或种子的一部分进行冲洗,再经表面消毒(升汞或漂白粉),最后用灭菌水洗涤后移到人工培养基平板上培养(或者直接放在皿内保湿培养于25℃温箱中)。
3.为害输导组织病原的分离(以枯萎病为代表)
先将分离茎作表面消毒,然后用灭菌刀剥去表皮,剪取其中小块变色的维管束组织,再用漂白粉进行表现消毒后,移于培养基平面上培养。
4.分离物的纯化
前述方法获得分离物,必须经过纯化,才能成为培养,纯化的方法有单孢子分离法和边续稀释培养法两种,后者简便,为了一般研究所常用。
连续稀释法:对真菌材料来说,就是从典型菌落边缘切取含有菌丝的培养基一小块,移植于另一培养基平板上,待菌落形成后,再依此法移植。
如此数次,直至菌落形态典型,无杂菌时即可移入斜面试管中培养保存。
附:
1、%升汞液的配制:升汞1克,浓盐酸毫升;加水1000毫升。
注意要先将升汞用盐酸溶解,然后加水稀释。
2、培养基成分;马铃薯200克,葡萄糖10—20克,洋菜17—20克,水1000毫升。
3、水洋菜培养基成分,洋菜17—20克,水1000毫升。
作业:
1、简述病原菌分离步骤;
2、报告分离培养结果,并分析成功或污染的原因;。
