2019版:美国胃肠病协会临床实践指南解读:胃黏膜肠上皮化生的管理(全文)
胃粘膜肠化生的治疗
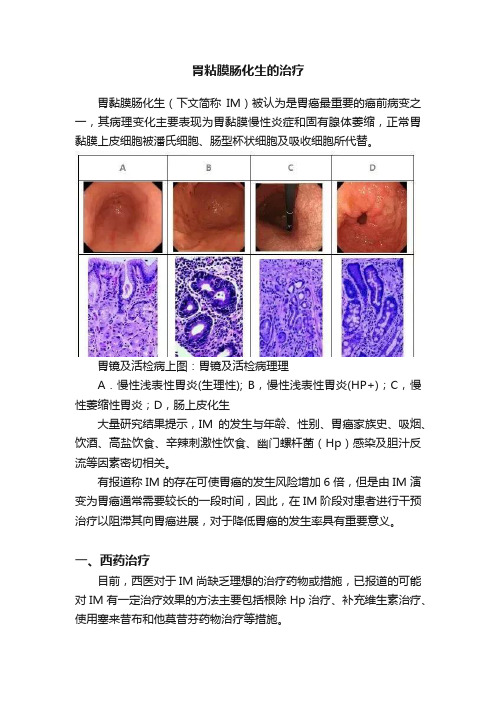
胃粘膜肠化生的治疗胃黏膜肠化生(下文简称IM)被认为是胃癌最重要的癌前病变之一,其病理变化主要表现为胃黏膜慢性炎症和固有腺体萎缩,正常胃黏膜上皮细胞被潘氏细胞、肠型杯状细胞及吸收细胞所代替。
胃镜及活检病上图:胃镜及活检病理理A.慢性浅表性胃炎(生理性); B,慢性浅表性胃炎(HP+);C,慢性萎缩性胃炎;D,肠上皮化生大量研究结果提示,IM的发生与年龄、性别、胃癌家族史、吸烟、饮酒、高盐饮食、辛辣刺激性饮食、幽门螺杆菌(Hp)感染及胆汁反流等因素密切相关。
有报道称IM的存在可使胃癌的发生风险增加6倍,但是由IM演变为胃癌通常需要较长的一段时间,因此,在IM阶段对患者进行干预治疗以阻滞其向胃癌进展,对于降低胃癌的发生率具有重要意义。
一、西药治疗目前,西医对于IM尚缺乏理想的治疗药物或措施,已报道的可能对IM有一定治疗效果的方法主要包括根除Hp治疗、补充维生素治疗、使用塞来昔布和他莫昔芬药物治疗等措施。
1、根除Hp治疗据报道,全球Hp感染率超过50%,认为Hp感染是胃炎、IM及胃癌的重要危险因素之一;Hp感染可通过导致胃黏膜炎症进而使IM 的发生风险增加4.5~9.0倍,尤其是Cag-A+的菌株。
因此,从理论上讲,根除Hp治疗有利于IM的恢复,故有人尝试通过根除Hp治疗进而诱导IM的逆转。
然而,一项荟萃分析结果显示,根除Hp治疗后,无论是胃窦部还是胃体部的IM并未像黏膜萎缩一样出现逆转。
来自日本等多个国家的研究结果也显示,根除Hp治疗并不能有效逆转IM,但一致认为,在胃黏膜出现IM病变之前进行根除Hp治疗有利于对胃炎的控制,而在出现IM之后进行Hp根除治疗虽然不能使IM发生逆转,但是有助于延缓IM的进展。
2、补充维生素目前已有充分证据证明摄入新鲜蔬菜和水果可有效预防胃癌,可能是由于其中含有抗氧化剂、维生素等;维生素C是存在于胃液中强有力的抗氧化剂,可使氧自由基失活,还有助于亚硝酸盐的清除。
因此有学者观察了补充维生素对IM的影响,结果显示,根除Hp治疗后给予补充β-胡萝卜素(在体内可转化为维生素A)和维生素C治疗,可使IM的逆转率从6%分别提高到20%和19%。
《慢性胃炎基层诊疗指南(2019年)》要点

《慢性胃炎基层诊疗指南(2019年)》要点一、概述(一)定义慢性胃炎是由多种病因引起的胃黏膜慢性炎症或萎缩性病变。
本质是胃黏膜上皮反复受到损害使黏膜发生改变,最终导致不可逆的胃固有腺体的萎缩,甚至消失。
该病易反复发作,不同程度地影响患者生命质量。
(二)流行病学慢性胃炎是基层消化内科门诊最常见的疾病,大多数慢性胃炎患者缺乏临床表现,因此在自然人群中的确切患病率难以获得。
(三)分类1. 基于病因分类:可将慢性胃炎分为Hp胃炎和非Hp胃炎。
2. 基于内镜和病理诊断分类:分为萎缩性和非萎缩性两大类。
3. 基于胃炎分布分类:分为胃窦为主胃炎、胃体为主胃炎和全胃炎三大类。
4. 特殊类型胃炎的分类:包括化学性、放射性、淋巴细胞性、肉芽肿性、嗜酸细胞性以及其他感染性疾病所致。
二、病因和发病机制(一)病因、诱因或危险因素1. Hp感染:2. 饮食和环境因素:3. 自身免疫:4. 其他因素:(二)发病机制1. Hp感染:2. 十二指肠-胃反流:3. 药物和毒物:4. 自身免疫:5. 年龄和饮食环境:三、诊断、鉴别诊断与转诊(一)诊断胃镜及活检组织病理学检查是慢性胃炎诊断和鉴别诊断的主要手段。
1. 临床表现:慢性胃炎无特异性临床表现,多数无明显症状,有症状者主要表现为上腹痛、腹胀、早饱感、嗳气等消化不良表现,部分还伴焦虑、抑郁等精神心理症状。
2. 内镜检查:上消化道内镜检查是诊断慢性胃炎的最主要方法,对评估慢性胃炎的严重程度及排除其他疾病具有重要价值。
3. 病理组织学检查:对慢性胃炎的诊断至关重要,应根据病变情况和需要进行活检。
4. 实验室检查:(1)Hp检测:(2)胃蛋白酶原(PG)、以及胃泌素-17(G-17)的检测:(3)血清抗壁细胞抗体、内因子抗体及维生素B12水平测定:(二)鉴别诊断慢性胃炎患者可出现上腹部不适、疼痛、反酸、腹胀等消化不良症状,需要与消化性溃疡、胃癌、慢性胆囊炎、胆结石以及肝、胰腺疾病相鉴别。
胃食管反流病基层诊疗指南(2019年)完整版

胃食管反流病基层诊疗指南(2019年)完整版一、概述(一)定义胃食管反流病(gastroesophageal reflux disease, GERD)是指胃十二指肠内容物反流入食管引起反酸、烧心等症状。
反流也可引起口腔、咽喉、气道等食管邻近的组织损害,出现食管外表现,如哮喘、慢性咳嗽、特发性肺纤维化、声嘶、咽喉炎和牙蚀症等。
(二)流行病学GERD是世界范围内的常见病,西方国家GERD患病率为10%~20%[1],国内尚缺乏大规模流行病学资料,有Meta分析显示国内GERD的患病率为12.5%[2],且呈现出南低北高的特点,可能与饮食习惯等因素有关。
虽然目前我国GERD患病率较西方国家低,但随着我国生活方式西化、人口的老龄化,GERD患病呈逐年上升趋势。
(三)分类根据反流是否导致食管黏膜糜烂、溃疡,分为糜烂性食管炎(erosive esophagitis, EE)、非糜烂性反流病(nonerosive reflux disease, NERD),其中NERD最常见。
EE可以合并食管狭窄、溃疡和消化道出血。
目前认为GERD的两种类型相对独立,相互之间不转化或很少转化,这两种疾病类型相互关联及进展的关系需要进一步研究证实。
二、病因和发病机制(一)诱因或危险因素流行病学资料显示GERD发病和年龄、性别、肥胖、生活方式等因素有关。
老年人EE检出率高于青年人[3]。
男性GERD患者比例明显高于女性[4]。
肥胖、高脂肪饮食、吸烟、饮酒、喝浓茶、咖啡等因素与GERD的发生呈正相关,而体育锻炼和高纤维饮食可能为GERD的保护因素[5,6]。
(二)发病机制胃食管反流的发生取决于抗反流防线与反流物攻击能力之间的平衡。
反流发生时,胃酸、胃蛋白酶、胆汁等反流物可直接刺激食管黏膜造成损伤,抗反流防御机制减弱可导致胃食管反流事件增多,而食管清除能力下降使反流物接触食管黏膜的时间延长,易导致攻击和损伤。
1.抗反流屏障结构和功能异常[7,8]:(1)贲门切除术后、食管裂孔疝、腹内压增高(妊娠、肥胖、腹水等)可导致食管下括约肌(lower esophagus sphincter, LES)结构受损。
USCAP2019消化系统病变主要内容总结

USCAP2019消化系统病变主要内容总结-本文已获作者授权,未经作者及本站授权,不得转载。
Best of USCAP:GI2019年3月16日~21日,在中华医学会病理学分会主要领导步宏教授和卞修武教授等精心组织和带领下,国内百余位病理专家赴美参加了108届北美病理学年会,本次会议在马里兰州Gaylord National Resort and Convention center召开。
与往届会议不同,本次会议上中华医学会病理学分会首次以Chinese Society of Pathology的名义举办伙伴会议及招待会;来自国内病理界的研究以口头发言或壁报形式进行交流的质量和数量与以往相比有了明显提高;CAPA会议上也对国内研究最佳摘要进行了评选和颁奖等等。
有关本次会议中国病理学家参会情况,李昱教授和沈丹华教授等已做了充分报道,本次报道就直奔主题,向大家介绍这次USCAP会议上消化系统疾病相关的内容。
该报道由来自复旦大学附属中山医院的纪元教授、华中科技大学同济医学院附属同济医院的王曦教授和南京大学医学院附属鼓楼医院的樊祥山副教授分别对肝脏、消化管道和胰腺胆道三个方面的内容进行总结,资料汇总后由樊祥山副教授进行整理,并由参加本次会议的我国消化病理界著名专家上海长海医院朱明华教授和河北医科大学附属第二医院张祥宏教授进行审校。
肝脏篇纪元复旦大学附属中山医院在Hans Popper肝脏病理协会组织下,本届年会的肝脏病理分会举办了大会报告及晚间读片,分会论坛共19个讲座,还有30个入选壁报的展示。
大会报告集中于肝脏病理中诊断中和鉴别诊断中具有挑战性的问题,内容涵盖了肝脏非肿瘤病理、肝脏肿瘤病理、肝移植病理等。
现就几个主要讲座分别进行介绍。
来自麻省总医院的Joseph Misdraji 教授介绍的肝脏炎性假瘤。
这是由纤维母细胞或肌纤维母细胞组成的伴有大量淋巴细胞、组织细胞和浆细胞浸润的肿块。
好发于年轻人,男性略多发,常见症状为无明显原因的发热、右上腹痛、体重减轻和疲乏。
幽门螺杆菌共识解读PPT课件

呼气试验原理 示意图
22
原理方程式
NH2-13CO-NH2+H2O → NH3+NH2-13CO-OH
尿素
氨 氨基甲酸酯
NH2-13CO-OH+ H2O → NH3+H213CO3
氨基甲酸酯
氨 碳酸
H213CO3 → 13CO2+ +H2O
碳酸 (气体)
NH3+H2O → OH-+NH4+
氨
33
幽门螺杆菌感染根除治疗指征
34
2012年井冈山共识推荐
Hp根除治疗适应证
HP阳性疾病
强烈推荐
消化性溃疡(不论是否活动和有无并发症史)
胃黏膜相关淋巴组织淋巴瘤
慢性胃炎伴消化不良症状
慢性胃炎伴胃黏膜萎缩、糜烂
早期胃肿瘤已行内镜下切除或手术胃次全切除
长期服用质子泵抑制剂
胃癌家族史
计划长期服用非甾体消炎药(包括低剂量阿司匹林)
2012 幽门螺杆菌感染处理共识
1
幽门螺杆菌
1982年,澳大利亚学者巴里·马歇尔和罗宾·沃 伦发现了幽门螺旋杆菌(Hp),并证明该细菌感染胃 部会导致胃炎、胃溃疡和十二指肠溃疡。这一研究 成果最终于20多年后获得了2005年诺贝尔医学奖。
2
幽门螺杆菌(HP)
Helicobacter Pylori
44
存在的问题 (1)
HP根除的适应症掌握不严且过滥 根据《幽门螺杆菌共识》中确定的适应症的 仅占8.1%
HP感染的诊断标准不规范 符合全国共识意见中的诊断标准仅占45.9%
45
存在的问题 (2)
抗HP方案不规范 抗生素使用不合理 疗程太长 ……
2019版:美国胃肠病协会临床实践指南解读:胃黏膜肠上皮化生的管理(全文)

2019版:美国胃肠病协会临床实践指南解读:胃黏膜肠上皮化生的管理(全文)胃癌在全球癌症相关性死亡率中排名第3位。
每年全球新发病例超过100万,其中绝大多数为非贲门型胃癌,主要发生于胃窦、胃角、胃体及胃底部[1,2]。
幽门螺杆菌(Helicobactor pylori,H. pylori)慢性感染是非贲门肠型胃癌的主要危险因素,全球至少80%胃癌可归因于H. pylori 感染。
非贲门肠型胃癌的发生通常经历正常胃黏膜—非萎缩性胃炎—萎缩性胃炎—肠上皮化生—胃癌的过程(Correa级联反应)[3]。
内镜下胃黏膜活检可发现癌前病变,近年来胃癌筛查和监测也引起了广泛关注。
在东亚,以人群为基础的筛查已在胃癌高发国家如日本和韩国开展;通过筛查提高了早期胃癌检出率,也使死亡率显著降低[4,5]。
而在胃癌发病率低的国家如美国,全民范围的筛查尚未得到认可;而对特定人群如具有组织学危险因素、特定种族及来自胃癌高发区的移民等是否有必要进行筛查和监测仍需明确。
胃黏膜肠上皮化生(gastric intestinal metaplasia,GIM)为发生异型增生前的组织学改变,与胃癌发生风险增加相关,在胃癌筛查和监测中可作为一种特异性的标志[3]。
但是,目前全球对GIM的管理模式尚存在较大差异,也缺乏基于循证医学证据的GIM患者管理指南。
因此,美国胃肠病协会(American Gastroenterological Association,AGA)发布本指南[6],指导临床医师对常规内镜检查中偶然发现GIM的患者进行管理。
一、指南解读本指南基于PICO框架确定了对于常规内镜检查中发现GIM的患者管理中的3个主要临床问题。
PICO框架包括如下要素:人群(Population)、干预措施(Intervention)、比较(Comparator)和结局(Outcome)。
1.对于GIM患者,是否需要进行H. pylori检测和治疗H. pylori是胃癌的致癌因子,全球范围内89%的非贲门型胃癌与H. pylori感染有关[7]。
胃黏膜低级别上皮内瘤变诊断和管理的研究进展

胃黏膜低级别上皮内瘤变诊断和管理的研究进展颜学良;艾耀伟;郭明文;田玲蓉【摘要】胃黏膜低级别上皮内瘤变(LGIN)是胃癌的癌前病变,以胃窦部多见,临床症状不典型,临床管理以随访或内镜干预为主.近年来,随着内镜技术的发展和临床研究的不断深入,LGIN在诊断和管理方面取得了一些新进展,但目前针对LGIN的临床管理仍缺乏统一认识,且活检病理易导致病灶被低估.本文就胃黏膜LGIN诊断和管理的研究进展作一综述.【期刊名称】《胃肠病学》【年(卷),期】2019(024)003【总页数】4页(P184-187)【关键词】胃;低级别上皮内瘤变;诊断;管理【作者】颜学良;艾耀伟;郭明文;田玲蓉【作者单位】三峡大学人民医院(宜昌市第一人民医院)消化内科 443000;三峡大学人民医院(宜昌市第一人民医院)消化内科 443000;三峡大学人民医院(宜昌市第一人民医院)消化内科 443000;三峡大学人民医院(宜昌市第一人民医院)消化内科443000【正文语种】中文胃癌是消化系统常见恶性肿瘤,全球死亡率仅次于肺癌[1]。
尽管近年来胃癌的诊断率和5年生存率不断提高,但其仍是全球最具挑战性的恶性肿瘤之一[2]。
1984年Ming等[3]提出胃黏膜异型增生是肠型胃癌发生前的终末阶段,现已得到大多数学者认可。
2000年引入上皮内瘤变概念,并使用二级分类标准分为低级别和高级别[4-5]。
高级别上皮内瘤变(high-grade intraepithelial neoplasia, HGIN)恶变风险高,目前临床上按早期胃癌标准进行内镜切除或外科治疗;而低级别上皮内瘤变(low-grade intraepithelial neoplasia, LGIN)具有部分可逆性,进展风险低,故临床和相关指南多推荐定期重复活检或内镜下治疗[6-7]。
近年来,随着内镜技术的发展和临床研究的不断深入,LGIN在诊断和管理方面取得了一些新进展,但目前针对LGIN的临床管理仍缺乏统一认识,且活检病理易导致病灶被低估。
ACG:Barrett 食管最新诊疗指南

ACG:Barrett 食管最新诊疗指南概述胃食管反流病(GERD)在世界范围内发病率逐年上升,其中 10%~15% 发生 Barret 食管(BE)。
后者因与食管腺癌(EAC)密切相关,其诊治受到广泛关注。
2015 年 11 月,美国胃肠病学会(ACG)在 Am J Gastrolenterol 杂志上在线发布了更新的 BE 临床诊治指南,对该病诊治提供了更多的循证依据,尤其是对需要筛查的高危患者范围规定以及内镜治疗的新内容更是亮点。
该指南共有 45 条推荐意见,分为诊断、筛查、监测、治疗(药物、内镜、手术)、内镜治疗后续处理、内镜培训等几个方面。
采用 GRADE 系统,证据等级分为:高、中等、低、极低四级,推荐等级分为:强烈、有条件二级(详见表 1)。
部分内容解读及循证依据1. BE 诊断的建立突起长度 < 1 cm 不诊断 BE 的原因为不同观察者之间可能存在差异及发生 EAC 的风险极低。
在美国诊断 BE 要求存在肠上皮化生(IM),而英国不要求。
研究发现 BE 发生 EAC 风险与 IM 有关,因此本指南仍以 IM 做为诊断 BE 的条件。
而 IM 的检出率与取材量正相关。
未证实 IM 者需在 1~2 年内复查,因有研究发现约 30% 会在复查时检出 IM。
2. BE 的流行病学及自然史发生 BE 的危险因素包括:慢性(5 年以上)GERD 史、年龄 >50 岁、男性、吸烟、中心型肥胖、白种人。
饮酒并不是危险因素,甚至可能是保护因素。
BE 患者的一级亲属更易罹患。
BE 患者发生异型增生及 EAC 的危险因素包括:年龄、BE 的突起长度、中心型肥胖、吸烟、非甾体类抗炎药(NSAIDs)/ 质子泵抑制剂(PPI)/ 他汀类药物使用不足。
BE 不同阶段与癌变的关系:无异型增生者癌变率约 0.2%~0.5% / 年,轻度异型增生(LGD)0.7%/ 年,重度异型增生(HGD)7%/ 年,>90% 的 BE 患者并非死于 EAC。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019版:美国胃肠病协会临床实践指南解读:胃黏膜肠上皮化生的管理(全文)胃癌在全球癌症相关性死亡率中排名第3位。
每年全球新发病例超过100万,其中绝大多数为非贲门型胃癌,主要发生于胃窦、胃角、胃体及胃底部[1,2]。
幽门螺杆菌(Helicobactor pylori,H. pylori)慢性感染是非贲门肠型胃癌的主要危险因素,全球至少80%胃癌可归因于H. pylori 感染。
非贲门肠型胃癌的发生通常经历正常胃黏膜—非萎缩性胃炎—萎缩性胃炎—肠上皮化生—胃癌的过程(Correa级联反应)[3]。
内镜下胃黏膜活检可发现癌前病变,近年来胃癌筛查和监测也引起了广泛关注。
在东亚,以人群为基础的筛查已在胃癌高发国家如日本和韩国开展;通过筛查提高了早期胃癌检出率,也使死亡率显著降低[4,5]。
而在胃癌发病率低的国家如美国,全民范围的筛查尚未得到认可;而对特定人群如具有组织学危险因素、特定种族及来自胃癌高发区的移民等是否有必要进行筛查和监测仍需明确。
胃黏膜肠上皮化生(gastric intestinal metaplasia,GIM)为发生异型增生前的组织学改变,与胃癌发生风险增加相关,在胃癌筛查和监测中可作为一种特异性的标志[3]。
但是,目前全球对GIM的管理模式尚存在较大差异,也缺乏基于循证医学证据的GIM患者管理指南。
因此,美国胃肠病协会(American Gastroenterological Association,AGA)发布本指南[6],指导临床医师对常规内镜检查中偶然发现GIM的患者进行管理。
一、指南解读本指南基于PICO框架确定了对于常规内镜检查中发现GIM的患者管理中的3个主要临床问题。
PICO框架包括如下要素:人群(Population)、干预措施(Intervention)、比较(Comparator)和结局(Outcome)。
1.对于GIM患者,是否需要进行H. pylori检测和治疗H. pylori是胃癌的致癌因子,全球范围内89%的非贲门型胃癌与H. pylori感染有关[7]。
既往22项相关研究(包括7项随机对照和3项队列研究)探讨了对于组织学检查发现GIM的患者是否应予根除H. pylori治疗,结果显示:与安慰剂相比,对于存在或不存在GIM者,根除H. pylori 可使胃癌发生总体风险减少32% (风险比0.68,95%CI:0.48~0.96),胃癌死亡总风险降低33%(风险比0.67;95%CI:0.38~1.17)。
对于存在H. pylori感染的GIM患者,根除H. pylori也可显著降低胃癌发生风险(风险比0.76;95%CI:0.36~1.61)。
鉴于H. pylori感染与胃癌发生风险的相关性,AGA强烈推荐对于内镜检查偶然发现GIM的患者,应予检测并根除H. pylori治疗。
支持这一推荐的证据质量为中等,部分原因是由于目前尚缺乏根除H. pylori后对于GIM患者结局(胃癌死亡率)影响的相关研究。
此外,研究结果很大程度受失访偏倚的影响;且这些研究均在中国本土人群中开展,而不同人群中的胃癌风险本身也存在差异。
2.对于GIM患者,是否需要常规进行内镜随访与监测GIM患病率约5%,GIM患者年胃癌发生风险仅为0.16%,10年累积风险约1.6%。
目前尚无证据表明内镜监测可影响GIM患者胃癌发生率或死亡率,故AGA不推荐对GIM患者常规进行内镜监测。
对具有胃癌高风险的GIM患者,可合理进行内镜监测。
胃癌高风险的GIM患者包括:具有不完全型肠化生(至少部分为结肠型化生)、广泛型肠化生[累及胃体及胃窦和(或)胃角]及有胃癌家族史者。
虽然没有证据表明部分民族/种族(西班牙裔、亚洲人、黑人)及来自胃癌高发区的移民中GIM患者胃癌风险增高,但由于这些人群胃癌发生的总体风险增高,故也应考虑予以内镜监测。
但是这些证据的等级均极低。
目前尚无直接证据支持或反对GIM患者根除H. pylori后进行内镜监测。
对于最佳内镜随访间隔目前尚无定论,基于GIM患者累积胃癌风险的间接证据,对于偶然发现的GIM,AGA建议每3~5年进行1次内镜检查,应对胃黏膜进行仔细检查并对胃窦、体或任何可疑部位进行活检。
3.对于不存在异型增生的GIM患者,是否需要进行以胃癌危险分层为目的的短间隔重复内镜及活检目前尚无直接证据支持短间隔(<1年)重复内镜检查会影响GIM患者的结局。
有研究显示:诊断GIM后1年内患者胃癌的累积发生率估计值为0.5%(95%CI:0.4%~0.6%),提示漏诊胃癌的总体风险较低。
因此,AGA不推荐对于GIM患者常规进行以危险分层为目的的短间隔重复内镜检查。
对于具有胃癌高危因素的GIM患者(如内镜下发现异常改变)及胃癌风险增加的GIM患者(不完全型肠化生,广泛型肠化生,一级亲属有胃癌家族史,西班牙裔、亚洲裔、非洲裔、美国原住民/阿拉斯加原住民及来自胃癌高发区的移民),可基于医患共同决策,合理进行内镜复查。
复查时间为完成基线内镜检查1年后,可于异常部位进行靶向性活检或于胃窦和胃体部进行非靶向性活检,从而根据肠化生的范围和组织学分型对患者进行胃癌风险分层,并进一步排除胃癌可能。
若对于基线内镜检查的质量或完整性存疑,和(或)需对肉眼发现的异常进行再评价的患者,也可选择短间隔重复内镜检查以排除胃癌。
二、讨论GIM是内镜检查中常见的病理改变,且通常患者进行内镜检查的最初目的并不是筛查胃癌,由此就产生了一系列问题:对于GIM患者是否应检测和根除H. pylori?是否应进行内镜监测?是否存在未被发现的进展性病变?为了进行精确危险分层和(或)排除胃癌是否需要短间隔重复内镜检查?该指南中,基于中等质量证据,AGA推荐对GIM患者检测并根除H. pylori;基于极低质量证据,AGA不推荐常规进行短间隔重复内镜检查和纵向内镜监测。
由于不完全型GIM和广泛型GIM与胃癌风险增加相关,医患双方可以共同决策,合理选择进行短间隔重复内镜检查以发现是否存在这些病变,或对已存在这些病变的患者进行纵向监测。
同样,由于一级亲属患有胃癌的GIM患者胃癌发生风险增加,故AGA建议对这些患者合理进行纵向内镜监测。
对部分民族/种族的GIM患者进行最佳管理仍然是一个挑战,有限的证据显示不同民族/种族GIM患者之间胃癌累积发生风险并无显著性差异,但是由于存在较宽的可信区间及不同的点估计值,不能排除实际存在有临床意义的差异。
故AGA推荐对部分民族/种族的GIM患者可合理选择短间隔重复内镜检查和(或)纵向内镜监测,以确定GIM的范围和组织学亚型并排除癌症。
与该指南相比,来自美国和欧洲的其他专业学会针对GIM患者的管理意见基本相似。
2015年,美国胃肠内镜学会(American Society for Gastrointestinal Endoscopy,ASGE)指南提出:推荐对具有种族背景或家族史的胃癌高风险GIM患者进行内镜监测;最佳监测周期应予个体化处理[8]。
ASGE指南还建议当连续2次内镜检查均未发现异型增生时可暂停内镜监测;如存在H. pylori感染,建议进行根除。
因此,ASGE和AGA指南均不推荐对GIM患者进行常规内镜监测;对有胃癌家族史或高风险的GIM患者应在医患双方共同决策下进行内镜监测,但监测周期目前尚无定论。
欧洲胃肠道内镜学会(European Society of Gastrointestinal Endoscopy,ESGE)2019年也发布了胃癌前病变的管理指南[9]。
与该AGA指南相似,ESGE也推荐GIM患者进行根除H. pylori 治疗。
ESGE建议对于局限型GIM并有胃癌家族史者、不完全性GIM、持续性H. pylori胃炎患者在基线内镜检查后3年内进行内镜监测(低质量证据,弱推荐);对胃窦和胃体均存在严重萎缩或肠化生和(或)与胃癌风险联系的胃炎评估(Operative Link for Gastritis Assessment,OLGA)、与胃癌风险联系的肠化生评估(Operative Link for Gastric Intestinal Metaplasia Assessment,OLGIM)分级为Ⅲ/Ⅳ级的患者建议每3年进行1次内镜检查(低质量证据,强烈推荐);对于有胃癌家族史且同时存在以上情况者可考虑每1~2年进行内镜监测(低质量证据,弱推荐)。
总之,对于不存在广泛型GIM、不完全型GIM及无胃癌家族史的GIM患者,ESGE和AGA均不推荐进行常规内镜监测。
对于存在广泛型GIM、不完全型GIM及有胃癌家族史者,AGA推荐权衡利弊后医患共同决策是否进行内镜监测;ESGE则明确推荐对广泛型GIM患者进行内镜监测,而对于有胃癌家族史和不完全型GIM者可考虑进行监测。
对于内镜监测周期,AGA建议为3~5年;而ESGE建议为3年,且对于广泛型GIM并有胃癌家族史者应进行更为密切的监测。
此外,ESGE并没有对为了证实GIM的存在或范围进行短间隔重复内镜检查做出明确的推荐或反对意见,其所有的推荐意见都以至少包含胃窦和胃体的活检结果为依据。
对于目前的证据缺陷AGA指南中还强调了未来的研究方向:目前尚缺乏观察性研究和随机对照研究证实内镜监测与否对GIM患者结局(如胃癌早期发现和预防)的影响;需要证实广泛型与局限型GIM对胃癌风险评估的意义;需要证实重复进行基线内镜检查以确定GIM范围和组织学亚型的临床收益;还应对常规病理学检查判断完全型或不完全型GIM的临床收益进行评价。
此外,目前对于根除H. pylori后GIM是否仍然进展尚存在争议[10,11,12,13];增加GIM检出率的理想活检方案也有待确定。
尽管之前的OLGA和OLGIM分级方案有助于识别胃癌高风险患者,但是这些方案在临床实际应用中也存在困难[14,15]。
应用色素内镜、窄带成像技术等进行靶向性活检有助于提高GIM的检出率[16,17],但这些技术应用于常规检查是否可改善患者的临床结局还有待进一步研究。
此外,还应在预防胃癌的大背景下研究GIM管理的成本效益比。
总之,AGA推荐对GIM患者进行H. pylori检测和根除以降低胃癌发生风险。
鉴于目前缺乏足够的证据,AGA不推荐对GIM患者进行常规内镜监测,不推荐以危险分层为目的的短间隔重复内镜检查及活检,医患双方可根据实际情况权衡利弊后决定是否进行内镜监测。
未来尚需进一步研究以弥补目前的证据缺陷,从而指导GIM患者的临床管理。
