imagej常规功能教程
imagej用户使用手册第三部分

imagej用户使用手册第三部分摘要:一、ImageJ 概述1.ImageJ 的定义与作用2.ImageJ 的发展历程二、ImageJ 的安装与配置1.安装环境要求2.下载与安装步骤3.配置ImageJ三、ImageJ 基本操作1.文件打开与保存2.图像调整与处理3.图像测量与分析四、ImageJ 的高级功能1.批量处理2.插件安装与使用3.脚本编写与运行五、ImageJ 的应用领域1.生物医学研究2.材料科学3.环境科学4.其他领域六、ImageJ 的社区与资源1.官方论坛与邮件列表2.ImageJ 教程与文档3.第三方插件与资源七、ImageJ 的更新与维护1.版本更新2.问题修复与改进3.未来发展方向正文:ImageJ 是一款功能强大的图像处理软件,适用于各种领域。
它不仅免费、开源,而且具有丰富的插件和大量的社区资源。
本文将介绍ImageJ 的概述、安装与配置、基本操作、高级功能、应用领域、社区与资源以及更新与维护。
ImageJ 是一款基于Java 的图像处理软件,最早由美国洛斯阿拉莫斯国家实验室开发。
它具有强大的图像处理、分析和可视化功能,适用于生物医学、材料科学、环境科学等多个领域。
ImageJ 的发展历程可追溯到1997 年,至今已经过多次更新与改进,拥有了丰富的功能和应用。
要使用ImageJ,首先需要满足一定的安装环境要求,如Java 运行环境等。
然后从官方网站下载合适版本的软件并按照安装向导完成安装。
安装完成后,用户可以根据需要对ImageJ 进行配置,如更改默认设置、安装插件等。
ImageJ 的基本操作包括文件打开与保存、图像调整与处理、图像测量与分析等。
用户可以通过菜单栏、工具栏和快捷键轻松完成各种操作。
此外,ImageJ 还提供了许多高级功能,如批量处理、插件安装与使用、脚本编写与运行等,方便用户进行更复杂图像处理任务。
ImageJ 广泛应用于生物医学研究、材料科学、环境科学等领域。
imagej使用手册

imagej使用手册
ImageJ是一款功能强大的图像处理和分析软件,使用手册如下:
1. 安装与运行:ImageJ可以在线或下载后运行,只要安装了Java 或更高
版本虚拟机的计算机即可。
支持Windows、Mac OS X以及Linux系统。
2. 显示、编辑、分析、处理、保存和打印图像:ImageJ可以显示、编辑、
分析、处理、保存和打印8位、16位和32位图像。
可读取的图片格式包括TIFF、GIF、JPEG、BMP、DICOM、FITS以及“原始图件”。
支持“堆栈”(以及多维的堆栈),一系列的图片共用一个窗口。
3. 图像处理和测量计算:可以计算用户自定义选择的面积和像素值统计,可以测量距离和角度,可以创建密度直方图和线图。
所有功能在任意倍数下均可使用。
此外,ImageJ是多线程的程序,因此,像图片读取这种较耗时的操作可与
其他操作同时进行。
希望以上信息对您有帮助。
imagej的使用方法

imagej的使用方法
ImageJ是一款功能强大的图像处理软件,可以帮助用户轻松地进行图像的测量、分析、编辑等操作。
本文将指导用户如何使用ImageJ来处理图像。
首先,用户需要下载ImageJ软件,然后将图像导入ImageJ中。
用户可以选择从本地文件夹中导入图像,也可以从网络中导入图像,比如URL、FTP等。
接下来,用户可以通过ImageJ的图像处理功能对图像进行处理。
用户可以根据自己的需要调整图像的亮度、对比度、饱和度等参数。
此外,ImageJ还支持用户对图像进行滤镜处理、裁剪、旋转和缩放等操作。
同时,ImageJ还支持用户对图像进行测量和分析。
用户可以通过ImageJ的测量工具来测量图像中的面积、长度和角度等信息。
此外,ImageJ还拥有强大的图像分析功能,可以帮助用户分析图像中的细节信息,提取出图像中的特征和目标。
最后,用户可以通过ImageJ对图像进行编辑。
ImageJ提供了大量的编辑工具,可以帮助用户轻松添加文字、图标、标签等内容,以增加图像的可读性。
总之,ImageJ是一款强大的图像处理软件,可以帮助用户轻松地
进行图像的测量、分析、编辑等操作。
通过本文的指导,用户可以轻松地使用ImageJ来处理图像。
ImageJ基础操作:给图片添加文字和标注
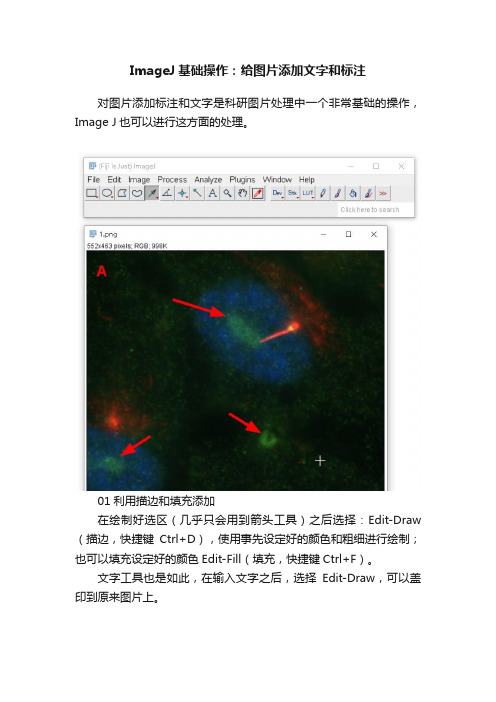
ImageJ基础操作:给图片添加文字和标注对图片添加标注和文字是科研图片处理中一个非常基础的操作,Image J也可以进行这方面的处理。
01利用描边和填充添加在绘制好选区(几乎只会用到箭头工具)之后选择:Edit-Draw (描边,快捷键Ctrl+D),使用事先设定好的颜色和粗细进行绘制;也可以填充设定好的颜色Edit-Fill(填充,快捷键Ctrl+F)。
文字工具也是如此,在输入文字之后,选择Edit-Draw,可以盖印到原来图片上。
如果要修改颜色、字体、粗细等绘图属性,可以选择Edit-Option-Colors/Fonts/Line Width…进行修改。
当然,其中一些选区工具如Arrow T ools(箭头工具)可以直接双击该工具修改其绘图属性。
颜色的修改还可以双击工具栏中的Color Picker(拾色器)来修改:当然,Fiji也提供简单的绘图工具,包括Pencil Tool(铅笔工具)、Paintbrush T ool(画笔工具)、Flood Fill Tool(填充工具)和Overlay Brush T ool(浮层画笔工具),可以直接或者以Overlay的形式在图片上面进行涂鸦,但是科研图片处理中基本用不到。
每个工具都可以双击进行属性修改。
02 利用ROI Manager添加也可以将标注(文字和箭头等)以选区的形式保存到选区管理器(ROI Manager)里面,勾选Show All,然后利用拼合图层(Flatten)来盖印生成新的图片。
注意:会新生成一个添加了标注的图片。
03 利用Overlay图层添加在利用选区工具和文字工具做好标注之后,还可以使用Image-Overlay-Add Selection(快捷键是Ctrl+B),来建立Overlay图层,最后直接导出成非tif格式图片,获得标注后的图片。
或者建立Overlay图层之后,利用ROI Manager的拼合图层(Flatten)在本图层盖印,再导出成各种位图格式。
imagej用法 -回复

imagej用法-回复ImageJ是一款功能强大且易于使用的开源图像处理软件。
它由美国国立卫生研究院(NIH)开发,广泛应用于科学研究领域和生物医学图像处理。
本文将一步一步介绍ImageJ的基本用法,帮助读者快速上手使用该软件。
一、ImageJ的安装和启动首先,我们需要下载ImageJ软件并安装到计算机中。
可以通过ImageJ 官方网站(安装完成后,双击桌面上的ImageJ图标启动软件。
软件启动后,会弹出一个欢迎界面,显示软件的版本号和一些基本信息。
点击“OK”按钮关闭欢迎界面,进入软件的主界面。
二、打开和保存图像ImageJ可以打开常见的图像格式,如JPEG、PNG、BMP等。
在主界面中,点击“File”菜单,选择“Open”选项,弹出文件选择对话框。
在对话框中选择要打开的图像文件,并点击“打开”按钮。
软件会将选中的图像文件加载到主界面中显示。
如果想要保存图像,可以选择“File”菜单,然后选择“Save As”选项。
弹出保存对话框后,选择保存的文件路径和文件名,并选择保存的文件格式,最后点击“保存”按钮完成保存操作。
三、基本图像处理操作ImageJ提供了丰富的图像处理操作,包括调整亮度和对比度、裁剪图像、旋转图像等。
下面我们来介绍几个常用的图像处理操作。
1.调整亮度和对比度:点击“Image”菜单,选择“Adjust”选项,然后选择“Brightness/Contrast...”选项。
弹出的对话框中可以通过调整滑动条来改变图像的亮度和对比度。
2.裁剪图像:点击“Image”菜单,选择“Crop”选项。
然后使用鼠标在图像上拖拽一个矩形框,表示要裁剪的区域。
释放鼠标后,软件会自动裁剪选定的区域,并更新显示。
3.旋转图像:点击“Image”菜单,选择“Transform”选项,然后选择“Rotate...”选项。
在弹出的对话框中,可以通过填写角度来指定旋转的角度,然后点击“OK”按钮完成旋转操作。
imagej基本操作

imagej基本操作
ImageJ是一个强大的图像处理软件,以下是其基本操作:
1. 打开图像:选择“File”菜单中的“Open”选项,然后选择要打开的图像文件。
2. 图像显示:在“Display”菜单中选择不同的颜色通道或颜色模式来显示图像。
3. 调整图像大小:选择“Image”菜单中的“Resize”选项,然后输入新的图像大小。
4. 裁剪图像:选择“Edit”菜单中的“Crop”选项,然后选择要裁剪的区域。
5. 调整亮度/对比度:选择“Image”菜单中的“Adjust”选项,然后选择“Brightness/Contrast”进行调整。
6. 滤镜处理:选择“Process”菜单中的“Filter”选项,然后选择不同的滤镜进行处理。
7. 测量工具:选择“Analyze”菜单中的“Measure”选项,然后选择要测量的长度、角度等参数。
8. 绘制线条或标记:选择“Draw”或“Label”工具,然后在图像上绘制线条或标记。
9. 保存图像:选择“File”菜单中的“Save As”选项,然后选择要保存的文件格式。
10. 退出程序:选择“File”菜单中的“Exit”选项,然后保存所有未保存的更改。
以上仅是ImageJ的基本操作,它还有更多高级功能和工具,可以进一步探索并掌握。
imagej常用功能教程
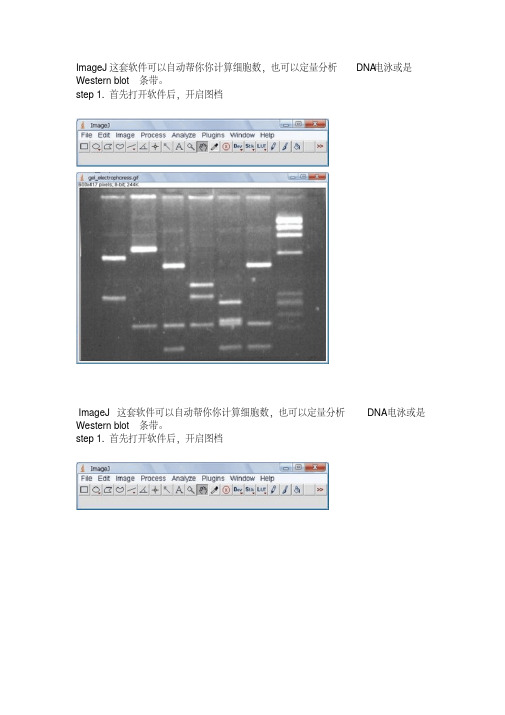
ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档step 2.请先做校正,选择Analyze底下的Calibrate选项,再选择校正的模式,使用Uncalibrate OD,再按ok按下ok之后会出现校正的图形Step 3.在要分析的第一条(first lane)加上一个长型框(工具列第一个选项),再按下Analyze/Gels/select first Lane快速键(Ctr+1),此时框架中会出现一个号码1,之后可以移动框架到第二个lane再选择Analyze/Gels/select second Lane快速键(Ctr+2),当然可以一直加下去,最后按Analyze/Gels/plot Lanes快速键(Ctr +3)。
Step 4.分析以后会出现图型表示你刚选择的框内的影像强度,此时可以看到有几个比较高的区段,就是我们想定量的band,使用直线工具(工具列第五个选项)先将图形中高点为有band的区域和没有band的区域分开再,使用魔术棒工具(工具列第八个选项)点选要分析的区域。
Step 5.当我们点选分析时,在result的对话视窗会出现分析的数据,依序点选就会出现每个band的值。
注:当我们选择分析的条带也可以是横向选取,就可以只比较相同大小的DNA 的含量,同样也可以应用在western blot或其它类似实验条带的分析上。
使用ImageJ 分析图像中的颗粒数[] 原创教程,转载请保留此行1,到本站资料下载-实用小工具栏目下载 ImageJ 并安装。
2,打开ImageJ并打开要分析的图片。
请看演示图片。
3,把图像二值话或者设定阈值。
选择Image - Adjust - Threshold...根据提示设定你需要的阈值。
imagej使用方法2篇

imagej使用方法2篇ImageJ是一款功能强大的图像处理软件,它提供了丰富的图像处理和分析工具,被广泛应用于各个领域,如生物学、医学、材料科学等。
本篇文章将介绍ImageJ的基本使用方法,帮助读者快速上手。
第一篇:ImageJ使用方法(上)一、ImageJ的安装与启动在使用ImageJ之前,首先需要下载并安装该软件。
ImageJ的官方网站提供了Windows、Mac和Linux系统的安装包,用户可以根据自己的操作系统选择相应的版本进行下载。
安装完成后,双击打开软件图标即可启动ImageJ。
在启动过程中,系统可能会提示安装Java环境,请按照提示进行操作。
二、图像的导入与显示ImageJ支持多种图像格式,包括常见的BMP、JPG、PNG等格式,用户可以通过以下几种方式将图像导入ImageJ中:1. 点击菜单栏中的“File”,选择“Open”选项,然后在弹出的文件选择窗口中找到并选择要导入的图像文件。
2. 直接将图像文件拖拽到ImageJ的界面上。
3. 使用快捷键Ctrl+O(Windows系统)或Command+O(Mac系统)打开图像文件。
导入图像后,ImageJ会自动显示图像的缩略图,并在软件窗口的上方显示图像的完整路径和名称。
三、图像处理与分析1. 亮度、对比度调整:点击菜单栏中的“Image”,选择“Adjust”子菜单,然后可以对图像的亮度和对比度进行调整。
2. 图像缩放:点击菜单栏中的“Image”,选择“Scale”选项,在弹出的对话框中输入缩放比例,即可对图像进行放大或缩小。
3. 噪声去除:点击菜单栏中的“Process”,选择“Noise”,然后选择“Despeckle”选项,可以去除图像中的噪声。
4. 图像滤波:点击菜单栏中的“Process”,选择“Filters”选项,然后可以选择不同的滤波算法对图像进行滤波处理。
5. 边缘检测:点击菜单栏中的“Process”,选择“Find Edges”选项,可以对图像进行边缘检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档step 2.请先做校正,选择Analyze底下的Calibrate选项,再选择校正的模式,使用Uncalibrate OD,再按ok按下ok之后会出现校正的图形Step 3.在要分析的第一条(first lane)加上一个长型框(工具列第一个选项),再按下Analyze/Gels/select first Lane快速键(Ctr+1),此时框架中会出现一个号码1,之后可以移动框架到第二个lane再选择Analyze/Gels/select second Lane快速键(Ctr+2),当然可以一直加下去,最后按Analyze/Gels/plot Lanes快速键(Ctr +3)。
Step 4.分析以后会出现图型表示你刚选择的框内的影像强度,此时可以看到有几个比较高的区段,就是我们想定量的band,使用直线工具(工具列第五个选项)先将图形中高点为有band的区域和没有band的区域分开再,使用魔术棒工具(工具列第八个选项)点选要分析的区域。
Step 5.当我们点选分析时,在result的对话视窗会出现分析的数据,依序点选就会出现每个band的值。
注:当我们选择分析的条带也可以是横向选取,就可以只比较相同大小的DNA 的含量,同样也可以应用在western blot或其它类似实验条带的分析上。
使用ImageJ 分析图像中的颗粒数[] 原创教程,转载请保留此行1,到本站资料下载-实用小工具栏目下载 ImageJ 并安装。
2,打开ImageJ并打开要分析的图片。
请看演示图片。
3,把图像二值话或者设定阈值。
选择Image - Adjust - Threshold...根据提示设定你需要的阈值。
这一步非常重要,关系到结果的正确性。
设定阈值的标准就是把是颗粒的地方都突出出来。
示例中颗粒都被染成了红色。
4,菜单Analyze - Anelyze particles... 自动统计结果。
示例图片中有2个1像素的点都被统计出来了。
结果非常准确。
ImageJ 功能强大,其他功能请自学或者听下回分解!再见~~~ #1使用ImageJ 分析图像中的颗粒数[] 原创教程,转载请保留此行1,到本站资料下载-实用小工具栏目下载 ImageJ 并安装。
2,打开ImageJ并打开要分析的图片。
请看演示图片。
3,把图像二值话或者设定阈值。
选择Image - Adjust - Threshold...根据提示设定你需要的阈值。
这一步非常重要,关系到结果的正确性。
设定阈值的标准就是把是颗粒的地方都突出出来。
示例中颗粒都被染成了红色。
4,菜单Analyze - Anelyze particles... 自动统计结果。
示例图片中有2个1像素的点都被统计出来了。
结果非常准确。
ImageJ 功能强大,其他功能请自学或者听下回分解!再见~~~附件:particle.JPG(9.26 KB)adjust.JPG(26.63 KB)adjust2.JPG(22.57 KB)analyze.JPG(24.67 KB)result.JPG(38.38 KB)2007/4/6 21:53生物医学影像分析软件--ImageJ计算细胞数2009年04月21日 22时21分52秒 来源:未知 浏览: 522次相信许多朋友也许也在找一种影像软体,可以自动帮你计算细胞数,比方说常常用使用4'-6-Diamidino-2-phenylindole (DAPI),或是用其它的抗体在做免疫染色(Immunohistochemistry Staining),要如何把影像的资讯数量化呢?最常用的就是计算染色的细胞数。
那有没有软体可以自动帮你算细胞数呢?大概在90年中就有人在做这种影像分析,在2000年左右也有不少文章介绍各实验室自己开发的软体,也免费的提供下载。
最近由猪排饭同学介绍一套软体ImageJ,是由National Institutes of Health (NIH)所开发免费且跨平台(windows、Mac、Linux都可用)的影像分析软体,试用一下觉得相当好用。
请参考以下之教学:step 1. 下载安装ImageJ软体: /ij/download.html 或ImageJ下载/html/protocol/ruanjianjiaocheng/2009/0421/284.html请依据不同作业系统选择适合的版本step 2. 打开软体,再开启要分析的图片(File->Open)。
step 3.设定分析影像的阈值(Image->Adjust->Threshold,或快捷键Ctr+Shift+T)step 4.调整阈值再按set决定。
step 5.选择analyze particle(Analyze->Analyze particle)并且记得要选择summarize,才会有分析的结果。
step 6.分析结果,可以看到原图像的视窗会出现电脑判读的数据,summary会显示个数及分析影像的区域大小Using ImageJ to Quantify Gel ImagesThis is a quick tutorial abour using ImageJ to process gel images taken with the GelDoc. ImageJ is a free program that was originally written at NIH. ImageJ is used to analyze/process all sorts of images in biology-related research. You can use ImageJ to crop/invert/rotate/enhance your gel images. There is even a way to quantify your bands.Rotating/Cropping Gel ImagesOpen ImageJ using the shortcut on the desktop.You can drag the image you want to open onto the ImageJ window. Once the gel image is open, you can zoom in with "Ctrl+" and zoom out with "Ctrl-". Your gel will look something like this (see below).C:/…/index.html1/10Now you can rotate the image in case it's crooked. Go to Image/Rotate/Arbitrarily... You will get the following dialog window. You can adjust the rotation angle (positive or negative values). To make it easy, make sure that the "Preview" box is checked, that will show you how your image is rotated, and it will also show you vertical/horizontal lines for orientation. Click OK when you're done.C:/…/index.html2/10Now it's time to crop the gel image. Use the "Rectangular Selection" tool. After selecting the region of interest go to Image/Crop to crop the selection.See below for screenshots.Enhancing the Gel ImageThis is a typical step when dealing with gel images. You need to adjust the histogram of the image. Please make sure not to blow-out (saturate) the whites. You want to make sure your image has enough dynamic range. Talk to me if you're confused. Anyways, you can do that withImage/Adjust/Brightness-Contrast... , see the Brightness&Contrast window and the enhancement results below. Click on "Apply" and close the menu.C:/…/index.html3/10Inverting the ImageIn most cases you will want to invert the EtBr gel images for convenient viewing and economic printing. Do this by going to Image/LookupTables/InvertLUT which will give you the result shown below. You can use Brightness&Contrast enhancement once again if you wish, but this one is good enough to move on.C:/…/index.html4/10Quantifying Gel Lanes with ImageJWarning - this is not going to be accurate to the percent. It works and you can put some numbers on your results, but digital camera images are not going to be numerically as accurate as a Typhoon scan. You need to select your lanes first. I will do horizontal selections, but you can also do vertical selections if needed. First of all, click on the "Rectangular Selection" toolDo a tight selection around the lane of interest. Press "Ctrl+1" to designate the first lane. Grab the selection and drag it down to select the background (to use late for background subtraction). Press "Ctrl+2" to designate the second lane, then if you select a third lane, you press "Ctrl+2" for any additional lane. Once you're done, press "Ctrl+3" to plot the lane grayscale density. You can access C:/…/index.html5/10other gel-related functions in the Analyze/Gels menu. If you select horizontal lanes like I did here, you will be asked whether you really want your lanes horizontal. Just say yes.I only had two lanes - the bands of interest and the background lane. So ImageJ plots two separate grayscale profiles. You can see that subtracting the background will really make a difference. If your profiles look weird, please go to Analyze/Gel/GelAnalyzerOptions and make sure that the "Invert Peaks" option is checked.C:/…/index.html6/10Now you will have to manually select your bands. This is done with the line select tool (press shift C:/…/index.html7/10key while drawing a vertical line). This is not as sophisticated as the Typhoon Software, but it offers a bit more control.Now you can identify each band by using the "Wand Tool" (see below). Click with the Wand Tool inside each selection corresponding to a band. Then you can go to Analyze/Gels/LabelPeaks and ImageJ will label each selection defined with the WandTool. There is also a "Results" window that lists the results. Use the "Area" values and make sure to subtract the corresponding background offset value.C:/…/index.html8/10Saving and PrintingAt the end, please save your gel image by going to File/SaveAs, I would recommend saving as TIFF or PNG (lossless). You can email the gel images to yourself. Currently there is no way to print gels directly from the GelDoc computer.Gao yanImageJ Features⏹Runs Everywhere:⏹ImageJ is written in Java, which allows it to run on Linux, Mac OS X and Windows,in both 32-bit and 64-bit modes.⏹Open Source:⏹ImageJ and its Java source code are freely available and in the public domain. Nolicense is required.⏹Plugins:⏹Extend ImageJ by developing plugins using ImageJ's built in text editor and Javacompiler. More than 500 plugins are available.⏹Analysis:⏹Measure area, mean, standard deviation, min and max of selection or entire image.Measure lengths and angles. Use real world measurement units such as millimeters.Calibrate using density standards. Generate histograms and profile plots.Installation ⏹Linux⏹Mac OS X⏹Mac OS 9⏹WindowsWindows/ij/download.html Download ImageJ 1.44 bundled with 32-bit Java 1.6.0_20(28MB), with 64-bit Java 1.6.0_20(24MB; requires 64-bit Windows) or without Java(3MB).OpenReads an image and displays it in a separate window. Files must be in TIFF, GIF, JPEG, DICOM, BMP, PGM or FITS format. Also opens ImageJ and NIH Image lookup tables (with ".lut" extension). Additional file formats are supported via plugins installed in the Import submenu.Subtract background U1幻灯片 10U1 User, 2011/4/17Merge channelScale barScale bars should be present on all publication/presentation images/movies. It’s worth putting them in sooner rather than later. Choose a standard scale bar size for all your images if possible to avoid confusion.⏹If you know the size of a feature (previously applied scale bar for instance) you can use this command to apply a calibration.⏹Using the line selection tool, draw a ling along the length of the feature/scale bar.⏹Run the menu command “Plugins/Spatial calibration/Set scale”[1].⏹Enter the dimensions of the object/scale bar in the “known distance”box and set the units in the Unit of length box.⏹Do not check Global unless you wish all your images to have this calibration! Click OK.⏹。
