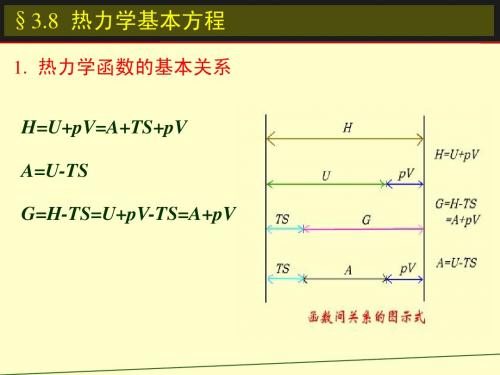
热力学函数间的关系
合集下载
热力学函数的基本关系式

dU = TdS- pdV
(1-108)
dH = TdS + Vdp
(1-109)
dA = -SdT- pdV
(1-110)
dG = -SdT + Vdp
(1-111)
式(1-108),(1-109),(1-110),(1-111)称为热力学基本方程
dU = TdS- pdV dH = TdS + Vdp dA = -SdT- pdV dG = -SdT + Vdp
常用的是式(1-120)及式(1-121),这两等式右边的变化率是可以由 实验直接测定的,而左边则不能。可用等式右边的变化率代替左
4.热力学状态方程
由dU=TdS-pdV
定温下, dUT=TdST-pdVT
等式两边除以dVT 即
dUT T dST p
dVT
dVT
由麦克斯韦方程 于是
U T S p V T V T S p V T T V
式(1-116)及 (1-117)叫吉布斯 - 亥姆霍茨方程。
(1-117)
G-H方程常用的形式为:
即
(G / T )
T p
H T2
加△
(1-116)
Gibbs自由能随压力的变化
因
(эG/эP)T,n=V
(э△G/эP)T,n=△V 此即G---V关系式
只要知道△V--p关系式,在定温下P1的△G1就可求算出P2的△G2。
在定压下从T1到 T2积分得: (△G)2/ T2- (△G)1/ T1=- =∫T1 T2 △H/T2dT 若知△H--T关系以及T1时的△G1就可求算T2时的△G2 而: △H= △H T0+∫ T0 T △CpdT △H T0是T0时的焓变。
热力学函数的基本关系式

dG = -SdT + Vdp
S p
T
V T
p
麦克斯韦关系式 :表示的是系统在同一状态的两种
变化率数值相等。 9
二阶混合偏导数
T p V S S V 麦氏方程记忆法:
T p
S
V S
p
① 对角乘积永远是pV,TS;
② 等式两边分母与外角标互换;
S p
T
V T
4
由四个热力学基本方程,分别加上相应的条件,可得到
8个派生公式:
dU = TdS- pdV
U S
V
T
U V
S
p
dH = TdS + Vdp
T V H
S p
H p S
dA = -SdT- pdV
A T
V
S
A V
T
p
dG = -SdT + Vdp
G T
P
S
G P
则
U T p p
V T T V
11
练习:由热力学基本方程出发证明,
H p
T
T
V T
p
V
证明:
dH=TdS+Vdp
定温下,等式两边除以dp
H p
T
T
S p
T
V
由麦克斯韦方程
S p
T
V T
p
返回
H p
T
T
V T
p
V
12
U T p p V T T V
S T p
T
T
定容
S CV T V T
S T V
15
T
V
5
2. 吉布斯 - 亥姆霍茨方程
热力学第二定律(4)
dH TdS Vdp
(3) dA SdT pdV (4)
A(T ,V )
G(T , p)
dG SdT Vdp
适用条件:(1)无相变化和化学变化(恒定组成)的均 相封闭系统发生单纯pVT变化的可逆或不可逆过程(2) 对于化学反应和相变化只适用于非体积功为零的可逆过程 即非体积功为零的恒定组成的封闭系统
解:对理想气体,
pV nRT
p nRT /V
p nR ( )V T V
p nR U ( )T T ( )V p T p 0 V T V
所以,理想气体的热力学能只是温度的函数。
§3.8 热力学基本方程
8、偏微分运算规则: z f ( x, y ) 循环关系式:
=
2U U V S SV V S T V S
S一定时对V 微分 U T ; S V
§3.8 热力学基本方程 (1) dU TdS pdV
§3.8 热力学基本方程 3、热力学方程的简单应用
例:试证明理想气体恒温过程ΔA=ΔG
dT 0 dA pdV A
V2 V1
dT 0 dG Vdp G Vdp nRT ln
p1 p2
V1 pdV nRT ln V2
p2 V nRT ln 1 p1 V2
H G / T 2 T T p
积分:
G2
G1
T2 G H d( ) 2 dT T1 T T
T2 H G2 G1 dT 2 T1 T T2 T1
§3.8 热力学基本方程
§9.6 系统的热力学能与配分函数的关系
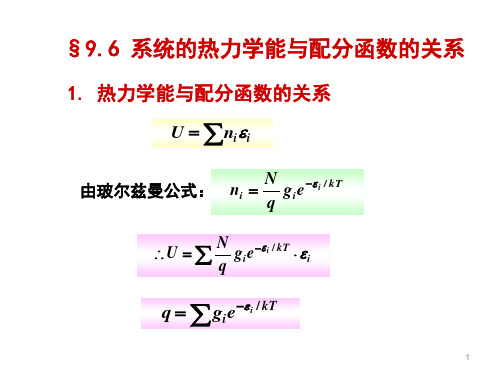
T
V
NkT 2 ln qt NkT 2 d ln qr NkT 2 d ln qvT VdT NhomakorabeadT
NkT 2 d ln qe NkT 2 d ln qn
dT
dT
Ut Ur Uv Ue Un
(因为q = qt qr qv qe qn ,只有qt 与V 有关,所以必须
写成偏导数, 其它均可写成全导数。)
1
kT 2
g e i / kT ii
移项得:
kT 2 q T V
i giei / kT
带入热力学能公式: U
N q
gi e i / kT i
得:
U N kT 2 q NkT 2 ln q
q T V
T V
2
将 q = qt qr qv qe qn 代入,则;
U NkT 2 ln qtqrqvqeqn
NkT 2
d
ln
1
1 e
ΘV
/T
dT
1 NkΘV ev /T 1
a)通常情况下,v>>T,量子化效应较突出
ΘV 1 T
,
qV0 1
,
U
0 V
0
振动基本都处于基态,对Uv0无贡献
8
b)v /T<<1 (高温或低V) 时
eΘV /T 1 ΘV T
U
0 v
NkΘV
1 eΘv /T
1
NkΘV
U
0 r
0
,
U
0 V
0
3 Um 2 RT U0,m
低温:振动能级未开放:
5 Um 2 RT U0,m
(U
0 v
0)
热力学函数间关系及其相互变换

证明: 先去掉U dU =TdS−pdV
恒压下,两边同时对S 求偏导
18
1.3 例证
或
19
1.3 例证
证明:
20
1.3 例证
任意绝热可逆过程膨胀后压力必降低。
21
中科院考研题
理想气体绝热膨胀时并不恒容,为什么仍可使用公式 dW=CvdT
dU U U U 答:dU dT dV 。 对理想气体 =0 ,故 dT T V V T V T U 或dU CV dT。因此在本例中dU d W CV dT 完全适用。 T V
热力学函数间关系及其相互变换
1
热力学函数间关系及其相互变换
两种情况:
一、U、H、S、F、G 等热力学量不能确定绝对值、 且不能通过设计实验直接测定,而p、V 、T、Cp 、 CV 、α、β、κ 等是可设计实验测定。而在研究U、H、 S、F、G 等变化规律时希望在不可测量与可测量的热 力学间建立起某些关系,从而取得某种规律性的认识
3
1.1 函数关系
三、定义式
四、Maxwell 关系
4 记忆口诀:“S−p、V−T,排成口字齐;平行求偏导,侧转找下 标”。
1.1 函数关系
◆ Maxwell 关系
5
1.1 函数关系
五、数学公式
Euler 关系
链关系:
倒易关系:
循环关系:
6
1.2 熵变换是函数变换之关键
(不含U、H、F、G)
24
25
二、科研和解决实际问题提出的许多命题要论证。
2
1.1 函数关系
一、基本方程
H = U+PV、 F=U-TS、 G = H-TS dU=TdS-pdV dF=-SdT-pdV dH=TdS+Vdp dG=-SdT+Vdp pV=nRT
恒压下,两边同时对S 求偏导
18
1.3 例证
或
19
1.3 例证
证明:
20
1.3 例证
任意绝热可逆过程膨胀后压力必降低。
21
中科院考研题
理想气体绝热膨胀时并不恒容,为什么仍可使用公式 dW=CvdT
dU U U U 答:dU dT dV 。 对理想气体 =0 ,故 dT T V V T V T U 或dU CV dT。因此在本例中dU d W CV dT 完全适用。 T V
热力学函数间关系及其相互变换
1
热力学函数间关系及其相互变换
两种情况:
一、U、H、S、F、G 等热力学量不能确定绝对值、 且不能通过设计实验直接测定,而p、V 、T、Cp 、 CV 、α、β、κ 等是可设计实验测定。而在研究U、H、 S、F、G 等变化规律时希望在不可测量与可测量的热 力学间建立起某些关系,从而取得某种规律性的认识
3
1.1 函数关系
三、定义式
四、Maxwell 关系
4 记忆口诀:“S−p、V−T,排成口字齐;平行求偏导,侧转找下 标”。
1.1 函数关系
◆ Maxwell 关系
5
1.1 函数关系
五、数学公式
Euler 关系
链关系:
倒易关系:
循环关系:
6
1.2 熵变换是函数变换之关键
(不含U、H、F、G)
24
25
二、科研和解决实际问题提出的许多命题要论证。
2
1.1 函数关系
一、基本方程
H = U+PV、 F=U-TS、 G = H-TS dU=TdS-pdV dF=-SdT-pdV dH=TdS+Vdp dG=-SdT+Vdp pV=nRT
热力学函数间的关系

则T = 1000 K, rG1000 = 61900 Jmol-1>0
计算结果说明,在给定条件下,298K时,合成氨反应可 以进行;而在1000K时,反应不能自发进行
再见!
H
U
TS
G
TS F
H U pV pV U H pV
G H TS F pV pV F U TS G pV
T1
T
T2 T1
H T2
dT
(1) 若温度变化范围不大,△H可近似为不随温度变化的常数
G T
T 2
G T
T 1
H
1 T2
1 T1
四、G与温度的关系—吉布斯-亥姆霍兹公式
25℃,反应 2SO3(g) 2SO2(g) O2(g)
rGm (298K) 1.400 10 5 J mol1 r Hm 1.966 105 J mol1
H T2
吉布斯-亥姆赫兹公式
G T
T
H T2
P
四、G与温度的关系—吉布斯-亥姆霍兹公式
吉布斯-亥姆赫兹方程式
Байду номын сангаас
G T
T
H T2
P
(微分形式)
应用:在等压下若已知反应在T1的rGm(T1),则可求得该反 应在T2时的rGm(T2)。
积分形式
T2 d ( G )
M 和N也是 x,y 的函数
二阶导数
M
2Z
( y )x xy ,
N
2Z
( x )y xy
所以
M N ( y )x ( x )y
三、Maxwell 关系式
热力学函数是状态函数,数学上具有全微分性质,将上述
关系式用到四个基本公式中, 就得到Maxwell关系式:
计算结果说明,在给定条件下,298K时,合成氨反应可 以进行;而在1000K时,反应不能自发进行
再见!
H
U
TS
G
TS F
H U pV pV U H pV
G H TS F pV pV F U TS G pV
T1
T
T2 T1
H T2
dT
(1) 若温度变化范围不大,△H可近似为不随温度变化的常数
G T
T 2
G T
T 1
H
1 T2
1 T1
四、G与温度的关系—吉布斯-亥姆霍兹公式
25℃,反应 2SO3(g) 2SO2(g) O2(g)
rGm (298K) 1.400 10 5 J mol1 r Hm 1.966 105 J mol1
H T2
吉布斯-亥姆赫兹公式
G T
T
H T2
P
四、G与温度的关系—吉布斯-亥姆霍兹公式
吉布斯-亥姆赫兹方程式
Байду номын сангаас
G T
T
H T2
P
(微分形式)
应用:在等压下若已知反应在T1的rGm(T1),则可求得该反 应在T2时的rGm(T2)。
积分形式
T2 d ( G )
M 和N也是 x,y 的函数
二阶导数
M
2Z
( y )x xy ,
N
2Z
( x )y xy
所以
M N ( y )x ( x )y
三、Maxwell 关系式
热力学函数是状态函数,数学上具有全微分性质,将上述
关系式用到四个基本公式中, 就得到Maxwell关系式:
6.热力学基本关系式
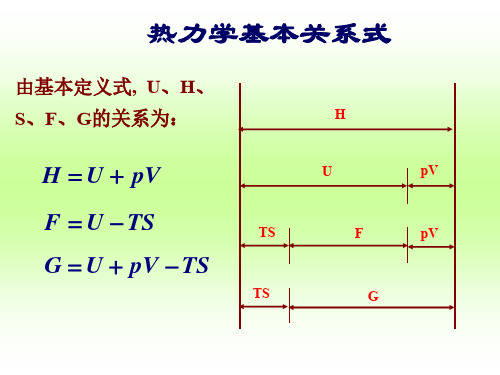
G U pV TS
dG S dT V d p
U、H、F、G这些热力学函数之间的关系实质是勒让德变换 勒让德变换实际上是在我们得到了一个不变量后,要得到它的对偶自变量下的 不变量的一个重要的变换。
热力学四个基本关系式(Gibbs关系式)如下:
d U T d S p dV
S p V T T V
(1)
U p V T T p T V
得证
几个重要的偏导关系式
1.与S有关的
S p V T T V
S V T p p T
d H T d S V d p
(1)
(2) (3)
d F S d T p dV dG S dT V d p
(4)
条件: 简单封闭系统,只作体积功。
• 基本关系式实质上是 U 、 H 、 F 和 G 的数学全 微分展开式。 • 简单的封闭系统, 状态只需两个独立变量即可 决定, 这两个变量可以任意选取. • 从四个关系式的微分变量可知, 对不同的状态 函数, 在作全微分展开时, 选取的独立变量是 不一样的:
例: 试证明:
U p V T T p T V
解:有基本热力学关系式
d U T d S p dV
在等温条件下,求内能对体积的偏微商:
U S V T V p T T
由麦克斯韦关系式: 代入(1)式得:
Wf 0
Qr T d S
将上式代入内能的全微分:
W p dV
d U T d S p dV
(1)
3.7 热力学基本方程及Maxwell关系式

恒T、p、W= 0: G 0
自发 平衡
dGm α dGm β Sm α dT Vm α dp Sm β dT
Vm β dp
[Sm β Sm α ]dT [Vm β Vm α ]dp
dp Sm β Sm α
βαSm
dT Vm β Vm α
βαVm
又因 βαSm
βαHm T
dp dT
βαH m T βαVm
U
SV
H
A
pT
G
说明: 1. 等式右边只有四个物理量T,S, p,V
2. 十字交叉法:
对U来说,S,V分别表示dS和dV; dS对角线 对应T,dV对角线对应p;箭头方向表示正负,指向 为负,则为TdS和 –pdV
2. U、H、A、G的一阶偏导数关系式
U f (S,V ) H f (S, p) A f (T ,V ) G f (T , p)
p
S V
T
p T
V
V T
p
S p
T
T V
S
p S
V
T p
S
V S
p
S V
T
p T
V
V T
p
S p
T
说明:
1. 关系式中只有四个物理量T, S, p,V
2. 对角线乘积为 TS 与 pV
3. 等式两边的分母与下标互换
4. S和V为广度量,而T和p为强 度量。同种性质的状态函数 的分式,不取负号。
分析:利用克拉佩龙方程 dT T βαVm
dp 解:由克拉佩龙方程有 dT
T
βαH m
lsVm lsH m
dp
积分,得 lnT2
T1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T2 G2 G1 H = ∫ 2 dT T1 T2 T1 T rGm 2 rGm1 1 1 = rHm( ) T2 T1 T2 T1
r Gm ,2
1.400 × 105 1 1 5 ) = 1.966 × 10 ( 873 298 873 298
r Gm ,2 = 30820J mol -1
吉布斯- 吉布斯-亥姆赫兹方程式
G T = H T2 T P
(微分形式)
应用:在等压下若已知反应在 应用:在等压下若已知反应在T1的rGm(T1),则可求得该反 应在T 时的 应在 2时的rGm(T2)。 积分形式
∫
T2
T1
T2 G H ( ) = ∫ 2 dT T1 T T
( V V ) p dT = ( )T dp T p
1mol理想气体, PV = RT 理想气体, 理想气体 p T ( )p = , R V V V ( )T = , p p R p ( )V = V T 则 ( T ) p ( V )T ( p )V = 1
V p T
可写成
T V p ( )p( )T ( )V = 1 V p T
2010-8-2
三、Maxwell 关系式
证明: 例3证明:(
T V p )p( )T ( )V = 1 并以理想气体验证上式的正确。 并以理想气体验证上式的正确。 V p T
定量纯气体, 证: 定量纯气体, V = f (p,T)
dV = ( V V ) p dT + ( )T dp T p
当V恒定,dV = 0,则 恒定, , 恒定
dU = Td S pdV
U S 等温对V求偏微分 等温对 求偏微分 ( )T = T ( )T p V V
S p S 不易测定,根据Maxwell关系式 ( )T = ( ) V 关系式 ( )T 不易测定,根据 V T V
求得
U p ( )T = T ( )V p V T
只要知道气体的状态方程, 只要知道气体的状态方程,就可得到 ( 力学能随体积的变化值。 力学能随体积的变化值。
O r Gm ,T = 39340 + 25.46T ln T 9.17 × 10 3 T 2 + 0.35 × 10 7 T 3 + IT
代入得: 将T = 298 K, rG298 = 16.45kJ代入得:I= 65.5 , 代入得 则T = 1000 K, rG1000 = 61900 Jmol-1>0 ,
1 1 r H m = H 0 25.46T + × 18 33 × 103 T 2 × 2 05 × 107 T 3 则 2 3
1 3 N 2 ( g ) + H 2 ( g ) = NH 3 ( g ) 氨的合成 2 2
将T = 298 K, rH298 = -46.11kJ代入得: H0 = 39340 代入得: , 代入得
(1) 若温度变化范围不大,△H可近似为不随温度变化的常数 若温度变化范围不大, 可近似为不随温度变化的常数
1 1 G G T T = H T T T 2 T 1 1 2
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
O m ,T
b 2 c 3 T T + + IT = H 0 aT ln T 2 6
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
已知, 各种气体均处于100kPa时,rH298 = -46.11kJ, 已知,在298K各种气体均处于 各种气体均处于 时 , 时的 rG298 = 16.45kJ,试求 ,试求1000K时的rGm值 时的 解答: × × 解答:查表可知 Cp = 25.46 + 18.33× 103T 2.05× 10-7T2
S 不易测定,据Maxwell关系式 ( S ) = ( V ) 关系式 ( )T 不易测定, T p p T p
H V )T = V T ( )p 可得: 可得: ( p T
只要知道气体的状态方程, 只要知道气体的状态方程,就可求得 ( )T 值,即等 p 温时焓随压力的变化值。 温时焓随压力的变化值。
d G = d H Td S S d T
将
(3) dF = SdT pdV (4)
dH = TdS + Vdp 代入
得 dG = SdT + Vdp
适用条件:组成恒定、不 适用条件:组成恒定、 作非体积功的封闭系统的 作非体积功的封闭系统的 任何过程。 任何过程。
二、对应系数关系式
(1) (2)
= TdS pdV 代入
得 dH = TdS + Vdp
得 dF = SdT pdV
一、热力学基本关系式
(4)
dG = SdT + Vdp
G = H TS
总结: 总结:热力学四个基本关系式
根据定义式 取全微分: 取全微分:
(1) dU = TdS pdV (2)
dH = TdS + Vdp dG = SdT + Vdp
= T nR p = 0
V
所以,理想气体的热力学能只是温度的函数。 所以,理想气体的热力学能只是温度的函数。
三、Maxwell 关系式
(2)求等温条件下,H 随 p 的变化关系 )求等温条件下, 已知基本公式
d H = Td S + Vd p
H S 等温对p求偏微分 等温对 求偏微分 ( )T = T ( )T + V p p
r Gm (298K) = 1.400 × 10 5 J mol 1
25℃,反应 2SO (g) = 2SO (g) + O (g) ℃ 3 2 2
r H m = 1.966 × 10 5 J mol 1
不随温度而变化试求上述反应在600℃进行时的rGm rHm不随温度而变化试求上述反应在 ℃进行时的 视为常数,由公式: 解:由于温度变化不大,可将rHm视为常数,由公式: 由于温度变化不大,可将
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
(2) 若温度变化范围大,△H随温度变化而改变 若温度变化范围大, 随温度变化而改变 Cp写成温度的函数 Cp = a + bT + cT2 + …… 产物与反应物恒压热容之差为 rCp = a + bT + cT2 + …… 则 r H = H 0 + ∫ 0 r C p dT
H
三、Maxwell 关系式
证明理想气体的焓只是温度的函数。 例2 证明理想气体的焓只是温度的函数。 解:对理想气体, p V 对理想气体,
= nRT
p = nR T /V
nR V ( )p = p T
V H nR ( )T = V T ( )p = V T =0 T p p
所以,理想气体的焓只是温度的函数。 所以,理想气体的焓只是温度的函数。
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
对于一个化学反应:自一个温度反应的 求另一温度的 对于一个化学反应:自一个温度反应的rG1求另一温度的rG2 G dG = SdT + Vdp = S T P 在温度T时 在温度 时 G = H T S
第十一节 热力学函数间的关系
H
H = U + pV pV
U
U = H pV
TS TS
G
G = H TS = F + pV pV F = U TS = G pV
F
函数间关系的图示
H
U
H=U+ pV
pV
U = H pV
TS TS
F
G
G= HTS = F+ pV
pV F =UTS =G pV
一、热力学基本关系式
G H G 因此 = T T P
两边同时除以T 两边同时除以
1 G G H T T 2 = T 2 T P
G T = H T2 T P
吉布斯-亥姆赫兹公式 吉布斯-
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
U F p = ( ) S = ( )T V V
H G V =( ) S = ( )T p p
F G S = ( )V = ( ) P T T
三、Maxwell 关系式
全微分的性质 设函数Z的独立变量为 , , 具有全微分性质 设函数 的独立变量为x,y, Z具有全微分性质 的独立变量为
z = z( x , y )
对于定组成只作体积功的封闭系统 存在 dU = δQ pdV
δQ 若系统经历可逆过程 若系统经历可逆过程 dS = T
代入上式即得 dU = TdS pdV
(1)
这是热力学第一与第二定律的联合公式,适用于组成恒 这是热力学第一与第二定律的联合公式,适用于组成恒 热力学第一与第二定律的联合公式 不作非体积功的封闭系统。 定、不作非体积功的封闭系统。 的封闭系统 注意理解: 注意理解: 在推导中引用了可逆过程的条件, 在推导中引用了可逆过程的条件,但导出的关系式中所有的 物理量均为状态函数,在始终态一定时,其变量为定值, 物理量均为状态函数,在始终态一定时,其变量为定值,热力学 关系式与过程是否可逆无关。 关系式与过程是否可逆无关。
一、热力学基本关系式
(2)
dH = TdS + Vdp
H = U + pV
(3) dF = SdT pdV
根据定义式 取全微分: 取全微分:
根据定义式 取全微分: 取全微分:
F = U TS
r Gm ,2
1.400 × 105 1 1 5 ) = 1.966 × 10 ( 873 298 873 298
r Gm ,2 = 30820J mol -1
吉布斯- 吉布斯-亥姆赫兹方程式
G T = H T2 T P
(微分形式)
应用:在等压下若已知反应在 应用:在等压下若已知反应在T1的rGm(T1),则可求得该反 应在T 时的 应在 2时的rGm(T2)。 积分形式
∫
T2
T1
T2 G H ( ) = ∫ 2 dT T1 T T
( V V ) p dT = ( )T dp T p
1mol理想气体, PV = RT 理想气体, 理想气体 p T ( )p = , R V V V ( )T = , p p R p ( )V = V T 则 ( T ) p ( V )T ( p )V = 1
V p T
可写成
T V p ( )p( )T ( )V = 1 V p T
2010-8-2
三、Maxwell 关系式
证明: 例3证明:(
T V p )p( )T ( )V = 1 并以理想气体验证上式的正确。 并以理想气体验证上式的正确。 V p T
定量纯气体, 证: 定量纯气体, V = f (p,T)
dV = ( V V ) p dT + ( )T dp T p
当V恒定,dV = 0,则 恒定, , 恒定
dU = Td S pdV
U S 等温对V求偏微分 等温对 求偏微分 ( )T = T ( )T p V V
S p S 不易测定,根据Maxwell关系式 ( )T = ( ) V 关系式 ( )T 不易测定,根据 V T V
求得
U p ( )T = T ( )V p V T
只要知道气体的状态方程, 只要知道气体的状态方程,就可得到 ( 力学能随体积的变化值。 力学能随体积的变化值。
O r Gm ,T = 39340 + 25.46T ln T 9.17 × 10 3 T 2 + 0.35 × 10 7 T 3 + IT
代入得: 将T = 298 K, rG298 = 16.45kJ代入得:I= 65.5 , 代入得 则T = 1000 K, rG1000 = 61900 Jmol-1>0 ,
1 1 r H m = H 0 25.46T + × 18 33 × 103 T 2 × 2 05 × 107 T 3 则 2 3
1 3 N 2 ( g ) + H 2 ( g ) = NH 3 ( g ) 氨的合成 2 2
将T = 298 K, rH298 = -46.11kJ代入得: H0 = 39340 代入得: , 代入得
(1) 若温度变化范围不大,△H可近似为不随温度变化的常数 若温度变化范围不大, 可近似为不随温度变化的常数
1 1 G G T T = H T T T 2 T 1 1 2
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
O m ,T
b 2 c 3 T T + + IT = H 0 aT ln T 2 6
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
已知, 各种气体均处于100kPa时,rH298 = -46.11kJ, 已知,在298K各种气体均处于 各种气体均处于 时 , 时的 rG298 = 16.45kJ,试求 ,试求1000K时的rGm值 时的 解答: × × 解答:查表可知 Cp = 25.46 + 18.33× 103T 2.05× 10-7T2
S 不易测定,据Maxwell关系式 ( S ) = ( V ) 关系式 ( )T 不易测定, T p p T p
H V )T = V T ( )p 可得: 可得: ( p T
只要知道气体的状态方程, 只要知道气体的状态方程,就可求得 ( )T 值,即等 p 温时焓随压力的变化值。 温时焓随压力的变化值。
d G = d H Td S S d T
将
(3) dF = SdT pdV (4)
dH = TdS + Vdp 代入
得 dG = SdT + Vdp
适用条件:组成恒定、不 适用条件:组成恒定、 作非体积功的封闭系统的 作非体积功的封闭系统的 任何过程。 任何过程。
二、对应系数关系式
(1) (2)
= TdS pdV 代入
得 dH = TdS + Vdp
得 dF = SdT pdV
一、热力学基本关系式
(4)
dG = SdT + Vdp
G = H TS
总结: 总结:热力学四个基本关系式
根据定义式 取全微分: 取全微分:
(1) dU = TdS pdV (2)
dH = TdS + Vdp dG = SdT + Vdp
= T nR p = 0
V
所以,理想气体的热力学能只是温度的函数。 所以,理想气体的热力学能只是温度的函数。
三、Maxwell 关系式
(2)求等温条件下,H 随 p 的变化关系 )求等温条件下, 已知基本公式
d H = Td S + Vd p
H S 等温对p求偏微分 等温对 求偏微分 ( )T = T ( )T + V p p
r Gm (298K) = 1.400 × 10 5 J mol 1
25℃,反应 2SO (g) = 2SO (g) + O (g) ℃ 3 2 2
r H m = 1.966 × 10 5 J mol 1
不随温度而变化试求上述反应在600℃进行时的rGm rHm不随温度而变化试求上述反应在 ℃进行时的 视为常数,由公式: 解:由于温度变化不大,可将rHm视为常数,由公式: 由于温度变化不大,可将
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
(2) 若温度变化范围大,△H随温度变化而改变 若温度变化范围大, 随温度变化而改变 Cp写成温度的函数 Cp = a + bT + cT2 + …… 产物与反应物恒压热容之差为 rCp = a + bT + cT2 + …… 则 r H = H 0 + ∫ 0 r C p dT
H
三、Maxwell 关系式
证明理想气体的焓只是温度的函数。 例2 证明理想气体的焓只是温度的函数。 解:对理想气体, p V 对理想气体,
= nRT
p = nR T /V
nR V ( )p = p T
V H nR ( )T = V T ( )p = V T =0 T p p
所以,理想气体的焓只是温度的函数。 所以,理想气体的焓只是温度的函数。
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
对于一个化学反应:自一个温度反应的 求另一温度的 对于一个化学反应:自一个温度反应的rG1求另一温度的rG2 G dG = SdT + Vdp = S T P 在温度T时 在温度 时 G = H T S
第十一节 热力学函数间的关系
H
H = U + pV pV
U
U = H pV
TS TS
G
G = H TS = F + pV pV F = U TS = G pV
F
函数间关系的图示
H
U
H=U+ pV
pV
U = H pV
TS TS
F
G
G= HTS = F+ pV
pV F =UTS =G pV
一、热力学基本关系式
G H G 因此 = T T P
两边同时除以T 两边同时除以
1 G G H T T 2 = T 2 T P
G T = H T2 T P
吉布斯-亥姆赫兹公式 吉布斯-
与温度的关系—吉布斯 四、G与温度的关系 吉布斯 亥姆霍兹公式 与温度的关系 吉布斯-亥姆霍兹公式
U F p = ( ) S = ( )T V V
H G V =( ) S = ( )T p p
F G S = ( )V = ( ) P T T
三、Maxwell 关系式
全微分的性质 设函数Z的独立变量为 , , 具有全微分性质 设函数 的独立变量为x,y, Z具有全微分性质 的独立变量为
z = z( x , y )
对于定组成只作体积功的封闭系统 存在 dU = δQ pdV
δQ 若系统经历可逆过程 若系统经历可逆过程 dS = T
代入上式即得 dU = TdS pdV
(1)
这是热力学第一与第二定律的联合公式,适用于组成恒 这是热力学第一与第二定律的联合公式,适用于组成恒 热力学第一与第二定律的联合公式 不作非体积功的封闭系统。 定、不作非体积功的封闭系统。 的封闭系统 注意理解: 注意理解: 在推导中引用了可逆过程的条件, 在推导中引用了可逆过程的条件,但导出的关系式中所有的 物理量均为状态函数,在始终态一定时,其变量为定值, 物理量均为状态函数,在始终态一定时,其变量为定值,热力学 关系式与过程是否可逆无关。 关系式与过程是否可逆无关。
一、热力学基本关系式
(2)
dH = TdS + Vdp
H = U + pV
(3) dF = SdT pdV
根据定义式 取全微分: 取全微分:
根据定义式 取全微分: 取全微分:
F = U TS
