2019版GMP批生产记录模板word资料35页
药品化妆品批生产记录模板

设备是否完好,容器具是否已清洁
设备完好,容器具已清洁,
是□否□
计量器具是否校验,并在有效期内
计量器具有校验合格证,并在有效期内
是□否□
核对原辅料名称、数量是否与生产指令一致
原辅料名称、数量与生产指令一致
是□否□
配料记录
序号
原料名称
配方数(kg)
实际称量数(kg)
序号
原料名称
配方数(kg)
实际称量数(kg)
用量/100kg
投料量
序号
原料名称
单位
用量/100kg
投料量
1
Kg
22
Kg
2
Kg
23
Kg
3
Kg
24
Kg
4
Kg
25
Kg
5
Kg
26
Kg
6
Kg
27
Kg
7
Kg
28
Kg
8
Kg
29
Kg
9
Kg
30
Kg
10
Kg
31
Kg
11
Kg
32
Kg
12
Kg
33
Kg
13
Kg
内包材名称
单位
用量/100kg
用量
14
Kg
15
Kg
1
玻璃瓶
检查时间
净含量(g)
检查结果
合格□不合格□
密封性检查记录
检查时间
检查人
质检员
密封性
好/差
好/差
好/差
好/差
好/差
好/差
好/差
好/差
原料药批生产记录模板

********有限公司****批生产记录
品名:
规格:
批号:
理论产量:
成品数:
成品率:
生产日期:
生产部审阅:
质管部审阅:
目录
批生产指令单
开工前现场检查表
检查日期:年月日
生产管理员:QA检查员:
***** 岗位生产记录(三)
***** 岗位生产记录(四)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 岗位生产记录(一)
***** 岗位生产记录(二)
***** 岗位生产记录(三)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 岗位生产记录(一)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 干燥岗位生产记录
原料药洁净区岗位清场记录
生产管理员:QA检查:
批包装指令单
可编辑
***** 粉碎过筛岗位生产记录
原料药洁净区岗位清场记录
生产管理员:QA检查:
可编辑
***** 混合包装岗位生产记录(一)
***** 混合包装岗位生产记录(二)
原料药洁净区岗位清场记录
生产管理员:QA检查:
原料药包装岗位清场记录
生产管理员:QA检查:
***** 批生产汇总表
生产管理员:QA检查员:
产品生产检验报告单记录表
日期:年月日
生产管理员:QA检查员:
***** 关键岗位工艺查证记录(一)
生产管理员:QA检查员:
生产管理员:QA检查员:
批生产记录部门审核表
日期:年月日
可编辑
精品。
药品批生产记录
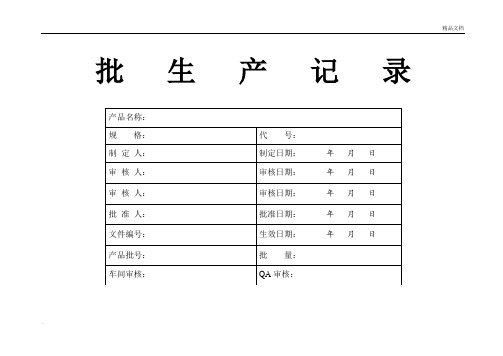
批生产记录
药业有限公司批生产记录
批生产记录
称量单
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
页号:1/3
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
充填中间控制记录
充填中间控制记录
充填中间控制记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
内包装中间控制记录
内包装中间控制记录
页号:2/2
批生产记录
批生产记录
批生产记录
外包装中间控制记录
页号:1/2
外包装中间控制记录
页号:2/2
附页
变更记载。
批生产记录样张

--------------------批生产记录编号:品名:批号:数量:规格:批记录整理人:时间:批记录审核人:时间:批记录批准人:时间:批生产记录目录1批生产指令单――――――――页2精制工序生产记录――――――页3精制、干燥岗位清场检查记录(前批副本)页4精制、干燥岗位清场检查记录(本批副本)页5清场合格证―――――――――――――页6干燥工序生产记录――――――――――页7干燥工序称量记录――――――――――页批生产批令单编号:精制岗位生产记录___精制岗位称量记录编号:___精制岗位清场检查记录(正副本)编号:清场合格证编号:--------------------批包装记录编号:品名:批号:数量:规格:整理人:时间:审核人:时间:批准人:时间:批包装记录目录1批包装指令单――――――――页2包装岗位清场检查记录(前批副本)页3包装岗位清场检查记录(本批副本)页4清场合格证―――――――――――――页5包装工序称量记录――――――――――页6包装工序操作记录――――――――――页7标签样张―――――――――页8合格证――――――――――页批包装指令单编号:____包装清场检查记录(正副本)编号:清场合格证编号:包装岗位称量记录品名:编号:包装岗位操作记录合格证(单位地址)标签样张成品检验报告单生产过程质量监督记录成品批审核确认记录编号:。
片剂批生产记录模板标准无误完整版.

片剂批生产记录
产品名称规格
批号理论量
成品量包装规格
生产周期:年月日至年月日
车间审核意见审核人审核日期
********有限公司
领料单
日期
领料人保管人
批生产指令单
称量配料岗位生产记录
年月日
物料核对记录
年月日
清场记录
年月日
粉碎岗位生产记录
清场记录
年月日
混合制粒干燥岗位生产记录
年月日
清场记录
年月日
整理总混岗位生产记录
年月日
清场记录
年月日
填充装囊岗位生产记录
年月日
清场记录
年月日
清场人:质监员:
领料人:保管人:
批包装指令单
起草人:审核人: 接收人:
塑瓶内包装岗位生产记录
年月日
清场记录
年月日
清场人:质监员:
*************有限公司。
药品生产片剂批生产记录(全套完整版)

XXXX制药有限公司
XXXX片批生产记录
产品批号:
生产日期:
有效期至:
包装规格:
投料总数:
成品数量:
XXXX制药有限公司XXXX片批生产记录总汇
XXXX片批生产记录,第2页
XXXX制药有限公司
XXXX制药有限公司岗位清场记录
XXXX制药有限公司
XXXX片批生产记录,第5页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司浓缩岗位生产记录
XXXX片批生产记录,第7页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司矾沉岗位生产记录
XXXX片批生产记录,第9页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司
XXXX片批生产记录,第11页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司粉碎岗位生产记录
XXXX制药有限公司岗位清场记录
XXXX制药有限公司配料称量记录
XXXX制药有限公司
配料、混合、制粒记录
XXXX制药有限公司干燥岗位生产记录
XXXX制药有限公司
整粒、总混记录
XXXX制药有限公司岗位清场记录
XXXX制药有限公司
XXXX制药有限公司岗位清场记录
岗位清场记录
内包装(瓶装)记录
岗位清场记录
XXXX制药有限公司
铝塑包装记录
岗位清场记录
XXXX制药有限公司
外包装岗位操作记录
XXXX制药有限公司
岗位清场记录
XXXX片批生产记录,第31页。
新版GMP颗粒剂批生产记录
X X X X颗粒制剂批生产记录、指令单号:产品批号:包装规格:Xg/袋×X袋/盒×XXX盒/件成品数量:盒(其中取样盒)操作日期:年月日至月日汇总人:审核人:XXXXX制药有限公司制剂批生产指令制粒、干燥岗位生产操作记录(1/2)3、制粒操作:取一份配料后的蔗糖粉、糊精加入高效湿法混合制粒机,开启搅拌预混合XXXX 秒后边搅边加入XXXX颗粒稠膏。
再搅拌约X~X秒制成软材。
达到手握成团,轻捏即散,再将软材加入摇摆式颗粒机中加适量乙醇过XXX目筛网制成颗粒。
每锅干燥整粒后的尾料及时与本批下锅物料一并混合制粒,最后一制粒、干燥岗位生产操作记录(2/2)4、干燥:按《沸腾干燥制粒机标准操作规程》调试好沸腾干燥制粒机。
设定进风温度为:XXX℃,开启沸腾干燥,将制成的湿颗粒吸入沸腾干燥机,控制物料温度在:XXX~XXX℃,干燥XXX~XXX分钟,打开移动料斗,收料,转入整粒工序。
5、完工清场:工序负责人:QA员:工艺员:整粒、总混岗位生产操作记录(1/2)2、整粒、收料:按《高效振荡筛标准操作规程》组装好XXX目和XXX目筛网。
取干燥后的物料过筛,收取粒度合格的颗粒,称量并记录(每锅尾料转入制粒工序一并制粒)。
控制:水分≤XXX%,颗粒均匀,色泽一致。
3、整粒后合格颗粒收料称量记录:工序负责人:QA员:工艺员:整粒、总混岗位生产操作记录(2/2)4、总混物料准备:接收整理合格的XXXX颗粒,领取薄荷挥发油及制粒工序剩余的乙醇,复核名称、批号、数量、质量状态等。
5、总混操作:严格执行“混合岗位标准操作规程”、“二维混合机操作规程”等有关文件。
将整粒后的合格颗粒置二维运动混合机中进行总混,混合时用喷洒壶喷入用95%乙醇溶解的XXX挥发油,混合时间15分钟。
将总混后的颗粒用内置洁净塑料袋的洁净物料桶进行盛装,填写请检单,请QA抽样检验。
6、完工清场:工序负责人:QA员:工艺员:包装批生产指令复合膜小袋分装岗位生产操作记录1、工前检查:3、复合膜小袋分装操作:严格执行“复合膜分装机操作规程”、“内包岗位标准操作规程”等文件。
2019版GMP批生产记录模板35页word
洗瓶工序批生产记录文件编号:BPR-01-004品名:注射液规格:批号生产日期:年月日XXX工序批生产记录文件编号:BPRXXXX品名:注射液规格: ml 批号生产日期:年月日配制工序批生产记录文件编号:BPRXXXX 页数:1/2品名:注射液规格: ml 批号生产日期:年月日配制工序批生产记录文件编号:BPRXXXX 页数:2/2品名:注射液规格: ml 批号生产日期:年月日灌装加塞工序批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日轧盖工序批生产记录文件编号:BPRXXXX品名:注射液规格: ml 批号生产日期:年月日上瓶岗位批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日灭菌岗位批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日下瓶岗位批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日灯检工序批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日打批号工序批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日包装工序清场记录文件编号:XXXXXX品名:注射液规格: ml 批号生产日期:年月日输液瓶贴签工序批生产记录文件编号:品名:注射液规格: ml 批号生产日期:年月日输液瓶贴签工序清场记录文件编号:品名:注射液规格: ml 批号生产日期:年月日瓶装输液包装箱贴签工序批生产记录文件编号:品名:注射液规格: ml 批号生产日期:年月日包装工序清场记录文件编号:品名:注射液规格: ml 批号生产日期:年月日包装工序批生产记录文件编号:品名:注射液规格: ml 批号生产日期:年月日包装工序批生产记录文件编号:BPRXXX品名:注射液规格: ml 批号生产日期:年月日包装工序批生产记录文件编号:BPRXXXX品名:注射液规格: ml 批号生产日期:年月日包装工序清场记录文件编号:BPRXXXX品名:注射液规格: ml 批号生产日期:年月日希望以上资料对你有所帮助,附励志名言3条:1、理想的路总是为有信心的人预备着。
XXX版GMP口服液制剂全套批生产记录
XXX版GMP口服液制剂全套批生产记录产品名称:XXX版GMP口服液制剂生产批号:XXXXX生产日期:XXXX年XX月XX日一、原辅材料准备及检查1.原辅材料准备:(1)主要原料清单:原料名称供应商批号用量xxx xxx公司 xxx xxxxxx xxx公司 xxx xxx(2)辅料清单:辅料名称供应商批号用量xxx xxx公司 xxx xxxxxx xxx公司 xxx xxx2.原辅材料检查:(1)主要原料:按照相关要求进行外观、标识、包装、规格等检查,检查记录见附件1(2)辅料:按照相关要求进行外观、标识、包装、规格等检查,检查记录见附件2二、制剂生产过程1.准备制剂设备和容器:(1)根据工艺要求,准备好所需的制剂设备和容器,洗净并消毒。
2.准备生产用水:(1)检查生产用水的水质,并记录相关数据。
3.准备制剂溶剂:(1)按工艺要求,准备好制剂所需的溶剂。
4.配制制剂溶液:(1)按照工艺要求,将制剂原料逐一加入搅拌容器中,适当加热并搅拌至均匀。
5.过滤制剂溶液:(1)将配制好的制剂溶液通过过滤器过滤,去除悬浮物等杂质。
6.灭菌处理:(1)将过滤好的溶液进行灭菌处理,确保产品的微生物指标符合要求。
7.装瓶包装:(1)将灭菌好的制剂液体装入瓶中,按规定数量进行包装。
9.封瓶:10.封装包装:三、质量控制及分析1.进行质检样品的取样及标记。
2.根据质检样品的检验项目和方法,进行质检操作。
3.记录质检结果,并进行分析。
4.对合格的产品进行包装交接。
四、记录1.生产批次报告:记录生产过程中的设备、操作、环境等要点,检查合格项目等,附件32.温度记录:记录生产过程中的各个环节的温度,附件43.湿度记录:记录生产过程中的各个环节的湿度,附件54.净化度验证记录:记录净化设备的验证情况,附件65.灭菌验证记录:记录灭菌设备的验证情况,附件76.质量检查记录:记录质量检查的结果,附件8以上内容为生产批次记录的基本内容,详细操作和检验项目及方法需根据具体工艺和要求进行调整。
新版GMP批生产记录模板
目的:建立阿胶补血口服液批生产记录,用于追溯每批产品的生产历史以及与质量有关的情况。
范围:适用于阿胶补血口服液生产全过程。
责任:生产部、质量保证部、制剂车间。
内容:1生产处方依据:注册批件:湖南省食品药品监督管理局药品再注册批件(批件号:2009R000033)。
执行标准:《中国药典》2010年版一部P790。
2生产处方和制法:【处方】阿胶62.5g 熟地黄125g 党参125g黄芪62.5g 枸杞子62.5g 白术62.5g【制法】以上六味,熟地黄加水煎煮三次,第一次2小时,第二、三次每次1.5小时,煎液滤过,滤液合并,静置,取上清液,备用;白术、枸杞子用60%乙醇作溶剂,党参、黄芪用25%乙醇作溶剂,浸渍,渗漉,收集渗漉液,静置,滤过,滤液回收乙醇并浓缩至适量,备用;阿胶加水适量,加热使溶化,滤过,滤液与上述浓缩液及熟地黄提取液混合,滤过,加苯甲酸钠3g或山梨酸2g及矫味剂适量,加热至沸,加水至1000ml,混匀,即得。
阿胶补血口服液提取生产操作记录生产批号:T-药圣堂(湖南)制药有限公司提取批生产指令熟地黄提取液煎煮生产操作记录述熟地黄(400kg)加水煎煮三次,第一次加约1600Kg饮用水,加热至沸腾,煎煮2小时;第二次加约1200Kg饮用水,加热至沸腾,煎煮1.5小时;第三次加约1000Kg饮用水,加热至沸腾,煎煮1.5小时,熟地黄提取液浓缩收膏生产操作记录度:18~26℃;湿度:45~65%)进行收膏,盛装于洁净的不锈钢桶内,QA员同时进行取样送检,称重醇提渗漉液渗漉生产操作记录用60%乙醇作溶剂,党参、黄芪用25%乙醇作溶剂。
先用3倍药材量指定浓度的乙醇浸渍约3小时,润透,再加1倍药材量指定浓度的乙醇,浸渍36小时后再用2倍药材量指定浓度的乙醇渗漉,收集渗漉液,工序负责人:QA员:工艺员:乙醇配制记录、渗漉速度监控记录枸杞子浸渍、渗漉共用60%乙醇约为药材总量的6倍量(约3600L);黄芪、党参浸渍、渗漉共用25%乙醇提渗漉液乙醇回收、浓缩生产操作记录1、工前检查:2、浓缩操作:严格执行“浓缩岗位标准操作规程”等有关文件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
洗瓶工序批生产记录
文件编号:BPR-01-004品名:注射液规格:批号生产日期:年月日
XXX工序批生产记录
文件编号:BPRXXXX
品名:注射液规格: ml 批号生产日期:年
月日
配制工序批生产记录
文件编号:BPRXXXX 页数:1/2品名:注射液规格: ml 批号生产日期:年月日
配制工序批生产记录
文件编号:BPRXXXX 页数:2/2品名:注射液规格: ml 批号生产日期:年月日
灌装加塞工序批生产记录
文件编号:BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
轧盖工序批生产记录
文件编号:BPRXXXX
品名:注射液规格: ml 批号生产日期:年月日
上瓶岗位批生产记录
文件编号:BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
灭菌岗位批生产记录
文件编号:BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
下瓶岗位批生产记录
文件编号:
BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
灯检工序批生产记录
文件编号:BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
打批号工序批生产记录
文件编号:BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
包装工序清场记录
文件编号:XXXXXX
品名:注射液规格: ml 批号生产日期:年月日
输液瓶贴签工序批生产记录
文件编号:
品名:注射液规格: ml 批号生产日期:年月日
输液瓶贴签工序清场记录
文件编号:
品名:注射液规格: ml 批号生产日期:年月日
瓶装输液包装箱贴签工序批生产记录
文件编号:
品名:注射液规格: ml 批号生产日期:年月日
包装工序清场记录
文件编号:
品名:注射液规格: ml 批号生产日期:年月日
包装工序批生产记录
文件编号:
品名:注射液规格: ml 批号生产日期:年月日
包装工序批生产记录
文件编号:BPRXXX
品名:注射液规格: ml 批号生产日期:年月日
包装工序批生产记录
文件编号:BPRXXXX
品名:注射液规格: ml 批号生产日期:年月日
包装工序清场记录
文件编号:BPRXXXX
品名:注射液规格: ml 批号生产日期:年月日
希望以上资料对你有所帮助,附励志名言3条:
1、上帝说:你要什么便取什么,但是要付出相当的代价。
2、目标的坚定是性格中最必要的力量源泉之一,也是成功的利器之一。
没有它,天才会在矛盾无定的迷径中徒劳无功。
3、当你无法从一楼蹦到三楼时,不要忘记走楼梯。
要记住伟大的成功往往不是一蹴而就的,必须学会分解你的目标,逐步实施。
