实验二十四第一过渡系元素二铁钴镍
实验二十四:第一过渡系元素(二)(铁、钴、镍)
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
d 区金属元素 铬、锰、铁、钴、镍 一、实验目的

d区金属元素(铬、锰、铁、钴、镍)一、实验目的1. 试验并掌握铬、锰主要氧化态化合物的重要性质及各氧化态之间相互转化的条件。
2. 试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性。
3. 试验并掌握铁、钴、镍的配合物的生成及性质。
二、实验原理位于周期表中第四周期的Sc~Ni称为第一过渡系元素,第一过渡系元素铬、锰、铁、钴、镍是最常见的重要元素。
铬为周期表中ⅥB族元素,最常见的是+3和+6氧化态的化合物。
+3价铬盐容易水解,其氢氧化物呈两性,碱性溶液中的 +3价氧化态铬以CrO2-形式存在,易被强氧化剂如Na2O2或H2O2氧化为黄色的铬酸盐。
2 CrO2- +3 H2O2 + 2 OH-CrO42- +4 H2O常见+6价氧化态的铬化合物是铬酸盐和重铬酸盐,它们的水溶液中存在着下列平衡:2 CrO42- + 2 H+Cr2O72- + H2O除了加酸、加碱条件下可使上述平衡发生移动外,向Cr2O72-溶液中加入Ba2+、Ag+、Pb2+离子时,根据平衡移动规则,可得到铬酸盐沉淀。
2 Ba2+ + Cr2O72- + H2O BaCrO4↓(柠橙黄色) + 2 H+4 Ag+ + Cr2O72- + H2O Ag2CrO4↓(砖红色) + 2 H+2 Pb2+ + Cr2O72- + H2O PbCrO4↓(铬黄色) + 2 H+重铬酸盐是强氧化剂,易被还原成+3价铬(Cr3+溶液为绿色或蓝色)。
锰为周期表ⅦB族元素,最常见的是+2、+4、+7氧化态的化合物。
+2价态锰化合物在碱性介质中形成Mn(OH)2。
Mn(OH)2为白色碱性氢氧化物,溶于酸及酸性盐溶液中,在空气中易被氧化,逐渐变成棕色MnO2的水合物[MnO(OH)2]。
4 Mn(OH)2 + O MnO(OH)2(褐色) + 2 H2O+2价态锰化合物在酸性介质中比较稳定,与强氧化剂(如NaBiO3、PbO2、S2O82-等)作用时,可生成紫红色MnO4-离子,这个反应常用来鉴别Mn2+。
第一过渡元素实验报告

第一过渡元素实验报告第一过渡元素实验报告引言:过渡元素是化学中一类重要的元素,它们的特性和性质对于我们理解化学反应和物质变化起着关键的作用。
本实验旨在通过实际操作和观察,探究第一过渡元素的一些性质和反应。
实验材料与方法:1. 实验材料:- 铜片- 锌片- 镁片- 铁片- 镍片- 铬片- 锰片- 钛片- 锂片- 钾片- 盐酸- 硫酸- 纸巾- 试管- 火柴2. 实验方法:1) 将实验材料准备齐全,并按照实验步骤依次进行实验。
2) 将每种过渡元素片放入不同的试管中,注意标记。
3) 分别将盐酸和硫酸倒入不同的试管中,观察反应情况。
4) 使用火柴点燃每种过渡元素片,观察燃烧现象。
实验结果与讨论:1. 盐酸和硫酸反应:在盐酸中,铜片发生了气泡的产生,同时溶液颜色变为浅蓝色。
而锌片、镁片和铁片则产生了更多的气泡,且溶液颜色变为无色。
这表明铜和锌、镁、铁之间具有不同的反应性,铜的反应性较低。
在硫酸中,铜片同样发生了气泡的产生,但溶液颜色变为深蓝色。
而锌片、镁片和铁片则产生了更多的气泡,且溶液颜色变为无色。
这表明铜和锌、镁、铁之间在硫酸中的反应性也存在差异,但与盐酸反应性的差异不同。
2. 燃烧现象:铜片在点燃后迅速燃烧,产生了明亮的火焰和黑色的氧化铜。
锌片、镁片和铁片也发生了燃烧,但火焰较铜片暗淡,且产生了不同颜色的氧化物。
这表明不同过渡元素在燃烧时产生的反应产物和火焰特性也存在差异。
结论:通过本实验,我们观察到了第一过渡元素的一些性质和反应。
在盐酸和硫酸中,铜与锌、镁、铁之间的反应性不同,且硫酸中的反应性差异与盐酸有所不同。
此外,不同过渡元素在燃烧时产生的反应产物和火焰特性也存在差异。
这些观察结果与过渡元素的电子结构和周期表上的位置密切相关。
过渡元素具有不完全填充的d轨道,因此它们的化学性质与其他元素有所不同。
其反应性和燃烧特性的差异可以归因于元素之间的电子转移和氧化还原反应。
本实验只涉及了第一过渡元素的一些基本性质和反应,对于进一步研究和理解过渡元素的化学行为仍有待深入探索。
实验二十四第一过渡系元素(二)(铁、钴、镍)

2Fe3++2I-=2Fe2++I2
结论
水溶液中Fe3+的氧化力大于I2,而Co3+和Ni3+的氧化力大于Cl2。
三、配合物的生成
1铁的配合物
(1) 亚铁氰化钾溶液中加入碘水,摇荡试管后,加入硫酸亚铁。
加入硫酸亚铁后生成蓝色物质。
Fe(II)的CN-配合物被I2氧化成Fe(III)配合物,加入Fe2+后生成了铁蓝。
查电极电势可知,Fe2+不能被I2氧化
Fe2+?+I2=(不反应)
强氧化剂可以将Fe2+氧化成Fe3+,后者与SCN-反应生成血红色配合物:
Fe2++H2O2=Fe3++H2O
Fe3++nSCN-=[Fe(SCN)n]3-n(n=1~6)
结论
由于电极电势 I2不能将Fe2+氧化成为Fe3+,生成配合物改变了电极电势, 因此I2可以将Fe(II)的氰配合物氧化成Fe(II)配合物;H2O2能将Fe2+氧化成Fe3+。
总结:
铁、钴、镍的主要化合价为+2和+3。
其中+2氧化态具有还原性,+3氧化态具有氧化性。
通常,酸性条件下的氧化能力增加;碱性条件下物质还原能力增加;
配合物的形成能够在较大的程度上能改变元素电对的电极电势;
还原性增强
Fe(II)
Co(II)
Ni(II)
Fe(III)
Co(III)
Ni(III)
氧化性增强
2钴的配合物
(1)CoCl2溶液中加入少量KSCN固体,观察固体周围溶液的颜色。再加入戊醇和乙醚,观察有机相颜色。
无机化学实验第四版实验24 铁钴镍
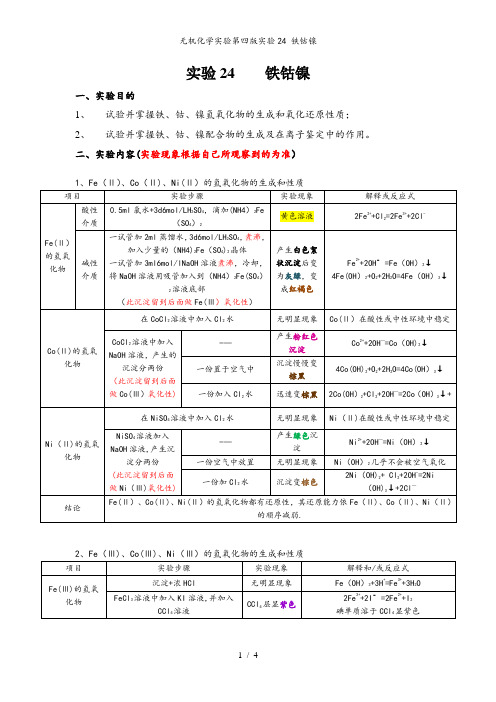
实验24 铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验内容(实验现象根据自己所观察到的为准)三、实验讨论(从自己实验操作展开)四、实验思考题和习题1。
实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结+2价的铁、钴、镍化合物的还原性和+3价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物都有还原性,其还原能力依Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的顺序增加。
3。
比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co(Ⅲ)氨配合物。
即镍盐更稳定.4。
为什么制取+3价的钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而Co(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
5。
如何分离混合液中的?Fe3+、Cr3+、Ni2+ ?6.总结Fe(Ⅱ、Ⅲ)、Co(Ⅱ、Ⅲ)、Ni(Ⅱ、Ⅲ)主要化合物性质。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)具有强的还原性,都易形成配合物,且Co的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强的氧化性,也易生成配合物。
7。
(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。
实验24第一过渡系元素(铬、锰、铁、钴、镍)

实验24 第一过渡系元素(铬、锰、铁、钴、镍)一、实验目的掌握铬、锰主要氧化态的化合物的重要性质及各氧化态之间相互转化的条件。
掌握铁、钴、镍的氢氧化物及配合物的生成和性质。
掌握铁盐的性质。
学习Fe2+、、Fe3+和Ni2+的鉴定方法。
二、实验前应思考的问题1.转化反应须在何种介质(酸性或碱性)中进行?为什么?2.从电势值和还原剂被氧化后产物的颜色考虑,选择哪些还原剂为宜?如果选择亚硝酸钠溶液可以吗?3.转化反应须在何种介质中进行?为什么?4.从电势值和氧化剂被还原后产物的颜色考虑,应选择哪些氧化剂?3%H2O2溶液可用否?三、实验用品仪器:试管、台秤、沙浴皿、蒸发皿、试管、离心试管、烧杯、玻璃棒、滴管、点滴板、酒精灯固体药品:二氧化锰、亚硫酸钠、高锰酸钾、FeSO4·7H2O、KCl、NH4Cl液体药品:H2SO4(浓,1 mol·L-1),H2O2(3%)、NaOH(40%,6 mol·L-1,2 mol·L-1,0.1 mol·L-1),CuCl2(0.2 mol·L-1)、HCl(浓,6 mol·L-1,2 mol·L-1,0.1 mol·L-1)、H2SO4(2 mol·L-1)、HAc(2 mol·L-1)、NH3·H2O(浓)、K2SO4·Cr2(SO4)3·24H2O(0.2 mol·L-1)、NH3·H2O(2 mol·L-1)、K2Cr2O7(0.1 mol·L-1)、FeSO4(0.5 mol·L-1)、K2CrO4(0.1 mol·L-1)、AgNO3(0.1 mol·L-1)、BaCl2(0.1 mol·L-1)、Pb(NO3)2(0.1 mol·L-1)、MnSO4(0.2 mol·L-1,0.5 mol·L-1)、NH4C1(2 mol·L-1 )、NaClO(稀)、H2S(饱和)、Na2S(0.1 mol·L-1、0.5 mol·L-1),KMnO4(0.1 mol·L-1)、Na2SO3(0.1 mol·L-1)、K4[Fe(CN)6] (0.1 mol·L-1)、K3[Fe(CN)6] (0.1 mol·L-1)、CoCl2(0.1 mol·L-1)、NiSO4(0.1 mol·L-1)、FeCl3(0.1 mol·L-1)、KI(0.1 mol·L-1)、Na2CO3(0.1 mol·L-1)、KMnO4(0.1 mol·L-1)MnSO4(0.1 mol·L-1)、CrCl3(0.1 mol·L-1)、NH4F(1 mol·L-1)、NH4Cl(1 mol·L-1)、KSCN(0.1 mol·L-1、25%)、Pb(Ac)2(0.5 mol·L-1)、KNO2(饱和)溴水、淀粉溶液、二乙酰二肟(1%)、H2O2(3%)、滤纸、淀粉KI试纸、邻菲罗啉、戊醇材料:pH试纸、沸石四、实验内容1 铬的化合物的重要性质⑴铬(Ⅵ)的氧化性Cr2O72-转变为Cr3+。
无机化学实验第四版实验2铁钴镍
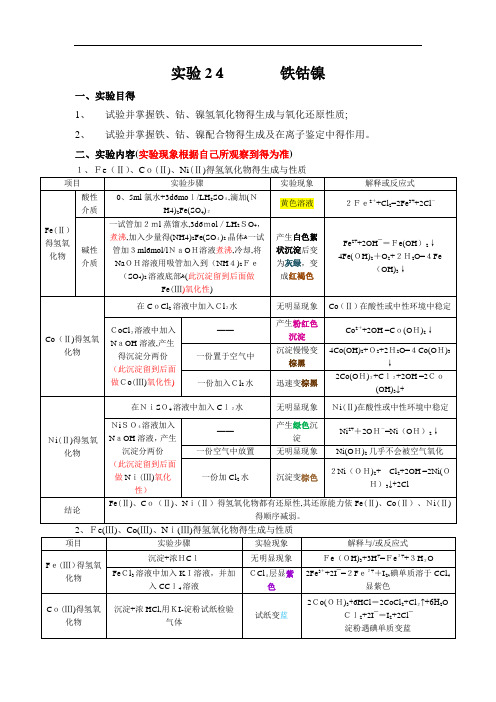
实验24铁钴镍一、实验目得1、试验并掌握铁、钴、镍氢氧化物得生成与氧化还原性质;2、试验并掌握铁、钴、镍配合物得生成及在离子鉴定中得作用。
二、实验内容(实验现象根据自己所观察到得为准)三、实验讨论(从自己实验操作展开) 四、实验思考题与习题1、实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?F e(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色得转化过程。
2.根据实验现象总结+2价得铁、钴、镍化合物得还原性与+3价得铁钴镍化合物氧化性得变化规律。
Fe (Ⅱ)、Co (Ⅱ)、Ni(Ⅱ)得氢氧化物都有还原性,其还原能力依Fe (Ⅱ)、Co (Ⅱ)、Ni (Ⅱ)得顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni (Ⅲ)在酸性介质中得氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)得顺序增加。
3、比较钴镍氨配合物得氧化还原性相对大小及溶液稳定性。
钴盐与镍盐生成碱式盐溶于过量得氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co (Ⅲ)氨配合物。
即镍盐更稳定。
4、为什么制取+3价得钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co 3+、Ni 3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而C o(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
53+3+2+ﻩ6.配合物极易被氧化,它们得氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强得氧化性,也易生成配合物。
7、(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe(SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都就是简单得,都可以轻易写出,在此我不一一写出了。
第一过渡元素二铁钴镍实验报告

第一过渡元素二铁钴镍实验报告一、引言二铁钴镍合金是一种重要的金属材料,具有高强度、高韧性、高温稳定性等优点,被广泛应用于航空、航天、汽车等领域。
本实验旨在制备二铁钴镍合金,并研究过渡元素对合金性能的影响。
二、实验方法1.实验材料:铁、钴、镍粉末。
2.实验设备:熔融法制备设备、高温炉、电子显微镜、扫描电子显微镜等。
3.实验步骤:(1)将铁、钴、镍粉末按一定比例混合均匀。
(2)将混合粉末放入熔融法制备设备中,在氩气氛围下进行熔融处理,保持温度为1650℃,时间为2h,使其充分熔融混合。
(3)将熔融合金放入高温炉中,在氩气氛围下进行加热处理,升温速度为5℃/min,将温度升至1000℃保持10h,随后降温处理。
(4)用电子显微镜和扫描电子显微镜对制备的二铁钴镍合金进行形貌和组织结构分析。
三、实验结果经过制备和分析,得到的二铁钴镍合金的形貌和组织结构如下:1.形貌分析:合金表面呈灰黑色,略带光泽,无氧化现象,颗粒较细。
2.组织结构分析:经电子显微镜观察,发现合金中含有大量的球形和棒状的晶粒,晶粒大小约为1-10μm。
通过扫描电子显微镜,发现晶界清晰,无明显的孔洞、裂纹等缺陷。
四、实验分析二铁钴镍合金是由铁、钴、镍三种金属元素组成,其中铁为主要成分,钴和镍是过渡元素。
过渡元素的添加对合金的性能有重要的影响。
实验结果表明,制备的二铁钴镍合金表面光泽度高,无氧化现象,晶粒分布均匀,晶界清晰。
这表明合金制备工艺优良,达到了预期的效果。
钴和镍的添加可以提高二铁钴镍合金的热稳定性和耐腐蚀性,同时对其力学性能和磁性能也有影响。
在合金中添加适量的过渡元素,可以调节晶粒尺寸、组织结构和晶格畸变等因素,从而优化合金的性能。
五、结论本实验成功制备了二铁钴镍合金,并对其形貌和组织结构进行了分析。
实验结果表明,过渡元素的添加可以调节合金的性能,优化其力学性能和磁性能等。
通过本实验的研究,对二铁钴镍合金的制备和性能分析有了更加深入的认识,为进一步研究和应用该材料奠定了基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、工程概况 1、本工程为******工程,地址位于******。由****公司*开发建设,由 *****公司设计,监理单位:*****公司,施工单位:*****公司。 2、本工程为全现浇框剪结构。由裙楼及塔楼组成,结构布局较为复杂,造型 新颖。施工现场比较狭窄,可供使用的场地较小,给施工带来极大的不便。建筑物为**** 型。 3、根据本工程结构及施工特点,拟在建筑***物**轴中部靠外侧布置一台QTZ50塔 式起重机能满足施工中垂直运输和水平运输的需要。 二、准备情况 1、采用*****建筑机械有限公司生产的 QTZ50自升式塔式起重机。 2、安装塔机时,需一汽车吊,其性能适应起吊部件的需要。能妥善协调各种安 装和组装步骤,合理配置塔机安装人员及来往通道,组装现场之间的关系,则能将 使用汽车吊的时间减至最少。 3、组织有资质的专业安装队伍。
提高施工效率。 4、回转机构采用行星齿轮减速机,结构紧凑,采用液力偶合器联接,使起
动平稳,并设有回转制动装置,重物就位准确。 5、小车牵引机构采用蜗轮杆减速机,双速电机驱动,具有二种牵引速度,
以提高工效。 6、采用机械式力矩限制器和最大起重量限制器,结构简单,灵敏可靠,便于维修。 7、采用联动控制台操作,灵活轻便,舒适可靠。 四、塔吊基础 固定式塔式起重机的地基基础是保证塔机安全使用的必要条件,对基础的基本
B、安装基础节、标准节、套架 装基础节吊装到底架上,用件8 专用螺栓和16件专用螺母将底架与基础节相连, 再吊装2 件标准节( 标准节上有踏步的一方应与准备安装平衡臂的方向一 用),标致准节螺 栓连接好后吊装套架。使套架上的爬爪放在标准节的踏步上。再调整个8爬升好导轮与 标准节的间隙(间隙为2—3 毫米)。
G、安装司机室 司机室的电气设备安装齐全后,把司机室吊起到上支座右平台的前端,对准耳 板上孔的位置,然后用三根销轴联接并穿好开口销。 H、安装吊臂总成 先按照要求拼装好吊臂,把吊臂停靠在约 0.6在m高的支架上,将维修吊栏紧固在 变幅小车上,然后按要求将变幅小车装在吊臂上,并收紧变幅小车的钢丝绳,以小 车在载重情况下,不松弛为宜。再将吊臂拉杆按要求拼装好后与吊臂上的吊点用销 轴铰接,穿好开口销,放在吊臂上弦杆的定位托架内,检查吊臂上的电线路是否完 善,挂绳,试吊是否平稳,否则可适当移动挂绳位置。 I、安装平衡重 根据所使用的臂长,按要求选择相应的平衡重。本方案平衡重为: 2.2×2+1.5×2=7.4。各种臂长的平衡重的配置及安装位置严格按要求安装,然后在 于衡重的上部用连接板将每块平衡重互相串连好,并装入弹簧垫圈,拧紧螺母。再 用两件长拉拉板按要求安装。尾部两端分别装入开口销,前面用螺M母24拧紧。塔机工 作时不允许平衡重有摆动现象。吊装完毕后,按要求进行起升钢丝绳的穿绕,钢丝 绳从起升机构卷筒上放出,绕过塔顶上部导向滑轮向下,进入回转塔身上起重量限
(3)、调整小车位置进行实际配平。
10、塔机基础必须达到使用荷载地基承力的要求。 11、塔机安装时必须具有专业资质的安装队,并有专业经验的技术工程师指 挥安装。 12、安装时,必须设置安全警示区域,设置警示牌。 八、顶升过程及操作 待塔机组装完毕,并进行空车试运转正常后,可作顶升升塔操作。 顶升过程应在风力小于级4 时进行。 顶升前,应使上部回转塔身处于制动状态,并不允许有回转运动。 顶升过程中,塔机除自己安装需要吊装外,不得进行吊装作业。 若液压顶升系统出现异常,应立即停止顶升,收回油缸,检查有否顶升障碍和 油路系统障碍。 1、顶升前的准备工作 (1)、按要求规定泵站用油给液压泵站油箱加油,并在空载状态使顶升油缸在最 大行程范围内,活塞杆伸缩数次,确认整个顶升机构正常后才能进入工作状态。 (2)、清理好各个标准节,除锈,去油漆,焊疤等。在标准节结合处涂上黄油, 将待顶升加节用的标准节在顶升位置时的吊臂下排成一排,这样能使塔机在整个顶
要求提出如下: 1、基础的土质应坚固牢实,要求承载能力大于2吨0 平/方米。 2、基础采用1 个人工挖孔桩,桩顶为现浇砼承台,见基础。) 图
ห้องสมุดไป่ตู้3、桩孔嵌入中风化持力层500mm。 4、混凝土基础的强度等级为C30。
5、混疑土基础表面应校水平,平面度允许差不大1/5于00。 6、浇筑基础砼承台前,应先将塔吊地脚螺栓预埋好后(按基础图)。筑在砼浇,
行程限位器有: 起升高度限位器、回转限位器、幅度限位器; 载荷限制器有: 起重刀矩限位器、起重量限制器; 塔机在安装完毕后,顶升加节和投入使用前必须将上述安全保护装置调试合格。 七、整机安装保护装置的安装位置 包括调整程度、起升高度限位器的调整方法,回转限位器的调整方法,幅度 限位器、力矩限位器。 塔机安装安全保证措施。 1、参加塔机安装的司机(包括操作使用塔机的司机,) 安装工,起重工必须是按劳 人事部门有关规定进行考核,并取得合格证者,严禁无证操作安装,维修塔机。 2、安装人员在安装前必须熟读塔机的使用说明书,熟练掌握该塔机的操作、 安装程序及要求,否则一律不准上岗。 3、安装塔机前必须按使用说明书的要求给塔机各部加油。 4、塔机安装工作应在风力小于级4 时进行。 5、特别注意吊点的选择,根据吊装部件选用长度适当,质量可靠的吊具,保
C、安装回转支承总成 下支座,回转支承,上支座出厂时已用螺栓连为整体。将该组件吊起至套架 上,使下支座上焊有阿拉伯数字的一面对正套架上引进标准节的一面,对正下支座 上四根主弦杆与标准节上的止口,用销轴与套架连接起来,并件 8M用30的标准节螺栓 将下支座与标准节连接,然后安装上支座的工作平台。 D、安装回转塔身总成 吊起回转塔身,安装时注意与平衡臂和吊臂铰接用支耳的方向,回转塔身上支 耳为单片的一面与准备安装平衡臂的方向一致,反之则是安装在吊臂方向,应朝前 方。用16件 M24X114的专用螺栓和32件 M24的专用螺母将回转塔身与上支座紧固。 调整8 件爬升导轮与塔身主弦杆之间的间隙2-3毫米。 E、安装塔顶
