反式_1_2_环己二醇合成研究
1,2环己二醇的连续合成工艺研究

1,2环己二醇的连续合成工艺研究沈磊;何伟;方正;田启涛;郭凯【期刊名称】《南京工业大学学报(自然科学版)》【年(卷),期】2017(039)001【摘要】以环己烯为原料,在微反应器中将环氧化反应与水解反应串联制备1,2环己二醇。
实验发现,环氧化反应采用双氧水/甲酸体系,而皂化反应采用NaOH催化开环产物水解。
在环氧化反应中,当选用HCOOH作为载氧体,n (环己烯)∶n(双氧水)∶n(HCOOH)=1∶2∶8,40℃下在微反应器中反应5 min;在皂化反应中,n(环己烯)∶n( NaOH)为1∶1�5,70℃下反应10 min,所得到的1,2环己二醇的产率高达98�1%。
【总页数】7页(P51-56,63)【作者】沈磊;何伟;方正;田启涛;郭凯【作者单位】南京工业大学生物与制药工程学院材料化学工程国家重点实验室,江苏南京 210009;南京工业大学生物与制药工程学院材料化学工程国家重点实验室,江苏南京 210009;南京工业大学生物与制药工程学院材料化学工程国家重点实验室,江苏南京 210009;南京工业大学生物与制药工程学院材料化学工程国家重点实验室,江苏南京 210009;南京工业大学生物与制药工程学院材料化学工程国家重点实验室,江苏南京 210009【正文语种】中文【相关文献】1.单取代Keggin型磷钼酸催化氧化环己烯合成反-1,2-环己二醇 [J], 解启慧;王晓来2.1,2-环己二醇合成己二酸的氧化动力学 [J], 倪风超;蒋鑫;沈介发;严生虎3.由环己烯合成1,2-环己二醇的研究进展 [J], 王小光;杨月云4.环氧环己烷废液中1,2-环己二醇合成己二酸的工艺研究 [J], 段文蕊;王麦见;陈天天;张晓阁;韩娟5.1,2-环己二醇二缩水甘油醚的合成及应用 [J], 王永强;王红卫因版权原因,仅展示原文概要,查看原文内容请购买。
2-亚甲基戊二腈及反式1,2-环己二醇合成研究的开题报告

2-亚甲基戊二腈及反式1,2-环己二醇合成研究的开题报告一、选题背景及意义:亚甲基戊二腈是一种重要的有机合成中间体,广泛应用于制备药物、染料、农药、香料等化学品的生产中。
而反式1,2-环己二醇则是一种具有重要生物活性的有机化合物,在医药、化妆品、涂料等领域具有潜在的应用价值。
因此,对于亚甲基戊二腈及反式1,2-环己二醇的合成研究,不仅能够满足工业上的应用需求,同时也有利于深入探究有机合成的基本原理,丰富有机合成化学的研究内容。
二、研究内容:本研究旨在探究亚甲基戊二腈及反式1,2-环己二醇的合成方法及反应机理,具体研究内容如下:1. 亚甲基戊二腈的合成方法研究通过文献调查和实验探究,选择一种实用、高效的方法来合成亚甲基戊二腈,包括反应条件、催化剂选择、反应机理等方面的研究。
2. 反式1,2-环己二醇的合成方法研究通过文献调查和实验探究,选择一种实用、高效的方法来合成反式1,2-环己二醇,包括反应条件、催化剂选择、反应机理等方面的研究。
3. 亚甲基戊二腈与反式1,2-环己二醇的反应机理研究通过实验探究和理论计算,深入探究亚甲基戊二腈与反式1,2-环己二醇反应的机理,解析反应中的中间体和过渡态,为其工业应用提供有力的理论支持。
三、研究方法:1. 实验方法:通过选择不同的反应条件、催化剂和反应中的反应物量等因素,开展不同条件下亚甲基戊二腈及反式1,2-环己二醇的合成实验,通过NMR、IR、GC-MS、HPLC等手段对实验产物进行表征。
2. 理论计算方法:利用现代计算化学手段,如密度泛函理论(DFT)、分子力学(MM)、分子动力学模拟(MD)等方法,对亚甲基戊二腈与反式1,2-环己二醇反应的机理进行计算和模拟。
四、预期结果:本研究计划通过实验和理论计算的相结合的方法,为亚甲基戊二腈及反式1,2-环己二醇的合成方法及反应机理等方面进行探究,预期结果如下:1. 发现亚甲基戊二腈合成反应的最优条件,并得到高产率、高纯度的产物。
反式—1,2—环己二醇合成研究

收 稿 日期 :1 20 -0 20 -43 2
分析 : 实验通 过科创 90 本 80气相 色谱仪 ( 配有 H 色谱工作站 ) W 分析确定 12 , 一环 己二醇 的选择 性 和收率 。程序 升温 , 内标 物为庚醇 , 氢火焰 检测。使 用 数 字 熔 点 仪 ( 海 精 密 科 学 仪 器 有 限 公 司 物 理 化 上
中图分 类 号 :Q2 T 2 文 献标 识码 : A
St y o y he ii a ud n s nt szng Tr ns一 1,2一 c co xa di l y l he ne o
Z HOU irn Ca-o g, J 4 n - a tNG Deg g o, WA NG e , L Fi I
维普资讯
第3 4卷 第 5 期
20 0 2年 9月
四 川 大 学 学 报 (工 程 科 学 版 )
J U A FSC A NIE ST ( N I E I CE E E II O RN L O IHU N U V R IY E G N ERNGS INC DTON)
Ke wo d ta s一 1, 一c c o e a e il y lhe e y r s:r n 2 y lh x n d o ;c co x ne;s n e ie;s l e te ta t n y t sz h o v n xr c i o
邻 苯 二 酚 又 名 焦 儿 茶 酚 , 精 细 化 工 的 重 要 中 是 间体 。早 期 生 产 邻 苯 二 酚 曾 采 用 邻 氯 苯 酚 碱 解 法 , 近 年来 , 际 上 纷 纷 改 用 苯 酚 双 氧 水 氧 化 法 。这 些 国 方 法 都 存 在 着 邻 苯 二 酚 选 择 性 低 , 产 物 对 苯 二 酚 副 多 的 缺 点 。 因 此 , t 、 罗 斯 、 国 等 国 外 研 究 机 E本 俄 德
反式1、2 (自动保存的)

反式1,2-环己二醇的制备及拆分本实验设计研究分为三个部分:1、由环己醇制备环己烯,已有成熟条件如浓硫酸、浓磷酸或固体催化剂催化制备环己烯,探索其他催化剂催化环己醇制备环己烯。
2、(1)由环己烯制备1,2-环己二醇的工艺路线,考察了物料配比,反应温度,反应时间,加料方式,PH值等诸多因素的影响。
(2)环氧环己烷制备反式1,2-环己二醇。
3、反式1,2-环己二醇的拆分。
一、环己醇制备环己烯1、硼酸或有机硼酸催化:(探索)硼酸容易与醇反应生成酯,实验探索催化剂用量,物料摩尔比,反应温度、时间及水解反应的影响。
若使用有机硼酸,可否克服硼酸与醇反应生成酯,又能有效催化环己醇反应生成环己烯。
硼酸参数:熔点169℃加热至107.5℃时失水而成偏硼酸(HBO2):H3BO3→HBO2+H2O偏硼酸再热至150~160℃时则又失水而成焦硼酸(H2B4O 7):4HBO2→H2B4O 7+H2O沸点300℃水溶性溶于水、酒精、甘油、醚类及香精油中,水溶液呈弱酸性密度1.43kg/m³外观白色结晶性粉末实验原理实验物料环己醇实验试剂,10g(10.4mL,约0.1mol)硼酸实验试剂,实验装置图图 1 反应装置 图 2 蒸馏装置图3 分液漏斗把硼酸换成有机硼酸B(OR)3,进行实验,研究催化效果。
表征催化剂,筛选催化剂。
2、浓硫酸或浓磷酸法:(成熟) 实验原理OH+ H 2O OH2+ H 2O主反应副反应主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。
但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。
为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过73℃。
实验装置图图 1 反应装置 图 2 蒸馏装置图3 分液漏斗 主要物料用量及规格环己醇 实验试剂,10g(10.4mL,约0.1mol) 浓硫酸 实验试剂,1.0mL(浓磷酸:3.0mL)实验步骤、现象记录对馏分进行测定折光率;红外光谱(KBr压片)分析;检测纯度(气相色谱法)与文献值对照。
反式-1,2-环己二醇合成新工艺的研究

反式-1,2-环己二醇合成新工艺的研究
周彩荣;王斐;高斌;蒋登高;孙利民
【期刊名称】《郑州大学学报(工学版)》
【年(卷),期】2003(024)001
【摘要】根据环己烯分子结构特点及有关单元反应的基础理论,提出了在乙酸和乙酸酐作为载氧剂的条件下,由双氧水氧化环己烯制备1,2-环己二醇的工艺路线.用正交试验法和单因素实验法考察了物料配比、反应温度、反应时间等诸多因素的影响,产物采用溶剂萃取,并利用熔点测试、红外光谱仪分析方法证实了本合成反应的产物为反式-1,2-环己二醇.
【总页数】6页(P32-37)
【作者】周彩荣;王斐;高斌;蒋登高;孙利民
【作者单位】郑州大学化工学院,河南,郑州,450002;郑州大学化工学院,河南,郑州,450002;郑州大学化工学院,河南,郑州,450002;郑州大学化工学院,河南,郑
州,450002;郑州大学化工学院,河南,郑州,450002
【正文语种】中文
【中图分类】TQ214
【相关文献】
1.反式-1,2-环己二醇合成工艺中甲酸回收的研究 [J], 强黎明;周彩荣;蒋登高;吴彬
2.反式-1,2-环己二醇合成研究 [J], 周彩荣;蒋登高;王斐;李九菊;李惠萍
3.环氧环己烷制备反式-1,2-环己二醇的新工艺 [J], 田红艳;章亚东;王振兴
4.反1,2-环己二醇的合成新工艺 [J], 李琼;奚旦立;毛海舫;肖作兵;蔡宝国
5.具有生物活性的金属配合物的研究——Ⅵ.3,6-二(二甲氨基)-二苯并碘六环镧反式-1,2-环己烷二胺四乙酸配合物的合成、性质及抗肿瘤活性 [J], 陈淑英;刘展良;侯自杰;李笃
因版权原因,仅展示原文概要,查看原文内容请购买。
1-苯基-1,2-环己二醇的合成
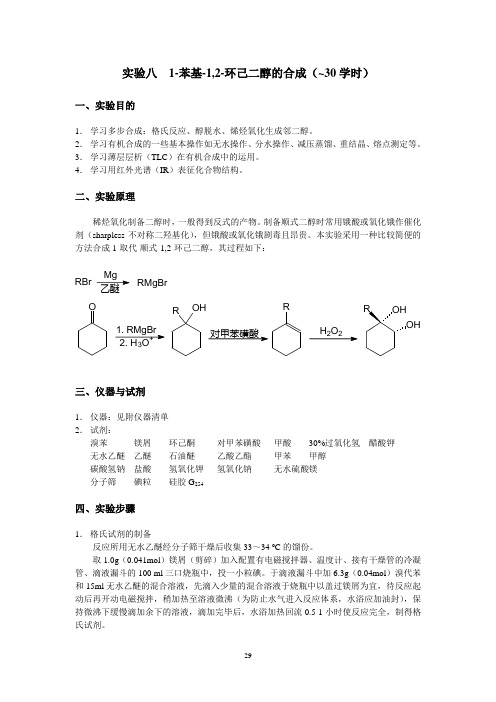
实验八1-苯基-1,2-环己二醇的合成(~30学时)一、实验目的1.学习多步合成:格氏反应、醇脱水、烯烃氧化生成邻二醇。
2.学习有机合成的一些基本操作如无水操作、分水操作、减压蒸馏、重结晶、熔点测定等。
3.学习薄层层析(TLC)在有机合成中的运用。
4.学习用红外光谱(IR)表征化合物结构。
二、实验原理稀烃氧化制备二醇时,一般得到反式的产物。
制备顺式二醇时常用锇酸或氧化锇作催化剂(sharpless不对称二羟基化),但锇酸或氧化锇剧毒且昂贵。
本实验采用一种比较简便的方法合成1-取代-顺式-1,2-环己二醇,其过程如下:RBr MgRMgBrO1. RMgBrOHR RH2O2OH2. H3O+对甲苯磺酸三、仪器与试剂1.仪器:见附仪器清单2.试剂:溴苯镁屑环己酮对甲苯磺酸甲酸30%过氧化氢醋酸钾无水乙醚乙醚石油醚乙酸乙酯甲苯甲醇碳酸氢钠盐酸氢氧化钾氢氧化钠无水硫酸镁分子筛碘粒硅胶G254四、实验步骤1.格氏试剂的制备反应所用无水乙醚经分子筛干燥后收集33~34 o C的馏份。
取1.0g(0.041mol)镁屑(剪碎)加入配置有电磁搅拌器、温度计、接有干燥管的冷凝管、滴液漏斗的100 ml三口烧瓶中,投一小粒碘。
于滴液漏斗中加6.3g(0.04mol)溴代苯和15ml无水乙醚的混合溶液,先滴入少量的混合溶液于烧瓶中以盖过镁屑为宜,待反应起动后再开动电磁搅拌,稍加热至溶液微沸(为防止水气进入反应体系,水浴应加油封),保持微沸下缓慢滴加余下的溶液,滴加完毕后,水浴加热回流0.5-1小时使反应完全,制得格氏试剂。
2.1-苯基环己醇的制备反应所用环己酮需要重蒸收集154~156ºC的馏分。
将上述制得的格氏试剂用冰水浴冷却降温到20ºC以下,在快速搅拌下用滴液漏斗滴加3.92g(0.04mol)环己酮与15ml无水乙醚的混合物,控制反应温度在20ºC以下, 滴加完毕后水浴加热回流2小时完成反应。
反式_1_2_环己二醇合成研究
第34卷第5期四川大学学报(工程科学版)V ol.34N o.5 2002年9月JOURNA L OF SICHUAN UNIVERSITY(E NGINEERING SCIE NCE E DITION)Sept.2002文章编号:100923087(2002)0520085204反式-1,2-环己二醇合成研究周彩荣,蒋登高,王 斐,李九菊,李惠萍(郑州大学化工学院,郑州450002)摘 要:提出了由环己烯制备1,2-环己二醇的工艺路线,考察了物料配比,反应温度,反应时间,加料方式,PH值等诸多因素的影响。
产物采用溶剂萃取,结果1,2-环己二醇的重量收率达90%以上,产品纯度98%。
关键词:反式-1,2-环己二醇;环己烯;合成;溶剂萃取中图分类号:T Q22文献标识码:AStudy on synthesizing Trans-1,2-cyclohexanediolZHOU Cai2rong,JIANG Deng2gao,WANG Fei,LI Jiu2ju,LI Hui2ping(Inst.of Chem.Eng.,Zhengzhou Univ.,Zhengzhou450002,China)Abstract:The method of synthesizing trans-1,2-cyclohexanediol was investigated.The effecting factors on synthesizing 1,2-cyclohexanediol,such as raw material ratio,reaction tem perature,reaction time,method of adding raw materials, pH value,and s o on,were discussed.T rans-1,2-cyclohexanedilo was purified by the s olvent extraction.K ey w ords:trans-1,2-cyclohexanediol;cyclohexene;synthesize;s olvent extraction 邻苯二酚又名焦儿茶酚,是精细化工的重要中间体。
反式_1_2_环己二醇合成工艺中甲酸回收的研究
收稿日期:2003-11-12;修订日期:2003-12-12基金项目:河南省自然科学基金资助项目(021*******),河南省杰出人才创新基金资助项目(01210011900) 作者简介:强黎明(1974-),女,河南省南阳市人,郑州大学硕士研究生.文章编号:1671-6833(2004)01-0060-03反式-1,2-环己二醇合成工艺中甲酸回收的研究强黎明1,周彩荣1,蒋登高1,吴 彬2(1.郑州大学化工学院,河南郑州450002;2.煤炭工业部郑州设计研究院,河南郑州450007)摘 要:考察了操作回流比和全回流开工时间对反式-1,2-环己二醇合成工艺中甲酸回收率、回收甲酸浓度和间歇操作周期的影响,及回收甲酸对反式-1,2-环己二醇收率的影响.结果表明,一次回收的甲酸不必浓缩,可直接循环使用,不影响产品的收率;循环使用回收的甲酸需用间歇精馏方法浓缩,全回流时间为015h,适宜的回流比为5~6,将回收浓缩的甲酸循环使用,也不影响产品的收率.关键词:反式-1,2-环己二醇;甲酸;回收;浓缩;间歇精馏中图分类号:TQ 028.1+3 文献标识码:A0 引言反式-1,2-环己二醇(trans-1,2-cyclohex -anediol)是一种重要的有机中间体,分子中具有两个羟基、环状结构,因而具有较为活泼的化学性质,可进行加成、取代、氧化、脱氢等反应,已被应用于制备聚酯、医药、农药等精化产品.本实验室已开发出了以环己烯为原料,以过氧化氢作氧化剂、甲酸作载氧剂合成反式-1,2-环己二醇的工艺路线[1].甲酸(Fromic Acid)俗名蚁酸,是最简单的脂肪酸,是重要的有机化工原料,广泛用于农药、皮革、纺织、印染、医药和橡胶工业等,还可以制取各种溶剂、增塑剂、橡胶凝固剂、动物饲料添加剂及新工艺合成胰岛素等.在反式-1,2-环己二醇合成工艺中,第一步是过量甲酸与过氧化氢反应生成过氧化甲酸,第二步是过氧化甲酸与环己烯发生氧化反应,在氧化反应之后要进行减压精馏除去甲酸,其中甲酸需要循环使用.对甲酸的浓缩已有用渗析电解法对其进行研究[2,3],本文针对这一问题,用间歇精馏方法对甲酸的浓缩回收工艺进行研究,以回收率、回收甲酸的浓度和间歇操作周期为主要考察目标,研究了所需理论板数、操作回流比、全回流开工时间等操作参数.1 实验部分1.1 实验装置及理论塔板数的测定1.1.1 实验装置精馏柱采用外径为30mm 的玻璃柱,柱长1000mm,保温良好,内装陶瓷拉西环填料,填料高度为940mm.塔釜用1000mL 的两口烧瓶,用封闭式电炉加热,另加一数字显示调压器,塔顶用自来水冷却.回流比采用常规的数滴法估算.1.1.2 理论塔板数的测定[4]精馏柱首先用甲醇全回流洗柱,再用真空泵抽出柱内残存的甲醇.然后用推荐的标准测试物-正庚烷和苯的混合物,进行测定.常压下全回流2~3h 后,截取部分前馏分弃去,继续全回流,每隔1h,取柱顶馏分测其组成(用气相色谱完成).当相邻两次测得组成不变时,则认为测试混合物在柱内已分布平衡,这时同时截取塔顶塔釜样测定20e 下的组成,对照苯-正庚烷系统的分离级数-浓度曲线(根据Stage 与Schultze),求得该填料柱的理论板数.实验结果为9块(含塔釜).1.2 原料实验原料为反式-1,2-环己二醇合成工艺中经减压精馏得到的甲酸、水混合物,其中甲酸浓度随合成原料的不同而不同.甲酸-水混合体系存在最高恒沸点.常压下最高恒沸点为10712e ,共沸物组成含甲酸7715%[5](质量百分数浓度,下文同).对甲酸的精馏,工业上一般采用加压精馏或萃取精馏[6],本实验采用常压间歇精馏.1.3 实验方法称取一定量经减压精馏所得的甲酸和水的混合物,加入两口烧瓶,并加入沸石.打开冷却水,加2004年 3月第25卷 第1期郑州大学学报(工学版)Journal of Zhengzhou University (Eng i neering Science)Mar 1 2004Vol 125 No 11热.精馏开始时全回流一定时间,直至淹塔后,以一定的回流比采出塔顶馏分,取塔顶馏分分析,当塔顶馏分浓度达到要求时,降温停止.塔釜剩余物即为精馏浓缩的甲酸.2 实验结果合成反式-1,2-环己二醇所用原料甲酸为88%的分析纯甲酸,反应后经减压蒸馏所得粗甲酸浓度为75%左右.由于甲酸-水混合体系是具有最高恒沸点的体系,所得粗甲酸的浓度在相图的左半部,即精馏在相图的左半部进行,实验最终只能得到恒沸组成的甲酸,浓度约为7715%[5].在当地大气压(10015kPa 左右)下,塔釜甲酸的最高温度为10915e ,塔顶温度可达100?015e .当塔顶温度达99e 后,塔顶馏分浓度便快速增加.当塔顶馏分浓度达69%左右时,塔釜物浓度可达75%左右.因此,可根据塔顶馏分的浓度来终止实验.用88%甲酸作合成后回收的甲酸称为一次回收甲酸,用一次回收甲酸作合成后回收的甲酸称为二次回收甲酸,依次可称为循环使用甲酸.2.1 回流比的选择回流比是精馏操作中一个对产品质量和产量有重大影响又便于调节的重要参数,由于填料柱高度固定,回流比的变化实际上反映了理论塔板数对产品收率的影响.本实验对一次回收甲酸和循环回收甲酸所需回流比进行考察.表1为回流比对含量为75152%粗甲酸精馏实验的影响结果.表1 甲酸的一次回收实验结果Tab.1 The experimental result of first recycle of formic acid实验序号处理量/g 操作周期/h回流比初始浓度/%浓缩后浓度/%回收率/%1584.0 6.510~1175.5277.4584.642578.5 2.55~675.5276.9288.823576.02.00.575.5276.3070.4由表1可看出,在实验3当中,由于回流比较小,虽然缩短了操作周期,但精馏所得甲酸的浓度和回收率均减小了;在实验1中回流比较大,虽然精馏所得甲酸的浓度较高,回收率也较高,但操作周期太长,大大增加了操作成本,对生产不利;在实验2中,精馏所得甲酸的浓度比实验1稍低,但操作周期缩短了4h,回收率也提高了.因此对浓度为7515%左右的甲酸的精馏浓缩回流比选择为5~6较适宜.分别采用88%、浓缩和未浓缩的甲酸合成反式-1,2-环己二醇,所得平均收率如表2所示.从表2可以看出,用精馏浓缩回收的甲酸合成反式-1,2-环己二醇,产品收率同浓度为88%甲酸合成的相当.由于存在恒沸点,含量为7515%的甲酸经浓缩后浓度提高得并不多.用蒸馏的粗甲酸直接用于合成,结果收率也同浓度为88%甲酸合成的相当,因此,经一次回收所得甲酸不必进行精馏浓缩,可直接用于合成.用一次回收的甲酸进行合成后,再经减压蒸表2 合成反式-1,2-环己二醇的平均收率Tab.2 The average production ratio o ftrans -1,2-cyclohexanediol 甲酸平均收率/%88%(分析纯)75.875.5%(未浓缩)76.577.5%(精馏浓缩)76.0馏所得粗甲酸的浓度在57%左右.这样的甲酸由于浓度太低,用于合成会影响过氧化甲酸的生成,同时由于对反应体系引进太多的水,造成减压蒸馏阶段的负担,所以需经过精馏浓缩.所得精馏实验结果如表3所示.由表3可看出,回流比较小时,回收率大大降低,且回收后的浓度也不高;随着回流比的增大,回收率增加,但操作周期大大延长;当回流比过大时,回收率反而有所下降,这时由于回流比增大,单位时间内采出量减小,塔釜物浓度增加缓慢,操作周期延长,使塔顶采出馏分的质量增加,从而造成最终回收率下降.循环回收甲酸的浓度虽未达到共沸组成,但从表2数据知,这样的甲酸已能满表3 甲酸的循环回收实验结果Tab.3 The experimental result o f cyclical recycle o f formic acid实验序号加料量/g 操作周期/h回流比初始浓度/%浓缩后浓度/%回收率/%1897.0 4.80.5555.4073.5136.542891.5 5.8 4.0057.8174.4968.083590.0 5.5 4.8057.5475.3567.044560.0 6.4 6.0058.5575.4772.6061第1期 强黎明等 反式-1,2-环己二醇合成工艺中甲酸回收的研究足合成工艺要求,若再提高其浓度,势必造成回收率的下降,这样既造成了浪费,又提高了生产成本.结合表3数据,综合考虑回流比对精馏甲酸浓度和回收率的影响,回流比宜选择为5~6.2.2全回流开工时间的选择全回流时精馏塔不加料也不出料.利用全回流尽快润湿全塔,预热塔身,并建立一定的浓度梯度.在间歇精馏过程的优化中开车时间是很重要的,特别是对沸点相近的物系和持液较大的情况[7].本试验中甲酸和水的沸点非常相近,常压下分别为10017e和100e,因此对间歇精馏的全回流开工时间进行了选择.将每次的物料加入塔釜之后,全回流2h,每隔015h取塔顶馏分分析其浓度,结果如表4所示.表4全回流时塔顶甲酸浓度分析结果Tab.4The concentration of form ic acid intower roof when overall reflux%序号物料浓度C0C0.5C1C1.5C2157.54 4.98 3.88 4.43 4.86 5.51257.54 5.05 3.76 4.51 4.92 5.50357.54 6.86 6.17 6.36 6.447.89说明:C0、C015、C1、C115、C2分别为全回流开始、015h、1h、115h、2h时塔顶甲酸的浓度.由表4数据可以看出,随着全回流的进行,全塔浓度梯度逐渐形成,起初塔顶浓度逐渐下降,当回流015h后达到最低,继续全回流,塔顶浓度又开始上升.因为浓缩甲酸主要是除去其中过多的水分,当塔顶浓度为最小时开始采集,有利于提高塔釜甲酸的浓度和回收率.因此,全回流时间应选择为015h.3结论(1)通过对甲酸回收实验的研究知,用88%甲酸做合成后回收的甲酸,不必经过浓缩,可直接用于合成,不影响反式-1,2-环己二醇的收率.(2)用循环回收的甲酸做合成,需经过精馏浓缩.精馏过程的回流比宜选择为5~6,全回流时间宜选择为015h.精馏后浓度可达75%以上,回收率在70%以上,且二次回收的甲酸用于合成也不影响反式-1,2-环己二醇的收率.(3)通过本实验的研究,得出了反式-1,2-环己二醇合成工艺中甲酸回收的工艺条件,节约了合成原料,降低了生产成本,使合成工艺更加完善,为其工业化生产提供了理论基础.参考文献:[1]周彩荣,蒋登高,王斐,等.反式-1,2-环己二醇合成研究[J].四川大学学报,2002,34(5):85~88. [2]骆广生,伍方勇,朱慎林.渗析电解法提浓甲酸的研究[J].膜科学与技术,2000,20(4):1~4.[3]LUO G S,PAN S,LIU J G.Concentration of a formic acidsolution[J].Desalination,2002,150(3):227~234. [4]KRELL E.实验室蒸馏指南[M].陈甘棠,译.北京:化学工业出版社,1988.[5]徐克勋.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1988.[6]杨华.国内外甲酸生产概况及对我公司的建议[J].化工生产与技术,1995,7(3):38~41.[7]许锡恩,马瑞国,白庚辛.间歇精馏[J].石油化工,1987,16(11):809~816.Stu dy on the Recycle of Formic A cid in the Synthesis Process of T ran s-1,2-cyclohexanediolQI ANG Li-ming1,Z HOU Cai-rong1,JIANG Deng-gao1,W U Bin2(1.College of Chemical Engineering,Zhengzhou University,Zhengzhou450002,China;2.Design and Research Institute of Coal Indus-try,Zhengzhou450007,China)Abstract:The e xcessive formic acid in the synthesis of trans-1,2-cyclohe xanediol is recycled and concentrated with batc h distillation.The effec t of reflux ratio and overall reflux when beginning on rec ycle ratio,c oncentration of recycling formic acid and operation period is studied,as well as the effect of recycling formic acid on product ratio of trans-1,2-cyclohexanediol.The formic acid recycled firstly can be used for synthesis cyclically without con-centra tion and has no effect on production ratio of trans-1,2-cyclohexanediol.The formic acid recycled cyclically is concentrated with batch distillation in which the ratio of reflux was controlled to be between5~6and overall re-flux time0.5hour.After being concentrated,the formic acid is used for synthesis cyclically as well as the fresh. Key words:trans-1,2-cyclohe xanediol;formic acid;recycle;c oncentration;batch distillation 62郑州大学学报(工学版)2004年。
反式-12-环己二醇绿色制备工艺
决 了 废 液 处 理 等 环 境 问 题 ,探 究 了 较 佳 工 艺 条 件 ,S卩:以 25.0 g 环 氧 环 己 烷 计 ,m( 环 氧 环 己 烷 ) /m ( 水 )= 1.0/ 4. 42,
催 化 剂 用 量 为 26.0 g ,反 应 温 度 为 60 I :,反 应 时 间 2. 0 〜2. 5 h ,在 此 条 件 下 进 行 4 次 试 验 ,环 己 二 醇 的 选 择 性 约
中 图 分 类 号 :T233. 1
文 献 标 志 码 :八
反 式 一1 ,2—环 己 二 醇 ( trans —1 ,2 —cyclohexanediol,CHD)是 重 要 的 有 机 合 成 原 料 ,主 要 用 于 医 药 、农 药 、高 档 涂 料 、表 面 活 性 剂 、橡 胶 助 剂 等 方 面 ,是 一 种 应 用 前 景 非 常 广 阔 的 有 机 合 成 中 间 体 ,随 着 C H D 应用 到 环 氧 树 脂 、聚 氨 酯 等 工 业 中 ,C H D 越 来 越 受 到 关 注 ,其 应 用 价 值 正 逐 渐 提 升 ,因 此 研 究 C H D 生 产 工 艺 意 义重 大 .反式一 1 ,2 —环 己 二醇可以 通 过 邻 苯 二 酚 催 化 氢 化 [1]、环 己 烯 直 接 氧 化 制 备 ,也可以通过环氧环己烷 酸 性 水 解 制 备 .环 己 烯 直 接 氧 化 制 备 C H D 的 研 究 较 多 ,重 点 为 催 化 剂 和 氧 化 剂 的 选 择 .Swern[2]等 ,以过氧 化 氢 做 氧 化 剂 ,用 甲 酸 作 载 氧 剂 ,环 己 烯 氧 化 制 备 C H D ;Mugdan™ 等 ,以 三 氧 化 钨 为 催 化 剂 ,过 氧 乙 酸 为 氧 化 剂 直 接 氧 化 环 己 烯 制 备 C H D ;孙 志 强 [4]以 过 氧 化 氢 为 氧 化 剂 ,在 甲 酸 条 件 下 氧 化 环 己 烯 ,然 后 水 解 制 备 C H D ;从 报 道 的 工 艺 来 看 ,环 己 烯 直 接 氧 化 制 备 C H D 工 艺 ,大 多 采 用 甲 酸 、乙 酸 和 乙 酸 酐 做 载 氧 剂 ,生产过 程 中 产 生 大 量 的 废 液 ,严 重 污 染 环 境 ,因此没有工业化应用.吴延华等[5]报 道 了 以 叔 丁 基 过 氧 化 氢 为 氧 化 剂 , 金 属 氧 化 物 为 催 化 剂 ,采 用 甲 苯 为 溶 剂 ,虽 然 避 免 了 前 人 所 使 用 的 甲 酸 、过 氧 乙 酸 过 程 中 大 量 废 液 问 题 ,但叔 丁 基 过 氧 化 氢 刺 激 性 强 ,毒 性 较 大 .与 环 己 烯 氧 化 制 备 C H D 相 比 ,环 氧 环 己 烷 水 解 制 备 C H D 更 经 济 、更绿 色 .首 先 ,环 氧 环 己 烷 可 以 从 己 二 酸 生 产 的 K A 油 中 回 收 ,以 往 己 二 酸 生 产 商 都 当 废 液 来 处 理 ,如果将这些环 氧 环 己 烷 分 离 出 来 ,制 备 高 附 加 值 的 C H D ,既 能 减 轻 环 境 压 力 ,又 能 为 整 个 己 二 酸 工 艺 节 约 成 本 .其 次 ,环氧 环 己 烷 水 解 制 备 反 式 一 1,2 —环 己 二 醇 ,工艺比较简单.
1,2环己二醇合成工艺的研究进展
Abstract:Theprocessofsynthesintyears,especiallythe catalyticsystem usedinthesyntheticroutewasanalyzed,aswellastheadvantagesanddisadvantages.It waspointedoutthatthedevelopmentofhighefficiencygreen1,2cyclohexanediolproductionprocess routeundertheincreasinglyprominentsituationofenvironmentalproblemswasstillthefocusofscientific expertsinvariouscountries. Keywords:1,2cyclohexanediol;cyclohexeneoxide;cyclohexene;catalyst;solidacid;metalorganic frameworkmaterial
为实现 1,2环己二醇高效绿色化生产,科学工 作者们进行不懈的研究。但 1,2环己二醇合成仍 然有些问题需要解决,如催化剂稳定性差,制备过程
需要添加有毒溶剂,合成效率比较低,目前大部分文 献报道都是利用间歇法合成 1,2环己二醇,鲜见有 关 1,2环己二醇连续法报道。所以对 1,2环己二 醇的合成方法进行分析综述具有重要意义。本文对 1,2环己二醇的合成方法进行详细分析和阐述,并 对该合成工艺研究方向进行评述和展望。
1 环氧环己烷水解法
目前,利用硫酸等无机酸水解环氧环己烷合成 1,2环己二醇是比较简单合成方法,催化活性高,产 品收率较高但是无机酸反应过程中腐蚀设备,污染 环境,不符合绿色化学发展的趋势。近年来人们对 环氧环己烷合成 1,2环己二醇的催化体系进行大 量的研究,报道多种适用于环氧环己烷水解催化剂。 1.1 固体酸催化剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第34卷第5期四川大学学报(工程科学版)Vol.34No.5 2002年9月JO UR NAL OF SICHUAN UNIVERSITY(ENGINEERING SCIENCE EDITION)Sept.2002文章编号:1009 3087(2002)05 0085 04反式-1,2-环己二醇合成研究周彩荣,蒋登高,王 斐,李九菊,李惠萍(郑州大学化工学院,郑州450002)摘 要:提出了由环己烯制备1,2-环己二醇的工艺路线,考察了物料配比,反应温度,反应时间,加料方式,PH值等诸多因素的影响。
产物采用溶剂萃取,结果1,2-环己二醇的重量收率达90%以上,产品纯度98%。
关键词:反式-1,2-环己二醇;环己烯;合成;溶剂萃取中图分类号:TQ22文献标识码:AStudy on synthesizing Trans-1,2-cyclohexaned iolZ HOU Cai rong,JIANG Deng gao,WANG Fei,LI Jiu ju,LI Hui ping(Ins t.of Chem.Eng.,Zhengzhou Uni v.,Zhengzhou450002,China)Abstract:The method of synthesizing trans-1,2-cyclohe xanediol was investigated.The effecting factors on synthesizing 1,2-cyclohe xanediol,such as raw material ratio,reaction temperature,reaction time,method of adding ra w materials, pH value,and so on,were discussed.Trans-1,2-cyclohexanedilo was purified by the solvent extraction.Key words:trans-1,2-cyclohexanediol;cyclohexene;synthesize;solvent extraction邻苯二酚又名焦儿茶酚,是精细化工的重要中间体。
早期生产邻苯二酚曾采用邻氯苯酚碱解法,近年来,国际上纷纷改用苯酚双氧水氧化法。
这些方法都存在着邻苯二酚选择性低,副产物对苯二酚多的缺点。
因此,日本、俄罗斯、德国等国外研究机构正在研究1,2-环己二醇脱氢法制取邻苯二酚新的工艺路线,这种方法的特点是只得到邻苯二酚,无副产物对苯二酚生成。
由1,2-环己二醇脱氢法制取邻苯二酚的关键在于1,2-环己二醇的合成。
目前,以环己烯为原料采用定位法直接合成1,2-环己二醇,国内研究不多,且都处于实验室研究阶段。
有关1,2-环己二醇合成工艺条件的优化及其性能方面的研究尚未见报道[1~8]。
本文就其关键步骤1,2-环己二醇的较佳合成工艺条件进行了深入探讨。
收稿日期:2002 04 30基金项目:河南省自然科学基金资助项目作者简介:周彩荣(1959 ),女,教授.研究方向:化学工程.1 实验部分1.1 试剂及分析方法试剂:本实验所用试剂甲酸、双氧水皆为市售,化学纯;环己烯来自于平顶山神马集团尼龙66盐厂生产。
分析:本实验通过科创9800气相色谱仪(配有HW色谱工作站)分析确定1,2-环己二醇的选择性和收率。
程序升温,内标物为庚醇,氢火焰检测。
使用数字熔点仪(上海精密科学仪器有限公司物理化学仪器厂)测定熔点。
1.2 合成工艺路线的确定及实验操作在分析有关技术资料和探索性实验的基础上,确定采用图1工艺路线。
反应在500ml装有搅拌器、温度计和进料滴瓶的三口烧瓶中进行。
将一定比例的双氧水和甲酸加入到三口烧瓶中,开动搅拌并加热至指定温度,反应一段时间后,滴加一定配比的环己烯,进行氧化反应。
反应结束后,减压精馏除去催化剂和溶剂。
然后在一定温度下加入碱进行水解反应到终点。
再在一定温度下,用一定量的有机溶剂进行萃取,减压蒸馏,过滤,得到1,2-环己二醇的粗品。
重结晶后得到1,2-环己二醇目的产品。
图1 1,2-环己二醇合成流程简图Fig.1 Flow diagram of synthesize 1,2-cyclohexanediol2 结果与讨论2.1 加料方式1)先将甲酸预热到40 ,加入双氧水后立即滴加环己烯,反应一段时间后,静置过夜。
经后处理,得到1,2-环己二醇粗品约0.4g 。
2)先合成过氧化甲酸,再以此作氧化剂进行环己烯的氧化反应。
双氧水与甲酸在一定条件下混合,同时滴加几滴硫酸,混合反应2h 后滴加环己烯。
反应一段时间后,静置过夜。
经后处理,得到1,2-环己二醇粗品约2.1g 。
(3)除了不加硫酸,甲酸与双氧水混合反应1h,其他条件与方法2)相同的情况下,得到1,2-环己二醇粗品约4.2g 。
由上述结果可见,在相同的物料配比、相同的控制条件和相同的后处理方法下,合成方式以首先合成过氧化甲酸,再与环己烯进行氧化反应较好。
从实验结果来看,双氧水与甲酸反应时间增加,得到1,2-环己二醇的量增多。
2.2 有机过氧化酸合成对氧化反应的影响2.2.1 反应物料配比的影响在相同的反应条件和后处理条件下,考察反应物料配比对合成反应的影响,实验结果见图2。
从图2结果可看出,甲酸与双氧水的物料配比对1,2-环己二醇的收率影响比较大,随着甲酸量的增多,生成1,2-环己二醇的量增加,当其配比为17 1时,达到最大,随之,再增大甲酸的量,其生成1,2-环己二醇的量减少。
有机过氧化物是环己烯氧化反应的氧化剂,由于有机过氧化物的不稳定性,所以实验以自制为主。
实验中对过氧化酸合成的原料配比、过氧化反应的时间和反应温度等因素对1,2-环己二醇合成反应的影响进行了考察。
图2 物料配比对1,2-环己二醇的收率的影响F ig.2 Effect of raw materia l ratio on systhesizing 1,2-cyclohexanediol2.2.2 有机过氧化酸合成的反应温度对环己烯氧化反应的影响在相同的物料配比和后处理条件下,考察有机过氧化甲酸生成反应温度对合成1,2-环己二醇的影响。
实验结果见图3。
图3 过氧化甲酸生成反应温度对1,2-环己二醇的收率的影响Fig.3 Effect o f synthesizing temperrature of superroxideformic aid on the yield of 1,2-cyclohexanediol从实验结果来看,生成过氧化酸的反应温度,在25 下较为适宜。
温度过低,不宜达到过氧化反应的活化温度,生成过氧化酸的量较少;温度过高,生成的有机过氧化酸易于分解。
2.2.3 有机过氧化酸的反应时间对环己烯氧化反应的影响在相同的物料配比和后处理条件下,考察有机过氧化甲酸生成反应时间对合成1,2-环己二醇的影响。
实验结果见图4。
从实验结果来看,反应刚开始,过氧化甲酸反应时间的增加,有利于1,2-环己二醇的生成;但随着过氧化甲酸反应时间的进一步增加,生成1,2-环己二醇的量反而降低。
这是因为反应达到平衡后,延长反应时间可能会使生成的过氧化甲酸进一步氧化。
86四川大学学报(工程科学版)第34卷图4 合成过氧化甲酸的反应时间对合成1,2-环己二醇的收率的影响Fig.4 Effect of synthesiaing time of superroxide formicaid on the yield of 1,2-cyclohexanediol2.3 环己烯氧化反应温度对合成反应的影响在相同的物料配比和后处理条件下,考察反应温度对合成反应的影响。
其实验结果见图5。
从实验结果来看,氧化反应温度越高,越不利于目的产物1,2-环己二醇的生成。
这是与热力学原理相符合的。
因为氧化反应是放热反应,升高温度不利于放热反应的进行。
图5 反应温度对环己烯氧化反应的影响Fig.5 Effect of reaction temperature on synthesing1,2-cyclohexanediol2.4 滴加环己烯的速度对合成反应的影响环己烯氧化反应为强放热反应,反应放出的热量必须及时移出,否则,会发生飞温现象,甚至会发生爆炸。
从实验结果来看,见图6。
图6 环己烯滴加时间对合成反应的影响Fig.6 Effect of drapping cyclohexene rate onsynthesing 1,2-cyclohexanediol环己烯的滴加速度对合成1,2-环己二醇有较大的影响。
随着滴加环己烯的速度降低,时间增长,生成1,2-环己二醇的量增加,当滴加时间达到45min 时,收率达到最大,随之收率开始降低。
因而滴加环己烯的速度要适宜。
速度过快使氧化反应不充分,过慢使氧化反应生成的目的产物过度氧化,生成其他副产物。
2.5 水解反应对合成1,2-环己二醇的影响环己烯氧化反应过程中,生成的产物中,除有目的产物1,2-环己二醇存在外,还有一些氧化副产物,如:环氧环己烷和单酯物质。
在碱溶液中进行水解反应,使之生成1,2-环己二醇。
在相同的反应和后处理条件下,考察水解反应对合成1,2-环己二醇的影响。
2.5.1 水解反应终点pH 值对合成1,2-环己二醇的影响采用pHS-25酸度计(上海雷磁仪器厂),用混合磷酸盐和硼砂作为缓冲液。
取相同量的环己烯氧化反应液,在温度不超过45 ,水解反应30min,滴加浓度约为0.35%(W t)的碱水溶液,其结果见图7。
由图可见,随着pH 值的增大,产品的收率增加,表明了水解反应进行的愈完全。
图7 水解反应对合成1,2-环己二醇的影响F ig.7 E ffect o f hydrlysis reactio n ons ynthesing 1,2-cyclohexa nedio l2.5.2 水解反应温度对合成1,2-环己二醇的影响取相同量的氧化反应液,用0.35%(wt)的NaO H 水溶液滴加。
水解时间约为30min,水解反应终点pH 值控制在8.5之间,考察水解反应温度对合成1,2-环己二醇的影响。
其结果见图8。
由图可见,水解反应的温度对合成1,2-环己二醇的影响不是很大,当温度变化范围为35~55 时,1,2-环己二醇的收率的变化幅度不大。
较为适宜的温度为47 。
2.5.3 水解反应时间对合成1,2-环己二醇的影响取相同量的氧化反应液,用0.35%(wt)的NaO H 水溶液滴加。
水解反应温度为45 ,水解反应终点pH 值控制在7.5之间,考察水解反应时间对合成1,2-环87第5期周彩荣,等:反式-1,2-环己二醇合成研究己二醇的影响。
