第十一章 化学动力学(1)
物理化学11章化学动力学基础一

N2O4
1 2
O2
r k[N 2O5 ]
上一内容 下一内容 回主目录
返回
7/14/2020
一级反应的微分速率方程
反应:
A P
t 0 cA,0 a
0
t t cA a x x
r
dcA dt
k1cA
r
dx dt
k1(a
x)
上一内容 下一内容 回主目录
返回
7/14/2020
一级反应的积分速率方程
(2) 2A P r k2[A]2
上一内容 下一内容 回主目录
返回
7/14/2020
二级反应的微分速率方程
(1) A B P
t 0 a b 0
t t a-x b-x x
dx dt
k2 (a
x)(b
x)
当a b 时
dx dt
k2 (a
x)2
上一内容 下一内容 回主目录
(2) 2A P
t0 a
例如:
R P
速度
速率
d[R] 0 dt
d[P] 0 dt
d[R] d[P] 0 dt dt
上一内容 下一内容 回主目录
返回
7/14/2020
平均速率
rR
([R]2 [R]1) t2 t1
上一内容 下一内容 回主目录
rp
([P]2 [P]1) t2 t1
不能确切反映速率的变
化情况,只提供了一个平
上一内容 下一内容 回主目录
返回
7/14/2020
质量作用定律
对于基元反应,反应速率与反应物浓度的幂乘积 成正比。幂指数就是基元反应方程中各反应物的系数。 这就是质量作用定律,它只适用于基元反应。
《化学动力学》PPT课件

§11.1 化学反应的速率及速率方程
速率常数 k
物理意义:当反应物 A、B 的物质的量浓度 cA、cB均为单 位物质的量浓度时的反应速率。
单位: [k]= [浓度]1-n [时间]-1
一级反应: [时间]-1 二级反应: [浓度]-1[时间]-1
k 与反应物的物质的量浓度无关,当催化剂等其它条件确 定时,它只是温度的函数。
υp
1
A
dpA dt
1
B
dpB dt
1
Y
dpY dt
1
Z
dpZ dt
υp,A υp,B υp,Y υp,Z
- A - B Y Z
§11.1 化学反应的速率及速率方程
2. 基元反应与反应分子数
基元反应:宏观的反应过程一般在微观上包含有多个反应 步骤,称微观上的每一步反应为一个基元反应。
§11.2 速率方程的积分形式
3. 二级反应
(1) 只有一种反应物:a A
P
dcA
dt
kcA2
积分:
cA dcA
c cA,0
2 A
k
t
dt
0
11 积分结果: kt
cA cA,0
用转化率表示:
xA cA,(0 1
xA)
kt
§11.2 速率方程的积分形式
该类型二级反应的特征
① k 的单位是 浓度-1时间-1; ② 反应的t1/2与cA,0 成反比
1. 零级反应(n = 0)
速率方程:
υA
dcA dt
kcA0
k
积分:
dc CA
CA,0
A
k
t
dt
0
cA,0 cA kt
物化第十一章动力学(一)教案

第十一章 化学动力学基础(一)教学目标:1.使学生理解一些动力学基本概念2.掌握简单级数反应以及典型复杂反应的动力学特点。
3.理解并应用阿仑尼乌斯公式。
4.能用稳态近似、平衡假设等处理方法推导一些复杂反应的速率方程教学要求:1.掌握等容反应速率的表示法及基元反应、反应级数等基本概念。
2.对于简单级数反应,要掌握其速率公式的各种特征并能由实验数据确定简单反应的反应级数。
3.对三种典型的复杂反应,要掌握其各自的特点及其比较简单的反应的速率方程。
4.明确温度、活化能对反应速率的影响,理解阿仑尼乌斯公式中各项的含义。
5.掌握链反应的特点,会用稳态近似、平衡假设等处理方法。
教学重难点:反应的级数与反应的分子数,基元反应与非基元反应以及反应的速率的描述方法等;简单级数反应的动力学特征,几种典型复杂反应的动力学特征,温度对反应速率的影响(反应的活化能的概念),链反应的动力学特征以及动动学方程的推导方法。
11.1 化学动力学的任务和目的一、化学动力学与热力学的关系热力学:研究反应进行的方向和最大限度以及外界条件对平衡的影响,即研究物质变化的可能性。
动力学:研究反应进行的速率和反应的历程(机理),即研究如何把这种可能性变为现实性。
二、化学动力学的任务和目的1. 研究各种因素,包括浓度、温度、催化剂、溶剂、光照等对化学反应速率的影响; 2. 揭示化学反应如何进行的机理,研究物质的结构与反应性能的关系,了解反应历程可帮助了解有关物质结构的知识;3. 目的是为了能控制反应的进行,使反应按人们所希望的速率进行并得到所希望的产品。
三、化学动力学的发展简史11.2 化学反应速率表示法一、反应速率(描述化学反应进展情况)P R β→α β-=α--=ξ)0(n )t (n )0(n )t (n P P R Rdt )t (dn 1dt )t (dn 1dt d P R β=α-=ξdt d V 1r ξ=定容反应 dt dc 1r B B ν= 量纲:浓度·时间-1对于任意反应 eE + fF = gG + hHdt d[B]1dt d[H]h 1dt d[G]g 1dt d[F]f 1-dt d[E]e 1-r B ν=====(1)对气相反应)RT (r 'r dt dp RT 11r dtdp 1'r =⇒⎪⎪⎭⎪⎪⎬⎫⋅⋅ν=⋅ν=量纲:压力·时间-1(2)对多相催化反应二、反应速率的测定c~t1、化学方法:骤冷、冲稀、加阻化剂或除去催化剂2、物理方法:利用与物质浓度有关的物理量(如旋光度、电导、折射率、电动势、V、P、光谱等)进行连续监测,获得一些原位反应的数据。
第十一章化学动力学基础一

第十一章 化学动力学基础(一)教学目的:1.使学生理解一些动力学基本概念2.掌握简单级数反应以及典型复杂反应的动力学特点。
3.理解并应用阿仑尼乌斯公式。
4.能用稳态近似、平衡假设等处理方法推导一些复杂反应的速率方程 基本要求:1.掌握等容反应速率的表示法及基元反应、反应级数等基本概念。
2.对于简单级数反应,要掌握其速率公式的各种特征并能由实验数据确定简单反应的反应级数。
3.对三种典型的复杂反应,要掌握其各自的特点及其中比较简单的反应的速率方程。
4.明确温度、活化能对反应速率的影响,理解阿仑尼乌斯公式中各项的含义。
5.掌握链反应的特点,会用稳态近似、平衡假设等处理方法。
教学重点、难点:简单级数反应以及典型复杂反应的动力计算;反应级数和活化能的测定;从反应机理推导速率方程。
教学内容:§11.1 化学动力学的任务和目的一、化学动力学的任务和目的化学热力学主要研究反应的方向、限度和外界因素对平衡的影响。
解决反应的可能性,即在给定条件下反应能不能发生,及反应进行的程度?而化学动力学主要研究反应的速率及反应机理。
主要解决反应的现实性问题。
化学动力学的基本任务是:了解反应速率;讨论各种因素(浓度、压力、温度、介质、催化剂等)对反应速率的影响;研究反应机理、讨论反应中的决速步等。
二、化学动力学发展概况1850年,人们提出浓度与反应速率的关系;十九世纪末:范特荷夫、阿仑尼乌斯讨论了反应速率与温度的关系;二十世纪化学动力学、催化等有了新的发展,特别是许多新技术如:激光、交叉分子束、计算机等用于动力学的研究,目前动力学的研究已从宏观动力学的研究进入到态-态反应动力学的研究。
§11.2 化学反应速率的表示一、反应速率的表示在等容反应体系中,化学反应速率通常用反应物浓度随时间的变化率来表示,此为瞬时反应速率,但由于反应物浓度随时间的增加而减小,产物浓度随时间的增加而增加,反应速率一般规定为正值。
故反应速率以反应物或产物表示时,分别为dt dc 反应物和dt dc 产物,但对于一般反应说,采用不同物质的浓度随时间的变化率表示时,反应速率的数值是各不相同的。
傅献彩《物理化学》(第5版)(下册)章节题库-化学动力学基础(一)(圣才出品)

【解析】活化焓相等,则活化能也近似相等,活化熵相差 30 J gK −1 gmol −1 ,则根据
k = P exp( S )exp( − Ea )
R
RT
k2
( S2 − S1 )
= exp R R
30
= exp8.314
= 37
k1
8. 某化学反应,当温度每升高 1K 时,该反应的速率常数 k 增加 1%,则该反应的活化
k = Aexp( − Ea ) RT
1 / 74
圣才电子书 十万种考研考证电子书、题库视频学习平台
得
k2
( E1 − E2 )
= exp RT RT
80000
= exp8.314298
= 1014
k1
3.某二级反应,反应物消耗 1/3 需时间 10min,若再消耗 1/3 还需时间为( )。
应的半衰期为 t1/2=1/(kCA,0)=100s。
10.在简单硬球碰撞理论中,有效碰撞的定义是( )。 A.互撞分子的总动能超过 EC B.互撞分子的相对动能超过 EC C.互撞分子的内部动能超过 EC D.互撞分子的相对平动能在连心线上的分量超过 EC 【答案】D 【解析】能导致旧键破裂的碰撞成为有效碰撞。只有相对平动能在分子连心线上的分量 超过临界值的分子对,才能把平动能转化为分子内部的能量,使旧键破裂而发生原子间的重 新组合。
速率常数的温度系数较小。
12.某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为 定值,此反应是( )。
A.负级数反应 B.一级反应 C.零级反应 D.二级反应 【答案】C
【解析】零级反应速率方程式为:cA,0 − cA = kt ,一定温度下,k 为定值,时间也一定 时,等式右边是常数,所以, cA,0 − cA 即反应物消耗的浓度为定值
第十一章 化学动力学(一)自测题

第十一章 化学动力学基础(一)自测题I .选择题1. 某化学反应的方程式为2A P −−→,则在动力学研究中表明该反应为(d )。
(a )二级反应 (b )基元反应(c )双分子反应 (d )以上都无法确定2.某化学反应为 2A+B P k−−→,实验测定其速率常数k =0.25(mol· dm -3)-1 s -1,则该反应的级数为(c )。
(a )零级反应 (b )一级反应 (c )二级反应 (d )三级反应 3. 某一基元反应为A P m −−→,动力学方程为r =k[A]m , [A]的单位是mol· dm -3 ,时间的单位是s ,则k 的单位是(a )。
(a ) 1m 3m 11mol dm s ---⋅⋅()() (b) m 3m 1mol dm s --⋅⋅ (b ) (m 1)3(1m)mol dm s ---1⋅⋅ (d )m 3m 1mol dm s --⋅⋅4. 某气相反应在400 K 时的31110kPa s p k ---=⋅,若用k e 表示应等于(b )。
(a ) 3113326(mol dm s ---⋅⋅) (b )3113.326(mol dm s ---⋅⋅) (c ) 43113.0110(mol dm s ----⨯⋅⋅) (d )73113.0110(mol dm s ----⨯⋅⋅)5.某反应,当反应物反应掉59所需时间是它反应掉13所需时间的2倍,则该反应是(c )(a )32级反应 (b)二级反应 (c )一级反应 (d )零级反应6. 半衰期为10天的某放射性元素净重 8 g ,40天后其净重为(d )。
(a )4 g (b )2 g (c )1 g (d )0.5 g7. 有两个都是一级反应的平行反应:下列说法错误的是(b )。
(a ) k 总=k 1+k 2 (b ) E 总=E 1+E 2(c )k 1/k 2=[B]/[C] (d ) 12122t k k =+/ln8.两个活化能不相同的反应,如E 1<E 2,且都在相同的升温区内升温,则(a )。
第十一章 化学动力学基础(一)

第十一章 化学动力学基础(一)一 选择题1.某反应进行完全所需时间是有限的,且等于C 。
/k ,则该反应是( )(1)一级反应 (2)二级反应 (3)零级反应 (4)三级反应2.基元反应A+B-C →A-B+C 的摩尔反应焓∆rHm <0,B-C 键的键能为εBC,A 为自由基,则反应活化能等于( )(1)0.30εBC (218)0.05εBC (3)0.05εBC +∆rHm (4)0.05εBC -∆rHm3.如果反应2A+B=2D 的速率可表示为 r=-1/2d [A ]/dt=- d [B ]/dt=1/2 d [D ]/dt 则其反应分子数为( )(1)单分子 (2)双分子 (3)三分子 (4)不能确定4.400K 时某气相反应的速率常数Kp=10-3(kpa)-1s -1 若速率常数用k c 表示,则k c 应为( )(1)3.326(mol dm -3)-1 s -1 (2)3.0∗10-4(mol dm -3)-1 s -1(3) 3326(mol dm -3)-1 s -1 (4) 3.0∗10-7(mol dm -3)-1 s -15.关于H 2和O 2 等混合气体存在爆炸高限和低限,下列哪种说法是正确的(1) 高界限主要是热来不及散出所引起的.(2) 高界限主要是由器壁销毁决定.(3) 高界限主要是由器相销毁所决定(4) 高界限与温度基本无关6.如果某反应的∆rHm=100kJ mol -1,那么活化能Ea ( )(1) Ea ≠100kJ mol -1, (2) Ea ≥100kJ mol -1,(3) Ea ≤100kJ mol -1, (4)都可以.7.一级反应,反应物反应掉1/n 所需时间是 ( )(1)-0.6932/k (2) (2.303/k)lg [n/(n-1)](3)(2.303k)lgn (4) (2.303/k)lg(1/n)8.对于基元反应 NO 2+NO 3→NO+O 2+NO 2 ,可作断论 ( )(1)一定是二级反应 (2)一定不是二级反应(3)一定是双分子反应 (4)一定不是双分子反应9.某反应.当反应物反应掉5/9所需时间是它反应掉1/3所需时间 的2倍,则该反应是( )(1)一级反应 (2)零级反应 (3)二级反应 (4)3/2级反应10.当一反应物的初始浓度为0.04 mol dm -3时,反应的半衰期为360S. 初始浓度为0.024 mol dm -3时,反应的半衰期为600S.此反应为 ( )(1) 零级反应 (2)1.5级反应 (3)二级反应 (4)一级反应 11.连串反应A B C,其中k 1=0.1min -1,k 2=0.2min -1.,假定反应开始时只有A,且浓度为1 mol dm -3,则B 浓度达最大的时间为 ( )K 2K (1)0.3 min (2)5.0 min (3)6.93 min (4) ∞12.某放射性同位素的半衰期为5天,则经过15天后所剩的同位素的量是原来的( )(1)1/3 (2)1/4 (3)1/8 (4)1/1613.气固相催化反应 2CO(g)+O 2(g) 2CO 2(g) 的速率方程为r=kP(o 2)/p(co).其反应级数应为 ( )Pt <700k (1) 一级反应 (2)二级反应 (3)对O 2一级,对CO 是负一级(4)级数不能确定.14.某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度 ( )(1)成正比(2)成反比(3)平方成反比(4)无关15.反应A→2B在温度T 时的速率方程为d[B]/dt=k B[A] ,则反应的半衰期为 ( )(1)ln2/ k B(2)2ln2/ k B (3) k B ln2 (4)2 k B ln216.两个活化能不相同的反应,如E2>E1,且都在相同的升温区间内升温,则( )(1)dlnk2/dT> dlnk1/dT (2) dlnk2/dT<dlnk1/Dt(3) dlnk2/dT=dlnk1/dT (4)dk2/dT>dk1Dt17.饱和分子间反应活化能一般都是 ( )(1)比较小 (2)167kJ mol-1以上(3)不需要活化能 (4)400 kJ mol-1以上K1K2K318.在反应A B C, A D 中,活化能E1>E2>E3,C是所需要的产物.从动力学的角度考虑,为了提高C的产量,选择反应温度时,应选择( )(1)较高反应温度(2)较低反应温度(3)适中反应温度(4)任意二填空题1.反应A+B→C的速率方程为: -dC A/dt=k A C A C B/C C,则该反应的总级数是级.若浓度为mol dm-3.时间以S为单位,则速率常数k A的单位是2.反应分子数只能是,一般不会大于3.水溶液中过氧化氢催化分解反应历程为:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) k1H2O(l)+IO-(aq) →H2O(l)+O2+I-k2当k2>>k1时,该反应的速率方程为4.有一反应mA nB是简单反应,其动力学方程-dC A/dt=kC A m ,C A单位为mol dm-3.时间以S为单位,则(1)k的单位为(2)以dC B/dt表达的反应速率方程和题中给的速率方程关系为5.在恒温下,加入催化剂能加快反应速率的原因是由于,而升高温度能增加反应速率的原因是由于6.分别用反应物和生成物表示反应A+3B=2C的反应速率.并写出它们间关系为.7.某反应的表观活化能为50kJ/mol.在300K下测其速率常数.若要求k的测定误差在1.5%以内,则恒温槽的控温精度为因为.8.N2和H2合成NH3.在4000C下,动力学实验测定结果表明没有催化剂时,其活化能为334.9 kJ/mol.用Fe催化时,活化能降至167.4 kJ/mol.假定催化和非催化反应的指前因子相等. ,则两种情况下反应速率常数之比为9.反应2N2O5→4NO2+O2在328K时O2(g)的生成速率为0.75*10-4mol·dm-3·s-1.(如其间任一中间物浓度极低,难以测得)则该反应的总包反应速率为mol·dm-3·s-1,N2O5的消耗速率为moldm-3s-1 NO2的生成速率为mol·dm-3·s-110.某反应物的转化率分别达到50%,75%,87.5%所需时间分别为t1/2,2t1/2,3t1/2.则反应对此物质的级数为.11.实验测得反应 2A+B→2C+D的速率方程为r=k[A][B],反应历程为A+B→C+F k1(慢)A+F→C+D k2(快)则k1与k的关系为.12.一般情况下,连续反应的决速步是 13.综合反应A B C,稳态近似处理的条件是 ,稳态浓度C B = .K -1K 1K 2 14.在恒温下,加入催化剂能加快反应.速率的原因是由于而升高温度能增加反应速率的原因是由于 15反应A+B AB AB+C D(决速步) 其表观活化能与基元活化能的关系 为 K 2 ,因为 . K -1K 1 16.气相基元反应2A B 在一恒容的容器中进行,P 0为A 的初始压力,P t 为时间t 时反应体系的总压.此反应的速率方程dP t /dt= .K 1 三.计算题1.(1)某溶液含有NaOH 和CH 3COOC 2H 5浓度均为0.01 moldm -3,设为二级反应,在298K.10min 内有39%CH 3COOC 2H 5分解,而在308K 时10min 分解55%.粗略估计288K 在10min 内能分解多少?(2)用对数公式计算293K 时若有50%的CH 3COOC 2H 5分解需时间若干? 2.硝基异丙烷在水溶液中与碱的反应是二级反应.其速率常数可用下式表示: lnk=-7284.4/T+27.383.时间以min,浓度以moldm -3表示(1) 计算反应的活化能.(2) 在283K 时, 硝基异丙烷与碱的浓度均为0.008 moldm -3,求反应的半衰期3.N 2O(g)的热分解反应2N 2O(g) 2N 2(g)+O 2(g).从实验测出不同温度时各个起始浓度与半衰期如下k 反应温度T/K 初始压力P 0/kpa 半衰期t 1/2 /s967 156.787 380967 39.197 15201030 7.066 14401030 47.996 212求(1)反应级数和不同温度下的速率常数(2)实验活化能(3)若1030K 时N 2O(g)的初始压力为54.00kpa.,当压力达到64.02kpa 时所需时间.。
化学动力学基础1(1)
d • 1 dnB
dt
B dt
r 1 d 1 • 1 dcB V dt V B dt
2.基元反应与非基元反应
基元反应: 反应物分子在碰撞中相互作用直接转化为生成物分子.
非基元反应〔总包反应〕:由若干个基元反应构成 .
反应机理〔reaction mechanism〕
反应机理又称为反应历程.在总反应中,连续或 同时发生的所有基元反应称为反应机理,在有些情况 下,反应机理还要给出所经历的每一步的立体化学结 构图.
同一反应在不同的条件下,可有不同的反应机理. 了解反应机理可以掌握反应的内在规律,从而更好 的驾驭反应.
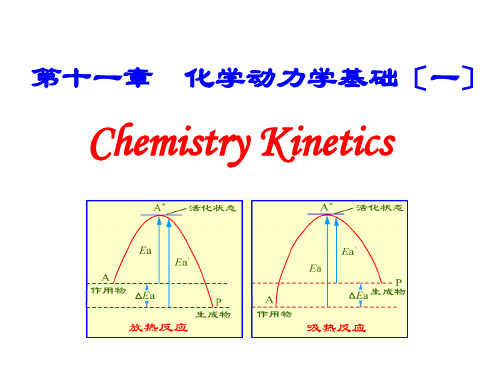
基元反应的速率方程——质量作用定律
在基元反应中,实际参加反应的分子数目称为反 应分子数.反应分子数可区分为单分子反应、双分子 反应和三分子反应,四分子反应目前尚未发现.反应分 子数只可能是简单的正整数1,2或3.
基元反应简称元反应.如果一个化学反应,反应物 分子在碰撞中相互作用,在一次化学行为中就能转化 为生成物分子,这种反应称为基元反应.
例如上述反应历程中,所有反应历程都是基 元反应.
如果一个化学计量式代表了若干个基元反应 的总结果,那这种反应称为总包反应或总反应,是非 基元反应.
复
习
1.转化速率和反应速率的定义式
谢苗诺夫 欣歇尔伍德
1960年,李远哲等人<Lee Yuan Tseh,1936--,美籍华人> 研究交叉分子束反应, 从分子微观反应动力学角度深入探讨化学反 应的机理,于1986年获诺贝尔化学奖.
李远哲
波拉尼 赫施巴赫
五、化学动力学的任务和目 的
<1>研究各种因素,包括浓度、温度、催化剂、溶剂、 光照等对化学反应速率的影响;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十一章 化学动力学11.1 反应SO 2Cl 2(g )→SO 2Cl (g )+ Cl 2(g )为一级气相反应,320 ℃时k =2.2×10-5s -1。
问在320℃加热90 min SO 2Cl 2(g )的分解分数为若干?解:根据一级反应速率方程的积分式1ln1-kt x= 即有:51ln2.21090601-x-=⨯⨯⨯ x = 11.20%11.2某一级反应A →B 的半衰期为10 min 。
求1h 后剩余A 的分数。
解:根据一级反应的特点-2-11/21/2ln 2ln 2ln 2==6.9310min 10t k k t ==⨯,即有 又因为:1ln 1-kt x= 即有:-21ln6.93101601-x=⨯⨯⨯ 1-x = 1.56%11.3某一级反应,反应进行10 min 后,反应物反应掉30%。
问反应掉50%需多少时间?解:根据一级反应速率方程的积分式1ln1-kt x= 当t =10min 时:-2-1111ln10 = ln = 3.5710min 1-30%101-30%k k =⨯,即有: 当x =50%时:-21ln3.5710= 19.4min 1-50%t t =⨯,即有: 11.4 25℃时,酸催化蔗糖转化反应()()()12221126126126C H O H O C H O6+C H O +→蔗糖 葡萄糖 果糖的动力学数据如下(蔗糖的初始浓度c 0为1.0023 mol·dm -3,时刻t 的浓度为c )(1)使用作图法证明此反应为一级反应。
求算速率常数及半衰期; (2)问蔗糖转化95%需时若干? 解:(1)将上述表格数据转化如下: 对0ln c t c ⎛⎫⎪⎝⎭~作图如下080160-0.6-0.30.0ln(c /c 0)=-0.00358t -0.0036l n (c /c 0)t /min30ln 3.5810-0.0036c t c -⎛⎫=-⨯ ⎪⎝⎭则:k = 3.58×10-3min -11/23ln 2ln 2193.6min 3.5810t k -==⨯= (2)31111=ln =ln = 836.8min 1-1-95% 3.5810t k x -⨯ t /min 0 30 60 90 120 180 (c 0-c )/ mol·dm -30.10010.19460.27700.37260.4676t /min 0 30 60 90 120 180 c / mol·dm -3 1.0023 0.9022 0.8077 0.7253 0.6297 0.5347 ln ( c / c 0)-0.1052-0.2159-0.3235-0.4648-0.628311.5 对于一级反应,使证明转化率达到87.5%所需时间为转化率达到50%所需时间的3倍。
对于二级反应又应为多少?解:对于一级反应而言有:1ln1-kt x= 即有:()()()()2211ln 1ln 187.5%3ln 1ln 150%x t t x --===-- 对于二级反应而言有:01-xkc t x= 即有:()()()()212112187.5%150%7150%187.5%x x t t x x -⨯-===-⨯- 11.6偶氮甲烷分解反应CH 3NNCH 3(g )→ C 2H 6(g )+ N 2(g )为一级反应。
在287 ℃时,一密闭容器中CH 3NNCH 3(g )初始压力为21.332 kPa ,1000 s 后总压为22.732 kPa ,求k 及t 1/2。
解:设在t 时刻CH 3NNCH 3(g )的分压为p ,即有:33262000CH NNCH g C H g N g p p p p p p→+--()() () 0 01000 s 后2p 0-p =22.732,即p = 19.932kPa 。
对于密闭容器中的气相反应的组成可用分压表示:5-1001119.932ln-=-ln -ln 6.7910s 100021.332p p kt k p t p -===⨯,即有41/25ln 2ln 2==1.0210s 6.7910t k -=⨯⨯ 11.7 基乙酸在酸性溶液中的分解反应(NO 2)CH 2COOH→CH 3 NO 2(g )+ CO 2(g )为一级反应。
25℃,101.3 kPa 下,于不同时间测定放出的CO 2(g )的体积如下: t /min 2.28 3.92 5.92 8.42 11.92 17.47 ∞ V /cm 34.098.0512.0216.0120.0224.0228.94反应不是从t =0开始的。
求速率常数。
解:设放出的CO 2(g )可看作理想气体,硝基乙酸的初始量由t =∞时放出的CO 2(g )算出:3630101.3251028.9410 1.183010mol 8.314298.15pV n RT --∞⨯⨯⨯===⨯⨯在时刻t ,硝基乙酸的量为0pVn n RT=-,其列表如下: t /min 2.28 3.92 5.92 8.42 11.92 17.47 ∞ n ×1000/mol 1.01580.85390.69160.52850.36460.20111.1830 ln (n / n 0)-0.1524 -0.3260 -0.5368 -0.8057 -1.1770 -1.77191作图ln (n / n 0)~t ,由于反应不是从t =0开始,用公式ln (n / n 0)=-k t +b 拟合714-1.4-0.70.0ln(n /n 0)=-0.1066t +0.0924l n (n /n 0)t /min得到k =0.1066min -1。
11.8 某一级反应A→产物,初始速率为1×10-3mol·dm -3·min -1,1h 后速率为0.25 mol·dm -3·min -1,求k ,t1/2和初始浓度。
解:一级反应的速率方程A 0A Aln=c kt v kc c =,即有:()A 0exp -v kc kt =,那么有:()2A 02111exp -ln v v kc kt k t t v ==--, ,即-3-12-3211110.2510ln =-ln =0.0231min 60-0110v k t t v ⨯=--⨯ 1/2ln 2ln 2==30min 0.0231t k =3-30A 0110=0.0433mol dm 0.0231v c k -⨯=⋅, = 11.9 现在的天然铀矿中238U/235U=139.0/1。
已知238U 的蜕变反应的速率常数为 1.520×10-10a -1,235U 的蜕变反应的速率常数为9.72×10-10a -1。
问在20亿年(2×109a )前,238U/235U 等于多少?(a 是时间单位年的符号。
)解:根据速率常数的单位知235U 和238U 的蜕变反应为一级反应,()A 0A A 0Aln==exp -c kt c c kt c ,, ,即则:()2382380238235235235U Uexp UU k k t =--⎡⎤⎣⎦ ()()2382381092382352352350U U 139.0exp exp 1.5209.72102101U Uk k t -⎡⎤=-=-⨯⨯⨯⎡⎤⎣⎦⎣⎦ 238235U 26.961U =∶ 11.10某二级反应A (g )+B (g )→2D (g )在T 、V 恒定的条件下进行。
两种反应物初始浓度为c A.0 = c B.0 = 0.2 mol·dm -3时,反应的初始速率为2-3-10510mol dm s t dc dt ==⎛⎫-=⨯⋅⋅ ⎪⎝⎭,求k A 即k D 。
解:根据二级反应的速率方程A B v kc c =A D AB 002t t dc dc kc c dt dt ==⎛⎫⎛⎫-== ⎪ ⎪⎝⎭⎝⎭ 23-1-10A.0 B.0510 1.25dm mol s 0.20.2v k c c -⨯===⋅⋅⨯k A =k = 1.25dm 3·mol -1·s -1 k D =2k = 2.5dm 3·mol -1·s -111.11 某二级反应A+B→C ,两种反应物初始浓度皆为1mol·dm -3时,经10min 后反应掉25%,求k 。
解:根据二级反应的速率方程A 0A 01=11x xkc t k x c tx =⨯--,,,即 3-1-1A 01125%===0.0333dm mol min 11101-25%x k c tx ⨯⨯⋅⋅-⨯,11.12 在OH -离子的作用下,硝基苯甲酸乙脂的水解反应: NO 2C 6H 4COOC 2H 5 + H 2O → NO 2C 6H 4COOH + C 2H 5OH在15℃时的动力学数据如下,两反应物的初始浓度皆为0.05mol·dm -3,计算此二级反应的速率常数。
t /min120 180240330530600脂水解的转化率%32.9551.75 48.8 58.05 69.0 70.35解:根据二级反应的速率方程A 01xkc t x=-,讲述表格数据处理如下: t /min120 180 240 330 530 60032.9551.7548.858.0569.070.35拟合求得k = 0.0814dm 3·mol -1·s -1。
11.13 某气相反应2A (g )→A 2(g )为二级反应,在恒温恒容下的总压p 数据如下。
求k A 。
t /s 0 100 200 400 ∞ p /kPa41.33034.39731.19727.33120.665解:设在时刻t ,A (g )的分压为,()2A 0A 2A g A g 1 2p p p →-()()则:()A 0A A 0122p p p p p p p +-=- =,即有: ,因此 t /s 0 100 200 400 (1/p )/kPa -10.02420.03640.04750.07504A 011 1.2510t p p --=⨯,即k = 1.25×10-4kPa -1·s -1= 1.25×10-7Pa -1·s -1 11.14 溶液反应()()432228488S O 2Mo CN 2SO 2Mo CN ----+→+的速率方程为()()4482288Mo CN S O Mo CN dc k dt---⎡⎤⎣⎦⎡⎤-=⎡⎤⎣⎦⎣⎦ 在20℃,若反应开始时只有两反应物,其初始浓度依次为0.01mol·dm -3,0.02mol·dm -3,反应26 h 后,测得[()48Mo CN -]=0.01562 mol·dm -3,求k 。
