《有机化学第四版》习题答案和课件 炔烃和二烯烃
有机化学C第6章 炔烃和二烯烃问题参考答案

第6章 炔烃和二烯烃问题参考答案1.炔烃没有顺反异构体。
因为三键碳是sp 杂化,为直线形构型,故无顺反异构现象。
2.HC CCH 2CH 2CH 2CH 3H 3CC CCH 2CH 2CH 3H 3CH 2CC CCH 2CH 2CH 3HCCCHCH 2CH 3HCCCH 2CHCH 3HCCCCH 3H 3CC CCHCH 3CH 3CH 3CH 3CH 3CH 31-己炔2-己炔3-己炔3-甲基-1-戊炔4-甲基-1-戊炔3,3-二甲基-1-丁炔4-甲基-2-戊炔3.化)4. 表面上看来,碳碳三键更具不饱和性,那末怎样来理解这些事实呢? 解释烯烃比炔烃更容易亲电加成的原因,有以下三点:(1).由于三键和双键的碳原子的杂化状态不同三键碳原子的杂化状态为sp ,较双键(sp 2)的s 成份为多,由于s 成份的增加,使sp 杂化轨道比sp 2杂化轨道的直径短,因而造成碳碳三键较双键为短。
所以在炔烃中形成π键的两个p 轨道的重叠程度较烯烃为大,使炔烃中的π键更强些。
而且由于不同杂化状态的电负 性为sp >sp 2>sp 3,炔烃分子中的sp 碳原子和外层电子(π电子)结合得更加紧密,使其不易给出电子,因而使快烃不易发生亲电加成反应。
(2).由于电子的屏蔽效应不同炔烃和烯烃分子中,都存在着σ电子和π电子,可以近似地看成π电子是在σ电子的外围。
σ电子受原子核的吸引而π电子除受原子核的吸引外还受内层电子的排斥作用,因而就减弱了受核的束缚力,即为电子的屏蔽效应。
乙烯分子中有五个σ键,即有五对σ电子,而乙炔分子中只有三个σ键即只有三对σ电子,因而乙烯分子中的电子的屏蔽效应大于乙炔分子,所以乙烯分子中的π电子受原子核的吸引力小,易给出电子,也就容易发生亲电加成反心,而乙炔则较难。
(3).炔烃比烯烃的加成较难的原因,还可以从形成的中间体碳正离子的稳定性不同来说明:R CH CH 2+E+R +H C H 2C E RCCH+E +RC +C HE由于烷基正离了要比烯基正离子稳定些,所以烯烃的亲电加成较易。
03有机化学第4版教案第三章-炔烃和二烯烃课件

SP杂化轨道中,有1/2的S成分,键长为 0.120nm。杂化轨道间的夹角是1800 ,呈直 线型。未杂化的2Py、2Pz轨道互相垂直,并 与该杂化轨道(的对称轴)垂直。
碳碳三键及炔烃分子的形成:
①两个SP杂化的碳原子各以一个SP轨道互相重叠 形成一个C-Cσ键。
②每个碳原子未杂化的2Py、2Pz与另一个碳原子未 杂化的2Py、2Pz两两相互从侧面重叠形成两个互相垂 直的π键。这两个π键的电子云分布好象是围绕两个碳 原子核心连线的圆柱。见P79图4-4。
CH2 =CH-CH -CH =CH-CH= CH2
C ≡ CCH3
5-乙烯基-1,3-辛二烯-6-炔
2>、1,3-丁二烯的两个双键可在2,3-碳原子 之间的同一侧或在相反的一侧,这两种构象式 分别用S-顺或S-反表示。(是不同构象,可转 变)。
S-顺-1,3-丁二烯或 S-(Z)-1,3-丁二烯
相连时给出π电子(或P电子)的原子或原子团 显示+C效应。
一般,共扼比超共扼稳定,超共扼比不共扼
稳定。如:
+
++
CH2=CH-CH2 >(CH3) 2CH>CH3
(1)、π-π共扼体系
二、共扼效应的传递
共扼效应通过π键来传递。能沿着共扼键 传递的很远,同时在共扼键上的原子将依次 出现电子云分布的交替现象。
CH ≡ CH + H2O
HgSO4
OH
H+
[H2C=CH]
CH3CHO
R C ≡ CH + H2O
HgSO4
H+ [R—C=CH2] OH
RCOCH3
3、氧化oxidation 与KMnO4 /OH- 、KMnO4 /H+ 、O3作用时:
有机化学4 炔烃试题及答案

第三章 炔烃和二烯烃(习题和答案)一、给出下列化合物的名称1.H C CH 3H C CH 3C C HH 2. CH CH CH 2CH 2C(Z ,E)-2,4-己二烯 1-戊烯-4-炔3. CH CH 2CH 3C 2H 5CH 3C C C4. (CH 3)2CH C(CH 3)3CC4-乙基-4-庚烯-2-炔 2,2,,5-三甲基-3-己炔5. CH CH CH CH 2CH C6. CH CH CH CH 3CC C1,3-己二烯-5-炔 5-庚烯-1,3-二炔7. (CH 3)2CH H C C 2H 5C H C C 8.CH 2CH 22CH 3CH 2CH 3CH C C(E)-2-甲基-3-辛烯-5-炔 3-乙基-1-辛烯-6-炔9. H H C C 2H 5C CH 3C C H H 10. CH H C CH CH3C CH 3CH 3C(Z ,Z)-2,4-庚二烯 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构1. 丙烯基乙炔 2. 环戊基乙炔CH CH CH CH 3CCHC3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 CH 2CH 3H C CH 3C H C C CH CH CH 2CH 3CH CH 3CH C5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔 6.1-己烯-5-炔CH CH 2CH3CHCH 2C CH 3C C CH CH CH 2CH 2CH 2C7.(Z ,E)-6-甲基-2,5-辛二烯 8.3-甲基-5-戊烯-1-炔H H C C 2H 5CH 2CH 3C CH 3C C H 9.甲基异丙基乙炔 10.3-戊烯-1-炔 CH (CH 3)2CH 3C C CHCH 3CH CH C三、完成下列反应式 1.Cl 2CH 2CH 2CH CHC ClCH 2CH 2CH CHC2.稀H 2SO 4CH 3CH 2CHCHgSO 4OCH 3CH 3CH 23.+CHCH CH CH 3OCH=CH 2CC CH OOO CH 3C C OO4.NaCH 2CH NH 3O s O 4H 2O 2CH 3CC 液 HHC C 2H 5CH 3C HO C 2H 5(±)OHCH 3HH 5.CH CH 3Br 24CH 3CC CHCH CH 3CH 3CC CH6.H 2催化剂Lindlar CH 3CH CC HHC CH 3C CH 37.2CHCOCH 3C 8.Na2CH 2CHCCH 2CHCCH 2CH 3C9.H 2OCH 稀H 2SO 4+CH CH 3CH CHgSO 4CH CH 3C OCH 3CH10.KMnO 4KOHCH 3CH 2CCOOK +CO CH 3CH 211.CH 2Cl CH 2CH +C C Ag(NH 3) CH 2C ClCH2F C CAg12.CHCH 3CH 2CCHO CH 2CH 3CH 213.Na INH 3CH 3CHCH 3C液H 2Pt /PbCNa CH 3CCCH 3CH 3C H HC CH 3C CH 314.H 2OCOOHKMnO 4C 2H 5CH 3CH +B 2H 6CC 2H 5CH=CH 2CH 2C 2H 5CH 15.CH 2CH 2CH HBr CH+C(1mol)CH 2CH CHCH 3C16.CH 2C CH 3+CH=CH 2 CH 2C 3Br +CH CH 3(主)CH 2C CH 3CH CH 3(次)17.CH C 6H 5+CH CH=CH 2 CH C 6H 5CH CH CH 318.CH3CHC COCH3CH3CH219.O3CH2OCH3CH2CH3CCOOHCH3CH2CH3COOH+20.△ClNa NH2 CH3ClCCHC CH2CHO四、用化学方法鉴别下列化合物1.(A) 己烷(B) 1-己炔(C) 2-己炔答:加入溴水不褪色的为(A),余下两者加入Ag(NH3)2+溶液有白色沉淀生成的为(B),另者为(C)。
曾昭琼《有机化学》(第4版)课后习题(炔烃和二烯烃)【圣才出品】

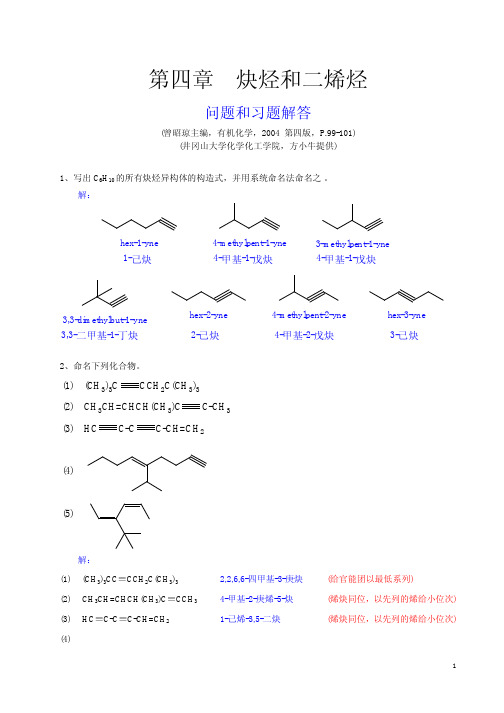
第4章 炔烃和二烯烃1.写出C 6H 10的所有炔烃异构体的构造式,并用系统命名法命名之。
答:C 6H 10的所有炔烃异构体的构造式及系统命名为:(1),命名:1-己炔;(2),命名:4-甲基-1-戊炔;(3),命名:3-甲基-1-戊炔;(4),命名:3,3-二甲基-1-戊炔;(5),命名:2-己炔;(6),命名:4-甲基-2-戊炔;(7),命名:3-己炔。
2.命名下列化合物。
(1)(CH 3)3CC≡CCH 2C(CH 3)3(2)CH 3CH =CHCH(CH 3)C≡CCH 3(3)HC≡CC≡CCH=CH 2(4)(5)答:(1)2,2,6,6-四甲基-3-庚炔(3)1-己烯-3,5-二炔(4)(Z)-5-异丙基-5-壬烯-1-炔(5)(2E,4Z)-3-叔丁基-2,4-己二烯3.写出下列化合物的构造式和键线式,并用系统命名法命名。
(1)烯丙基乙炔(2)丙烯基乙炔(3)二叔丁基乙炔(4)异丙基仲丁基乙炔答:(1)烯丙基乙炔的构造式:CH2=CHCH2C≡CH;键线式:;系统命名:1-戊烯-4-炔。
(2)丙烯基乙炔的构造式:CH3CH=CHC≡CH;键线式:;系统命名:3-戊烯-1-炔。
(3)二叔丁基乙炔的构造式:(CH3)3CC≡CC(CH3)3;键线式:;系统命名:2,2,5,5-四甲基-2-己炔。
(4)异丙基仲丁基乙炔的构造式:(CH3)2CHC≡CCH(CH3)CH2CH3;键线式:;系统命名:2,5-二甲基-3-庚炔。
4.写出下列化合物的构造式,并用系统命名法命名之。
(1)5-ethyl-2-methyl-3-heptyne(3)(2E,4E)-hexadiene(4)2,2,5-trimethyl-3-hexyne答:(1)构造式:;系统命名:2-甲基-5-乙基-3-庚烯。
(2)构造式:;系统命名:3,4-二甲基-4-己烯-1-炔。
(3)构造式:;系统命名:(2E,4E)-己二烯。
有机化学 曾昭琼 第四版 答案 第四章
2H 2, Pt
Ag(NH 3)2+
CAg
∴
该炔烃为:
12、 某二烯烃和一分子 Br2 加成的结果生成 2,5-二溴-3-已烯, 该二烯烃经臭氧分解而生成两分子 CH3CHO 和一分子 OCH-CHO。 ⑴ 写出某二烯烃的构造式。 ⑵ 若上述的二溴另成产物,再加一分子溴,得到的产物是什么? 解:
Br
(2) 在两个试样中加入硝酸银的氨溶液,有白色炔化银沉淀形成的为 1-戊炔;否则为 2-戊炔。 10、1.0 g 戊烷和戊烯的混合物,使 5ml Br2-CCl4 溶液(每 1000 mL 含 Br2 160 g)褪色,求此混合物中戊烯
5
的质量分数。 解:设 10 g 戊烷中所含烯的量为 x g ,则:
H2, Lindlar cat.
H3C H
CH3 H
NaNH 2
NaC CNa
2CH3Cl
H3C-C C-CH3
Na / NH 3 (l)
H3C H
H CH3
注意:此处不需要 H2。 (8) 乙醛
7
CH CH
15、指出下列化合物可由哪些原料通过双烯合成制得: 解: (1) :
HgSO4 -H2SO4 CH3 -CH=O H2 O
HCl, HgCl2 120-1800C
(2) 1,1-二溴乙烷
CH2=CH-Cl
2HBr
(3) 1,2-二氯乙烷
CH3CHBr2
Cl2
(4) 1-戊炔
Cl-CH=CH-Cl
H2 , Ni
Cl-CH2-CH2-Cl
CH CH
NaNH2
CH C- Na+
CH3Cl
CH C-CH3 Na + NH3 (l ) CH-CH3
有机化学(曾昭琼高教社第四版)课后习题答案

(3) 含一个侧链和分子量为 86 的烷烃: 因为 CnH2n+2=86 所以 n=6 该烷烃为 C H6 14,含一个支链甲烷的异构体为:
(4) 分子量为 100,同时含有伯,叔,季碳原子的烷烃
(5) 3-ethyl-2-methylpentane CH3CH(CH3)CH(C2H5) (6) 2,2,5-trimethyl-4-propylheptane CH3C(CH3)2CH2CH(CH2CH2CH3)CH(CH3)CH2CH3 (7) 2,2,4,4-tetramethylhexane (CH3)3CCH2C(CH3)2CH2CH3 (8) 4-tert-butyl-5-methylnonane CH3CH2CH2CH(C(CH3)3)CH(CH3)CH2CH2CH2CH3 4 解:
方程式:
19 解: (1) (2)
(3) (4)
(5) (6) (7) 20 解: (1)C>B>A(2)A>C>B(3)B>A>C
第五章 脂环烃
1 解:
2 解:
e CH(CH3)2
CH3
3 解: 规律(a)环己烷多元取代物较稳定的构象是 e-取代基最多的构象。 (b)环上有不同取代基时,大的取代基在 e 键的构象较稳定。 (1)
CL
HC L C H 3C H C C H 3
C H 3C H 2
C C H3
C H3
C H3
(2)
C L2
CL
450 CL
(3)
C H2
C H C H (C H 3)2
(1)H 2S O 4 (2)H 2O
(4)
HB r H 2O 2
C H 3 C H C H (C H 3)2 OH
(完整word版)有机化学(第四版)习题解答
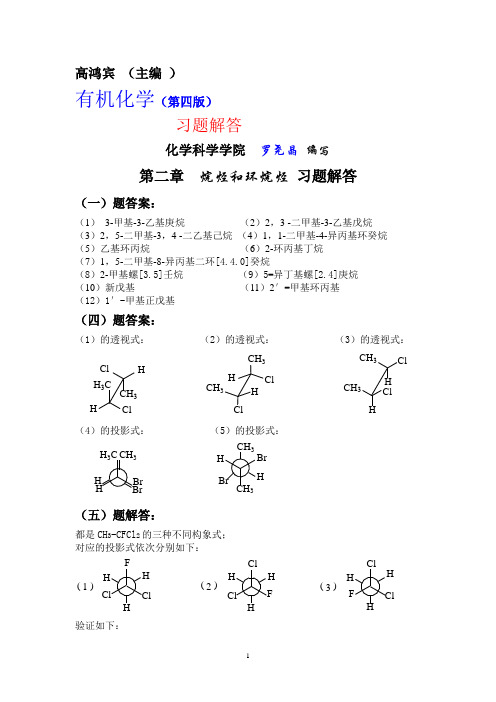
高鸿宾 (主编 )有机化学(第四版)习题解答化学科学学院 罗尧晶 编写第二章 烷烃和环烷烃 习题解答(一)题答案:(1) 3-甲基-3-乙基庚烷 (2)2,3 -二甲基-3-乙基戊烷 (3)2,5-二甲基-3,4 -二乙基己烷 (4)1,1-二甲基-4-异丙基环癸烷 (5)乙基环丙烷 (6)2-环丙基丁烷 (7)1,5-二甲基-8-异丙基二环[4.4.0]癸烷(8)2-甲基螺[3.5]壬烷 (9)5-异丁基螺[2.4]庚烷 (10)新戊基 (11)2′-甲基环丙基 (12)1′-甲基正戊基(四)题答案:(1)的透视式: (2)的透视式: (3)的透视式:Cl HCH 3H 3C ClHCH 3CH 3ClClHHCH 3ClClCH 3H H(4)的投影式: (5)的投影式:BrBr CH 3HH H 3CBrBr CH 3CH 3HH(五)题解答:都是CH 3-CFCl 2的三种不同构象式; 对应的投影式依次分别如下:ClClCl ClClCl FFF H HHH H H H H ( )( )( )123验证如下:把投影式(1)的甲基固定原有构象位置不变,将C-C 键按顺时针方向分别旋转前面第一碳0°、60°、120°、180°、240°得相应投影式如下:ClClClClClClClCl ClClFF FF F H HH H H HHH H H H H HH H ( )( )( )( )( )ab c de各投影式对应的能量曲线位置如下:由于(a )、(c )、(e )则为(1)、(2)、(3)的构象,而从能量曲线上,其对应能量位置是一样的,所以前面三个透视式只是CH 3-CFCl 2的三种不同构象式。
(六)题解答:(1)、(2)、(3)、(4)、(5)所代表的都是相同的化合物(2,3-二甲基-2-氯丁烷),只是构象表示式之不同,而(6)代表的则为2,2-二甲基-3-氯丁烷,是不同于(1)~(5)的另一个化合物。
有机化学教学课件第四版

影响亲核取代反应的因素包括底物结构、离去基团性质、亲核试剂的性质和反应条 件等。
卤代烯烃和卤代芳烃的化学性质
卤代烯烃的化学性质
卤代烯烃具有烯烃和卤代烃的双重性 质,可发生加成、氧化、还原等反应。 此外,卤代烯烃还可发生消除反应和 重排反应等。
卤代芳烃的化学性质
卤代芳烃具有芳香性和卤代烃的性质, 可发生亲电取代反应、亲核取代反应 和消除反应等。其中,氟代芳烃的反 应活性最高,碘代芳烃的反应活性最 低。
命名
卤代烃的命名遵循系统命名法,以烃为母体,卤原子作为取代基进行命名。
卤代烃的物理性质
状态
常温下,低级卤代烃为气体或液体,高级卤代烃为固体。
溶解性
低级卤代烃不溶于水,易溶于有机溶剂;高级卤代烃在水中的溶解 度增大。
密度
卤代烃的密度一般比水大。
卤代烃的化学性质
亲核取代反应
卤代烃中的卤原子可被 亲核试剂取代,生成相 应的醇或醚等化合物。
有机化学的建立
18世纪至19世纪初,有机化合物的分离和提 纯技术的发展
有机化学的结构理论
现代有机化学的发展
19世纪末至20世纪初,价键理论、分子轨道 理论和配位场理论等的提
20世纪后半叶至今,有机合成、天然产物化 学、生物有机化学、金属有机化学、超分子 化学等分支领域的快速发展
有机化学与生产生活的关系
命名规则
选择包含环的最长碳链作为主链,从靠 近环的一端开始编号,用“环”字表示 环状结构。
环烷烃的物理性质
熔沸点
随着分子量的增加和环的增大,熔沸点逐渐升高。
溶解性
低级环烷烃不溶于水,易溶于有机溶剂;高级环烷烃难溶于有机溶 剂。
颜色与气味
纯净的环烷烃通常是无色、无味的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
共轭效应的产生,有赖于共轭体系中各个σ键都在同一个平面上,这样才能使参加共轭的轨道互相平行而发生重叠。如果这种共平面性受到破坏,p轨道的互相平行就会发生偏离,减少了它们之间的重叠,共轭效应就随之减弱,或者完全消失。
对于p-π共轭来说,p电子朝着双键方向转移,呈推电子效应(+C)。
三、精选题及其解
4-1用系统命名法命名下列各化合物或根据下列化合物的命名写出相应的结构式。
(1)(CH3)2CHC≡CC(CH3)3(2) CH2=CHCH=CHC≡CH
(3) CH3CH=CHC≡CC≡CH (4)环己基乙炔
(5) (E)-2-庚烯-4-炔(6) 3-仲丁基-4-己烯-1-炔
(7)聚-2-氯-1,3-丁二烯
(b)环太小,张力过大,不能生成环丁炔。
4-4从乙炔合成下列化合物(其他有机、无机试剂任选):
(a)1-戊炔(b)2-己炔(c)1,2-二氯乙烷(d)顺-2-丁烯
(e)反-2-丁烯(f)2-丁醇(g)CH3CH2CH2CH2Br(h)2,2-二氯丁烷
解
(见d)反-
4-5考虑下列反应,哪些反应适宜于制备顺-2,3-二氘代-2-丁烯。
2-乙基-1,3-丁二烯
无
H2C=O,CH2CH3C OCH=O,O=CH2
(11)
H2C=CH—CH(CH3)—CH=CH2
3-甲基-1,4-戊二烯
无
H2C=O,O=CH—CH(CH3)—CH=O,O=CH2
4-3下列哪个反应有可能生成环烯烃?说明理由。
(醇)
(醇)
解(a)产物之一是环辛炔。尽管这里所形成的炔键倾向于呈直线状而造成较大的张力,但因环较大,此产物仍能被分离出来。
对π-π共轭来说,电负性强的元素原子吸引π电子,使共轭体系的电子云偏向该原子,呈现出拉电子效应(-C),例如:
π-π共轭的强度次序对同周期元素来说,电负性愈强,-C效应愈大:=O > =NR > =CR2;对同族元素来说,随着原子序数的增加,π键叠合程度变小,因而-C效应的次序为:=O > =S
σ-π共轭效应和σ-p共轭效应统称为超共轭效应,例如:CH3—CH=CH2,(CH3)3C+等。超共轭效应与π-π共轭效应和p-π共轭效应比较起来弱得多。超共轭效应一般是供电子的,其大小次序为:—CH3>—CH2R >—CHR2>—CR3,所以碳正离子的稳定性次序是3°>2°>1°>CH3+。
6、共轭二烯烃的性质
(1)、1,2-加成和1,4加成
1,2-加成产物1,4-加成产物
(2)、双烯合成——狄尔斯-阿德耳反应
一般称共轭二烯烃为双烯体,与双烯体进行合成反应的不饱和化合物称为亲双烯体。当亲双烯体双键碳原子上连有拉电子基(如-CHO,-COOR,-COR,-CN,-NO2)时,反应能顺利进行,产率也较高。双烯合成实际上是在光或热作用下由共轭二烯烃和一个亲双烯体发生的1,4-加成反应,是生成六元环状化合物的重要途径。
3、炔烃的制法
(1) 、形成三键
(醇)
(2)、金属炔化物和伯卤代烷反应
°
(3)、特殊制法
℃
(或石油烃)
4、二烯烃的分类和命名
根据两个双键的相对位置,二烯烃分为:
(1)累积二烯烃:具有C=C=C的结构(例如丙二烯H2C=C=CH2),性质较活泼,可发生水化和异构化反应:
异构化
(2)共轭二烯烃:具有C=C—C=C的结构(例如1,3-丁二烯H2C=CH—CH=CH2),性质活泼。
(3)、聚合反应
7、共轭二烯烃的制法
(1)卤代烷去HX
(醇)
(醇)
(2)、特殊制法
8、共轭体系和共轭效应
共轭体系有如下几种类型:
π-π共轭:例:CH2=CH—CH=CH2
p-π共轭:例:CH2=CH—CH2+
CH2=CH—CH2--
CH2=CH—CH2·
σ-π超共轭:例:CH3—CH=CH2
σ-p超共轭:例:(CH3)3C+
由于乙炔的ch键是sps键而乙烯和乙烷的ch键分别是sp2ssp3s键和sp杂化轨道相比较sp杂化轨道的碳原子的有效电负性最大因此炔氢的酸性较强可被金属置换ohmgosiochch390600chchchchchchchchchchkohchchchch共轭二烯烃的结构和性质丁二烯分子中键的离域以及由之而来的键长的改变能量的降低或稳定性的增加都是丁二烯分子形成共轭体系的结构所造成的
CH3C≡CH
化学性质
试剂和条件
产物
Ⅰ-C≡C-中π键的断裂
亲电试剂*的加成
游离基加成
亲核试剂的加成
氢化
水化
环加成
聚合
X+:X2
H+:HX/Hg2+
B(+):1)B2H6,2)H2O2,OH-
1)B2H6, 2)CH3COOH,H2O
Br·:HBr/ROOR(过氧化物)
ROH/RO-**
RCOOH/BF3或HgO
第四章炔烃和二烯烃
一、基本内容
1、炔烃的命名和结构
链状单炔烃(CnH2n-2)分子中含一个碳碳三键(—C≡C—),与具有两个碳碳双键的直链二烯烃互为同分异构体。其IUPAC命名法与烯烃基本相同,词尾用“炔”表示。俗名法则将炔烃视为乙炔的衍生物来命名。
乙炔HC≡CH是最简单的炔烃。乙炔是一个线形分子,两个碳原子分别以sp杂化轨道形成两个互成180°的σ键。两个碳的未杂化的p轨道相互重叠形成互相垂直的π键,分布于两个碳原子的上、下、前、后,形成一个圆筒形的电子云分布。
共轭效应是指在共轭体系中原子间的一种相互影响,这种影响造成分子更稳定,内能更小,键长趋于平均化,并引起物质性质的一系列改变。
σ-π共轭效应和σ-p共轭效应统称为超共轭效应。
共轭效应通过共轭π键来传递。当共轭体系一端受电场的影响时,就能沿着共轭键传递得很远,同时在共轭键上的原子将依次出现电子云分布的极性交替现象。
(3)H2C=CH—CH2—CH2—CH=CH2
1,5-己二烯
无
H2C=O,O=CH—CH2CH2—CH=O,O=CH2
(4)H2C=C(CH3)—CH=CH—CH3
﹋﹋﹋
2-甲基-1,3-戊二烯
2
H2C=O,O=C(CH3)—CH=O,O=CHCH3
(5) H2C=C(CH3)—CH2—CH=CH2
解(表中‘﹏’表示与顺反异构体有关的C=C双键)
(a)结构式和名称
(b)几何异构体
(c)溴氧分解产物
(1) H2C=CH—CH=CH—CH2CH3
﹋﹋﹋
1,3己二烯
2
H2C=O, O=CHCH=O, O=CHCH2CH3
(2) H2C=CHCH2CH=CHCH3
﹋﹋﹋
1,4己二烯
2
H2C=O, O=CHCH2CH=O,O=CHCH3
对同族元素而言,随着原子序数的增加,原子半径增大,外层p轨道也变大,它们与碳原子的π轨道重叠也变得困难,也就是形成p-π共轭的能力变弱。它们的+C效应大小顺序为:
—F >—Cl >—Br >—I
—OR >—SR >—SeR >—TeR
—O->—S->—Se->—Te-
对同周期元素而言,p轨道的大小相接近,但元素的电负性依次变大,也就是说元素原子核对其未共用电子对的吸引力增强,使电子对不易参加共轭,因此+C效应的次序是:-NR2>-OR >-F。
共轭二烯烃与溴或氢卤酸加成时,与单烯烃相似,分两步进行。
第一步;
由于碳正离子(1)中,带正电荷的碳原子和双键碳原子相连,即这个碳原子空的p轨道和π键的p轨道互相平行,侧面互相重叠,即形成p-π共轭体系,π电子云离域到相邻的三个碳原子上,体系能量降低,因此碳正离子(1)比碳正离子(2)稳定。加成反应的第一步,主要是通过形成碳正离子(1)进行的。
5、共轭二烯烃的结构
丁二烯分子的每个碳原子都以sp2杂化轨道互相重叠或与氢原子的1s轨道重叠,形成三个C—Cσ键和六个C—Hσ键。这些σ键都处于同一个平面上,即四个碳原子和六个氢原子都在同一个平面上,它们之间的夹角都接近120°。此外,每个碳原子还剩下一个未杂化的与这个平面垂直的p轨道,四个p轨道的对称轴互相平行,侧面互相重叠,形成了四中心四电子的共轭体系。共轭体系的形成,使丁二烯分子中双键的π电子云,发生了离域作用,扩展到了整个共轭双键的所有碳原子周围,使得共轭二烯烃中两个双键之间的单键具有部分双键的性质。
(3)孤立二烯烃:具有C=C—(CH2)n—C=C(n≥1)的结构(例如4-甲基-1,4-庚二烯),化学性质与单烯烃相似。
如前所示,多烯烃的系统命名法与烯烃相似,命名时,将双键的数目用汉字表示,位次用阿拉伯数字表示。多烯烃的顺反异构用顺、反或Z、E法命名。1,3-丁二烯的两种主要构象可表示为S-顺式或S-反式。
RMgX
NaOBr/hγ
KFe(CN)6/Cu2(Oac)2,O2
CH3C≡C—M
CH3C≡CMgX + RH
CH3C≡C—Br
CH3C≡C—C≡CCH3
*亲电加成一般为反式加成,顺马取向。但硼氢化-氧化反应和游离基加成则为反马取向。连在芳环上的炔键性质和脂肪族时相似。
**丙炔和ArOH/OH-,RSH/OH-的反应与之类似。
二、重点与难点评述
本章的重点是炔烃的结构和化学性质、共轭二烯烃的结构和重要反应。难点是对结构与性质的关系、共轭效应及其相对强弱的认识和理解。
1、炔烃的结构与性质
和p轨道相比较,s轨道上的电子更靠近原子核。一个杂化轨道的s成分愈多,则在此杂化轨道上的电子也愈靠近原子核,电负性越大,成键后键长越短,键的离解能就越大。炔烃叁键的碳原子是sp杂化的,而烯烃双键的碳原子是sp2杂化的,前者s成分较多,故炔烃虽较烯烃多一个π键,但与亲电试剂时存在时,则加成、氧化首先发生在双键上。
