尼妥珠单抗
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自行缓解,未影响治疗皮疹 1.43%- 1.43%自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
泰欣生(尼妥珠单抗注射液)说明书

泰欣生(尼妥珠单抗注射液)说明书【泰欣生药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumablnjection汉语拼音:NiTuoZhuDanKangZhusheye【泰欣生成份】每支10mL含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【泰欣生性状】外观澄清、无色无味,无不溶物的液体。
【泰欣生适应症】泰欣生与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用泰欣生前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用泰欣生。
检验操作应由熟练掌握EGFR检测试剂盒检测技术的实验室完成。
检验中的某些失误,如使用较差的组织样本、未能严格遵从操作规程、使用不当的对照等均可能导致不可靠的结果。
【泰欣生规格】13.5毫升西林瓶装量10毫升(±0.5毫升),尼妥珠单抗浓度为5mg/mL,每支含50毫克。
【泰欣生用法用量】100mg尼妥珠单抗稀释于250ml生理盐水中,前臂静脉输液给药,进药过程在60分钟以上。
次给药时间为放射治疗的天,于放疗前完成,以后每周一次,共8次。
患者同时接受标准的鼻咽癌放射治疗。
【泰欣生不良反应】该药物的不良反应主要表现为发热、血压下降、恶心、头晕、皮疹。
在70例晚期鼻咽癌患者中进行的Ⅱ期临床试验中发现,用药后发热的发生率为4.28%,体温39℃,对症处理后缓解,不影响治疗;血压下降,头晕发生率2.86%,达80/50mmHg,休息后缓解,不影响治疗;恶心发生率为1.43%,轻度,可自行缓解,不影响治疗;头晕发生率2.86%,时有头晕,可自行缓解,不影响治疗;皮疹发生率1.43%,轻度,可自行缓解,不影响治疗。
在古巴和加拿大进行的临床试验发现该药常见的不良反应有发热、寒颤、恶心、呕吐、发冷、贫血、血压降低。
不常见的不良反应有肌肉痛、运动语言障碍、口干、潮红、下肢无力、嗜睡、丧失方向感、肌酐水平升高、白细胞减少、血尿、胸痛、口腔绀紫。
头颈部肿瘤用药 尼妥珠单抗 nimotuzumab

头颈部肿瘤用药尼妥珠单抗 nimotuzumab
制剂与规格:注射液:50mg(10ml)/瓶
适应证:与放疗联合治疗EGFR基因阳性表达的Ⅲ~Ⅳ期鼻咽癌。
合理用药要点:
1.尼妥珠单抗冻融后抗体大部分活性将丧失,故在储存过程中严禁冷冻。
2.尼妥珠单抗配制的溶液在输液容器中2~8℃时,其物理和化学稳定性可保持12小时,在室温下可保持8小时。
储存时间超过上述时间,不宜继续使用。
3.尼妥珠单抗与放疗联合适用于治疗EGFR基因阳性表达的Ⅲ~Ⅳ期鼻咽癌。
4.使用尼妥珠单抗前,建议先确认肿瘤组织的EGFR基因表达水平,针对EGFR基因中、高表达的患者推荐使用本品。
5.免疫组化法检验EGFR基因表达,操作应由熟练掌握EGFR基因检测试剂盒检测技术的实验室完成。
检验中的某
些失误,如组织样本质量较差、操作不规范、对照使用不当等均可影响结果。
6.治疗期间因毒性不可耐受时可在同一代药物之间替换,因疾病进展不能在同一代药物之间替换。
7.首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药一次,共8周,患者同时接受标准的放射治疗。
8.用药期间必须注意常见的皮肤反应和腹泻。
9.尚未确定18岁以下儿童使用本品的安全性和疗效。
尼妥珠单抗治疗晚期非小细胞肺癌的有效性及安全性研究 徐敏仙

尼妥珠单抗治疗晚期非小细胞肺癌的有效性及安全性研究徐敏仙发表时间:2019-04-24T10:30:06.890Z 来源:《中国结合医学杂志》2019年2期作者:徐敏仙[导读] 说明尼妥珠单抗可有效提高晚期非小细胞肺癌的治疗效果,且临床应用无明显其他不良反应,安全性良好,值得推广应用。
湘南学院附属医院肿瘤科 423000【摘要】目的探讨尼妥珠单抗在晚期非小细胞肺癌治疗中的安全性和有效性。
方法收集2015年9 月至2017 年9 月我院收治的非小细胞肺癌患者78 例,采用随机数字法分为两组,39 例患者紫杉醇脂质体联合卡铂进行治疗,作为对照组,39 例患者在对照组治疗的基础上联合应用尼妥珠单抗,作为观察组,比较两组患者治疗效果和不良反应发生率。
结果观察组患者治疗有效率明显高于对照组,P<0.05;两组患者不良反应发生率组间差异无统计学意义。
结论尼妥珠单抗可有效提高晚期非小细胞肺癌的治疗效果,且临床应用无明显其他不良反应,安全性良好,值得推广应用。
【关键词】非小细胞肺癌;尼妥珠单抗;晚期[Abstract] objective to investigate the safety and efficacy of nituzumab in the treatment of advanced non-small cell lung cancer. Methods between September 2015 and September 2015,our hospital 78 cases of patients with non-small cell lung cancer,can be divided into two groups by random number method,39 patients were treated with paclitaxel plus carboplatin liposomes,as control group,39 patients in the control group therapy on the basis of joint application,this bead sheet resistance,as observation group,compared two groups of patients with therapeutic effect and the incidence of adverse reactions. Results the treatment efficiency of the observation group was significantly higher than that of the control group(P<0.05). There was no significant difference in the incidence of adverse reactions between the two groups. Conclusion nituzumab can effectively improve the therapeutic effect of advanced non-small cell lung cancer(NSCLC),and its clinical application has no obvious adverse reactions,so it is safe and worthy of promotion. 【Key words 】 non-small cell lung cancer;Nituzumab;In the late肺癌是临床上常见的恶性肿瘤疾病,严重威胁人类的健康,近年来随着环境污染的加剧和人们生活方式的改变,肺癌的发生率和死亡率呈逐年递增的趋势,调查发现,目前全球每年约有140 万人确诊为肺癌[1],其中非小细胞肺癌患者约占80 %,大部分患者确诊时已经处于中晚期,失去了手术根除的最佳时机,临床治疗主要以改善患者的症状、延长患者的寿命为主。
尼妥珠单抗治疗15例非小细胞肺癌临床疗效及不良反应的回顾性分析

尼妥珠单抗治疗15例非小细胞肺癌临床疗效及不良反应的回顾性分析倪军;斯晓燕;王汉萍;张力【摘要】Objective To retrospectively analyze the therapeutic efficacy and adverse events of nimotuzumab in advanced non-small cell lung cancer (NSCLC). Method Nimotuzumab was administrated to 15 cases of stage IV NSCLC, including 9 cases of adenocarcinoma and 8 cases of squamous cell carcinoma. All patients were confirmed by either histopathology or cytopathology, and were treated by nimotzumab (nimotuzumab 400 mg, i.v., qw). The ef-ficacy was evaluated after six weeks of treatment according to RECIST standards. For adverse events, the NCI-CTC 3.0 was applied. Result There were 11 cases that were qualified for efficacy evaluation and 15 cases for safety evaluation. Among the 11 cases included in efficacy evaluation, there were 8 cases achieving SD and 3 cases of PD. The disease control rate was 72.2% (8/11). The safety evaluation results showed that the incidence of skin rash relat-ed to nimotuzumab was low, and which was in no association with clinical benefit. All adverse events related with nimotuzumab were mild. Conclusion Nimotuzumab combined with chemotherapy or radiotherapy for patients with NSCLC increases disease control rate and has a better safety profile.%目的:回顾性分析尼妥珠单抗治疗晚期非小细胞肺癌(NSCLC)的临床疗效及不良反应。
尼妥珠单抗注射液说明书-泰欣生
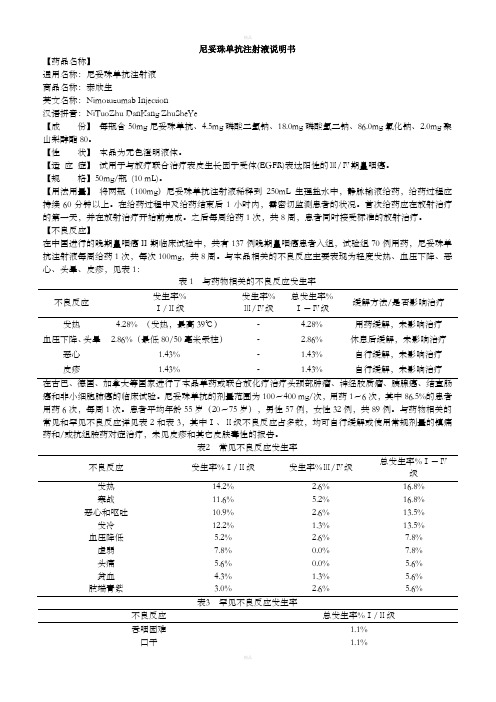
尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自行缓解,未影响治疗皮疹 1.43%- 1.43%自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
尼妥珠单抗治疗大肠癌1例报告

尼妥珠单抗治疗大肠癌1例报告
郭翔宇;孙涛;于绍芬;姜翠
【期刊名称】《癌症进展》
【年(卷),期】2010(008)001
【摘要】近年来,我国大肠癌发病率呈逐年上升趋势,随着对其发病机制研究的
不断深入,也为临床大肠癌的诊治提供了更多依据,使治疗方案的制定逐渐趋于个体化。
目前,国内大肠癌的分子靶向治疗临床应用广泛,与传统放化疗方法结合使用的疗效也得到更多专家认可。
作为以表皮生长因子受体(epidermal growth factor receptor,EGFR)为靶点的人源化单抗药物,尼妥珠单抗(nimotuzumab)于2009年被《NCCN头颈部肿瘤临床实践(中国版)》推荐,【总页数】2页(P100-101)
【作者】郭翔宇;孙涛;于绍芬;姜翠
【作者单位】辽宁省肿瘤医院内一科,沈阳110000;辽宁省肿瘤医院内一科,沈阳110000;辽宁省肿瘤医院内一科,沈阳110000;辽宁省肿瘤医院内一科,沈阳110000
【正文语种】中文
【相关文献】
1.尼妥珠单抗联合GP方案治疗晚期肺鳞癌脑转移完全缓解1例报告 [J], 赵静;王
华庆;钱正子;任旭升;张馨允
2.尼妥珠单抗靶向治疗联合TC化疗方案治疗晚期非小细胞肺癌患者的效果观察[J], 李山岭;王杰;陈素芳;王振兴
3.尼妥珠单抗降低BRCA1蛋白表达提高大肠癌SW480细胞对伊立替康敏感性的研究 [J], 孙晓东
4.尼妥珠单抗联合化疗一线治疗晚期大肠癌的临床研究 [J], 陈望花;王文玲;张若荣;董洪敏;王刚;李小凯
5.尼妥珠单抗靶向治疗联合常规化疗方案治疗晚期非小细胞肺癌临床研究 [J], 王学森
因版权原因,仅展示原文概要,查看原文内容请购买。
泰欣生说明书

规格50mg/瓶(10mL)瓶ﻫ【泰欣生功效】尼妥珠单抗注射液;泰欣生(尼妥珠单抗注射液)治疗鼻咽癌及其他肿瘤的单抗药。
ﻫ【简述】泰欣生(尼妥珠单抗注射液)与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌.使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品.本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显著,不良反应轻微。
ﻫ【泰欣生药理作用】ﻫ【泰欣生临床疗效】ﻫ【泰欣生不良反应】ﻫ【其它】【商品名】泰欣生【通用名】尼妥珠单抗注射液【英文名】Nimotuzumab Injection【汉语拼音】Nituozhudankang Zhusheyeﻫ【成份】每支10ml含50mg尼妥珠单抗(人源化抗人表皮生长因子受体单克隆抗体)、4。
5mg磷酸二氢钠、18。
0mg磷酸氢二钠、86。
0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体.ﻫ【适应证】本品与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品.本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显著,不良反应轻微。
ﻫ【用法用量】ﻫ100或200mg泰欣生(尼妥珠单抗)稀释于250ml生理盐水中静脉滴注,输液进药过程在60分钟以上,每周1次,共8次,患者同时接受标准的放、化疗ﻫ【药理作用】泰欣生(尼妥珠单抗)能够竞争性抑制内源性配体与EGFR的结合,阻断由EGFR介导的下游信号传导通路和细胞学效应,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,抑制肿瘤血管生成,抑制肿瘤细胞浸润和转移,增强放、化疗疗效。
ﻫ药理研究:EGFR是分子量为170KD的跨膜糖蛋白,其胞内区具有特殊的酪氨酸激酶活性。
尼妥珠单抗可在体内或体外培养细胞中阻断EGF与其受体EGFR的结合,并对EGFR过度表达的肿瘤具有有效的抗血管生成、抗增殖和促凋亡作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
尼妥珠单抗注射液
Nituozhu Dankang Zhusheye
Nimotuzumab Injection
本品系由稳定转染可表达人表皮生长因子受体单克隆抗体重组质粒的小鼠骨髓瘤(NS0)细胞,经细胞培养、分离和高度纯化后获得的重组人表皮生长因子受体单克隆抗体(尼妥珠单抗)制成。
不含防腐剂和抗生素。
1 基本要求
生产和检定用设施、原材料及辅料、水、器具和动物等应符合“凡例”的有关要求。
2 制造
2.1 工程细胞
2.1.1 名称及来源
尼妥珠单抗的工程细胞系由编码尼妥珠单抗重链的pSV2-gpt质粒和编码轻链的pSV-hyg质粒转入NS0宿主细胞构建而成。
2.1.2细胞库建立、传代及保存
细胞库建立、传代及保存应符合“生物制品生产检定用动物细胞基质制备及检定规程”规定。
将细胞种子经无血清培养液驯化,传代、扩增后冻存于液氮中,作为主细胞库;从主细胞库的细胞传代,扩增后冻存于液氮中,作为工作细胞库。
各级细胞库细胞传代应不超过批准的代次。
各级细胞库的细胞应经检定合格后方可用于生产。
2.1.3主细胞库及工作细胞库的检定
应符合“生物制品生产检定用动物细胞基质制备及检定规程”规定。
2.1.
3.1 支原体检查
依法检查(附录ⅫB),应符合规定。
2.1.
3.2抗体表达量测定
细胞库的抗体表达量应不低于5 µg/ml。
2.2原液
2.2.1细胞的复苏与扩增
从工作细胞库来源的细胞复苏后,进行传代、扩增,接种细胞培养罐。
2.2.2生产用细胞培养液
生产用细胞培养液应不含任何血清和抗生素。
2.2.3细胞培养
采用经批准的工艺进行细胞培养,收集含目的产物的培养液,即为收获液。
细胞培养全过程应严格按照无菌操作。
2.2.4分离纯化
采用经批准的工艺对收获液进行纯化和病毒灭活,制得高纯度的尼妥珠单抗,除菌过滤后即为尼妥珠单抗原液。
如需存放应规定保存温度和时间。
2.2.5原液检定
按3.1 项进行。
2.3 半成品
2.3.1配制与除菌
按经批准的配方配制稀释液,配制后应立即用于稀释。
将原液用稀释液稀释至所需浓度,除菌过滤后即为半成品。
2.3.2半成品检定
按3.2项进行
2.4 成品
2.4.1分批
应符合“生物制品分批规程”规定。
2.4.2 分装
应符合“生物制品分装和冻干规程”及附录ⅠA有关规定。
2.4.3 规格
应为经批准的规格。
50mg/瓶(10ml)。
2.4.4包装
应符合“生物制品包装规程”及附录ⅠA有关规定。
3检定
3.1 原液检定
3.1.2
照
加入
m
3.1.2.4 N端氨基酸序列(至少每年测定1次)
用氨基酸序列分析仪或质谱法测定,N端序列应为:
轻链:Asp-Ile-Gln-Met-Thr-Gln-Ser-Pro-Ser-Ser-Leu-Ser-Ala-Ser-Val。
重链:pGln-Val-Gln-Leu-Gln-Gln-Ser-Gly-Ala-Glu-Val-Lys-Lys-Pro-Gly
3.1.3纯度和杂质
3.1.3.1电泳法
依法测定(附录IV C)。
用非还原SDS-聚丙烯酰胺凝胶电泳法,分离胶浓度为7.5%,上样量应不低于10 μg(考马斯亮蓝R250染色法),非还原电泳条带应与对照品的一致;还原型SDS-聚丙烯酰胺凝胶电泳法,分离胶浓度为10%,上样量应不低于10 μg(考马斯亮
蓝R250染色法)。
经扫描仪扫描,免疫球蛋白重链和轻链含量应不低于95.0%。
3.1.3.2毛细管凝胶电泳法(CE-SDS)
依法测定(附录XXX),采用CE-SDS还原电泳法测定,免疫球蛋白重链和轻链含量应不低于90.0%,非糖基化重链应不高于5.0%;采用CE-SDS非还原电泳法测定,免疫球蛋白单体应不低于92.0%。
3.1.3.3高效液相色谱法
(1)分子排阻色谱法
依法测定(附录III B)。
色谱柱以适合分离分子量为10~500KD蛋白质的色谱用凝胶为填充剂(如:TSK3000SW凝胶色谱柱或其它适宜的色谱柱);流动相为0.1mol/L磷酸氢二钠-0.1mol/L氯化钠-0.01%叠氮钠缓冲液,pH6.7;检测波长为280nm。
用流动相将供试品稀释至每1ml中约含4mg,作为供试品溶液,取供试品溶液25µl注入液相色谱仪。
按面积归。
依法测定(附录II A),应不低于4.8 mg/ml。
用磷酸盐缓冲液(称取磷酸二氢钠0.45g,磷酸氢二钠1.8g,氯化钠8.6g,聚山梨酯80 0.2g,加水适量使溶解成1000ml)将供试品稀释至每1ml中约含0.5 mg,作为供试品溶液,以磷酸盐缓冲液作为空白,测定3份供试品溶液在波长280nm吸光度,计算吸光度平均值。
按下式计算供试品蛋白质含量:
C=DA/El
C为蛋白质含量(mg/ml);
D为稀释倍数;
A为吸光度平均值;
E为消光系数(1.404ml/mg.cm);
l为液层厚度(cm)。
3.1.5效价
3.1.5.1 生物学活性
依法测定(附录XXX),生物学活性应为标准品的50%-200%。
3.1.5.2相对结合活性
依法测定(附录XXX),相对结合活性应为标准品的80~150%。
3.1.6 细菌内毒素检查
依法检查(附录XII E),应小于1 EU/mg。
3.2 半成品检定
3.2.1蛋白质含量
按3.1.4项进行,应为4.6~5.5 mg/ml。
3.2.2 无菌试验
依法检查(附录XII A),应符合规定。
3.2.3 细菌内毒素检查
依法检查(附录XII E),应小于1 EU/mg。
3.3成品检定
3.3.1 鉴别试验
3.3.1.1 等电点
依法测定(附录ⅣD)。
供试品的等电点图谱应与对照品的一致。
3.3.1.2 相对结合活性
照3.1.5.2项进行。
与空白对照相比,供试品应有明显的相对结合活性。
3.3.2 物理检查3.3.2.1外观
应为无色澄明液体,可带轻微乳光。
3.3.2.2可见异物
依法检查(附录V B),应符合规定。
3.3.2.3 溶液的澄清度
取本品,溶液应澄清。
如显浑浊,与1号浊度标准液(附录XX)比较,不得更浓。
3.3.2.4 装量
依法测定(附录I A),应不低于标示量。
3.3.2.5 不溶性微粒
依法检查(附录V I),应符合规定。
3.3.3 化学检定
3.3.3.1 pH值
应为6.5~7.5(附录V A)。
3.3.3.2渗透压摩尔浓度
依法检查(附录Ⅴ H),应为240~360 mOsmol/kg。
3.3.3.3 聚山梨酯80含量
依法检查(附录ⅥH),应不高于0.1~0.3mg/ml。
3.3.4 纯度和杂质3.3.
4.1电泳法
按3.1.3.1项进行,非还原电泳条带应与对照品的一致,还原电泳重链和轻链含量应不低于95.0%。
3.3.
4.2毛细管凝胶电泳法(CE-SDS)
依法测定(附录XXX)),采用CE-SDS还原电泳法测定,免疫球蛋白重链和轻链含量应不低于90.0%,非糖基化重链不得高于5.0%。
采用CE-SDS非还原电泳法测定,免疫球蛋
白单体不得低于92.0%。
3.3.4.3高效液相色谱法按3.1.3.3项进行,采用分子排阻色谱法,免疫球蛋白单体含量应不低于95.0%;采用弱阳离子色谱法,供试品图谱应与对照品一致。
3.3.5蛋白质含量
按3.1.4项进行,应为4.6~5.5 mg/ml。
3.3.6 效价
3.3.6.1 生物学活性
依法测定(附录XXX),生物学相对活性应为标准品的50%-200%。
3.3.6.2相对结合活性
依法测定(附录XXX),相对结合活性应不低于标准品的60~140%。
3.3.7.无菌试验
依法检查(附录XII A),应符合规定。
3.3.8细菌内毒素检查
依法检查(附录XII E),应小于1 EU/mg。
3.3.9异常毒性检查
依法检查(附录XII F),应符合规定。
4 保存、运输及有效期
于2~8℃避光保存和运输。
自生产之日起,按批准的有效期执行。
5 使用说明
应符合“生物制品包装规程”规定和批准的内容。
