正四面体的结构与稳定性
第二章烷烃和环烷烃
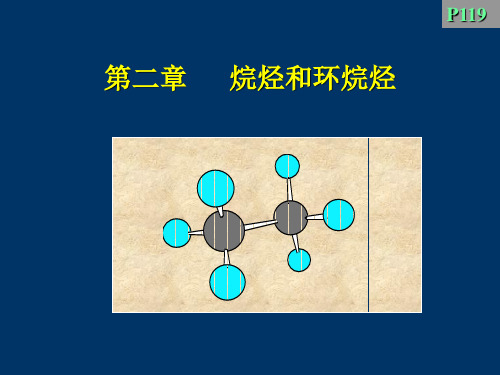
(1)乙烷的构象
H3C CH 3
当C-C键旋转时, 可产生无数个构象
有两种典型conformation:
乙烷的两种典型构象的表示方法
优势构象
交叉式 staggered
H
重叠式 eclipsed
作业:P130 /1, 6, 7 ,8; P105 / 8(3) (4) *C2-C3键旋转 阅读Section 1. Alkanes and Cycloalkanes 全文
翻译 1.1第一段,1.2.2第一段,1.2.3 第四段
CH3 CH3 CH C Br
CH3 CH3
四、环烷烃的异构现象
1. 顺反异构 cis-trans isomer (P84) 环烷烃环中C-C单键受环约束不能自由旋转,导致产生顺反异构
HH
H
CH 3
CH 3 CH 3
顺-1,2-二甲基环丙烷
CH 3 H
反-1,2-二甲基环丙烷
练习:写答出案: 1-甲基-3-乙H基环己烷的顺反异构体CH 3
伯碳(1°):一级碳原子,只与1个其他碳原子直接相连
仲碳(2°):二级碳原子,只与2个其他碳原子直接相连
叔碳(3°):三级碳原子,只与3个其他碳原子直接相连
季碳(4°):四级碳原子,只与4个其他碳原子直接相连
CH3
CH3
H3C
C CH2
3° 2°
H
伯氢(1°H):伯碳上的H
仲氢(2°H):仲碳上的H
练习:预测2-甲基丁烷在室温下进行氯代反应所得的一氯代物
Cl
答 案 : C3 C H H C2C H H 3 +C 2l 光 C3 C H C2 C H H 3
甲烷正四面体结构

甲烷正四面体结构
甲烷是一种简单的有机化合物,由一个碳原子和四个氢原子组成,化学式为CH4。
虽然甲烷的结构看似简单,但其分子结构却是具有重要意义的。
甲烷分子的结构为正四面体结构,这种结构不仅在化学、物理学领域有着广泛的应用,也成为了自然界中一些分子的结构基础。
甲烷分子的正四面体结构是指四个氢原子均匀地分布在一个碳
原子周围,并且四个氢原子相互之间的距离相等,形成一个四面体。
这种结构的稳定性非常高,是因为每个氢原子都与碳原子形成了共价键,使得甲烷分子的能量最低,因此也是最稳定的构型。
甲烷分子的正四面体结构是由美国化学家Linus Pauling在1930年提出的。
正四面体结构在自然界中也有广泛的应用。
例如,水分子的结构也是正四面体结构,这是因为水分子中氧原子与两个氢原子的键角度为104.5°,正好符合正四面体结构。
此外,一些分子如硫酸和氯仿等也具有正四面体结构。
正四面体结构的应用不仅局限于化学领域,在物理学、工程学等领域也有着重要的应用。
例如,在光学领域,正四面体结构被用于制造光学棱镜,因为它能够将光线分解成不同的波长。
在工程学领域,正四面体结构被用于设计分子筛,这是一种具有高度选择性的材料,可以用于分离化学物质。
总之,正四面体结构是一种具有重要意义的分子结构,不仅在化学领域有着广泛的应用,也在物理学、工程学等领域中发挥着重要作用。
甲烷分子的正四面体结构是一种能量最低、最稳定的结构,是自
然界中一些分子结构的基础。
物质结构与化学稳定性综述

物质结构与化学稳定性综述摘要:物质的化学稳定性是一个关乎其制备、使用、存放等问题的重要性质,在化学实验室中,我们经常需要了解物质的化学稳定性。
从物质结构角度来说明物质的化学稳定性,才是对该物质性质的最本质解释。
本文汇总简述了从不同层次分析的物质结构与化学稳定性的关系的理论。
关键词:物质结构,化学稳定性1 前言:物质稳定性的概念化学稳定性的定义是物质在物理、化学因素作用下保持原有化学性质的能力。
从分析这些问题时所用到的化学理论来看,物质的化学稳定性有热力学稳定性与动力学稳定性之分。
热力学稳定性是指在某体系中,该物质没有任何可想象的化学反应能自发地进行。
化学动力学稳定性是指在某体系中,该物质至少有一个可想象的化学反应能自发地发生,只是这个反应在以无法观测到的、极慢的速度在进行着,从而可以被宏观地认为这个化学反应并没有发生。
因为一个反应可以按许多历程进行,过渡态的寿命又很短,所以化学动力学研究的广度及深度与热力学稳定性相比大有不足,关于动力学稳定性的理论还很不完善。
因此通常的化学物质稳定性研究,都仅限于物质的热力学稳定性。
因为其作用因素的多变性,物质的化学稳定性有针对性,必须明确、统一作用条件这个概念才有意义。
同时物质的化学稳定性难以定量计量,是一个相对的概念,但可间接地通过热力学指标指示其强弱。
要从本质解释物质的稳定性,则需要研究物质的结构。
一方面物质结构导致的物质能量高低体可以较好地反映物质的稳定性:能量高的结构不稳定,能量低的结构稳定;另一方面特殊的物质结构也可以解释热力学难以解释的物质对特定物质的异常的稳定或不稳定性。
下文将简述从不同微观层次分析的物质结构与化学稳定性的关系的理论。
2 原子层面的结构与稳定性2.1 核外电子排布情况核外电子排布大多遵循如下规律:1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对;2、能量最低原理:电子尽可能占据能量最低的轨道;3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子;4.等价轨道在全充满、半充满或全空的状态是比较稳定的。
高中高一下册化学教案:最简单的有机化合物——甲烷

高中高一下册化学教案:最简单的有机化合物——甲烷一、教学目标1.知识目标了解甲烷的物理性质和化学性质。
掌握甲烷的分子结构及其与性质的关系。
理解有机化合物的概念和特点。
2.能力目标培养学生实验操作和实验设计的能力。
3.情感目标激发学生对化学的兴趣,培养学生的科学素养。
培养学生合作、探究的精神。
二、教学重难点1.教学重点甲烷的物理性质和化学性质。
甲烷的分子结构及其与性质的关系。
2.教学难点甲烷的化学性质。
有机化合物的概念和特点。
三、教学过程1.导入利用生活中的实例(如火柴、蜡烛等)引导学生思考有机化合物的概念。
提问:同学们,你们知道有机化合物吗?它们有什么特点?2.甲烷的物理性质通过观察甲烷的图片,引导学生了解甲烷的物理性质。
分析:甲烷是一种无色、无味的气体,密度比空气小,不易溶于水。
3.甲烷的化学性质通过实验演示,引导学生观察甲烷的燃烧现象。
分析:甲烷燃烧时产生蓝色火焰,二氧化碳和水。
提问:甲烷燃烧时发生了什么化学反应?燃烧产物是什么?4.甲烷的分子结构利用模型和动画,引导学生了解甲烷的分子结构。
分析:甲烷的分子结构为正四面体结构,每个碳原子与四个氢原子形成共价键。
5.甲烷的性质与结构关系分析甲烷的化学性质与其分子结构的关系。
6.有机化合物的概念和特点通过对甲烷的分析,引导学生理解有机化合物的概念和特点。
7.课堂小结8.作业布置请同学们课下查阅资料,了解其他有机化合物的特点和性质,下节课分享。
四、板书设计1.甲烷的物理性质:无色、无味、气体、密度小、不易溶于水。
2.甲烷的化学性质:燃烧二氧化碳和水。
3.甲烷的分子结构:正四面体结构,碳原子与四个氢原子形成共价键。
4.甲烷的性质与结构关系:稳定性。
5.有机化合物的概念和特点:多样性、复杂性和稳定性。
五、教学反思重难点补充:一、教学重点1.甲烷的物理性质和化学性质教学过程中,可以这样设计对话:“同学们,我们来看看甲烷的物理性质。
甲烷是无色、无味的气体,你们能感受到它吗?它比空气轻,如果我们在空气中释放甲烷,会发生什么现象呢?”2.甲烷的分子结构及其与性质的关系对话可以这样设计:“现在,让我们用这个模型来了解甲烷的分子结构。
正四面体场分裂能

正四面体场分裂能全文共四篇示例,供读者参考第一篇示例:正四面体场分裂能是物理学中一个重要的概念,指的是正四面体晶体在外加电场下会出现的分裂现象。
正四面体结构是一种特殊的晶体结构,其具有四个等边三角形构成的三维结构,具有对称性,因此在外加电场下会出现场分裂能效应。
本文将详细介绍正四面体场分裂能的相关知识,并探讨其在物理学中的应用和意义。
正四面体场分裂能的概念最早由物理学家克里斯托弗·继光在20世纪初提出。
正四面体场分裂能是指在一个正四面体结构的晶体中,由于外加电场的作用,晶体内部的电子云发生位移,导致晶体的能级结构产生分裂。
这种分裂现象是由于电场在晶体中的作用力所造成的,可以通过量子力学的方法来描述。
正四面体场分裂能在物理学中有广泛的应用和意义。
在材料科学领域,正四面体场分裂能可以用来解释晶体的电学性质和光学性质。
在材料的设计和合成过程中,了解正四面体场分裂能可以帮助科学家们选择合适的晶体结构,从而调控材料的性能。
在固态物理学中,正四面体场分裂能可以用来研究电子的行为和能级结构,帮助我们理解物质的性质和行为规律。
在光电子学和半导体领域,正四面体场分裂能可以用来设计新型的光电子器件和半导体器件,提高器件的性能和效率。
正四面体场分裂能是物理学中一个重要的概念,它可以帮助我们理解晶体的能级结构和光学性质,对材料科学、固态物理学和光电子学等领域具有重要的应用意义。
我们相信随着科学技术的不断发展,正四面体场分裂能将会有更广泛的应用和深入的研究,为人类的科学进步和技术发展做出更大的贡献。
【文章结束】。
第二篇示例:正四面体是一种几何体,具有四个等边等角的三角形面,四个相同的顶点和六条相等的棱,是几何学中的重要概念之一。
正四面体在自然界和人造物体中都有广泛的应用,可以看到它在晶体学、分子结构、建筑设计等领域中的身影。
在研究正四面体时,我们经常会涉及到一个概念,那就是正四面体的场分裂能。
场分裂能是描述正四面体结构中电荷分布和成键性质的物理参数,它直接影响着正四面体的稳定性和化学性质。
浅谈物质热稳定性的比较

浅谈物质热稳定性的比较摘要通过对几种典型物质的热稳定性分析,得出了比较物质热稳定性的一般思路和方法。
其中包括卤化氢、氨气、甲烷、卤化铵、碳酸钠、碳酸氢钠、硅酸钠、碳酸镁、碳酸钙等物质的热稳定性。
关键词热稳定性化学热力学硅酸钠碳酸镁碳酸钠卤化氢1 问题提出热稳定性是物质的重要性质之一。
在中学阶段,通过实验设计验证物质热稳定性的强弱,一般从2个方面考虑:一是控制相同的温度,通过实验现象比较物质发生热分解的难易或快慢;二是测量在相同时间内物质发生相同程度的热分解所需要的不同温度。
2种方法相比较,第一种方法比较容易操作。
中学阶段,对物质热稳定性强弱的解释或推测,有2种常见的思路:一种是通过比较元素金属性或非金属性的强弱来得出结论;另一种是通过比较反应物在发生热分解反应时所断裂的化学键的强弱来得出结论。
这2种思路虽然都能够解释一些现象和问题,也能够用来推测一些物质热稳定性的强弱,但都忽视了生成物的结构和性质对物质热稳定性的影响,论证不够严密充分,有时甚至会推出一些与事实不符的结论。
本文拟从中学阶段常见物质热稳定性强弱的比较入手,综合考虑热力学和动力学因素,探讨比较物质热稳定性强弱的一般规律和方法。
2 分析讨论决定物质热稳定性强弱的本质因素是物质及其分解产物的结构。
因为物质结构决定了物质的性质。
从热力学的角度分析,反应物和生成物的结构决定了反应的吉布斯自由能变(ΔrG m =ΔrH m-T×ΔrS m)的大小。
所示反应的ΔrG m越小,反应的热力学趋势就越大;从动力学的角度分析,反应物和生成物的结构决定了反应历程,而不同的反应历程具有不同的活化能,从而导致了热分解反应的难易程度有所不同。
由于本文基本没有涉及不同温度下物质的热分解产物可能不同的问题,所举例子基本属于反应物和分解产物相似(即反应历程相似)的情况,故本文论证时主要考虑热力学因素,通过热力学有关理论基本可以推测中学阶段常见物质热稳定性的强弱。
正四面体的结构与稳定性

正四面体的结构与稳定性江苏省如皋市丁堰中学冒春建 226521物质的组成、结构决定物质的性质。
如果某物质具有稳定的空间构型,就有稳定的性质。
那么怎么样的空间构型才是稳定的呢?按照价键理论,只要化学键的键角方向与其成键原子的价电子云在空间的伸展方向一致,则成键原子间的作用力最强烈,而成键电子与成键电子之间的排斥力最小(即通常所说的“键角张力”),非成键原子或原子团之间的空间距离最大,达到最大程度的舒展,使非成键原子或原子团间的空间位阻最小,具有这样的结构其内能最小,结构稳定。
正四面体结构是中学生所遇化学物质中最常见的空间构型之。
例如,原子晶体中的金刚石、晶体硅、水晶等,它们的熔沸点高、硬度大,通常情况下很难跟一般的化学试剂反应,表现出较强的稳定性;分子晶体中的甲烷、四氯化碳等,它们在通常情况下与大多数化学试剂如强酸、强碱、强氧化剂、强还原剂等都不起反应,也表现出较强的稳定性。
这是什么原因呢?因为在这些物质中,碳原子、硅原子都是以四个sp3杂化轨道与其相邻的四个原子形成典型的共价键基团“CC4”、“SiSi4”、“SiO4”或小分子“CH4”、“CCl4”,它们的键角方向与其中心原子的四个sp3杂化轨道的空间伸展方向一致,均为109°28′,不存在“键角张力”。
并且它们的成键原子的电子云之间达到最大程度的重叠,键能大,内能低,结构稳定,所以它们的性质也稳定。
我们知道,浓硫酸中+6价的硫具有强氧化性,而稀硫酸中同样为+6价的硫却没有氧化性,这是为什么呢?在浓硫酸中,+6价的硫绝大多数是以H2SO4分子形式存在,而H2SO4分子的空间构型是不规则的四面体,在H2SO4分子中O—S—O键的键角与硫原子的四个sp3杂化轨道的空间伸展方向(夹角为109°28′)不一致,化学键之间存在较强的“键角张力”,内能较大。
并且四个S—O键的键长不等,使位于中间的+6价硫原子的周围空间相对来说有一定的空隙,易受到具有还原性微粒的攻击,夺得电子,从而表现出氧化性。
键角为60度的分子空间构型正四面体

分子空间构型是化学中一个重要的概念,它描述了分子在空间中排列的方式。
而正四面体构型是一种特殊的构型,其中分子的键角为60度。
本文将深入探讨键角为60度的分子空间构型正四面体。
一、正四面体构型的定义正四面体是一种特殊的几何形状,它由四个相等的三角形构成,这些三角形共享一个顶点。
正四面体构型在化学中指的是分子中的原子之间的排列方式呈现出的几何形状,其中分子的键角为60度。
二、正四面体构型的性质1. 对称性:正四面体具有最高的对称性,具有四个等价的顶点和四个等价的面。
2.键角:正四面体构型中,分子的键角固定为60度。
3.稳定性:正四面体构型的分子通常具有较高的稳定性,这种构型使得分子中的电子云分布均匀,有利于分子的稳定性。
4.应用:正四面体结构广泛存在于化学和生物领域,例如硼烷、甲硼烷等分子中均具有正四面体构型。
三、正四面体构型的实现1. 分子中心原子四面体构型的实例以甲硼烷(BH4)- 分子为例,甲硼烷(BH4)-分子由一个硼原子和四个氢原子组成,硼原子和每个氢原子之间的键角均为120度,而整个甲硼烷分子的结构与正四面体构型非常相似。
硼原子位于正四面体的中心,四个氢原子分别位于四个顶点,形成正四面体构型。
2. 键角为60度构型的原子排列对于分子中的原子排列方式,常见的是分子中含有四个相同的原子,它们均位于分子的四个顶点上,形成正四面体构型。
这样的分子中,每个原子之间的键角均为60度,呈现出对称的几何形状。
四、正四面体构型的意义正四面体构型在化学与生物领域中具有重要的意义:1. 理论意义:正四面体构型的研究有助于深化对分子空间结构的理解,加深对分子之间相互作用的认识。
2. 应用价值:正四面体构型的分子在物理、化学、生物等领域具有广泛的应用价值,例如在材料科学中的应用以及对分子性质的研究等。
3. 化学合成:正四面体构型的分子在化学合成中具有一定的指导意义,有助于设计以及合成具有特定性质的分子,具有重要的应用前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
正四面体的结构与稳定性
江苏省如皋市丁堰中学冒春建 226521
物质的组成、结构决定物质的性质。
如果某物质具有稳定的空间构型,就有稳定的性质。
那么怎么样的空间构型才是稳定的呢?按照价键理论,只要化学键的键角方向与其成键原子的价电子云在空间的伸展方向一致,则成键原子间的作用力最强烈,而成键电子与成键电子之间的排斥力最小(即通常所说的“键角张力”),非成键原子或原子团之间的空间距离最大,达到最大程度的舒展,使非成键原子或原子团间的空间位阻最小,具有这样的结构其内能最小,结构稳定。
正四面体结构是中学生所遇化学物质中最常见的空间构型之。
例如,原子晶体中的金刚石、晶体硅、水晶等,它们的熔沸点高、硬度大,通常情况下很难跟一般的化学试剂反应,表现出较强的稳定性;分子晶体中的甲烷、四氯化碳等,它们在通常情况下与大多数化学试剂如强酸、强碱、强氧化剂、强还原剂等都不起反应,也表现出较强的稳定性。
这是什么原因呢?因为在这些物质中,碳原子、硅原子都是以四个sp3杂化轨道与其相邻的四个原子形成典型的共价键基团“CC4”、“SiSi4”、“SiO4”或小分子“CH4”、“CCl4”,它们的键角方向与其中心原子的四个sp3杂化轨道的空间伸展方向一致,均为109°28′,不存在“键角张力”。
并且它们的成键原子的电子云之间达到最大程度的重叠,键能大,内能低,结构稳定,所以它们的性质也稳定。
我们知道,浓硫酸中+6价的硫具有强氧化性,而稀硫酸中同样为+6价的硫却没有氧化性,这是为什么呢?在浓硫酸中,+6价的硫绝大多数是以H2SO4分子形式存在,而H2SO4分子的空间构型是不规则的四面体,在H2SO4分子中O—S—O键的键角与硫原子的四个sp3杂化轨道的空间伸展方向(夹角为109°28′)不一致,化学键之间存在较强的“键角张力”,内能较大。
并且四个S—O键的键长不等,使位于中间的+6价硫原子的周围空间相对来说有一定的空隙,易受到具有还原性微粒的攻击,夺得电子,从而表现出氧化性。
在稀硫酸中,+6价的硫原子是以自由移动的SO42-离子形式存在,而SO42-离子的空间构型是正四面体,所有的S—O键都是沿着硫原子的四个sp3杂化轨道在空间的伸展方向成键,不存在化学键之间的“键角张力”,四个S—O键的键长、键能完全相同,四个氧原子均匀地、等距离地分布在硫原子周围,使位于正四面体中心的+6价硫原子难以被其它原子或原子团攻击,也就没有得电子的可能性,故稀硫酸中+6价的硫没有氧化性。
又如,氨气和硝酸中的氮元素分别处于最低价态-3价和最高价态+5价,按理说,前者具有较强的还原性,后者具有很强的氧化性,两者相遇应发生强烈的氧化还有反应,而事实上,它们之间发生的是非氧化还原反应(简单的化合反应),这又是什么原因呢?这是由于N H3分子中的氮原子在成键时的四个sp3杂化轨道有一个被自身的孤对电子占领,当它遇到H+后很快形成N→H配位键,变成N H4+离子。
而N H4+离子的空间构型又是正四面体,四个N—H键的键长、键能均完全一样,键角均为109°28′,与N原子的四个sp3杂化轨道的夹角完全吻合,不存在“键角张力”;四个氢原子也均匀地分布在氮原子周围,使位于中心的-3价氮原子难以被其它原子或原子团进攻。
故氨气在遇到硝酸、浓硫酸等酸性强氧化剂时,表现不出还原性。
但是,当N H3在一定条件下,遇到CuO、Cl2等氧化剂时又表现出一定的氧化性。
这是因为N H3分子中,N原子的四个sp3杂化轨道中有一个被孤对电子占用,根据价电子对互斥原理,N—H键间的夹角受孤对电子的排斥挤压,键角不再是109°28′,而是107°,故N H3分子中氮原子的周围空间不是被氢原子均匀包围,氮原子的价电子云有了一定程度的“裸露”,较易受到其它氧化性微粒的进攻,从而表现出一定的还原性。
也许有人要问:白磷分子不也是正四面体结构吗?为何白磷的性质又很活泼呢?在白磷分子中每个磷原子用它的3个p轨道与另外三个磷原子的p轨道间形成三个σ键时,这种纯p轨道间的键角应为90°,实际上却是60°,所以P4分子具有较强的“键角张力”,这种张力的存在使每一个P—P键的键能减弱,易于断裂,从而导致白磷在常温下具有较高的化学活性。
综上所述,当物质具有体心正四面体结构时,其中心原子在成键时的价电子云伸展方向与它所形成的化学键方向一致,非成键原子间呈最大程度的舒展,不存在“键角张力”,内能最低,结构稳定,决定着其性质亦稳定。
参考资料:1、《无机化学》上、下册/北京师范大学无机化学教研室等编*3版*
——北京:高等教育出版社,1992.9(2000重印).
2、《物质结构》/潘道皑等编*2版*
——北京:高等教育出版社,1989.5(1999重印).。
