数型结合处理甲烷的正四面体结构
巧用甲烷的楔形式数算有机物分子的共线共面原子数

原子 的典型 分子 乙烯等 平面构 型进行 连接 , 得 到 四种
类型 , 在此类 型基础 上可数算复杂有机分子 的共线 、 共
面原子数 。 1 饱和碳原子共面 问题
一
H / \ H
将 甲烷 中的两个 氢原子换 成两个 甲基 , 若 以楔 形
式表 示丙烷 分子' 以三个碳原子共一面 ( 称为三角形规
键角为 1 2 0 。 。 碳碳 双键所连 的四个氢原子与这两 个碳 原子 同在一 个平面上 。 当乙烯分 子 中某氢 原子 被 其他原子或原子团取代时, 则取代 该氢原子 的原子一定
在乙烯 的平面内。 需要注意的是 : 碳 碳双键 不能转动。
2 . 2 乙炔 的空 间构型 为直线 形
3 . 4 类型 I V : 甲基与碳 氧双键的不饱和碳 原子连接 甲基与醛基 连接得 到乙醛 分 子。 画出乙醛 分 子中
条件。 有机 物分 子因碳 原子 的成键特点导 致其 种类 繁 多, 数量 庞大。 大多数有机物分 子因呈三维空间立体 构 型而使学 生对其结 构认识存 在困难。 对 有机物分 子共
机物分子, 它的四面体模型只有一个 I l l  ̄
c /
线、 共面的考查不仅是教学的重点 , 更是教学的难点 。
在纸平面上对有机化合物分子空间构型表 达式有 四种 : F i s h e r 投影式、 N e w m a n 投影式、 锯 架 式 和楔 形 式。 其 中具 有立体感 的楔形式 能较好地处 理有机 分子 中各原子 或原子 团在 空间 的位 置关 系, 使 有机物分 子
共线 、 共面问题变得简单 。 楔 形式与高中课 堂教学中有
机 物分 子的 比例模 型与球 棍模 型相关 联, 经 常使 用可 培养 学生空间想象能力。 目前高考对有 机物分 子共线 、 共 面命题 的设 问方
甲烷结构

(1)为使价电子对间斥力最小,可将价电子对看作等距 离地排布在同一球面上,形成规则的多面体形式。 当m+n=2时,取直线形;为3时,取三角形;为4时, 取四面体形等等 (2)中心原子A与m个配位体L之间所形成的键可能是 单键也可能是多键和三键等多重键 (3)成键电子对和孤对电子对的分布情况并不相同。由 于孤对电子对的肥大,是它对相邻电子对的排斥作 用力大一些 lp-lp>>lp-bp>bp-bp (4)电负性高的配体,吸引价电子能力强,价电子离中 心原子较远,占据空间角度相对较小
烃的代表
——甲烷
小组成员:周林林 马海霞
王丹丹
知识回顾
甲烷的立体结构
球棍模型
经过科学实验证明甲烷分子的结构是正四面体 结构,碳原子位于正四面体的中心,4个氢原 子分别位于正四面体的4个顶点上。其中,4个 C-H键的长度和强度相同,夹角相等(键角 109°28′)。
比例模型
为什么甲烷分子 呈正四面体结构 呢?
在CH4中,中心原子为C原子,其配位体数m=4,孤 对电子对数n=0,则m+n=4,为使其价电子对斥力最 小,故取四面体形,又因四个C-H键距离相等,则形 成正四面NH3等的构型,大 家可以下去尝试
多原子分子的结构和性质
分子的理论结构决定了分子的许多重要性质,例如 分子中化学键的类型,分子的极性等
分子的结构类型包括两个方面:分子的几何构型和 分子的电子构型
分子结构的这两个方面内容互相联 系,并共同决定分子的性质
价层电子互斥理论
价电子对包括成键电子对(bp)和孤对电子对(lp)。 价电子对互斥理论认为:原子周围各个价电子对之 间由于相互排斥,在键长一定的条件下,互相间距 离越远越稳定。这就要求分布在中心原子周围的价 电子对尽可能离得远些。 当中心原子A周围存在m个配位体L及n个孤对电子对 E时,根据斥力效应,并考虑多重键中多对电子集中 在同一键区,又考虑孤对电子的空间分布比较肥大 及电负性大小因素等,提出判断分子的几何构型的 规则:
运用数形结合巧解化学题目

运用数形结合巧解化学题目数形结合是一种将数学与几何形状相结合的方法,通过图形的具体形态和性质来解决数学问题。
在化学学科中,数形结合也有很大的应用价值。
下面将通过举两个例子来介绍数形结合在化学题目中的巧妙应用。
例一:求解气体分子速度分布的平均速度在热力学中,气体分子的速度分布可通过麦克斯韦速度分布定律描述。
该定律告诉我们,气体分子的速度与温度呈正比,而与分子量呈反比。
求解气体分子速度分布的平均速度的问题也经常出现。
麦克斯韦速度分布定律公式为:f(v) = 4π(v^2) * (m / 2πkT)^(3/2) * exp(-(mv^2) / 2kT)f(v)表示速度为v的分子所占的百分比,m表示分子的质量,k表示玻尔兹曼常数,T 表示温度。
现求解气体分子速度分布的平均速度。
我们可以将麦克斯韦速度分布定律的公式与数形结合,构造一个半径为v的球体,球体的体积表示速度为v的分子所占的百分比,球体的体积与速度v满足的关系为:V = 4/3 * π * v^3根据麦克斯韦速度分布定律,速度为v的分子所占的百分比为f(v),故速度分布的平均速度v_avg可以表示为:v_avg = ∫(v * f(v) * dV)将球体的体积表达式代入,可得:v_avg = ∫(v * f(v) * (4/3 * π * v^3) * dv)通过对上式进行求解,可以求得气体分子速度分布的平均速度。
例二:计算化学平衡常数在化学反应中,平衡常数是用来描述反应物和生成物浓度之间平衡比例的定量指标。
对于一个反应式aA + bB ⇄ cC + dD,平衡常数Kc定义为反应物和生成物浓度的乘积之比的绝对值:Kc = ([C]^c * [D]^d) / ([A]^a * [B]^b)[C]表示C的浓度,[A]表示A的浓度,[B]表示B的浓度,[D]表示D的浓度。
当我们计算化学平衡常数时,可以将化学反应平衡的各个物质浓度用图形表示出来,并利用数形结合的思想解决问题。
高三化学一轮复习 生活中的有机物

之前必须验纯!!
烃的燃烧通式:
CxHy
(x
y 4 )O2
点燃 xCO2
y 2
H 2O
【甲烷的燃烧】
1.若1 mol某气态烃 CxHy 完全燃烧,需用5 mol O2,则( )
A.x=2,y=2
B.x=2,y=4
C.x=3,y=6
√D.x=3,y=8
解析:据烃燃烧通式:
CxHy
(x
y 4
)O2
点燃
xCO2
沸点/ ℃ -164 -88.6 -42.1 -0.5 36.1 301.8
相对密度 0.466 0.572 0.585 0.5788 0.6262 0.7780
水溶性 不溶 不溶 不溶 不溶 不溶 不溶
①所有烷烃均难溶于水,相对密度均小于1。 ②常温下烷烃的存在状态:C1~C4为气态;C5~C16为液态;C17以上为固态。 ③随着分子中碳原子数的递增,呈现规律性变化,沸点逐渐升高,相对密度逐渐增 大,常温下的存在状态由气态逐渐过渡到液态再到固态。
探究建构:生活中的有机物
---探究有机物性质不同的原因
1.结合271BAY资源,探究并总结重要有机物甲烷、乙烯、苯 的获取过程和方法。 2.实验探究烃类、乙醇和乙酸的化学性质,解释反应机理,建 构有机物官能团与性质的关系。 3.运用官能团结构与性质的关系,探究糖类、油脂、蛋白质的 性质,分析为生命提供能量的过程。
为甲醇(CH3OH),故D错误。
【甲烷的燃烧】
4.某气态烃(CxHy)在标准状况下的密度为3.215 g·L-1,现取3.6 g该烃完 全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:(1)该烃分子的摩尔质量为_____________。 (2)确定该烃的分子式:____7_2_g_·_m。ol(-3)1已知该烃的一氯代物只有一种, 写出该烃的结构简式:__C__5H__12____。
甲烷及烷烃的结构讲解
原子核结构不同 电子层结构相同
不同 化合物
原子(核素) 原子(核素)
1 1H
例子 CH 和 CH CH 4 3 3
正丁烷和 O 2和 O 3 异丁烷
和2 Biblioteka H课后练习第4题二.等效氢原子的判断 等效氢原子的判断
1.同一碳原子所连的氢原子是等效的; 同一碳原子所连的氢原子是等效的; 同一碳原子所连的氢原子是等效的 2.同一碳原子所连甲基上的氢原子是等效的 同一碳原子所连甲基上的氢原子是等效的; 同一碳原子所连甲基上的氢原子是等效的 3.处于镜面对称位置上的氢原子是等效的 处于镜面对称位置上的氢原子是等效的. 处于镜面对称位置上的氢原子是等效的
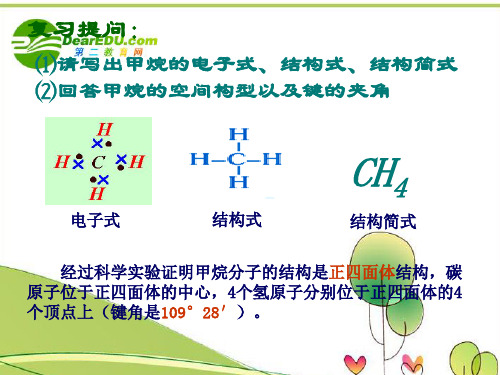
复习提问: 复习提问:
请写出甲烷的电子式、结构式、 ⑴请写出甲烷的电子式、结构式、结构简式 ⑵回答甲烷的空间构型以及键的夹角
CH4
电子式 结构式 结构简式 经过科学实验证明甲烷分子的结构是正四面体结构,碳 经过科学实验证明甲烷分子的结构是正四面体结构, 正四面体结构 原子位于正四面体的中心, 个氢原子分别位于正四面体的4 原子位于正四面体的中心,4个氢原子分别位于正四面体的4 109° 个顶点上(键角是109 28′ 个顶点上(键角是109°28′)。
碳原子数目越多, 3. 碳原子数目越多,同分异构体越多
碳原 子数 烷烃) (烷烃)
1
2
3
4
5
6
7
8
9 10
同分 异体 数
无 无 无 2
3
5
9 18 35 75
碳原 子数 11 烷烃) (烷烃)
12
…. .
15
20
40
同分 异体 159 数
355
…. .
使学生了解甲烷的结构式和甲烷的正四面体结构

第 一 节 甲烷1、 使学生了解甲烷的结构式和甲烷的正四面体结构。
2、 使学生掌握甲烷的化学性质,实验室制法和收集方法。
3、 使学生了解取代反应。
4、 培养学生观察、分析实验现象,形成规律性认识,并应用概念认识新事物的思维能力。
甲烷的实验室制法,甲烷的化学性质,取代反应。
甲烷的分子结构、甲烷的取代反应。
实验5——1、实验5——2用品二课时 自学——辅导法[引 言]1、什么是有机物?定义:含碳元素的化合物(碳氢化合物及其衍生物)称为有机化合物。
简称有机物(注意:CO 、CO 2、H 2CO 3及碳盐例外,它们称为无机物)。
2、有机物与人类的关系。
3、人类早期、和现在取得有机物的手段。
[阅 读]P115页上[提 问]1、有机物和无机物的种类比较(多少)2、为什么有机物的种类繁多?3、组成有机物的元素。
4、那类有机物叫烃?最简单的烃是什么?[简 述]有机物的特点:①有机物种类繁多,结构复杂。
②大多数有机物难溶于水而易溶于汽油、酒精、苯等有机溶剂。
③绝大多数有机物受热易分解,而且容易燃烧。
④绝大多数有机物是非电解质,不易导电,熔点低。
⑤有机物所起的化学反应比较复杂,一般比较慢,并且还常伴随有副反应发生。
[板 书] 第一节 甲 烷一、甲烷的分子结构[阅 读]P115页——116页上要求掌握:⑴甲烷的分子式⑵甲烷的电子式⑶甲烷的结构式⑷甲烷的分子结构示意图[展示甲烷的球辊模型和比例模型]加深对甲烷的正四面体结构的认识。
CH4分子中1个C与4个H形成一个四面体,C在正四面体中心,4个H在正四面体的4个顶点。
①键角:109°28 ˊ正四面体②键长:C-H键键长:1.09×10-10m③键能:413 KJ·mol-1但由于有机物的立体结构式书写起来比较费事,为方便起见,一般采用平面的结构式。
[板书]甲烷的物理性质⑴无色、无味气体⑵在标准状况下,ρ=0.717g·L-1⑶极难溶于水[板书]二、甲烷的实验室制法1、原料:无水CH3COONa和干燥的碱石灰(NaOH和CaO)。
有机物分子中原子共线共面问题
有机物分子中原子的共面共线问题衡南二中胡必爱有机分子中原子的共面共线是中学有机化学教学的一个难点。
此类题目的解题思维方法如下:原子共面共线问题思维的基础:甲烷的正四面体结构;乙烯、苯、萘、蒽的平面结构;乙炔的直线结构。
1.甲烷的正四面体结构在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三原子共面(称为三角形规则).当甲烷分子中某氢原子被其他原子或原子团取代时,该代替原子的共面问题,可将它看作是原来氢原子位置。
其结构式可写成如图2所示。
左侧甲基和②C构成“甲烷分子。
此分子中⑤H,①C,②C构成三角形。
中间亚甲基和①C,③C构成“甲烷"分子。
此分子中①C,②C,③C构成三角形,同理②C,③C,④H构成三角形,即丙烷分子中最多两个碳原子(①C,②C,③C)三个氢原子(④H,⑤H)五原子可能共面。
2.乙稀的平面结构乙烯分子中的所有原子都在同一平面内,键角为120°。
当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。
其结构式可写成如图4所示。
三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子一定共面。
根据三角形规则[⑤C,⑥C,⑦H构成三角形]。
⑦H也可能在这个平面上.至少6个原子(6个碳原子),至多10个原子[6个碳原子和4个氢原子(每个甲基可提供一个氢原子)]共面。
3.苯的平面结构苯分子所有原子在同一平面内,键角为120°。
当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平面内.甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的一个碳原子),5个氢原子(苯环上的5个氢原子)这12个原子一定共面。
此外甲基上1个氢原子(①H,②C,③C构成三角形)也可以转到这个平面上,其余两个氢原子分布在平面两侧。
故甲苯分子中最多有可能是13个原子共面.同理可分析萘分子中10个碳原子,8个氢原子18原子共面和蒽分子中14个碳原子,10个氢原子,共24个原子共面问题。
2020年高中化学·强化讲义 第65节 甲烷
第65节甲烷有机化合物中,有一大类物质仅由碳、氢两种元素组成,这类物质叫做烃。
甲烷是烃类中最简单的物质甲烷又叫沼气,也叫坑气。
其原因是池沼的底部和煤矿的坑道所产生的气体的主要成分是甲烷。
这些甲烷是在隔绝空气的情况下,由植物残体经某些微生物发酵的作用而生成的。
在天然气中,甲烷的体积分数为80%~97%。
农村中建沼气池可以解决部分农家使用燃料问题,同时也有利于改善农村环境卫生。
甲烷是没有颜色、没有气味的气体。
在标准状况下,密度为0.717g/L,甲烷极难溶于水,易燃烧。
一、甲烷分子的结构在前面的学习中我们已经知道甲烷的分子式是CH4.经过大量科学实验证明,甲烷分子中的一个碳原子和四个氢原子不在同一个平面上,而是形成了一个如图13-9所示的正四面体的立体结构:请运用学过的知识分析1个碳原子和4个氢原子是怎样结合成如此美妙的正四面体结构的分子的?哪些事实可以证明甲烷分子具有正四面体结构?写出甲烷分子的电子式和结构式二、甲烷的制法和性质先将无水醋酸钠和碱石灰按1:3质量比充分混合后,迅速装进试管中,用酒精灯加热。
并用排水集气法把甲烷收集到试管中。
观察甲烷的颜色并闻它的气味。
在实验室中,可用无水醋酸钠和碱石灰混合加热制备CH4.反应的化学方程式如下:在通常情况下,甲烷是比较稳定的物质,它与强酸、强碱或强氧化剂等一般不发生化学反应。
但是,甲烷的稳定性是相对的,在一定条件下,也会发生某些反应1.取代反应取一支大试管,用排饱和食盐水的方法收集4体积Cl2和1体积CH4,再把装有混合气体的试管放在盛有饱和食盐水的水槽中,光照,观察反应的现象,见图13-11。
在室温下,甲烷和氯气的混合气体可以在黑暗中长期保存而不起任何反应。
但混合物在紫外光照射下就会发生反应,黄绿色的C2会逐渐减少。
反应的化学方程式可表示如下(为了理解反应发生的情况,用结构式代替分子式):有机物分子中的某些原子或原子团被其他原子或原子团代替的反应叫做取代反应。
甲烷的空间构型
甲烷的空间构型甲烷(CH4)是一种无色、无臭的气体,由一个碳原子和四个氢原子组成。
甲烷是最简单的烷烃,也是天然气的主要成分之一。
甲烷的空间构型指的是分子中碳和氢原子之间的排列方式和几何结构。
本文将详细介绍甲烷的空间构型及其相关性质。
甲烷的空间构型可以用分子构型图来表示。
甲烷的分子式为CH4,碳原子位于中心,四个氢原子分别连接在碳原子的四个顶点上。
这种构型又被称为正四面体构型。
在正四面体构型中,碳原子与四个氢原子之间的键角都为109.5°。
甲烷分子的构型是由原子之间的共价键连接决定的。
碳原子有四个价电子,氢原子有一个价电子。
碳原子通过与四个氢原子形成共价键来实现其八个价电子的稳定配置。
每个碳-氢键都是共用一对电子,形成共价键。
甲烷的空间构型是通过碳-氢键的长度和键角来描述的。
甲烷分子的空间构型对其化学性质具有重要影响。
由于甲烷分子的空间构型稳定且紧凑,它具有低沸点、低密度和高燃烧热等性质。
甲烷是一种非极性分子,不溶于水。
由于其氢原子比碳原子电负性更低,使得碳和氢原子之间的键呈现等电子分布,不产生电荷偏离。
这导致甲烷分子没有极性,分子中的正负电荷分布均匀。
甲烷的空间构型也对其化学反应的进行起到重要作用。
例如,在燃烧反应中,甲烷与氧气反应生成二氧化碳和水。
这是一种高温反应,燃烧过程中,甲烷分子中的碳-氢键被断裂,产生新的碳-氧和氢-氧键。
空间构型的稳定性使得甲烷能够有效地与氧气反应,并释放出大量的能量。
总结起来,甲烷的空间构型是一个由一个碳原子和四个氢原子组成的正四面体构型。
空间构型的稳定性使甲烷具有一系列特性,如低沸点、低密度和高燃烧热等。
甲烷是一种非极性分子,不溶于水。
空间构型也对甲烷的化学反应起到重要的影响。
通过分析甲烷的空间构型,可以更好地理解其性质和参与的化学反应。
证明甲烷是正四面体结构的事实
证明甲烷是正四面体结构的事实甲烷,即化学式为CH4的分子,是一种简单的有机化合物。
它由一个碳原子和四个氢原子组成,四个氢原子均连接在碳原子上,形成一个四面体结构。
下面将从分子结构、键角和化学性质等方面来证明甲烷是正四面体结构的事实。
我们来看甲烷的分子结构。
甲烷的分子中有一个碳原子和四个氢原子。
碳原子与每个氢原子之间通过共价键相连。
共价键的形成是由于碳原子的四个价电子和氢原子的一个价电子之间的共享。
由于碳原子形成四个共价键,每个氢原子都与碳原子相连,甲烷分子的结构呈正四面体。
我们来分析甲烷分子中的键角。
键角是指两个相邻原子和其中一个氢原子之间的夹角。
在甲烷分子中,碳原子与四个氢原子之间的键角均相等。
根据实验测定,甲烷分子中的C-H键角约为109.5度。
正四面体的内角为109.47度,非常接近甲烷分子中的键角。
这进一步证明了甲烷是正四面体结构的事实。
甲烷的化学性质也支持它是正四面体结构。
由于甲烷分子中的四个氢原子位置相对等,因此它具有旋转对称性。
这种旋转对称性使甲烷分子在化学反应中具有特殊的稳定性。
甲烷与氧气反应时,氧气会优先与甲烷分子中的碳原子发生反应,而不是与氢原子发生反应。
这是因为甲烷分子中的四个氢原子位置相对等,氧气无法选择性地与其中的一个氢原子发生反应。
这种化学性质与正四面体的对称性一致,进一步证明了甲烷是正四面体结构的事实。
甲烷是正四面体结构的事实可以通过分子结构、键角和化学性质等方面来证明。
甲烷分子中的四个氢原子均连接在碳原子上,形成一个四面体结构。
碳原子与氢原子之间的键角约为109.5度,非常接近正四面体的内角。
甲烷分子具有旋转对称性,使其在化学反应中具有特殊的稳定性。
这些事实明确地表明甲烷是正四面体结构的。
