第四章 手性药物的制备技术
第四章 手性药物的制备技术2

3.手性配体的来源及其与过渡金属的络合
不对称合成中使用的大量手性配体主要来自手性 库中的天然原料,典型的例子是酒石酸及其酯类和 金鸡纳生物碱,酒石酸在非均相镍催化的不对称氢 化和均相钛催化的不对称环氧化等反应中充当手性 配体,金鸡纳生物碱作为手性配体用于非均相钯催 化的不对称氢化和均相锇催化的烯烃的不对称二羟 基化。金鸡纳生物碱本身作为不对称催化剂,用于 一系列碱催化反应中。大部分手性二瞵配体是以相 对便宜的天然化合物原料合成的。
在不对称催化合成中,手性配体有两方面的作用, 一是加速反应,二是手性识别和对映体控制。
在不对称催化合成反应中,手性配体与过渡金属 的络合加快了反应速度,并提高了反应的立体选择性, 这种现象被称为配体促进的催化。换句话说,当过渡 金属配合物催化活性远远高于过渡金属本身时,才能 看到反应的高度立体选择性。
5.生物碱类 生物碱类分子量大、价格高。常用的金鸡纳生物
碱类仅作为拆分剂用于某些外消旋酸的拆分,结构见 图4-7。关于金鸡纳生物碱类作为不对称催化剂的手性 配体或不对称催化反应的碱性催化剂的研究很多,有 一定的应用前景。
三、手性药物合成实例
直接结晶法简单经济,但适用范围有限。 非对映体结晶法较通用,但需要大量的拆分剂和 溶剂,操作繁琐,还有非目标对映体的消旋化、拆分 剂回收套用等工序。 动力学拆分中非目标异构体的自发消旋化提高了 收率,并可通过调节转化率控制产物光学纯度,可与 不对称合成相媲美。 催化不对称合成所用的手性催化剂结构明确、种 类繁多;反应条件温和,生产效率高,已成为合成手 性药物的重要方法。
▪
树立质量法制观念、提高全员质量意 识。20.12.2020.12.20Sunday, December 20, 2020
▪
手性制药技术

不对称合成
手性辅助剂法
特点: 与第一代方法类似 ,手性控制仍是通过底 物中的手性基团在分子内实现的。但需预先 连接手性辅助剂,反应完成后还要脱去,麻 烦。 例:降血压药 甲基多巴的合成。
不对称合成
手性辅助剂法
不对称合成
手性辅助剂法
特点: 1)与第一代及第二代方法不同 ,立体化学 的控制是通过分子间的作用进行的。 2)没有手性试剂与底物的连接,避免了 手性辅助剂与底物的连接与脱离的麻烦,而 且手性试剂能部分被回收。
诱导结晶法
优点:不需拆分剂,工艺简单,母液可套用多 次,成本低,是比较理想的大规模拆分法; 缺点:预先需要有纯的单一异构体晶体作为晶 种,而且拆分过程是间歇操作,生产周期较长。 另外得到的异构体纯度不够高。
化学拆分法
用手性试剂(拆解剂)通过化学反应的方法将 外消旋体中的两种对映体转变成非对映异构体, 然后利用非对映异构体之间的物理和化学性质的 差异将它们分开,得到单一的非对映异构体后再 转化成原来的手性化合物。 通常也叫做:非对映异构体拆分法 适用于对外消旋化合物的拆分。
诱导结晶法
将外消旋混合物加热形成热饱和溶液,向其中加 入一种纯对映体的晶种,然后冷却,此时与晶种 相同的对映体将附在晶体上不断析使 之达到饱和,然后加入另一种对映体的晶种,冷却 使另一对映体析出。交替进行,可得到大量纯对映 体的结晶。
基本概念
手性化合物的标记
R,S型,苏 赤式,D,L 型 将连接手性碳的四个基团按从大到小排序,并将 最小基团放在距观察者最远的位置 (纸面后方 ), 然后观察其它三个基团的排列,如果按由大到小 顺时针方向排列则该手性碳为R 构型, 若按逆时针方向排列则为S 构型。 常用透视式和费歇尔 投影式表示。
4制药工艺学_手性药物的制备技术
pKa=3.83(25oC)
pKa=3.86(25oC)
29
特
点
结构:镜影与实物关系 内能:内能相同。 物理性质和化学性质在非手性环境中相同,在手性 环境中有区别。 旋光能力相同,旋光方向相反。 对映体的生理性质不同。
30
外消旋体
一对对映体等量混合,得到外消旋体。
外消旋体与纯对映体的物理性质 不同,旋光必然为零。
T D
cl
D-钠光源,波长为589nm T-测定温度,单位为℃ -实测的旋光度 l-样品池的长度,单位为dm c-为样品的浓度,单位为g· -1 ml
10
对映体和手性
Louis Pasteur (1822-1895.9.25)法 国微生物学家、化 学家,近代微生物 学的奠基人。1848 年得到的酒石酸盐 晶体
13
不对称碳原子
不对称碳原子: (asymmetric carbon atom) 与四个互不相同的基 团相连的碳原子叫不 对称碳原子﹡.
C*
不对称碳原子是一种手性中心, 但手性中心不一定是不对称碳原子. 有不对称碳的分子不一定是手性分子.
14
• 饱和碳原子具有四面体结构. (sp3杂化) 例: 乳酸(2-羟基丙酸CH3-CHOH-酒石酸的情况分析 HOCH2CHCHCH2OH
HO OH
COOH
(R) (S)
H H
OH OH COOH
O N O
(S)
O O NH O O N COOH COOH
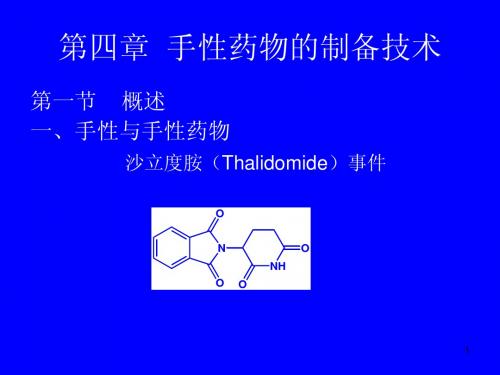
惨痛的教训使人们意识到,药物必须注意它们的 构型。从此,手性药物的开发引起了人们越来越多 5 的关注。
旋光性和手性
1 旋光性 (optical activity)
手性制药技术

手性化合物的标记
R,S型
CHFClBr分子
12
手性化合物的标记
取代基的次序规则
1)原子序数大的为优先基团;同位素中,原子量 大的为优先基团; 如:I > Br > Cl > F, D > H
2)如果与手性碳原子相连的两个原子相同,则比 较与这两个相同原子相连的其他原子的先后顺 序,把比较出的次序作为与手性碳相连的两基 团的先后顺序;
药物 普萘洛尔 噻吗洛尔
萘普生 奥美拉唑
药理作用 β-阻断作用 β-阻断作用
抗炎作用 H+,K+-ATP酶抑制剂
ER (S)/(R): 100 (S)/(R):80~90
(S)/(R):50 (S)/(R):38
24
手性药物的构型与活性
4)两个对映体具有不同的药理活性; 药物作用于不同的靶点而呈现不同的作用模式。 在临床用于不同目的。
13
手性化合物的标记 取代基的次序规则
3)对于重键化合物:
14
手性化合物的标记 取代基的次序规则
4)当两个基团有不同的取代基时,先比较在每个 基团中具有最高原子序数的取代基,依据这些 取代基的顺序来决定基团的顺序,含有优先取 代基的基团有最高的优先权; 如:-CH2OH > -CN
15
手性化合物的标记 R
7
基本概念
外消旋化合物:当同种对映体之间的晶间力小
于异种对映体的晶间力时,两种相反的对映体
总是配对地结晶,就像真正的化合物一样在晶
胞中出现,形成的是外消旋化合物。
或者说,晶体是 R 和 S 两种构型对映体分子
的有序排列,每个晶核包含等量的两种对映异
构体。
SR
8
基本概念
chapter04手性药物参考PPT

•10
三、影响手性药物生产成本的主要因素
(1)起始原料的成本 (2)拆分试剂,化学或生物催化剂的成本 (3)化学收率和产物的光学纯度 (4)反应步骤的数量 (5)拆分或不对称合成在多步合成中的位置 (6)非目标立体异构体的转化利用
•11
§4.2 外消旋体拆分
普通化学合成得到的是外消旋体,必须经过光学拆分才 能得到光学纯异构体。
(S)-amine-CAS salt
pKa
通过发酵方式大量生产的氨基酸,均为L-氨基酸。利 用非对映异构体的相互转化可将价廉易得的L-氨基酸 转化成D-氨基酸。例如以L-脯氨酸(4-38)为原料生 产D-脯氨酸(4-39)。
HO COOH
H
HO COOH
这些政策和法规极大地推动着手性药物的研究和发 展。手性药物大量增长的时代正在来临,手性技术 的发展和日趋完善,为手性工业的建立和壮大奠定 了基础。
•5
(三)、手性药物的分类
1、对映体之间有相同的药理活性,且作用强度相近 如局部麻醉药布比卡因(bupivacaine,4-8)的 两个对映体具有相近的局麻作用,然而(S)-体 还兼有收缩血管的作用,可增强局麻作用,因此 作为单一对映体药物上市。
(R)-体也有毒副作用。
O
O
H
N
O
N
H
N
O
N
OO H
OO H
(R)
(S)
(4-5)
•4
(二)、手性药物的地位与发展趋势 1992年美国FDA发布手性药物指导原则,要求所有在
美国申请上市的外消旋体新药,生产商均需提供报告 说明药物中所含对映体各自的药理作用、毒性和临床 效果。这大大增加了NCE以混旋体形式上市的难度。 而对于已经上市的混旋体药物,可以单一立体异构体 形式作为新药提出申请,并能得到专利保护。
第四章手性药物的制备技术

第三节利用前手性原料制备手性药物-、不对称合成的定义和发展(一)不对称合成Morrison和Mosher的将不对称合成定义为“一个反应, 底物分子中的非手性单元在反应剂作用下以不等量地生成立体异构产物的途径转化为手性单元。
也就是说不对称合成是这样一个过程,它将潜手性单元转化为手性单元,并产生不等量的立体异构产物。
”不对称合成分为对映体选择合成和非对映异构体选择合成两类。
对映体选择合成指潜手性底物在反应中有选择的生成一种对映体;非对映异构体选择性合成指手性底物在生成一个新的不对称中心时,选择性生成一种非对映异构体。
R -CH -CH 2+ R 1COOH例如潜手性烯桂和手性烯炷的环氧化反应: 由此可见:在不对称合成反应中,底物和反应剂结合 形成非对映过渡态,两个反应物中至少有一个手性中 心以便在反应位点上诱导不对称性。
通常不对称性是 在官能团点位上由三面体碳转化为四面体碳时产生的, 这些官能团包括拨基、烯胺、烯醇、亚胺或碳■碳不饱 和双键。
手蛙傕化剂■R'COjll+ RTOOH不对称合成的目标不仅是得到光学活性化合物,而且要达到高度的非对映选择性。
因此,一个成功的不对称合成反应的标准是:(1)具有高的对映体过量;;;;;;(2)手性试剂易于制备并能循环使用;:!(3)可以制备R和S两种构型的目标产物;(4)最好是催化型的合成反应。
(二)不对称合成的发展20世纪60年代以前,手性非均相催化反应是不对称合成研究的主流。
60年代后期发现了均相催化剂三苯麟氯化错(Rh(PPh3)3Cl) ,1971 年,Kagan和Dang发明了含有手性二麟DIOP的不对称催化氢化催化剂, DIOP-Rh⑴配合物催化a-(酰胺)丙烯酸及其酯的不对称催化氢化反应,生成相应的氨基酸衍生物,对映体过量高达80%,由此带来了不对称催化领域的突破性进展。
30年来,许多研究结果表明含有手性取代基的二麟类化合物在有机过渡金属催化的反应中是最有效的多功能配体,已在氢化、环氧化、环丙烷化、烯桂异构化、氢氧化和双烯加成等几十种反应中取得成功,其中DIOP、BINAP等手性二麟配体催化某些反应, 立体选择性达到或接近100%oPPh2PP%("-DKJPH3C ctiy/_\ph2p PPh? Ph* pPh2 (R) - PROPHOS ⑴ 5>CHIRAPHOSH3e{RRASKEWPHOS (凡&-CH1RAPH0S(RR)-NORPHOS(R&卜PYRPHOS(55)-8PPM水溶性手性麟配体的过渡金属配合物解决了均相催化剂不易貞原与回q攵的问题。
第4章手性制药技术
第四章手性制药技术4.1 概述4.1.1 手性及其标记1、手性手性(chirality)是用来表达化合物分子结构不对称性的术语,是指一个实物与其镜中的影像不能重合的性质,正如我们的左、右手互为镜像却永远不能重合。
如果化合物的实物和其镜像不能重合,则这个分子具有手性,就是手性分子。
反之,实物和镜像能重合,此物质是非手性的,无旋光性。
表示分子的立体结构关系可用透视式和费歇尔投影式(图4-1)。
透视式用实楔和虚楔,实楔代表指向纸前,虚楔代表指向纸后。
费歇尔的投影规则是:(1)把手性C原子置于纸面,用横竖两线交点代表C原子;(2)投影时竖线上的取代基在纸面的下方,横线的取代基在纸面的上方;(3)习惯上把含C原子的基团放在竖线方向,并把“最大”的取代基(编号最小的基团)放在上端。
COOH镜面费歇尔投影式透视式HOCOOHCH3HCCOOH3图4-1 乳酸的透视式(左)和费歇尔投影式(右)具有药理活性的手性化合物就是手性药物。
目前临床使用的药物相当一部分具有手性,其药理作用是通过与酶、核酸等手性大分子进行严格的手性匹配,产生分子识别而实现的。
为了使药物对人体内的各种酶、核酸有识别和选择性,就要选择与之匹配的药物的立体结构。
2、手性的种类手性化合物根据其不对称元素的不同,又有四面体中心手性、轴手性、平面手性和螺旋手性之分,它们的构型的定义方法也根据不对称元素的不同而各有不同。
(1)四面体中心手性绝大部分手性化合物是四面体中心手性的,当一个原子上连接的四个原子或基团(包括孤对电子)不同时,这个原子就是中心手心原子。
假设中心手性原子C上连接有四个不同基团x、y、z、w,其中x > y > z > w,如果从C到w的方向看,x→y→z 是顺时针方向,则这个碳的构型被定义为R;否则,就定义为S。
C x zRC xS(2) 轴手性对于四个基团围绕一根轴排列在平面之外的体系,当每对基团不同时,有可能是不对称的,这样的体系称之为轴手性体系。
手性制药技术
顺时针:R构型
逆时针:S构型
第一节 概 述
二、对映异构体与非对映异构体
1、对映异构体 互为镜像关系的立体异构体。 2、非对映异构体 具有两个或多个手性中心,并且互相不为镜像的立体异
构体。
如:化合物2,3,4-三羟基丁醛
第一节 概 述
第一节 概 述
三、消旋体
1、内消旋化合物 若两个分子内具有两个或多个手性中心,同时又有对称 面时,二者能够重合,称为内消旋化合物。
OH
(R)-DAIB:
HO
手性烯醇盐
R1
非手 性醛
R * 手性烯丙基金属试剂 OH
第二节 化学制备手性药物
4、双不对称合成反应
底物* 试剂* 产物*
如:手性底物与手性的烯醇硼试剂反应
R* MeOOC CHO
OB(C4H9)2
MeOOC BuMe2SiO R= H OH
R
+
MeOOC OH
R
R*= BuMe2SiO H
>100:1
液相色谱法
直接色谱拆分法
手性流动相添加剂法
手性固定相法 超临界色谱法 毛细管电泳法
第二节 化学制备手性药物
手性固定相法拆分
脉冲速度
手性固定相
移动相
两对映体与手性固定相的作用强 度不同,据此得以分离两对映体。
第二节 化学制备手性药物
3、动力学拆分
R kR kS P
R,P,S,Q
kR>>kS R 分离 P,S
第二节 化学制备手性药物
手性底物控制反应的实例:
O O O
1.LDA 2.H2C=CHCH 2Br
OLi N N Me
O
制药工艺学第四章.pdf
第四章手性制药技术
4.1 概述
4.2 化学法制备手性药物
4.3 生物酶法制备手性药物
1
4.1 概述
(一)基本概念
(二)手性化合物的标记
(三)手性药物的纯度表征
(四)手性药物的构型与活性
2
CHFClBr分子
R S
侧时叫苏式。
赤式苏式
4.2 化学法制备手性药物
化学法制备手性药物的方法(一)拆分法(二)不对称合成
1)直接结晶拆分法2)化学拆分法
3)柱色谱法
4)动力学拆分法1)手性源法
2)手性辅助剂法
3)手性试剂法
4)不对称催化合成法5)双不对称诱导法
26
4.3生物酶法制备手性药物
生物酶法制备手性药物的优势
1)反应条件温和;
2)催化效率高;
3)专一性强;
4)涉及的反应广泛;
5)底物的结构多样;
6)无毒可降解,环境友好。
49
思考题
4-1 手性药物单一对映体的制备方法有哪几种?分析它们的优缺点及使用范围。
4-2 化学拆分外消旋药物有几种方法?分别举例加以阐述。
4-3 不对称化学合成在手性药物制备中的原理及其应用。
4-4 举例叙述生物酶法制备手性药物的原理及其应用。
50。
《手性药物制备技术》课件
如何控制反应过程中的温度、pH值、反应时间等因素?
3 手性分离
如何有效分离左旋和右旋异构体,制备旋光性纯的手性药物?
手性分离技术
化学手性分离
利用手性反应、手性识别等方 法区分左旋和右旋异构体,分 离手性药物。
物理手性分离
利用晶态、液液萃取等方法区 分左旋和右旋异构体,分离手 性药物。
机理介绍
手性药物制备技术
手性药物是医学领域研究的热门话题,本课程将带你深入了解手性药物制备 技术。
手性药物概述
概念
手性药物是由手性分子组成 的药物,左旋和右旋异构体 在人体内的性质和作用不同。
特点
手性药物的两个异构体具有 不同的药效和副作用,需要 认真研究并纯化。
应用领域
手性药物广泛应用于治疗抑 郁症、心血管疾病等疾病, 也用于肿瘤治疗等领域。
化学手性分离和物理手性分离 的区别和原理是什么?
手性药物合成案例
手性莫西沙星制备
莫西沙星是一种广谱抗生素,制备时需纯化左旋异 构体。
手性阿莫西林制备
阿莫西林是一种常用的抗生素,制备时需纯化右旋 异构体。
未来发展趋势
新型手性合成方法
利用新型催化剂、反应条件和反应机制,发展高效、环保的手性药物制备方法。
手性药物制备方法
1
化学合成法
通过选择不同的试剂、催化剂、反应条件等,在反应过程中控制反应环境,制备 手性药物。
2
生物法
利用生物学技术,如酶工程、发酵等方法,制备手性药物。
3
分离法
通过手性分离技术,将左旋和右旋异构体分离,制备手性药物。
手性药物制备过程中的技术问题
1 反应选择性
如何实现特定的手性选择性,增大有用产物的比例?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
39
三、 对映异构体的动力学拆分
动力学拆分的特点 过程简单,生产效率高
可以通过调整转化程度提高剩余底物的对映体 过量
40
40
三、 对映异构体的动力学拆分
4. 动态动力学拆分(dynamic kinetic resolution) 利用手性底物或手性中间体的消旋化的动态平 衡,使其中一种手性底物或手性中间体转化成另 外一种立体异构体,达到最大限度得到单一手性 化合物的目的。
28
二、 结晶法拆分非对映异构体
(4)拆分剂的手性碳原子离成盐的官能团越近越 好。 (5)合成拆分剂的优点是两种对映体都能得到。 (6)拆分剂可回收,且回收方法简单易行。 (7)同等条件下应优先考虑低分子量的拆分剂, 这是因为低分子量拆分剂的生产效率高。
29
29
S = K×t =
二、 结晶法拆分非对映异构体
手性配合物催化 Sharpless不对称环氧化法
36
36
三、 对映异构体的动力学拆分
3. 对映异构体比E与动力学拆分效率 对映异构体比E 两种对映异构体假一级反应速度 常数的比值,常用于比较和衡量动力学拆分的效 率
37
37
三、 对映异构体的动力学拆分
38
对映体过量(e.e.)与转化率的关系曲线
镜像重合
手性优择( chiral preference):天然存在的手
性化合物以对映体中的一种存在的现象
手性药物(chiral drug) :以单一异构体注册为
药物
4
4
表4-1 手性药物与外消旋药物所占市场比例
药物总数 手性药物 数量 前10种最畅销药物 前30种最畅销药物 前60种最畅销药物 8 22 39 混旋体药物 非手性药物
0克% P C B A 24 100克% p AS
24
S
N E
B
M
E S
n
二、 结晶法拆分非对映异构体
从1:1的混合物得到的纯p盐的最大理论收率计算 公式。
就工业化的实际情况而言,通过一次结晶处理得 到光学纯度大于95%的产物,若化学收率大于 40%通常被认为是经济可行的拆分方法。
25
25
①一个对映体具有治疗作用,而另一个对映体仅有副作用或毒性 ;②对映体活性不同,但具有“取长补短、相辅相成”的作用; 10 ③对映体存在不同性质的活性,可开发成两个药物;④对映体具 有相反的作用。
10
二、 手性药物的制备技术
化学控制技术
前手性原料 普通化学合成 不对称合成 手性原料 手性源途径
11
外消旋体 拆分 手性产物
第三节 利用手性源制备手性药物
第四节 利用前手性原料制备手性药物
2
2
第一节 概述
一、 手性药物与生物活性 二、 手性药物的制备技术 三、 影响手性药物生产成本的主要因素
3
3
一、 手性药物与生物活性
手性(chirality): 三维物体的基本属性 手性物体(chiral object): 一个物体不能与其
根据手性催化剂的来源不同,催化的动力学拆分 34 分为生物催化和化学催化两类。
34
三、 对映异构体的动力学拆分
1.生物催化的动力学拆分
灰绿青霉菌 L-酰基转移酶 酯酶 第一个生物催化的动力学拆分 拆分氨基酸 制备手性醇和手性酸
35
35Βιβλιοθήκη 三、 对映异构体的动力学拆分
2. 化学催化的动力学拆分
7
7
一、手性药物与生物活性
沙利度胺(thalidomide, 反应停)曾是有效的镇静药 和止吐药。 致畸性由其(S)-体所引起,而其(R)-对映体具 有有效的镇静作用,即使在高剂量时也无致畸作用。
8
8
一、 手性药物与生物活性
(1) 从药效学角度看,药物与靶分子之间的作用,与 药物分子识别及手性匹配能力相关,这种特性即 手性药物的立体选择性。 (2) 药物的吸收、分布、转化和排泄过程也都存在立 体选择性。 (3) 由于药效学和药物代谢与动力学性质的不同,组 成混旋体药物的不同对映体可表现出不同的治疗 9 作用与副作用。
14
第二节 外消旋体拆分
结晶法拆分在手性药物生产中发挥重要的作用: (1) 关于对映异构体与非对映异构体的认识不断深 入和全面,提高了结晶法拆分的合理性和有效性。 (2) 结晶法既用于外消旋体的拆分,还用于提高不 对称合成或生物转化制得异构体的光学纯度。 (3) 结晶诱导的不对称转化使拆分的理论收率大于 50%,非目标异构体的转化利用提高了拆分法的经 济价值。 15
15
一、 结晶法拆分外消旋混合物 1. 外消旋混合物和外消旋化合物 外消旋混合物(conglomerate)是等量的两种对 映异构体晶体的机械混合物,虽然总体上是光学中 性的,但是每个晶核仅包含一种对映异构体。 外消旋化合物(racemic compound)的晶体是R 和S两种构型对映体分子的完美有序的排列,每个 晶核包含等量的两种对映异构体。约占所有外消旋 16 体的90%。
拆分剂(resolving agent):经典拆分法中应用 的手性化合物。最常见的是手性酸或手性碱。
21
21
二、 结晶法拆分非对映异构体
1. 结晶法拆分非对映异构体 当一个外消旋酸A与一个光学纯的碱B发生反应时, 就会形成两种非对映异构体盐的混合物。
p盐和n盐之间的溶解度差异越大,越利于结晶法拆 22 分。
12
12
第二节 外消旋体拆分
一、 结晶法拆分外消旋混合物
二、结晶法拆分非对映异构体
三、 对映异构体的动力学拆分
13
13
第二节 外消旋体拆分
外消旋体拆分技术已应用了100多年,一直是制备 光学纯异构体的重要方法之一。 拆分方法可分为三类: (1) 结晶法拆分 (2) 动力学拆分 (3) 色谱分离 14
拆分剂的拆分能力用拆分参数S表示,S等于产物 的化学收率K(收率50%时,K = 1)和光学纯度t (光学纯度100%时,t = 1)的乘积。
S = K×t = 1 2 C 0
30
Kp - Kn
30
二、 结晶法拆分非对映异构体
理论上,通过非对映异构体结晶法进行拆分,所得 目标对映体的量最多是消旋体量的一半。 若在结晶过程中留在溶液中的非对映异构体发生非 对映异构体的互变(diastereomer interconversion),整个过程构成了非对映异构 体混合物结晶诱导的不对称转化过程( crystallization-induced asymmetric transformation),理论收率可能提高到 100%。 31
拆分剂的设计比药物设计还要复杂,这是因为拆分
剂的模型必须模拟出晶体的排列形式,这在某种程 度上要远比模拟药物-受体相互作用复杂得多。
33
33
三、 对映异构体的动力学拆分
在手性试剂或催化剂作用下,利用两个对映体反 应速度不同而使其分离的过程,称为动力学拆分 (kinetic resolution)。
生物控制技术
天然物的提取分离技术 控制酶代谢技术(细胞或酶)
11
三、 影响手性药物生产成本的主要因素
(1) 起始原料的成本 (2) 拆分剂,化学或生物催化剂的成本 (3) 化学收率和产物的光学纯度 (4) 反应步骤的数量 (5) 拆分或不对称合成在多步合成中的位置 (6) 非目标立体异构体的转化利用
18
一、 结晶法拆分外消旋混合物
工业上常采用的直接结晶拆分方法: 同时结晶法(simultaneous crystallization): 将外消旋混合物的过饱和溶液,同时通过含有不 同对映体晶种的两个结晶室或两个流动床,得到 两种对映体结晶。 有择结晶法(preferential crystallization):在 单一容器中交替加入两种对映体的晶种,交替收 19 集两种对映体结晶的拆分方法。
(2) 用单一异构体代替临床应用的混旋体药物,实现 6 手性转换,也是开发新药的途径之一。
6
表4-2 2009~2013年世界新药(NCEs)上市情况分析表
2009 手性药物 混旋体药物 非手性药物 合计 10 4 6 20 2010 10 0 5 15 2011 14 1 9 24 2012 18 0 14 33 2013 15 1 9 25
38
三、 对映异构体的动力学拆分
动力学拆分通常应用于制备反应活性较低的单一 异构体。 如果某一反应E值在100以上,那么该反应转化率 达50%时,就可以得到光学纯度较高的剩余底物 异构体;E值低,则需要较高的转化率。 一般情况下,E值在20以上的动力学拆分过程有 一定实用价值;若E值大于100,可以较高收率获 39 得光学纯的单一立体异构体。
16
一、 结晶法拆分外消旋混合物
17
外消旋化合物和外消旋混合物的熔点图
17
一、 结晶法拆分外消旋混合物
2. 直接结晶法拆分外消旋混合物 直接结晶法:向一种外消旋体混合物的过饱和溶 液中,直接加入某一对映体晶种,即可得到该对 映体的结晶方法。
只有当外消旋体中的一个对映体具有最低的熔点 和最大的溶解度时,才是可利用的外消旋体混合 18 物。
31
二、 结晶法拆分非对映异构体
非对映异构体盐的不对称转化
32
32
二、 结晶法拆分非对映异构体
结晶法拆分非对映异构体的发展方向是实现拆分过
程的合理设计,也就是将拆分剂的拆分能力与分子 结构定量地联系起来。
将计算机技术与结晶法拆分技术有机地结合起来,
可望从已知的晶体结构推测拆分剂的拆分能力,并 定量地表示晶体结构与拆分能力之间的关系。
销售额 销售额 销售额 数量 数量 (亿美元) (亿美元) (亿美元)
