化学制药工艺学 第四章 手性药物
化学制药工艺学——第4章

第一节 概述 第二节 外消旋体拆分 第三节 利用前手性原料制备手性药物 第四节 利用手性源制备手性药物
1
第一节 概述
一、手性药物与生物活性 手性(chirality) 一个物体不能与其镜像重 合。 手性物体与其镜像被称为对映异构体。
2
1 手性分子的构型标记法-1
①R/S (绝对构型) • 顺时针:R1>R2>R3 R构型 • 逆时针:R3>R2>R1 S构型
4
2 手性药物
定义:以单一异构体存在并注册的药物 特点:毒副作用小、使用剂量低和疗效高
5
例1 L-多巴 (L-Dopa)
活性药物是L-多巴在多巴脱羧酶催化下经脱羧 反应形成的无手性化合物多巴胺。 多巴胺不能透过血脑屏障进入作用部位,因此 L-多巴作为多巴胺的生物前体发挥作用。 多巴脱羧酶具有立体专一性,只对L-多巴发挥 脱羧催化作用。 另外D-多巴不能被人体酶代谢,在体内蓄集, 可引起粒细胞减少等严重不良反应。
22
•由等量对映异构体组成的外消旋混合物是一种 低共熔混合物,两种对映异构体互相作用,使 得外消旋混合物的熔点低于任一对映异构体。 •只有外消旋混合物才能利用直接结晶法进行拆 分。
23
一、结晶法拆分外消旋混合物
1 结晶法拆分外消旋混合物
在一种外消旋混合物的过饱和溶液中,直接加 入某一对映体晶种,即可得到该对映体,这种结 晶方法叫做直接结晶法。
实际工作中,损失一点产率以获得高光学纯 产物是经常采用的策略。
38
例 氨基酸的拆分(生物酶催化)
动力学拆分的不利之处是需要一步额外的反 应,完成非目标立体异构体的消旋化。 在动力学拆分过程中实现非目标异构体自动 消旋化,动力学拆分的最高产率为 100% ,而 不是 50% ,那么,动力学拆分可与其它拆分方 法以及不对称合成相媲美。
第四章 手性药物的制备技术2

3.手性配体的来源及其与过渡金属的络合
不对称合成中使用的大量手性配体主要来自手性 库中的天然原料,典型的例子是酒石酸及其酯类和 金鸡纳生物碱,酒石酸在非均相镍催化的不对称氢 化和均相钛催化的不对称环氧化等反应中充当手性 配体,金鸡纳生物碱作为手性配体用于非均相钯催 化的不对称氢化和均相锇催化的烯烃的不对称二羟 基化。金鸡纳生物碱本身作为不对称催化剂,用于 一系列碱催化反应中。大部分手性二瞵配体是以相 对便宜的天然化合物原料合成的。
在不对称催化合成中,手性配体有两方面的作用, 一是加速反应,二是手性识别和对映体控制。
在不对称催化合成反应中,手性配体与过渡金属 的络合加快了反应速度,并提高了反应的立体选择性, 这种现象被称为配体促进的催化。换句话说,当过渡 金属配合物催化活性远远高于过渡金属本身时,才能 看到反应的高度立体选择性。
5.生物碱类 生物碱类分子量大、价格高。常用的金鸡纳生物
碱类仅作为拆分剂用于某些外消旋酸的拆分,结构见 图4-7。关于金鸡纳生物碱类作为不对称催化剂的手性 配体或不对称催化反应的碱性催化剂的研究很多,有 一定的应用前景。
三、手性药物合成实例
直接结晶法简单经济,但适用范围有限。 非对映体结晶法较通用,但需要大量的拆分剂和 溶剂,操作繁琐,还有非目标对映体的消旋化、拆分 剂回收套用等工序。 动力学拆分中非目标异构体的自发消旋化提高了 收率,并可通过调节转化率控制产物光学纯度,可与 不对称合成相媲美。 催化不对称合成所用的手性催化剂结构明确、种 类繁多;反应条件温和,生产效率高,已成为合成手 性药物的重要方法。
▪
树立质量法制观念、提高全员质量意 识。20.12.2020.12.20Sunday, December 20, 2020
▪
4制药工艺学_手性药物的制备技术
pKa=3.83(25oC)
pKa=3.86(25oC)
29
特
点
结构:镜影与实物关系 内能:内能相同。 物理性质和化学性质在非手性环境中相同,在手性 环境中有区别。 旋光能力相同,旋光方向相反。 对映体的生理性质不同。
30
外消旋体
一对对映体等量混合,得到外消旋体。
外消旋体与纯对映体的物理性质 不同,旋光必然为零。
T D
cl
D-钠光源,波长为589nm T-测定温度,单位为℃ -实测的旋光度 l-样品池的长度,单位为dm c-为样品的浓度,单位为g· -1 ml
10
对映体和手性
Louis Pasteur (1822-1895.9.25)法 国微生物学家、化 学家,近代微生物 学的奠基人。1848 年得到的酒石酸盐 晶体
13
不对称碳原子
不对称碳原子: (asymmetric carbon atom) 与四个互不相同的基 团相连的碳原子叫不 对称碳原子﹡.
C*
不对称碳原子是一种手性中心, 但手性中心不一定是不对称碳原子. 有不对称碳的分子不一定是手性分子.
14
• 饱和碳原子具有四面体结构. (sp3杂化) 例: 乳酸(2-羟基丙酸CH3-CHOH-酒石酸的情况分析 HOCH2CHCHCH2OH
HO OH
COOH
(R) (S)
H H
OH OH COOH
O N O
(S)
O O NH O O N COOH COOH
惨痛的教训使人们意识到,药物必须注意它们的 构型。从此,手性药物的开发引起了人们越来越多 5 的关注。
旋光性和手性
1 旋光性 (optical activity)
手性制药技术

手性化合物的标记
R,S型
CHFClBr分子
12
手性化合物的标记
取代基的次序规则
1)原子序数大的为优先基团;同位素中,原子量 大的为优先基团; 如:I > Br > Cl > F, D > H
2)如果与手性碳原子相连的两个原子相同,则比 较与这两个相同原子相连的其他原子的先后顺 序,把比较出的次序作为与手性碳相连的两基 团的先后顺序;
药物 普萘洛尔 噻吗洛尔
萘普生 奥美拉唑
药理作用 β-阻断作用 β-阻断作用
抗炎作用 H+,K+-ATP酶抑制剂
ER (S)/(R): 100 (S)/(R):80~90
(S)/(R):50 (S)/(R):38
24
手性药物的构型与活性
4)两个对映体具有不同的药理活性; 药物作用于不同的靶点而呈现不同的作用模式。 在临床用于不同目的。
13
手性化合物的标记 取代基的次序规则
3)对于重键化合物:
14
手性化合物的标记 取代基的次序规则
4)当两个基团有不同的取代基时,先比较在每个 基团中具有最高原子序数的取代基,依据这些 取代基的顺序来决定基团的顺序,含有优先取 代基的基团有最高的优先权; 如:-CH2OH > -CN
15
手性化合物的标记 R
7
基本概念
外消旋化合物:当同种对映体之间的晶间力小
于异种对映体的晶间力时,两种相反的对映体
总是配对地结晶,就像真正的化合物一样在晶
胞中出现,形成的是外消旋化合物。
或者说,晶体是 R 和 S 两种构型对映体分子
的有序排列,每个晶核包含等量的两种对映异
构体。
SR
8
基本概念
《手性药物合成》课件

生物合成
利用生物代谢途径合成手性药 物。这种方法通常比化学合成 节省能量和时间。
纳米技术合成
纳米技术可用于制备更为精确 的手性药物,包括手性纳米药 物、手性碳纳米管和手性金属 纳米粒子的制备。
化学合成
1
不对映选择性的化学反应
不对映选择性的化学反应,通常只能
对映选择性的化学反应
2
得到手性混合物,需要经过分离和纯 化。
手性药物的重要性
活性和副作用
手性药物中,左右两种异 构体的药效和副作用可能 截然相反。
区别
左旋和右旋异构体在结构 上不同,对人体的作用也 不同。
选择性
选择性是药物相对于不同 的目标蛋白具有的特异性。 选择性可能对治疗和副作 用都产生影响。
手性药物的合成方法
化学合成
通过化学反应制备手性药物, 包括转化选用对映体和合成特 定对映体两种方法。
手性药物合成
手性药物被广泛地应用于医学领域,但其合成过程充满挑战。这个课程将介 绍手性药物的基础知识、不同的合成方法和未来的发展方向。
什么是手性药物
手性分子
在手性分子中,左右两侧的结 构是成镜像对称的。
手性中心
手性中心是一个分子中,一个 原子团连接四个不同的基团的 碳原子。
左旋和右旋异构体
左旋和右旋异构体分别是一种 左旋结构和右旋结构,二者的 构型互为镜像对称。
实例
青霉素和龙胆酸是生物合成类手性药物的代表性例子。
纳米技术合成
1
手性纳米药物合成
通过纳米技术合成手性药物,减小颗
手性碳纳米管的应用
2
粒尺寸,提升溶解度。
利用手性碳纳米管对蛋白质和小分子
进行分离和拆分,提高手性分析的方
第4章手性制药技术

第四章手性制药技术4.1 概述4.1.1 手性及其标记1、手性手性(chirality)是用来表达化合物分子结构不对称性的术语,是指一个实物与其镜中的影像不能重合的性质,正如我们的左、右手互为镜像却永远不能重合。
如果化合物的实物和其镜像不能重合,则这个分子具有手性,就是手性分子。
反之,实物和镜像能重合,此物质是非手性的,无旋光性。
表示分子的立体结构关系可用透视式和费歇尔投影式(图4-1)。
透视式用实楔和虚楔,实楔代表指向纸前,虚楔代表指向纸后。
费歇尔的投影规则是:(1)把手性C原子置于纸面,用横竖两线交点代表C原子;(2)投影时竖线上的取代基在纸面的下方,横线的取代基在纸面的上方;(3)习惯上把含C原子的基团放在竖线方向,并把“最大”的取代基(编号最小的基团)放在上端。
COOH镜面费歇尔投影式透视式HOCOOHCH3HCCOOH3图4-1 乳酸的透视式(左)和费歇尔投影式(右)具有药理活性的手性化合物就是手性药物。
目前临床使用的药物相当一部分具有手性,其药理作用是通过与酶、核酸等手性大分子进行严格的手性匹配,产生分子识别而实现的。
为了使药物对人体内的各种酶、核酸有识别和选择性,就要选择与之匹配的药物的立体结构。
2、手性的种类手性化合物根据其不对称元素的不同,又有四面体中心手性、轴手性、平面手性和螺旋手性之分,它们的构型的定义方法也根据不对称元素的不同而各有不同。
(1)四面体中心手性绝大部分手性化合物是四面体中心手性的,当一个原子上连接的四个原子或基团(包括孤对电子)不同时,这个原子就是中心手心原子。
假设中心手性原子C上连接有四个不同基团x、y、z、w,其中x > y > z > w,如果从C到w的方向看,x→y→z 是顺时针方向,则这个碳的构型被定义为R;否则,就定义为S。
C x zRC xS(2) 轴手性对于四个基团围绕一根轴排列在平面之外的体系,当每对基团不同时,有可能是不对称的,这样的体系称之为轴手性体系。
制药工艺学第四章.pdf

第四章手性制药技术
4.1 概述
4.2 化学法制备手性药物
4.3 生物酶法制备手性药物
1
4.1 概述
(一)基本概念
(二)手性化合物的标记
(三)手性药物的纯度表征
(四)手性药物的构型与活性
2
CHFClBr分子
R S
侧时叫苏式。
赤式苏式
4.2 化学法制备手性药物
化学法制备手性药物的方法(一)拆分法(二)不对称合成
1)直接结晶拆分法2)化学拆分法
3)柱色谱法
4)动力学拆分法1)手性源法
2)手性辅助剂法
3)手性试剂法
4)不对称催化合成法5)双不对称诱导法
26
4.3生物酶法制备手性药物
生物酶法制备手性药物的优势
1)反应条件温和;
2)催化效率高;
3)专一性强;
4)涉及的反应广泛;
5)底物的结构多样;
6)无毒可降解,环境友好。
49
思考题
4-1 手性药物单一对映体的制备方法有哪几种?分析它们的优缺点及使用范围。
4-2 化学拆分外消旋药物有几种方法?分别举例加以阐述。
4-3 不对称化学合成在手性药物制备中的原理及其应用。
4-4 举例叙述生物酶法制备手性药物的原理及其应用。
50。
《手性药物制备技术》课件

如何控制反应过程中的温度、pH值、反应时间等因素?
3 手性分离
如何有效分离左旋和右旋异构体,制备旋光性纯的手性药物?
手性分离技术
化学手性分离
利用手性反应、手性识别等方 法区分左旋和右旋异构体,分 离手性药物。
物理手性分离
利用晶态、液液萃取等方法区 分左旋和右旋异构体,分离手 性药物。
机理介绍
手性药物制备技术
手性药物是医学领域研究的热门话题,本课程将带你深入了解手性药物制备 技术。
手性药物概述
概念
手性药物是由手性分子组成 的药物,左旋和右旋异构体 在人体内的性质和作用不同。
特点
手性药物的两个异构体具有 不同的药效和副作用,需要 认真研究并纯化。
应用领域
手性药物广泛应用于治疗抑 郁症、心血管疾病等疾病, 也用于肿瘤治疗等领域。
化学手性分离和物理手性分离 的区别和原理是什么?
手性药物合成案例
手性莫西沙星制备
莫西沙星是一种广谱抗生素,制备时需纯化左旋异 构体。
手性阿莫西林制备
阿莫西林是一种常用的抗生素,制备时需纯化右旋 异构体。
未来发展趋势
新型手性合成方法
利用新型催化剂、反应条件和反应机制,发展高效、环保的手性药物制备方法。
手性药物制备方法
1
化学合成法
通过选择不同的试剂、催化剂、反应条件等,在反应过程中控制反应环境,制备 手性药物。
2
生物法
利用生物学技术,如酶工程、发酵等方法,制备手性药物。
3
分离法
通过手性分离技术,将左旋和右旋异构体分离,制备手性药物。
手性药物制备过程中的技术问题
1 反应选择性
如何实现特定的手性选择性,增大有用产物的比例?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
∗
base R3
R1 R2
OH R3
一般都经过双键中间体
• 构型翻转
充分利用底物或手性试剂的立体结构特点和化 学反应特性进行设计和实现。 例:甲砜霉素非目标异构体的构型翻转p104.
以上是比较选择手性化合物的制备方法时 应重点考虑的因素,由于不同制备方法 都各有优缺点,所以应综合评价其可行 性和经济性。
• 3.3 对映体有不同性质的活性, 可开发成不同用途的药物
H3C H O N(CH3)2 O CH3 H CH3 N(CH3)2 O O CH3
右丙氧芬:镇痛
左丙氧芬:镇咳
• 3.4对映体具有相反的药理活性
利尿药:依托唑啉
H N O S N O CH3 OC2H5 H N O S N O CH3 OC2H5
[α]测定值 [α]绝对值
×100%
• Re和Si 关于面选择性的立体化学描述,三个取 代基的优先顺序为a>b>c,则向着观 察者以顺时针取向的面称为Re ,以逆 时针取向的面称为Si。
c b
Re Si
c b
a
a
• 顺式/反式(syn/anti)
syn/anti 用于描述两个取代基对于环上某 平面的相对构型的前缀。syn指同侧, anti指异侧。有时也用syn/anti直链化合 物中相邻取代基在同侧或异侧。
第四章 手性药物的制备技术
第一节 第二节 第三节 第四节
概述 外消旋体拆分 利用前手性原料制备手性药物 利用手性源制备手性药物
第一节 概述
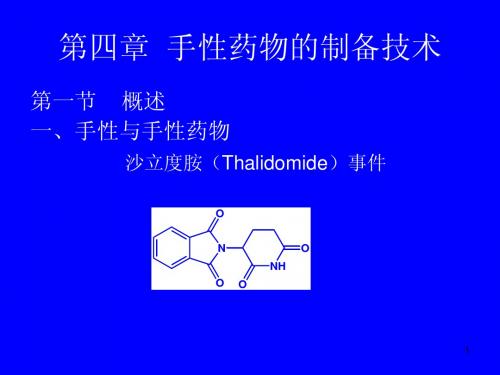
• 1961年10月,在原西德发现 数千名新生儿畸形。 “海豹肢 畸形”(或“海豹儿”)。 • “海豹儿”相继在英国、澳大利 亚、加拿大、日本,以及巴西 等国出现。 • 从1962年5月~1963年3月, 仅西德就有5 500名“海豹儿” 出生,英国8 000多例,日本 也有300多人。
B X A C syn anti Y A B A BA和B:syn B和C:anti
• 赤式/苏式(erythro/threo form)
赤式和苏式:用来表述相邻立体中心的相对构 型。赤式异构体指在Fischer投影式中相同 的或相似的取代基在垂直链的同侧;苏式异 构体则位于异侧。
A A' A A'
O H N OHH CH3
CH3O COOH
普萘洛尔 ER=130 以外消旋体上市
萘普生 ER=35 以单一异构体上市
• 3.对映体具有不同的药理活性 • 3.1一个对映体具有治疗作用,另 一个仅有副作用或毒性
治疗作用的对映体 (S)-体,镇咳 (S)-体,安眠镇痛 (-)-体,免疫抑制,抗 风湿 四咪唑 (S)-体,广谱趋虫 芬氟拉明 (S)-体,减肥 乙胺丁醇 (S,S)-体,抗结核 米安色林 (S)-体,抗忧郁 药物 羟基哌嗪 氯胺酮 青霉胺 毒副作用对映体 (R)-体,嗜睡 (R)-体,术后幻觉 (+)-体,致癌 (R)-体,呕吐 (R)-体,头晕,催眠 (R,R)-体,失明 (R)-体,细胞毒性
手,相互对称但不能重叠,呈现实物和镜像的关 系,是自然界中生物系统的基本特征。
与手性有关的术语
• D/L和d/l D或L,分子的绝对构型,与参照D-或L甘油醛的绝对构型并通过化学实验来 指定,常用于氨基酸和碳水化合物, 但最好用R和S来表示; d或l,dextro / levo, 右旋或左旋,与 该化合物的绝对构型无直接的联系。
(Unit: 100 million $)
2000 350 452 614 706 812 934 1180
Chem. & Eng. News, 2001, Vol. 79, No. 40, pp79
1330
1718
手性的定义及相关的一些规则及公式
手性
镜平面 对映体 A
对映体 B
手性:某化合物或某物质像人的左手和右
(R)-体:利尿作用
(S)-体:抗利尿作用
手性药物的分类
• 1.对映体之间有相同的药理活性,且作用 强度相近 • 2. 对映体具有相同的药理活性,但强度不 同 • 3.对映体具有不同的药理活性
• 一个对映体具有治疗作用,另一个仅有副作用或 毒性 • 对映体活性不同,但作用互补 • 对映体有不同性质的活性,可开发成不同用途的 药物 • 对映体具有相反的药理活性
•第一节 概述 •第二节 外消旋体拆分 •第三节 利用前手性原料制备手性药物 •第四节 利用手性源制备手性药物
第二节 外消旋体拆分
• 一、结晶法拆分外消旋混合物 • 二、结晶法拆分非对映异构体 • 三、对映异构体的动力学拆分 • 四、色谱分离与拆分新技术
传统方法 价廉、成熟
一、结晶法拆分外消旋混合物
两个不同构型对映 体分子之间的亲和力 大于同种构型对映体 分子之间的亲和力— —形成外消旋化合 物,约占外消旋体的 90%。
外消旋固体溶液
在某些情况下,当一个外消旋体的相 同构型的分子之间和相反构型分子之间的 亲和力相差很小时,则此外消旋体所形成 的固体,其分子的排列是混乱的。于是得 到的是外消旋固体溶液。 外消旋固体溶液与两个对映体在许多方面的 性质都是相同的。
• 3.2 对映体活性不同,但作用互补
Cl Cl HO O O O CH3 HO O Cl O Cl O CH3
(R)-茚达立酮
(S)-茚达立酮
(R)-茚达立酮具有利尿的作用,但(R)-茚达立酮 可增加血中尿酸的浓度,而(S)-茚达立酮可促进尿酸的 排泄。二则可配合使用,最佳比例为1:4~1:8。
3. 近年来,我国SFDA也对手性药物的研究
• • 开发作出了相应的规定。 目前正在开发的新药中超过一半的为单一 的立体异构体。 全球手性药物的年销售额增长率超过 20%。
全世界手性化合物需求逐年上升
2100 1800 1500 1200 900 600 300 0 1993 1994 1995 1996 1997 1998 1999 2000 2005 2008
COOH
OH
H2 HO N
H
OH CH3 OH L—丙氨酸 CH2OH
a-D-(+)-吡喃葡萄糖 -D-(+)吡喃葡萄糖 CH2OH HO H O OH OH H OH a-D-(+)-呋喃葡萄糖 H
R-S命名规则
1)遵循一定规则,把与手性中心相连的四个原子 或 原子团(a,b,c,d)确定一个次序,如 a>b>c>d。 2)将次序最小的基团(d)指向离开我们的方向 (对面),然后观察剩余基团的排列。沿最优先基 团a到b到c,如果是顺时针方向排列,则为R型 (右),反之S型(左)。
外消旋化合物和外消 旋混合物的区别: 1.熔点曲线; 外消旋化合物 2.溶解度曲线; 熔 3.外消旋化合物是两 点 种对映异构体以等量 的形式共存于晶格 中,其红外光谱,X S R 射线衍射谱及差热分 析谱与纯对映异构体 溶 解 有较大差别。而外消 度 旋混合物的晶格中只 含一种构型的分子, R S 以上各谱图与纯对映 异构体无显著差别。
出了具体的要求。手性合成及手性药物研发的重要 性和实用性已日益被人们所重视。
多巴脱羧酶的立体选择性
HO HO
H2N
HO
H COOH
多巴脱羧酶
多巴胺受体
HO Dopamine NH2
L-Dopa
×
HO HO D-Dopa H2N H
生物效应: 抗帕金森氏病
COOH
D-Dopa不能被多巴脱羧酶代谢,在人体内蓄 积还可引起粒细胞减少等副反应。
二、手性药物的制备技术
直接结晶法 结晶法拆分 非对映体结晶法 普通化学合成 前手性化合物 动力学拆分 色谱分离
化学控制
手性化合物
不对称合成
手性源合成 天然提取物
生物控制
控制酶代谢
发酵工程 酶工程
三、影响手性药物生产成本的主要因素 (可行性及经济性分析)
1. 2. 3. 4.
水 解 速 度 更 快 卤 代 烃 的
• 药物的药理作用是通过与生物体内的大分子之间严 格的手性识别和匹配而实现的 • 手性药物在体内的吸收、转运、分布、代谢、排泄 以及与受体、酶和离子通道等靶点的作用呈现出立 体选择性 • 手性药物的各单一对映体会显示出不同的药理、毒 理学特征及不同的动力学表现。 • 鉴于此,有关药物管理部门也对手性药物的申报提
• 外消旋,内消旋和外消旋化
外消旋:以外消旋体或两个对映体的等量混合 物存在的状态,以(±)表示。 内消旋化合物:分子内有两个或多个手性中心 但又有对称面,因而不能以对映体存在的化 合物。如:内消旋的酒石酸。 外消旋化:一种对映体转化为两个对映体的等 量混合物。如果转化成两个不等量的对映 体,则称为部分消旋化。
A A'
A A'
赤式
苏式
氯霉素
合霉素
一、手性药物与生物活性
(一)手性与手性药物
• 自然界中手性化合物的两个对映异构体的存在量是 不同的,如构成蛋白质的氨基酸都是L-氨基酸,而 构成多糖和核糖的单糖都是D-单糖。这种现象称为 手性优择。 • 手性优择使得作为生命活动重要基础物质的生物大 分子或其组成单元如核酸、蛋白质、酶等以及分子 机器如受体、离子通道等具有不对称的性质,这也 使得酶只催化特定手性的底物的反应,受体只与特 定手性的小分子化合物结合。 • 绝大多数内源性生物活性物质如激素、神经递质、 各种调节因子等均具手性。
起始原料的成本; 拆分试剂、化学或生物催化剂的成本; 化学收率和光学纯度; 反应的总步骤数;
(R,S)—RX + H2O Kinetic resolution (S)—RX + (R)—ROH racemization
R—
(R,S)—RX + H2O
Kinetic resolution racemization
