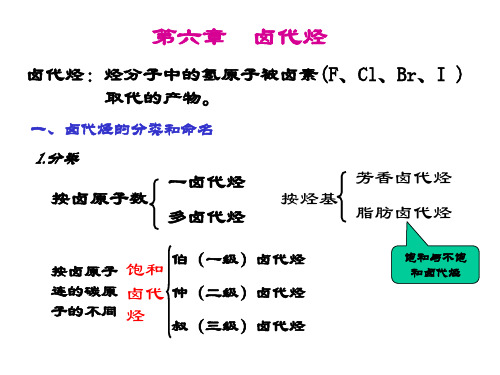
第六章卤代烃
有机化学第六章卤代烃

有机化学第六章卤代烃第六章卤代烃卤代烃是⼀种简单的烃的衍⽣物,它是烃分⼦中的⼀个或多个氢原⼦被卤原⼦(F, CL, Br, I)取代⽽⽣成的化合物。
⼀般可以⽤R-X表⽰,X代表卤原⼦。
由于卤代烃的化学性质主要有卤原⼦决定,因⽽X是卤代烃的官能团。
根据卤代烃分⼦中烃基的不同,可以将卤代烃分为卤代烷烃、卤代烯烃、卤代炔烃和卤代芳烃等。
第⼀节卤代烷烃⼀. 卤代烷烃的分类和命名(⼀) 卤代烷烃的分类1. 根据卤代烷烃分⼦中所含卤原⼦的种类,卤代烷烃分为:氟代烷:如CH3-F氯代烷:如:CH3-CL溴代烷:如:CH3-Br碘代烷:如:CH3-I2. 根据卤代烷烃分⼦中所好卤原⼦的数⽬的多少,卤代烷烃分为:⼀卤代烷:如:CH3CL, CH3-CH2-Br⼆卤代烷:如:CH2CL2,多卤代烷:CHCL33. 根据卤代烷烃分⼦中与卤原⼦直接相连的碳原⼦的类型的不同,卤代烷烃可以分为:伯卤代烷(⼀级卤代烷)R-CH2-Br仲卤代烷(⼆级卤代烷)叔卤代烷(三级卤代烷)(⼆)卤代烷烃的命名1. 普通命名使⽤范围:结构⽐较简单的卤代烷常采⽤普通命名法命名:原则:根据卤原⼦的种类和与卤原⼦直接相连的烷基命名为“某烷”,或按照烷烃的取代物命名为“卤某烷”。
如:CH 3CL甲基氯(氯甲烷)CH 3CH2Br⼄基溴(溴⼄烷)CH 3CH2CH 2CH2I正丁基碘(正碘丁烷)CH 3BrCH 3I1H 3 C -------- CH -------- CH CL1H 3 C -------- CH --------- CH 2CH 3H3C-—C------------- CL11CH 3异丁基氯仲丁基溴叔丁基氯(异氯丁烷)(仲溴丁烷)(叔氯丁烷)范围:复杂的卤代烷烃⼀般采⽤系统命名法原则:将卤原⼦作为取代基,按照烷烃的命名原则来R进⾏命名。
⽅法:1) 选择连有卤原⼦的最长碳链为主链,并根据主链所含碳原⼦的数⽬命名为“某烷”作为母体;2)将⽀链和卤原⼦均作为取代基;3) 对于主链不带⽀链的卤代烷烃,主链编号从距离卤原⼦最近的⼀端开始;4) 对于主链带⽀链的卤代烷烃,主链的编号应遵循 “最低系列规则”;5)把取代基和卤原⼦的名称按“次序规则”依次写在“某烷”之前(次序按先后顺序写),即得该卤代烷烃的名称。
第六章 卤代烃
R I > R Br > R Cl > R F
-碳电子密度增加利于 X- 形成
(二)双分子反应 SN2
1. SN2反应及其特征
δ + δ Y- + CH 2- X R
Hδδ -H [Y C X] R
活泼氢
d R-MgX +
炔基卤化 镁,新的 格氏试剂, 用于合成
因此,格式试剂的制备及其反应,均须不 含活泼氢试剂。在制备格氏试剂时,溶剂和 试剂均需干燥。
(3)在合成中的应用 • 与羰基化合物的反应,合成醇
R'
R' δ+ δ- δ- δ+ C=O R- MgX + R''
R'
etherR-C-OMgX R源自'五、卤代烃的制备
1.烷烃的卤化 仅限于结构简单、副产物少的烷烃
CH4 CH3CH3 CH3
2.烯烃加卤化氢
RCH=CH 2 + HX RCHCH 3 X
3.醇的卤化
ROH ROH ROH HX SOCl2 PX 3 RX RCl
副产物少
RX
81%
19%
Saytzeff(查依切夫)规律 在卤代烃的消去反应中,从含氢较少的β- 碳脱去氢生成的烯烃为主要产物,即主要产物为 双键碳上烃基最多的烯烃。 3. 结构与反应性 不同结构卤代烃的反应性 叔卤代烷> 仲卤代烷>伯卤代烷
B.
(CH3)3CCl + CH3ONa
×
(CH3)3COCH3
(三)与金属的作用
H C=C H
H CH3
CH3 CH3 + H2O
第六章卤代烃

R
X
R
X
R
+
X
紧密离子对
溶剂分隔离子对
在紧密离子对中R+ 和X -之间尚有一定键连,因此仍保持原构型, 亲核试剂只能从背面进攻,导致构型翻转。 在溶剂分隔离子对中,离子被溶剂隔开,如果亲核试剂介入溶剂 的位置进攻中心碳,则产物保持原构型,由亲核试剂介入溶剂的背 面进攻,就发生构型翻转。 当反应物全部离解成离子后再进行反应,就只能得到外消旋产物。
卤代烯烃命名时,以烯烃为母体,以双键位次最小编号。
CH2= CH-CH-CH -Cl 2 CH 3 Cl CH 3 4 - 甲基 -5- 氯环己烯 3- 甲基 -4- 氯 -1-丁烯 2- 甲基 -1- 氯 -3- 丁烯
×
卤代芳烃命名时,以芳烃为母体。侧链卤代芳烃命名时,卤 原子和芳环都作为取代基。 三、卤代烃的结构: 同分异构现象 卤代烃的同分异构体数目比相应的烷烃的异构体要多, 例如,一卤代烃除了碳干异构外,还有卤原子的位置异构。
反应通式如下
R-L
+ :Nu
-
R - Nu
+
L X-
-
RCH2X + 反应物 (底物)
OH
RCH2-OH + 产物
亲核试剂 进攻基团
离去基团
第三节 亲核取代反应历程(Nucleophilic substitution)
一、双分子亲核取代反应(SN2反应) 实验证明:伯卤代烷的水解反应为SN2历程。
慢
δ δ CH3 C …… Br
2
CH3
CH 3 C CH 3
+
Br
-
CH 3
过渡态(1)
第二步:
有机化学 第六章 卤代烃

+
+
H2 O ( C 2 H5 O H)
( C 2 H 5 O -)
第六章 卤代烃
36 15:49
单分子历程(E1)(续)
OH-、C2H5O-作为亲核试剂与碳正离子结合,生成醇或醚
R1 HOR C H2 R1 R2 R C H2 C+ R2 C 2H5OR C H2 C R2 O C 2H5 醚 R1 C OH 醇
E2表示。
第六章 卤代烃
34 15:49
单分子历程(E1)
首先生成碳正离子中间体:
R1 慢 R C H2 C R2 X R C H2 C+ R2 R1
+
X
下一步反应可能有两种情况: 第六章 卤代烃
35 15:49
单分子历程(E1)(续)
OH-、C2H5O-作为碱由-碳原子上夺取一个氢,生成烯
H HOR1 快 RCH C+ R2 RCH C R2 R1
9 15:49
亲核取代反应:起始于亲核试剂的进攻而发生的取代 反应(99页)※
Nu:-
+
+
R C
X R C : Nu
+
:X
亲核试剂
底物
离去基团
※三个概念:亲核试剂、底物、离去基团(99页) 第六章 卤代烃
10 15:49
①:被羟基取代:NaOH或KOH水溶液中共热, 生成醇。该反应被称为卤代烃的水解。
21 15:49
在化学动力学中,反应速率决定于反应中最慢的一步,反
应分子数则由决定反应速率的一步来衡量。上述历程
中第一步是决定反应速率的一步,而这一步决定于C-X
键的断裂,与作用试剂无关,所以叫做单分子历程。
第六章 卤代烃

醇溶液
(腈解) 腈解)
增一碳反应 NH3 AgNO3
R-COOH + NH4+ -
R-NH2 + HX(氨解) - (氨解) 胺 醇溶液 R-ONO2 + AgX ↓ 鉴别RX - 鉴别
生成的腈比反应物多一个碳原子,在有机合成中是 生成的腈比反应物多一个碳原子, 增长碳链的一个方法。 增长碳链的一个方法。 例:由C2H5Cl制备丙酸 制备丙酸
H2O
CH3 SN1 H 3C C CH CH3 CH3 OH CH3
H2O CH3 H+
重排
CH3 Br CH3 H 3C C CH CH3
H 3C
C
CH CH3
CH3
碳正离子中间体有重排成更稳定的碳正离子的趋势。 碳正离子中间体有重排成更稳定的碳正离子的趋势。
反应的特点小结: SN1反应的特点小结:
H C-Br HO H C H 过渡态 Br
HO-C
H + BrH H
构型的转 化——瓦 瓦 尔登转化
瓦尔登转化
若卤原子是连在手性碳原子上卤代烷发生S 反 若卤原子是连在手性碳原子上卤代烷发生 N2反 手性碳原子上卤代烷发生 则产物的构型和原反应物的构型相反 构型相反。 应,则产物的构型和原反应物的构型相反。
相对反 应速率: 应速率 30 1
CH3 H3C C Br CH3
0.001
反应的过渡态: 反应的过渡态:
Nu: Nu:
CH
3
CH
3
CH
3
随着α 上的CH 个数的增多,过渡态的拥挤程度增大 拥挤程度增大, 随着α-C上的CH3个数的增多,过渡态的拥挤程度增大,反 应的活化能增高 反应速率降低-活化能增高, 应的活化能增高,反应速率降低-- 空间效应 随着α 上的CH 个数的增多,由于CH 的供电子效应, 随着α-C上的CH3个数的增多,由于CH3的供电子效应,α-C --电子效应 上的负电荷增加,亲核试剂进攻α 就会越困难-上的负电荷增加,亲核试剂进攻α-C就会越困难--电子效应 一般情况,空间效应的影响大于电子效应。 一般情况,空间效应的影响大于电子效应。 反应的活性次序 的活性次序: >伯卤代烷 SN2反应的活性次序:CH3X >伯卤代烷 >仲卤代烷 >叔卤代烷
第六章 卤代烃

增大溶剂的极性,易使RX离子化,有利于SN1反应,一 般不利于SN2反应 。
多卤烃(P186~188)
取代 RCH 2CH 2-X + OH- 消除
RCH 2CH 2-OH +
X-
RCH=CH 2 + H2O + X-
3、与金属的反应——与镁的反应(格氏试剂的形成 )
RX + Mg 无水乙醚 RMgX
格氏试剂
RMgX分子中存在一个C-Mg极性键,其中带负电荷的 R是一个亲核试剂,可以跟正离子或分子中具有部分正电荷 的部位发生反应,因此格氏试剂的性质相当活泼。
CH2
仲卤烷
CH3 CH3CH2CCH3 Br KOH 乙醇
81%
H3CHC
19%
C(CH 3)2 + H3CH2CC CH3 CH2
叔卤烷
71%
29%
卤烷脱卤化氢时,主要产物双键上烃基最多的烯烃 ――札依采夫规则 SN与E是一对竞争反应,两者同时发生,究竟哪一种占 优势,则与分子结构及反应条件有关。
过渡态
Δ E2 E Δ E1 中间体
反应物 生成物
ΔE1>ΔE2 第一步 反应较慢,为决定 反应速度的一步
反应进程
⑷结论: 从ΔE1的大小可预测反应的难易程度,能生成稳定中间体 ――正碳离子的卤烷,其亲核取代反应有利于按SN1方式进行。 2、双分子亲核取代反应(SN2)
⑴反应历程
H HO + H H C Br 慢 H C H 过渡态 H 快 HO C H H + Br H
⑵按所含卤原子个数
二卤代烃
多卤代烃
第一卤代烃(伯)
RCH 2X R2CHX R3CX
⑶按卤素所连碳原子
第二卤代烃(仲)
第六章 卤代烃

(2)较复杂的卤代烃按系统命名法命名。
以相应的烃为母体,将卤原子作为取代基。命名 时,需在母体烃名称前标上卤原子及支链等取代基的 位置、数目和名称。取代基按“次序规则”排列。
① 卤代烷 一般以连有卤原子的最长碳链作为主链,卤原子 与其它支链作为取代基,碳原子编号一般从离取代基 较近一端开始(取代基按“次序规则”排列)。
=k[(CH3)3C-Br ]
⑵ SN1反应的立体化学
反应过程中产生一个碳正离子(sp2杂化-平面形)中间体, 如当该碳原子为手性碳原子时(反应前),且反应物卤代烃为旋 光异构体中的某一个构型时,由于从平面两侧成键机会均等,则 反应产物将为外消旋体,即50%的产物发生了构型的转化(外消 旋化)。
快
说明:
① 在化学动力学中,反应速率决定于反应中最慢 的一步,反应分子数则由决定反应速率的一步 来衡量。所以上述历程中第一步是决定反应速 率的一步,而这一步只决定于C-X键的断裂, 与作用试剂无关,故叫做单分子历程。
② SN1反应的特征是分步进行的反应,并有活泼中 间体碳正离子的生成。
第一步:
第二步:
亲核取代反应(SN):由亲核试剂进攻引起的取代反应。 亲核试剂( :Nu-):负离子或带未共有电子对的分子。 离去基团(X-):反应中离去的基团。 底物(卤代烷):反应中受试剂进攻的物质。 a-碳原子:与官能团直接相连的碳(其次为β-碳原子、γ-碳原 子)。
卤代烷可以和许多试剂发生亲核取代反应,如与 水、醇钠、氰化钠、氨等反应:
R
H2 C
R X R CH X
仲卤代烃
R R C X R
叔卤代烃
伯卤代烃
注:这三类卤代烃的反应活性有差异。
2.命名
(1)结构简单的卤代烃采用普通命名法,按与卤原子相 连的烃基的名称来命名,称为卤代某烃或某基卤。
医学生物化学第六章 卤代烃

R(H)
CH
CHCH2X
C2H5OH
AgX
CH2X
AgNO3
C2H5OH
结论:烯丙型、苄基型卤代烃
AgX
X
性质活泼,室温下即可与 AgNO3 醇溶液作用产生卤化银 沉淀
3. 孤立型不饱和卤代烃
在加热条件下与AgNO3 醇溶液作用 产生卤化银沉淀
苄基氯
对硝基苄基氯
2,3,3 -三甲 基-1-碘丁烷
(CH3)3CCH(CH3)CH2I
CHI3
碘仿
Cl
3一氯环己烯
第二节
卤代烃的物理性质
1. 形态:bp、mp比相应的烷烃高 。
2. 溶解性:不溶于水,能与烃混溶,并能溶解 许多非极性及弱极性有机物。
3. 密度: R-Cl < R-Br < R-I。多氯代烃、溴代 烃和碘代烃比重大于1。
2. 消除反应机制 E1 — 单分子 消除反应 反应机制:
B
-
H
2 1
H C X
慢
C
C
C
+
+ X
-
H
快
C
C
+
C
C
+
HB
决速步骤(第一步)的反应速率只与卤代烷浓度有关,
故为单分子反应。
E2 — 双分子 消除反应 反应机制:
B
-
H
2 1
B C X
慢
-
H
2
C
[
C
C X
]
快
C
C + HB + X
-
消除反应活性:叔卤代烷 > 仲卤代烷 > 伯卤代烷 三、消除反应与取代反应的竞争性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
查依采夫规则
当2-溴丁烷在强碱条件下发生消除反应时,Br的 位有2个,消除时要去掉哪个-H呢?经测定
KOH / 醇
Br
19%
+
81%
通过大量实验,俄国化学家查依采夫(Saytzeff) 总结出卤烃发生消除反应的经验规律。
查依采夫规则:
卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
卤代烃
烃中氢原子被卤原子取代后生成的产物,称为卤 代烃。卤原子是其官能团,通常是氯、溴、碘, 氟的性质极活泼,用常规方法不能制得,故不在 本章重点讨论之列。卤代烃的性质较为活泼,可 转化成多种有机化合物,在工业、农业和医药方 面都有广泛的用途。
目录
7.1 7.2 7.3 7.4 7.5 7.6 7.7
RCl + R'Cl + Na
R R + R R' + R' R'
7.4.3.1 与金属Mg的反应
卤代烷与金属镁反应,生成有机镁化合物RMgX, 由法国化学家格利雅(Grignard)在1900年发现, 于是RMgX就被人们命名为格利雅试剂,简称格氏 试剂。 RMgX的性质非常活泼,可与水、CO2、羰 基化合物反应,通常需保存在无水乙醚中。
7.1 卤烃的分类及命名
2. 按卤原子所连碳原子种类分为:
① 伯卤烃(一级卤代烃) RCH2-X ② 仲卤烃(二级卤代烃) R2CH-X ③ 叔卤烃(三级卤代烃) R3C-X
① 饱和卤烃(卤代烷) C2H5Cl ② 不饱和卤烃(卤代烯、卤代炔)CH2=CHCl ③ 卤代芳烃 Ar-X
3. 按分子中是否有不饱和键可分为:
CH3CH2Cl + NaCN CH3CH2CN + NaCl
3. 卤烃的氰解
若分子中有多个卤原子,则可全部被取代。如:
ClCH2CH2CH2CH2Cl
NaCN
NCCH2CH2CH2CH2CN
在卤烃中,伯卤烃、苄基卤代烃、烯丙基卤代烃 制腈的产率很高,而仲卤烃和叔卤烃在碱(氰化 钠、氰化钾)的作用下易发生消除反应,生成烯 烃,此反应一般不用仲、叔卤烃反应。 产物腈还可转化为胺、酰胺和羧酸,在合成纤维 工业中有重要的用途。
7.4.2 消除反应
1. 消除反应:
CH2 X
有机物分子中脱去一个小分子 (如X2 、HX、H2O等)后,生成不饱和化合物的 反应。用E(Elimination)表示。
CH H
R
KOH / 醇
R
CH
CH2
+ HX
在发生消除时,总是在位的H与X一起脱去,故又 叫-消除反应。 反应活性: 叔卤烃>仲卤烃>伯卤烃
3
CH3 CH3 C CH3 Cl
CH3 C CH3
+
CH3ONa
OCH3
CH3
CH3 C CH2
3. 卤烃的氰解
卤代烷与氰化钠或氰化钾的醇溶液中反应,生成腈。
RX + NaCN RCN + NaX
此反应是非常有用的一个反应,可以增加分子中碳 链的长度,每次可以增加一个碳原子,是增长碳链 的反应之一。如: 氯乙烷与氰化钠在乙醇溶液中加热反应生成丙腈。
卤代烷可以和某些活泼金属(如Li、Na、 Mg、Al等)反应,生成金属原子与碳原子 直接相连的一类化合物 —— 金属有机化合 物,目前,此部分已发展为一门独立的分 支学科,成为化学研究领域的一个热点, 对科研、生产、生活都有极重要的意义。 如齐格勒-纳塔催化剂:R3Al-TiCl4 格氏试剂:RMgX 二茂铁、铁卟啉、叶绿素、血红素及许多 维生素、激素都含有金属有机化合物。
7.1 卤烃的分类及命名
7.1.2 命名
1. 简单卤烃的命名,用习惯命名法。
结构简单的卤烃,可以根据与卤原子所连烃基 的名称来命名,叫做“烃基卤”。如:
CH3
CH3I 甲基碘
Cl
CH2 CH Br 乙烯基溴
CH Cl
CH3
CH2 Cl
Br
异丙基氯
烯丙基氯
丙烯基溴
苄氯 苯甲基氯
7.1 卤烃的分类及命名
7.4 卤烃的化学性质
卤代烃最典型、最具代表性的反应有两类: 亲核取代反应和消除反应,另外,卤代烷 还可与活泼金属反应生成金属有机化合物。 7.4.1 亲核取代反应 7.4.2 消除反应 7.4.3 与活泼金属的反应
7.4.1 亲核取代反应
亲核取代反应可用下面反应式表示
R X + Nu
6. 卤烃与炔化钠的反应
卤烃与炔钠的反应是制备高级炔烃的方法之一。
RX + R C
CNa
R C
C R +
NaX
反应中的卤代烃使用伯卤烃效果最好,原因是:
仲卤烃、叔卤烃在强碱的作用下易生成消除产物。
此反应是另一个可以增长碳链的反应,得到的产物 是高级炔烃。此反应在炔烃的性质中已经学过,在 此不再详述。
1. 卤烃的水解
卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提 高醇的产率,常加入强碱(氢氧化钠),使生成的 HX与强碱反应,可加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
RMgX
+
HO H HC CR
RH +
XMgOH RC CMgX
反应定量进行,根据生成甲烷的体积,可测定化 合物中活泼氢的数目,是目前最重要的有机试剂。
7.5.1 亲核取代反应机理
人们在研究卤烷水解时的反应速度时发现,卤代 烷水解大致可分为两类: ① 一类只与卤代烷有关,而与试剂浓度无关。 ② 一类则与卤代烷及试剂都有关。 这表明卤代烷水解至少有两种不同的反应机理:
7.3 卤烃的物理性质
4. 溶解度 虽然卤代烃分子具有极性,但所 有的卤烃都难溶于水,主要是因为它们与水 不能形成氢键。卤代烷易溶于醇、醚、烃等 有机溶剂,其本身亦是良好的有机溶剂。如 氯仿、四氯化碳等。 5. 特点 很多卤烷有麻醉性,如氯仿、氯乙 烷等,运动场,快速止血止痛的药剂就是氯 乙烷,将其液化后封装,使用时呈雾状喷出、 气化,冷却止血,麻醉止痛。卤烃不易燃烧, 并具有灭火性,一般卤烃的蒸气有毒,尤其 是含偶数碳的氟烷有剧毒。
5. 卤烃与AgNO3的反应
卤代烃与硝酸银的醇溶液发生亲核取代反应,生成 硝酸酯和卤化银沉淀。可用于卤烃的定性鉴别。
RX + AgNO3
RONO2 + AgX
反应产物中有AgX↓产生,据沉淀出现的时间及颜色 可确定分子中是何种卤原子。
不同卤原子的反应活性: RI>RBr>RCl 烃基的反应活性: 烯丙基卤、苄基卤>叔卤烃>仲卤烃>伯卤烃
1. 单分子亲核取代反应机理 (SN1) 2. 双分子亲核取代反应机理 (SN2)
1. 单分子亲核取代反应机理(SN1)
CH3
CH3 C Br CH3
KOH / H2O
CH3
CH3 C OH CH3
叔丁基溴在碱性条件下水解成叔丁醇时,经测定 该反应的水解速度只与叔丁基溴有关,而与氢氧 化钾(OH-)的浓度无关。该反应的速率只决定于 卤代烷分子中C-X键断裂的难易程度。 其水解反应速率方程为: k [ (CH3)3CBr ] 经过研究认为,该反应水解反应是分两步进行的: 第一步是卤代烷分子中的C-X键断裂; 第二步才是羟基加到烷基上完成反应过程。
R Nu + X
-
亲核试剂(Nucleophile) 通常用 :Nu 表示。 取代反应(Substitution) 通常用 S 表示。 亲核取代反应 就用 SN 表示。 卤烃常见的亲核取代反应有: 1. 水解 2. 醇解 3. 氰解 4. 氨解 5. 与硝酸银的反应 6. 与炔化钠的反应
苯一氯甲烷
3-氯-5-溴苯甲醇
命名练习
CH3 CH CH2 CH2Cl
3-苯基-1-氯丁烷
H Cl Cl C C Cl Cl Cl DDT
2,2-二对氯苯基-1,1,1-三氯乙烷
最低系列,三个氯
7.3 卤烃的物理性质
1. 状态 氯甲烷、溴甲烷、氯乙烷及氟烷 为气态,其它卤烃为液体,含碳数更多的 是固体。 2. 熔沸点 卤代烷的分子量和分子极性比 相应烷烃高,因此其沸点也相应增高。同 碳数的卤烃中。碘代烃的沸点最高,RBr、 RCl、RF依次降低,且直链卤烃的沸点高 于同碳数的带支链的卤烃。 3. 相对密度 一般情况下,氟烷、一氯烷 的d<1,其它卤烃的d>1。
2. 系统命名法
较复杂的卤烃命名采用系统命名法。其命名 原则与相应的烃命名类似,只是将卤原子视 为取代基。如: 卤代烷烃的命名与烷烃的命名规则相同。 卤代烯烃的命名与烯烃的命名规则相同。 卤代炔烃的命名与炔烃的命名规则相同。 卤代芳烃的命名与芳烃的命名规则相同。
卤烃的命名练习
CH3 CH CH CH2CH3 Cl CH3
SN1反应的两个步骤
CH3 CH3 C Br CH3
慢
CH3
CH3 C CH3
