第六章卤代烃
第六章 卤代烃
R I > R Br > R Cl > R F
-碳电子密度增加利于 X- 形成
(二)双分子反应 SN2
1. SN2反应及其特征
δ + δ Y- + CH 2- X R
Hδδ -H [Y C X] R
活泼氢
d R-MgX +
炔基卤化 镁,新的 格氏试剂, 用于合成
因此,格式试剂的制备及其反应,均须不 含活泼氢试剂。在制备格氏试剂时,溶剂和 试剂均需干燥。
(3)在合成中的应用 • 与羰基化合物的反应,合成醇
R'
R' δ+ δ- δ- δ+ C=O R- MgX + R''
R'
etherR-C-OMgX R源自'五、卤代烃的制备
1.烷烃的卤化 仅限于结构简单、副产物少的烷烃
CH4 CH3CH3 CH3
2.烯烃加卤化氢
RCH=CH 2 + HX RCHCH 3 X
3.醇的卤化
ROH ROH ROH HX SOCl2 PX 3 RX RCl
副产物少
RX
81%
19%
Saytzeff(查依切夫)规律 在卤代烃的消去反应中,从含氢较少的β- 碳脱去氢生成的烯烃为主要产物,即主要产物为 双键碳上烃基最多的烯烃。 3. 结构与反应性 不同结构卤代烃的反应性 叔卤代烷> 仲卤代烷>伯卤代烷
B.
(CH3)3CCl + CH3ONa
×
(CH3)3COCH3
(三)与金属的作用
H C=C H
H CH3
CH3 CH3 + H2O
第六章卤代烃

R
X
R
X
R
+
X
紧密离子对
溶剂分隔离子对
在紧密离子对中R+ 和X -之间尚有一定键连,因此仍保持原构型, 亲核试剂只能从背面进攻,导致构型翻转。 在溶剂分隔离子对中,离子被溶剂隔开,如果亲核试剂介入溶剂 的位置进攻中心碳,则产物保持原构型,由亲核试剂介入溶剂的背 面进攻,就发生构型翻转。 当反应物全部离解成离子后再进行反应,就只能得到外消旋产物。
卤代烯烃命名时,以烯烃为母体,以双键位次最小编号。
CH2= CH-CH-CH -Cl 2 CH 3 Cl CH 3 4 - 甲基 -5- 氯环己烯 3- 甲基 -4- 氯 -1-丁烯 2- 甲基 -1- 氯 -3- 丁烯
×
卤代芳烃命名时,以芳烃为母体。侧链卤代芳烃命名时,卤 原子和芳环都作为取代基。 三、卤代烃的结构: 同分异构现象 卤代烃的同分异构体数目比相应的烷烃的异构体要多, 例如,一卤代烃除了碳干异构外,还有卤原子的位置异构。
反应通式如下
R-L
+ :Nu
-
R - Nu
+
L X-
-
RCH2X + 反应物 (底物)
OH
RCH2-OH + 产物
亲核试剂 进攻基团
离去基团
第三节 亲核取代反应历程(Nucleophilic substitution)
一、双分子亲核取代反应(SN2反应) 实验证明:伯卤代烷的水解反应为SN2历程。
慢
δ δ CH3 C …… Br
2
CH3
CH 3 C CH 3
+
Br
-
CH 3
过渡态(1)
第二步:
有机化学 第六章 卤代烃

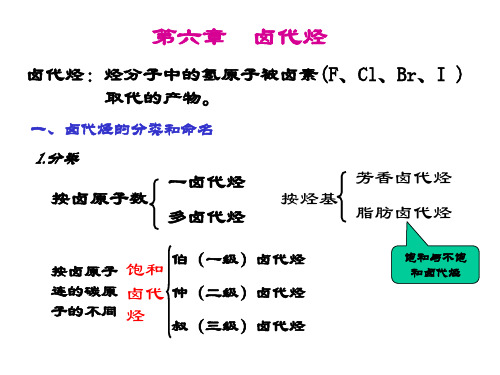
第六章卤代烃卤代烃是一种简单的烃的衍生物,它是烃分子中的一个或多个氢原子被卤原子(F, CL, Br,I)取代而生成的化合物。
一般可以用R-X表示,X代表卤原子。
由于卤代烃的化学性质主要有卤原子决定,因而X是卤代烃的官能团。
根据卤代烃分子中烃基的不同,可以将卤代烃分为卤代烷烃、卤代烯烃、卤代炔烃和卤代芳烃等。
第一节卤代烷烃一.卤代烷烃的分类和命名(一)卤代烷烃的分类1.根据卤代烷烃分子中所含卤原子的种类,卤代烷烃分为:氟代烷:如CH3-F氯代烷:如:CH3-CL溴代烷:如:CH3-Br碘代烷:如:CH3-I2.根据卤代烷烃分子中所好卤原子的数目的多少,卤代烷烃分为:一卤代烷:如:CH3CL, CH3-CH2-Br二卤代烷:如:CH2CL2,多卤代烷:CHCL33. 根据卤代烷烃分子中与卤原子直接相连的碳原子的类型的不同,卤代烷烃可以分为: 伯卤代烷(一级卤代烷) R-CH 2-Br 仲卤代烷(二级卤代烷)CHXR 1R 2叔卤代烷(三级卤代烷)CXR 1R 2R 3(二) 卤代烷烃的命名 1. 普通命名使用范围:结构比较简单的卤代烷常采用普通命名法 命名:原则:根据卤原子的种类和与卤原子直接相连的烷基 命名为“某烷”,或按照烷烃的取代物命名为“卤某烷”。
如:CH 3CL CH 3CH 2Br CH 3CH 2CH 2CH 2I CH CH 3H 3CCH 2CLCHBrH 3CCH 2CH 3CCH 3H 3CCH 3CL甲基氯(氯甲烷)乙基溴(溴乙烷)正丁基碘(正碘丁烷)异丁基氯(异氯丁烷)仲丁基溴(仲溴丁烷)叔丁基氯(叔氯丁烷)2. 系统命名法范围:复杂的卤代烷烃一般采用系统命名法。
原则:将卤原子作为取代基,按照烷烃的命名原则来进行命名。
方法: 1)选择连有卤原子的最长碳链为主链,并根据主链所含碳原子的数目命名为“某烷”作为母体; 2) 将支链和卤原子均作为取代基;3)对于主链不带支链的卤代烷烃,主链编号从距离卤原子最近的一端开始; 4)对于主链带支链的卤代烷烃,主链的编号应遵循“最低系列规则”; 5)把取代基和卤原子的名称按“次序规则”依次写在“某烷”之前(次序按先后顺序写),即得该卤代烷烃的名称。
第六章 卤代烃

醇溶液
(腈解) 腈解)
增一碳反应 NH3 AgNO3
R-COOH + NH4+ -
R-NH2 + HX(氨解) - (氨解) 胺 醇溶液 R-ONO2 + AgX ↓ 鉴别RX - 鉴别
生成的腈比反应物多一个碳原子,在有机合成中是 生成的腈比反应物多一个碳原子, 增长碳链的一个方法。 增长碳链的一个方法。 例:由C2H5Cl制备丙酸 制备丙酸
H2O
CH3 SN1 H 3C C CH CH3 CH3 OH CH3
H2O CH3 H+
重排
CH3 Br CH3 H 3C C CH CH3
H 3C
C
CH CH3
CH3
碳正离子中间体有重排成更稳定的碳正离子的趋势。 碳正离子中间体有重排成更稳定的碳正离子的趋势。
反应的特点小结: SN1反应的特点小结:
H C-Br HO H C H 过渡态 Br
HO-C
H + BrH H
构型的转 化——瓦 瓦 尔登转化
瓦尔登转化
若卤原子是连在手性碳原子上卤代烷发生S 反 若卤原子是连在手性碳原子上卤代烷发生 N2反 手性碳原子上卤代烷发生 则产物的构型和原反应物的构型相反 构型相反。 应,则产物的构型和原反应物的构型相反。
相对反 应速率: 应速率 30 1
CH3 H3C C Br CH3
0.001
反应的过渡态: 反应的过渡态:
Nu: Nu:
CH
3
CH
3
CH
3
随着α 上的CH 个数的增多,过渡态的拥挤程度增大 拥挤程度增大, 随着α-C上的CH3个数的增多,过渡态的拥挤程度增大,反 应的活化能增高 反应速率降低-活化能增高, 应的活化能增高,反应速率降低-- 空间效应 随着α 上的CH 个数的增多,由于CH 的供电子效应, 随着α-C上的CH3个数的增多,由于CH3的供电子效应,α-C --电子效应 上的负电荷增加,亲核试剂进攻α 就会越困难-上的负电荷增加,亲核试剂进攻α-C就会越困难--电子效应 一般情况,空间效应的影响大于电子效应。 一般情况,空间效应的影响大于电子效应。 反应的活性次序 的活性次序: >伯卤代烷 SN2反应的活性次序:CH3X >伯卤代烷 >仲卤代烷 >叔卤代烷
第六章 卤代烃

增大溶剂的极性,易使RX离子化,有利于SN1反应,一 般不利于SN2反应 。
多卤烃(P186~188)
取代 RCH 2CH 2-X + OH- 消除
RCH 2CH 2-OH +
X-
RCH=CH 2 + H2O + X-
3、与金属的反应——与镁的反应(格氏试剂的形成 )
RX + Mg 无水乙醚 RMgX
格氏试剂
RMgX分子中存在一个C-Mg极性键,其中带负电荷的 R是一个亲核试剂,可以跟正离子或分子中具有部分正电荷 的部位发生反应,因此格氏试剂的性质相当活泼。
CH2
仲卤烷
CH3 CH3CH2CCH3 Br KOH 乙醇
81%
H3CHC
19%
C(CH 3)2 + H3CH2CC CH3 CH2
叔卤烷
71%
29%
卤烷脱卤化氢时,主要产物双键上烃基最多的烯烃 ――札依采夫规则 SN与E是一对竞争反应,两者同时发生,究竟哪一种占 优势,则与分子结构及反应条件有关。
过渡态
Δ E2 E Δ E1 中间体
反应物 生成物
ΔE1>ΔE2 第一步 反应较慢,为决定 反应速度的一步
反应进程
⑷结论: 从ΔE1的大小可预测反应的难易程度,能生成稳定中间体 ――正碳离子的卤烷,其亲核取代反应有利于按SN1方式进行。 2、双分子亲核取代反应(SN2)
⑴反应历程
H HO + H H C Br 慢 H C H 过渡态 H 快 HO C H H + Br H
⑵按所含卤原子个数
二卤代烃
多卤代烃
第一卤代烃(伯)
RCH 2X R2CHX R3CX
⑶按卤素所连碳原子
第二卤代烃(仲)
第六章 卤代烃

(2)较复杂的卤代烃按系统命名法命名。
以相应的烃为母体,将卤原子作为取代基。命名 时,需在母体烃名称前标上卤原子及支链等取代基的 位置、数目和名称。取代基按“次序规则”排列。
① 卤代烷 一般以连有卤原子的最长碳链作为主链,卤原子 与其它支链作为取代基,碳原子编号一般从离取代基 较近一端开始(取代基按“次序规则”排列)。
=k[(CH3)3C-Br ]
⑵ SN1反应的立体化学
反应过程中产生一个碳正离子(sp2杂化-平面形)中间体, 如当该碳原子为手性碳原子时(反应前),且反应物卤代烃为旋 光异构体中的某一个构型时,由于从平面两侧成键机会均等,则 反应产物将为外消旋体,即50%的产物发生了构型的转化(外消 旋化)。
快
说明:
① 在化学动力学中,反应速率决定于反应中最慢 的一步,反应分子数则由决定反应速率的一步 来衡量。所以上述历程中第一步是决定反应速 率的一步,而这一步只决定于C-X键的断裂, 与作用试剂无关,故叫做单分子历程。
② SN1反应的特征是分步进行的反应,并有活泼中 间体碳正离子的生成。
第一步:
第二步:
亲核取代反应(SN):由亲核试剂进攻引起的取代反应。 亲核试剂( :Nu-):负离子或带未共有电子对的分子。 离去基团(X-):反应中离去的基团。 底物(卤代烷):反应中受试剂进攻的物质。 a-碳原子:与官能团直接相连的碳(其次为β-碳原子、γ-碳原 子)。
卤代烷可以和许多试剂发生亲核取代反应,如与 水、醇钠、氰化钠、氨等反应:
R
H2 C
R X R CH X
仲卤代烃
R R C X R
叔卤代烃
伯卤代烃
注:这三类卤代烃的反应活性有差异。
2.命名
(1)结构简单的卤代烃采用普通命名法,按与卤原子相 连的烃基的名称来命名,称为卤代某烃或某基卤。
医学生物化学第六章 卤代烃
R(H)
CH
CHCH2X
C2H5OH
AgX
CH2X
AgNO3
C2H5OH
结论:烯丙型、苄基型卤代烃
AgX
X
性质活泼,室温下即可与 AgNO3 醇溶液作用产生卤化银 沉淀
3. 孤立型不饱和卤代烃
在加热条件下与AgNO3 醇溶液作用 产生卤化银沉淀
苄基氯
对硝基苄基氯
2,3,3 -三甲 基-1-碘丁烷
(CH3)3CCH(CH3)CH2I
CHI3
碘仿
Cl
3一氯环己烯
第二节
卤代烃的物理性质
1. 形态:bp、mp比相应的烷烃高 。
2. 溶解性:不溶于水,能与烃混溶,并能溶解 许多非极性及弱极性有机物。
3. 密度: R-Cl < R-Br < R-I。多氯代烃、溴代 烃和碘代烃比重大于1。
2. 消除反应机制 E1 — 单分子 消除反应 反应机制:
B
-
H
2 1
H C X
慢
C
C
C
+
+ X
-
H
快
C
C
+
C
C
+
HB
决速步骤(第一步)的反应速率只与卤代烷浓度有关,
故为单分子反应。
E2 — 双分子 消除反应 反应机制:
B
-
H
2 1
B C X
慢
-
H
2
C
[
C
C X
]
快
C
C + HB + X
-
消除反应活性:叔卤代烷 > 仲卤代烷 > 伯卤代烷 三、消除反应与取代反应的竞争性
第六章卤代烃
CH3CCH3
NaI
CH3CHCH2CN
I
NaBr
丙酮的存在使生成的NaCl、NaBr不溶,使平 衡向右移动。
(5)与硝酸银-乙醇溶液作用 反应是典型SN1历程,生成沉淀的速度是: R3CX >R2CHX> RCH2X
可用于鉴别不同结构的卤烷。
RX
C2H5OH
AgNO3
RONO2
AgX
用化学方法鉴别: 1—溴丁烯 3—溴丁烯 4—溴丁烯 2—溴丁烷
(c)烯丙基型和苄基型卤代烃对SN反应的影响
++
CH2 CH CH2
++
CH2
由于这些碳正离子相当稳定,所以相应卤代烃 SN1反应活性很高。(比叔卤烷活性高)
SN2反应活性也很高(比伯卤烷活性高),因为 共轭而使过渡态活化能降低。
X δH
CCC H
Nu δ-
(d)乙烯型卤化物对SN反应活性的影响
支链增多对消除有利。 2、试剂碱性和亲核性 碱性强对消除有利,对E2更有利;(KOH/醇、
RONa/醇、RONa/DMSO)。 亲核性强对取代有利,SN2更有利,试剂体积
增大对消除有利。
3、反应温度
提高反应温度对取代、消除都有利,对消除更 有利。
六、有机氟化物
1、有机氟化物的命名
(1)含有一个或少数氟原子的化合物可采用系统 命名法命名。
C2H5OH/H2O
回流
CH3CH2CH2OH
NaBr
采用乙醇/水溶液作为溶剂,主要是增加卤烷在
反应体系中的溶解度。
此法常用于高级醇的制备。
(2)被氰基取代得到腈 伯卤烷与氰化钠在乙醇-水溶液中反应,可以得
第六章 卤代烃(讲授)
2、消除反应 、 卤代烃在碱的醇溶液中加热, 卤代烃在碱的醇溶液中加热 , 能由分子中脱去 一分子卤化氢而形成烯烃。 一分子卤化氢而形成烯烃。
CH3CHCH3 Br CH3 CH3CCH3 Br C2H5ONa C2H5OH, C2H5ONa C2H5OH, CH3CH=CH2 + NaBr + C2H5OH CH3 CH3C=CH2 + NaBr + C2H5OH
对于烃基相同而卤原子不同,则其活性顺序为: 对于烃基相同而卤原子不同,则其活性顺序为:
RI
键能 极化度
RBr
RCl
RF
亲核取代活性
六、亲核取代反应的立体化学
1、SN2的立体化学 、 的立体化学 亲核取代反应按双分子历程进行时, 亲核取代反应按双分子历程进行时,被认为亲 核试剂是从离去基团的背面进攻中心碳原子的。 核试剂是从离去基团的背面进攻中心碳原子的。
3、与金属的反应 、 卤代烃能与多种金属如Mg、 、 等反应生成 卤代烃能与多种金属如 、Li、Al等反应生成 金属有机化合物, 如卤代烷与镁在无水乙醚中作用, 金属有机化合物 , 如卤代烷与镁在无水乙醚中作用 , 则生成格氏试剂。 则生成格氏试剂。
R-X + Mg
无水乙醚
RMgX
格氏试剂的C-Mg键的极性很强,所以非常活泼, 格氏试剂的 键的极性很强,所以非常活泼, 键的极性很强 能被许多含活泼氢的物质,如水、 能被许多含活泼氢的物质 , 如水、 醇 、酸、 氨以至炔 氢等分解为烃。 氢等分解为烃。
2
2 3 2
3
3-溴丙烯 溴丙烯
3-甲基 氯-1-己烯 甲基-5-氯 己烯 甲基
芳烃为母体] ③、卤代芳烃,[芳烃为母体 卤代芳烃, 芳烃为母体
大学有机化学-卤代烃
+ -
(CH3)3C Br
过渡态A
(CH3)3C+ + Br叔丁基正碳离子
(CH3)3C+ + OH- 快
+ -
(CH3)3C OH 过渡态B
(CH3)3C OH
上页 下页 首页
CH3
CH3 CH3
第六章 卤代烃
第二节 化学性质 (一、亲核取代)
CH3
B-Br r-
HO-
CH3
C +
CH3
CH3
OH CH3
CH3 构型保持产物
CH3
HO
CH3
CH3 构型翻转产物
上页 下页 首页
第六章 卤代烃
第二节 化学性质 (一、亲核取代)
SN1历程的特点:
(1) 反应分两步进行
(2) 在反应中有活性中间体——碳正 离子生成;有可能发生重排反应
(3) 为1级反应 ν=k[R—X]
(4) 构型外消旋化
上页 下页 首页
SN2反应活性 CH3X > 1o RX > 2o RX > 3o RX
叔卤代烷一般不按SN2机制进行。
上页 下页 首页
第六章 卤代烃
第二节 化学性质 (一、亲核取代)
对SN1的影响:烷基的供电子效应及C—H σ-p 超共轭效应有利于稳定碳正离子中间体。有利于稳
定正碳离子的因素就有利于SN1(电子效应)。
一些试剂的亲核能力比较:
HS- > RS- > CN- > I- > NH3 > OH> Br- > OR- > Cl- > F- > H2O
上页 下页 首页
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CH2CHCH 2CHCH 2CH3 CH3 Cl
CH3CHCH 2Br CH3
2-甲基-1-溴丙烷 1-bromo-2-methylpropane
CH3CH=CHCH 2Cl
1-氯-2-丁烯 1-chloro-2-butene
1
7
2
6
3
5
4
4
5
3
6
2
7
1
H3C CH CH CH2 CH3 I
NH4Cl
CH3CH2CHNH2+NH4Br CH3
H2NCH2CH2NH2+ 2NH4Cl
乙二胺
(4)氰解:-X原子被氰基-CN取代生 成腈(R-CN)
RX + NaCN
乙醇溶液
Δ CH3CH2Cl + NaCN CH3CH2CH2OH
HX
RCN + NaX
乙醇溶液
Δ
[H]
CH3CH2CN + NaCl
产物
C
R1 R2 R3
单分子亲核取代反应的机理
由于反应速率由慢的第一步控制,其速率只与叔卤 代烃的浓度有关,而与亲核试剂的浓度无关。这种 反应历程称为单分子反应历程, 用 SN1表示。
SN1的特点:
*1、SN1反应是一个两步反应,有两个过渡态,一
个中间体,中间体为碳正离子。
*2、由于亲核试剂可以从碳正离子两侧进攻,而且
(7)炔烃的生成
R-C
C
+ R'-Br
R-C
C R' + Br
只适用于 R-CH2- X 否则,易消除。
亲核取代反应(Nucleophilic-substitution):
由亲核试剂首先进攻电子云密度较低的中 心碳原子而引起的取代反应,用SN表示。
亲核试剂(nucleophilic reagent):
H2O
CH3OH + NaBr
V=k[CH3Br][OH-]
CH3CH2 HO + H C Br CH3
HO H
δ-
CH3CH2 C
Br CH3
δ-
CH2CH3 HO C + Br H CH3
过渡态
SN2的特点:
构型翻转
*1、SN2是一步反应过程,只有一个过渡态。过渡态的结构
特点是:中心碳是sp2杂化,它与五个基团相连,与中心碳 相连又未参与反应的三个基团与中心碳原子处于同一平面上, 进入基团和离去基团处在与该平面垂直并通过中心碳原子的 一条直线上,分别与中心碳的p轨道结合。
CH CH CH3 Cl CH3
2,6-二甲基-3-氯-5-碘庚烷 5 4 3 2 1
CH3CHCHCHCH2Cl Cl CH3
2-甲基-4-苯基-1,3-二氯戊烷
二、卤代烃的物理性质
难溶于水,比水重。 二氯甲烷、三氯甲烷是常用的溶剂。
三、 卤代烃的化学性质
卤代烃的化学性质是由于卤原子的存在所引起的。
CH3
Br CH3CHCHCHCH Cl CH3
2-甲基-4-氯-3-溴戊烷
3
3-bromo-2-chloro-4-methylpentane
Cl CH3CCH 2CHCH 3 CH3 Cl
4-甲基-2,2-二氯戊烷 2,2-dichloro-4-methylpentane
3-甲基-5-氯庚烷 3-chloro-5-methylheptane
- Br-
CH3 + CH3CCH 2 重排 CH3
一级碳正离子
CH3 CH3-C CH 2
断裂
CH3 形成
C2H5O
-
CH3 CH3CCH 2CH3 OC2H5 (2) 重排产物
+ CH3CCH 2CH3 CH3
三级碳正离子 -H
+
CH3 CH3C=CHCH 3 (3) 消除产物
小结:SN1 与SN2的异同
RX + AgNO3
NaO H H2O C2H5O H
RONO2 + AgX
AgNO3
ROH + NaX
AgNO3 C2H5O H
CH3CH2CH2CH2I CH3CH2CH2CH2Br CH3CH2CH2CH2Cl
AgI (最快) AgBr (较快) + CH 3CH2CH2CH2ONO2 AgCl (最慢)
*2、SN1:由于亲核试剂可以从碳正离子两侧进攻,而且
机会相等,因此若与卤素相连的碳是不对称碳,则可以 得到构型保持和构型翻转两种产物。 SN2:当中心碳原子为不对称碳原子时,产物构型翻 转。
*3、SN1:是一个一级动力学控制的反应。又是单分
子反应。 SN2:在大多数情况下,是一个二级动力学控制 的反应。
大小,空间位阻愈小,愈易按SN2反应。
空间位阻大小的顺序: CH3X <伯卤代烷<仲~<叔~
不同卤代烷SN2反应的相对速度:
CH3X >伯卤代烷>仲~ >叔~
(2)单分子亲核取代反应(SN1)
(CH3)3C Br + OH (CH3)3C OH + Br v = k[(CH3)3CBr]
实验表明,叔丁基溴在碱性水溶液中发生水解反应, 反应速度只与叔丁基溴的浓度成正比,而与碱的浓度 无关。这种只有一种反应物参与了决定反应速度关键 步骤的亲核取代反应称为SN1 反应。
第六章 卤代烃
halohydrocarbons
烃分子中的一个或多个氢原子被卤素取代而 生成的化合物称卤代烃(halohydrocarbon),
简称卤烃。
卤原子(F、 Cl、 Br、 I)是卤代烃的官能 团。 结构通式为:R—X
一、卤代烃的分类和命名
1、分类 氟代烃 氯代烃 溴代烃 碘代烃
(1)根据卤原子数的多少 一卤代烃
*1、SN1:是一个两步反应,有两个过渡态,一个中间体,
中间体为碳正离子。 SN2:是一步反应过程,只有一个过渡态。过渡态的 结构特点是:中心碳是sp2杂化,它与五个基团相连,与 中心碳相连又未参与反应的三个基团与中心碳原子处于同 一平面上,进入基团和离去基团处在与该平面垂直并通过 中心碳原子的一条直线上,分别与中心碳的p轨道结合。
H3C
Br
CH2 Cl
CH2 CH2 I
多卤代烃
(2)按烃基的不同
饱和卤烃 RCH2X
不饱和卤烃 RCH=CHX
卤代芳烃 Ar-X
(3)根据卤素所连的碳原子不同类型 伯卤烃 RCH2X 仲卤烃 R2CHX 叔卤烃 R3CX
(4)根据卤素与双键的相对位置 卤代乙烯型 卤代烯丙型
RCH=CHX
X
CH2 X
Br
CH3 Br
烯丙基溴 溴苯
CH2Cl
邻-溴甲苯(2-溴甲苯) 2-bromotoluene
氯化苄 benzyl chloride
卤素英文名称和字头: Fluorine Chlorine Bromine Iodine fluorochlorobromoiodo-
(2)系统命名法
选连有卤原子在内的最长碳链作为主链,卤原 子作为取代基,按照烷烃或烯烃的命名法编号, 支链和不同取代基按立体化学中的“次序规则” 排列,优先次序高的基团后列出: 1 2 3 CH2=CCH2Cl 2-甲基-3-氯丙烯 3 2 1
R-X
NaO R’ NH3 AgNO3
(1)水解:-X原子被-OH取代生成醇
R X
NaOH H2O
R OH + NaX
NaOH
CH3CH2CH2Br + H2O
CH3CH2CH2OH + NaBr
(2)醇解:-X原子被-OR取代生成醚
R1X + R2ONa
R2OH
Δ
R1OR2 + NaX
CH3CH2CH2Cl+CH3CH2ONa CH3CH2CH2OCH2CH3+NaCl
反应用途:因有卤化银沉淀产生, 这反应可作为卤代烃的鉴别反应。 卤代烃反应活性: 烯丙基卤>叔卤代烃>仲~>伯~
(6)卤离子交换反应:在丙酮中,氯代烷 和溴代烷分别与碘化钠反应,生成碘代烷。
CH3CHCH3+ NaI Br
丙酮 25℃
CH3CHCH3 + NaBr I
氯化钠或和溴化 钠难溶于丙酮
氯代烷和溴代烷的活性次序是:1º >3º >2º
RX
Nu
_
(3)被氨基(-NH2)取代——氨解
(4)被氰基(-CN)取代——氰解
(5)被硝酸根(-ONO2)取代——与
硝酸银的醇溶液作用
RNu
X
_
卤代烷的亲核取代反应
NaO H/H O 2 NaC N/醇
R-OH(醇类)+NaX R-CN(腈类)+NaX R-OR’(醚类)+NaX R-NH 2(胺类)+HX R-ONO 2(硝酸酯)+AgX
*4、在SN1 反应中,伴随有重排和消除产物。SN2
反应则没有重排和消除反应。
卤代烷与氢氧化钠在水-乙醇溶液中进行 反应,从下列现象判断哪些属于SN2历程, 哪些属于SN1历程?
*2、当中心碳原子为不对称碳原子时,产物构型翻转。 *3、该反应在大多数情况下,是一个二级动力学控制的反应。
C6H13 H3C H (R)-(-)-2-溴辛烷 [α ] D =-34.6° C Br NaOH HO C
C6H13 CH3 H (S)-(+)-2-辛醇 [α ]D =+9.9°
SN2反应的难易取决于卤代烷的空间位阻的
烃基相同,卤原子不同
不同卤代烷的活性次序为: RI>RBr>RCl
