2018年高考化学经典模拟题专题汇编:电解质溶液
高考化学三轮冲刺重要考点专题专练卷电解质溶液(2021年整理)

2018年高考化学三轮冲刺重要考点专题专练卷电解质溶液编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年高考化学三轮冲刺重要考点专题专练卷电解质溶液)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年高考化学三轮冲刺重要考点专题专练卷电解质溶液的全部内容。
电解质溶液1.T℃时,AgCl在水溶液中的沉淀溶解平衡曲线如图所示。
在该温度下,下列说法中不正确的是()A.a点和b点对应的K sp(AgCl)相等B.K sp(AgCl)=2×10-10C.可采取蒸发溶剂的方法使溶液从c点变到b点D.已知K sp(AgI)=8。
5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中错误!=4.25×10-7解析:C2.已知:25 ℃时,K sp[Mg(OH)2]=5.61×10-12,K sp[MgF2]=7.42×10-11。
下列说法正确的是()A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大C.25 ℃时,Mg(OH)2固体在20 mL 0。
01 mol·L-1氨水中的K sp比在20 mL 0.01 mol·L-1NH4Cl 溶液中的K sp小D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2解析:选B3.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体.下列指定溶液中微粒浓度大小比较正确的是()A.原NH4HCO3溶液中:c(HCO-3)〉c(NH+4)〉c(OH-)>c(H+)B.原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO2-3)-c(NH3·H2O)+c(H2CO3)C.析出晶体后的溶液中:c(Cl-)=c(NH+4)、c(Na+)=c(HCO-3)D.析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO错误!)+c(NH3·H2O)解析:BD4.室温下,下列溶液中微粒的物质的量浓度关系正确的是()A.新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-)B.pH=8的NaClO2溶液中:c(Na+)〉c(ClO错误!)>c(OH-)〉c(H+)C.0.1 mol·L-1HCl溶液与0。
2018年高考真题电解质溶液汇编
2018年高考真题电解质溶液汇编(2018.全国I卷27)(4)Na2S2O5可用作食品的抗氧化剂。
在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗10.00mL。
滴定反应的离子方程式为__________________________________________,g L-⋅(以SO2计)。
该样品中Na2S2O5的残留量为_______1(2018.全国II卷28)(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L–1KMnO4溶液滴定至终点。
滴定终点的现象是________________________________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
加稀H2SO4酸化,用c mol·L–1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。
该晶体中铁的质量分数的表达式为________________。
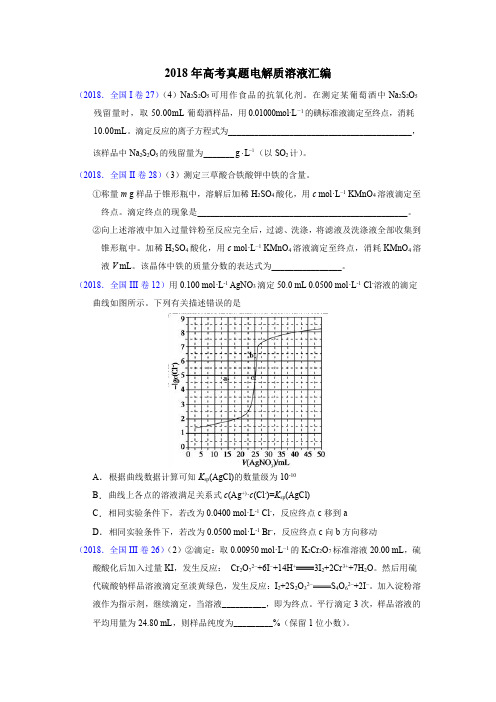
(2018.全国III卷12)用0.100mol·L-1AgNO3滴定50.0mL0.0500mol·L-1Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400mol·L-1Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500mol·L-1Br-,反应终点c向b方向移动(2018.全国III卷26)(2)②滴定:取0.00950mol·L−1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72−+6I−+14H+3I2+2Cr3++7H2O。
全国高考题电解质溶液专项试题荟萃

全国高考题电解质溶液专项试题荟萃1.下列说法正确的是(A)酸式盐的溶液一定显碱性(B)只要酸与碱的摩尔浓度和体积分别相等,它们反应后的溶液就呈中性(C)纯水呈中性是因为水中氢离子摩尔浓度和氢氧根离子摩尔浓度相等(D)碳酸溶液中氢离子摩尔浓度是碳酸根离子摩尔浓度的二倍2.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化不大....的是:(A)自来水(B)0.5摩/升盐酸(C)0.5摩/升醋酸(D)0.5摩/升氯化铵溶液3.把80毫升NaOH溶液加入到120毫升盐酸中,所得溶液的pH值为2.如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是(A)0.5摩/升(B)0.1摩/升(C)0.05摩/升(D)1摩/升4. 已知一种[H+]=1×10-3摩/升的酸和一种[OH-]=1×10-3摩/升的碱溶液等体积混和后溶液呈酸性.其原因可能是(A)浓的强酸和稀的强碱溶液反应(B)浓的弱酸和稀的强碱溶液反应(C)等浓度的强酸和弱碱溶液反应(D)生成了一种强酸弱碱盐5.将0.2摩/升CH3COOK与0.1摩/升盐酸等体积混和后,溶液中下列微粒的摩尔浓度的关系正确的是(A)[CH3COO-]=[Cl-]=[H+]>[CH3COOH] (B)[CH3COO-]=[Cl-]>[CH3COOH]>[H+](C)[CH3COO-]>[Cl-]>[H+]>[CH3COOH](D)[CH3COO-]>[Cl-]>[CH3COOH]>[H+]6.在80℃时,纯水的pH值小于7,为什么?7.用pH试纸测定某无色溶液的pH值时,规范的操作是(A)将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较(B)将溶液倒在pH试纸上,跟标准比色卡比较(C)用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较(D)在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较8.若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是(A)SO42-(B)S2-(C)CO32-(D)Cl-9.等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于(A)2.0 (B)12.3 (C)1.7 (D)12.010.摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是[ ](A)HX、HZ、HY(B)HZ、HY、HX(C)HX、HY、HZ(D)HY、HZ、HX11.在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是[ ]12.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的[ ].(A)NaOH(固体)(B)H2O(C)NH4Cl(固体)(D)CH3COONa(固体)13.在氯化铵溶液中,下列关系式正确的是[ ].(A)[Cl-]>[NH4+]>[H+]>[OH-] (B)[NH4+]>[Cl-]>[H+]>[OH-](C)[Cl-]= [NH4+]> [H+]=[OH-] (D)[NH4+]= [Cl-]> [H+]>[OH-]14.100毫升0.1摩/升醋酸与50毫升0.2摩/升氢氧化钠溶液混和,在所得溶液中( )A.[Na+]>[CH3COO-]>[OH-]>[H+]B.[Na+]>[CH3COO-]>[H+]>[OH-]C.[Na+]>[CH3COO-]>[H+]=[OH-]D.[Na+]=[CH3COO-]>[OH-]>[H+]15.100毫升6摩/升H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量.可向反应物中加入适量的( )A.碳酸钠(固体)B.水C.硫酸钾溶液D.硫酸铵(固体)16.甲酸的下列性质中,可以证明它是弱电解质的是( )A.1摩/升甲酸溶液的pH值约为2B.甲酸能与水以任何比例互溶C.10毫升1摩/升甲酸恰好与10毫升1摩/升NaOH溶液完全反应D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱17.下列物质能跟镁反应并生成氢气的是( )A.甲酸溶液B.氢氧化钠溶液C.氯化铵溶液D.碳酸钠溶液18.C1、C2、α1、α2,pH1,pH2分别表示2种一元弱酸的摩尔浓度、电离度和溶液的pH值如果已知pH1<pH2,且α1>α2,则C1和C2的关系()A.C1>C2B.C1=C2C.C1<C2D.无法确定19.相同温度下的0.1摩/升和0.01摩/升CH3COOH溶液中,CH3COOH的电离度( ).(A)大于(B)小于(C)等于(D)不能肯定20.把三氯化铁溶液蒸干灼烧,最后得到的固体产物是( ).(A)无水三氯化铁(B)氢氧化铁(C)氧化亚铁(D)三氧化二铁21.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(固) Ca 2++2OH -。
2018年高考化学二轮复习 专题七 电解质溶液提升卷导练 新人教版

专题七电解质溶液提升卷时间:60分钟满分:85分可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32一、选择题:本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2017·太原检测)某温度下,c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中c(H +)随溶液体积变化的曲线如图所示。
据图判断下列说法正确的是( )A.Ⅱ表示的是盐酸变化曲线B.b点溶液的导电性比c点溶液的导电性强C.水的离子积K w的大小关系:a>bD.溶液的体积越大,酸的pH越小2.(导学号:71224088)(2017·南阳模拟)常温时,1 mol·L-1的HClO2和1 mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液加水稀释至体积V,所得曲线如图所示。
下列说法正确的是( )A.酸性:HClO2>HMnO4B.稀释前分别用1 mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2 C.当稀释至pH均为3时,溶液中c(ClO-2)>c(MnO-4)D.在0≤pH≤5时,HMnO4溶液满足:pH=lg VV03.(导学号:71224089)室温下,用0.10 mol·L-1的盐酸分别滴定20.00 mL 浓度均为0.10 mol·L-1的氢氧化钠溶液和氨水,滴定过程中溶液的pH随加入盐酸的体积[V(HCl)]的变化关系如图所示。
下列说法错误的是( )A.曲线Ⅱ表示用盐酸滴定氨水,当V(HCl)=20 mL时:c(Cl-)>c(NH+4)>c(H+)>c(OH-) B.当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH+4)=c(Cl-)C.滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有c(Cl-)>c(Na+)>c(H+)>c(OH-) D.当滴定氨水消耗的V(HCl)=10 mL时,有2[c(OH-)-c(H+)]=c(NH+4)-c(NH3·H2O)4.(2017·海南模拟)常温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1NaOH 溶液,其pH变化曲线如图所示(忽略温度变化)。
2018高考化学分类解析-电解质溶液 精品

2018高考化学分类解析-电解质溶液1.(2018海南卷)下列离子方程式中,属于水解反应的是()A.HCOOH+H2O HCOO-+ H3O+B.CO2+H2O HCO3-+ H+C.CO32-+ H2O HCO3-+ OH-D.HS-+ H2O S2-+ H3O+2.(2018上海卷)常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④3.(2018上海卷)某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。
则下列描述正确的是( ) A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和4.(2018全国Ⅰ卷)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是()A.c(OH)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)5.(2018广东卷)已知Ag2SO4的K W为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO23-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。
若t1时刻在上述体系中加入100mL.0.020mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO23-浓度随时间变化关系的是()6.(2018广东卷)盐酸、醋酸和碳酸氢钠是生活中常见的物质。
高考二轮复习高考化学 专题七 电解质溶液(可编辑word)

专题七电解质溶液一、选择题(本题包括7小题,每小题6分,共42分)1.(2018广东茂名二模)已知部分弱酸的电离平衡常数如下表:下列叙述错误的是( )A.NaCN溶液中通入少量CO2发生的离子反应为CN-+H2O+CO2HCN+HC-B.等体积、等物质的量浓度的HCOONa溶液和NaCN溶液中所含阴离子总数前者大于后者C.等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HC-)>c(C-)>c(H+)D.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者2.(2018内蒙古呼和浩特二模)亚氯酸钠是一种高效氧化剂、漂白剂,主要用于亚麻、纸浆等漂白。
NaClO2在溶液中可生成ClO2、HClO2、Cl-、Cl-等含氯微粒,经测定,25 ℃时各组分含量随pH变化情况如图所示(部分没有画出)。
则下列分析不正确的是( ) A.亚氯酸钠在碱性条件下较稳定B.25 ℃时,HClO2的电离平衡常数Ka=10-6C.25 ℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(Cl-)+c(OH-)D.若浓度均为0.1 mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(Cl-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)3.(2018内蒙古鄂伦春二模)向一定浓度的Ba(OH)2溶液中滴加某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示。
下列说法中正确的是( )A.ab段反应的离子方程式为Ba2++OH-+H++S-BaSO4↓+H2OB.b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡C.bc段之间存在某点,其溶液中:c(N)=2c(S-)D.c点溶液中:c(H+)+c(N)=c(NH3·H2O)+c(OH-)4.(2018广东揭阳二模)常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )A.HX、HY均为一元强酸B.溶液中水的电离程度:a=b<cC.常温下,HY的电离常数Ka约为1.0×10-4D.c点溶液:c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)5.(2018山东济南一模)常温下,将11.65 g BaSO4粉末置于盛有250 mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )A.相同温度时,Ksp (BaSO4)>Ksp(BaCO3)B.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大C.若使0.05 mol BaSO4全部转化为BaCO3,至少要加入1.25 mol Na2CO3D.0.05 mol BaSO 4恰好全部转化为BaCO 3时,溶液中离子浓度大小为c(C -)>c(S -)>c(OH -)>c(Ba 2+)6.(2018四川攀枝花第三次联考)已知:25 ℃,NH 3·H 2O 电离平衡常数K=1.76×10-5。
2018届高考化学二轮复习测试专题(九)电解质溶液

2018届高考化学二轮复习测试专题含答案专题突破练(九) 电解质溶液1.[2017·全国卷Ⅰ,28(1)]下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( ) A .氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B .氢硫酸的导电能力低于相同浓度的亚硫酸 C .0.10 mol·L-1的氢硫酸和亚硫酸的pH 分别为4.5和2.1D .氢硫酸的还原性强于亚硫酸解析: A 能:氢硫酸不能与NaHCO 3溶液反应,说明酸性:H 2S <H 2CO 3;而亚硫酸能,则说明酸性:H 2SO 3>H 2CO 3。
B 能:相同浓度时导电能力越强,说明溶液中离子浓度越大,酸的电离程度越大,故可判断酸性:H 2S <H 2SO 3。
C 能:pH :H 2S >H 2SO 3,则c (H +):H 2S <H 2SO 3,故酸性:H 2S <H 2SO 3。
D 不能:还原性的强弱与酸的强弱无必然联系。
答案: D2.(2017·河南信阳、三门峡联考)次磷酸(H 3PO 2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。
下列有关说法正确的是( )A .H 3PO 2溶于水的电离方程式为:H 3PO 2H ++H 2PO -2B .H 3PO 2与过量NaOH 溶液反应的离子方程式为:H 3PO 2+3OH -===PO 3-2+3H 2O C .将H 3PO 2溶液加入到酸性高锰酸钾溶液中,H 3PO 2的还原产物为H 3PO 4 D .用惰性电极电解NaH 2PO 2溶液,其阳极反应式为:2H 2O -4e -===O 2↑+4H +解析: H 3PO 2是一元弱酸,溶于水的电离方程式为H 3PO 2H ++H 2PO -2,故A 正确;H 3PO 2与过量NaOH 溶液反应的离子方程式为H 3PO 2+OH -===H 2PO -2+H 2O ,故B 错误;将H 3PO 2溶液加入到酸性高锰酸钾溶液中,H 3PO 2的氧化产物为H 3PO 4,故C 错误;用惰性电极电解NaH 2PO 2溶液,其阳极反应式为2H 2O +H 2PO -2-4e -===H 3PO 4+3H +,故D 错误。
最新-北京市各区县2018届高三化学一模试题分类汇编4

2018北京市区县一模试题分类汇编5电解质溶液2018-朝阳一模-8. 下列解释事实的化学方程式或离子方程式不正确...的是A. 用食醋除去暖水瓶中的水垢: 2CH3COOH + CaCO3═ Ca2+ + 2CH3COO- + CO2↑+ H2OB. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS): Cu2+ + SO42- + PbS ═ CuS + PbSO4C. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4 + Na2CO3═ CaCO3↓+ Na2SO4D. 在燃煤时加入适量石灰石,可减少SO2的排放: 2CaCO3 + O2 + 2SO2 ═ 2CaSO3 + 2CO2 2018-朝阳一模-11. 常温时,在X的溶液中先滴入几滴酚酞溶液后变红,再加入等体积的Y 的溶液,混合溶液一定显红色的是(溶液物质的量浓度均为0.01 mol/L)2018-东城一模-11. 常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:下列判断不正确...的是A. c1一定大于0.2 mol·L-1B. HA的电离方程式是HA H+ + A-C. 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+)D. 乙反应后溶液中:c(Na+) < c(HA) + c(A-)2018-东城一模-12. 强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同)。
已知:① 甲溶液分别与其它三种溶液混合,均产生白色沉淀;② 0.1mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO...的3溶液,产生不溶于稀HNO3的白色沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解质溶液1.常温下,电解质溶液中的下列关系式不正确的是A.已知A-+H2B(过量)==HA+HB-,则结合H+的能力:HB-<A-<B2-B.在0.1mol·L-1的氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时,c(NH4+)+c(NH3 •H2O)=0.05 mol·L-1C.将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数ka=9 2100.02 c-⨯-D.将0.2 mol·L-1盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)> c(K+)> c(Al3+)> c(H+)> c(OH-)【答案】A2.10mL浓度均为0.1 mol/L的三种溶液:①HF溶液;②KOH溶液;③KF溶液。
下列说法正确的是A.①和②混合后,酸碱恰好中和,溶液呈中性B.①和③中均有c(F-)+c(HF) =0.1mol/LC.①和③混合:c(F-)+c(OH-) =c(H+) +c(HF) D.由水电离出来的c(OH-):②>③>①【答案】B3.下列电解质溶液中的关系正确的是A.NH4Cl溶液中:c2(H+)wB.Ca(OH)2溶液中:c(Ca2+)·c2(OH-)≥K sp[Ca(OH)2]C.CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)D.由NaAlO2和NaOH 组成的混合溶液中:c(Na+)>c(AlO2-)+c(OH- )【答案】C4.常温下,下列说法正确的是A.AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同B.在0.1mol/L的NaOH溶液中,由水电离出的c(H+)C.将NH4Cl溶液从20 ℃升温至30 ℃,溶液中增大D.CH3COONa和盐酸两溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH)【答案】A5.常温下,下列说法不正确的是()A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸B.相同pH 的CH3COONa、NaOH 和Na2CO3三种溶液:c(NaOH)<c(Na2CO3) <c(CH3COONa)C.0.1 mol/L NaHA 溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)D.已知H2CO3的电离常数K1=4.4×10-7、K2=4.7×10-11,HClO的电离常数K=2.9×10-8,若向新制氯水中加入足量Na2CO3固体,则c(HClO)增大【答案】D6.下列说法中不正确的是A.等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-) +c(HCO3-)B.pH相同的盐酸和醋酸,分别用蒸馏水稀释至原体积的m倍和n倍稀释后两溶液pH 相等,则m>nC.常温下,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数为10-7D.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图。
由图可知:Ksp[Fe(OH)3]2]【答案】B7.电解质溶液电导率越大导电能力越强.常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温K b[(CH3)2NH]=1.6×10-4。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A.曲线②代表滴定二甲胺溶液的曲线B.A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]C.D点溶液中:2c(Na+)=3c(Cl-)D.在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点【答案】B8.室温下,用0.1 mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积关系如图(P为曲线I上的点,M、N为曲线II上的点),下列说法不正确的是A.HX为弱酸B.将P点和N点的溶液混合,所得溶液呈酸性C.M 点c(HX)-c(X-)>c(OH-)-c(H+)D.向N点溶液中通入HCl至PH = 7:c(Na+)>c(HX)=c(Cl-)>c(X-)【答案】B9.下列关于电解质溶液的叙述正确的是A.常温下电离常数为Ka的酸HA溶液中c(H+mol·L-1B.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大C.0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合2c(H+)-2 c(OH-)=c(CH3COO-)- c(CH3COOH)D.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)【答案】C10.常温下,对下列电解质溶液的有关说法正确的是A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH一定等于7B.在NaHCO3溶液中,c(CO32-)>c(HCO3-)C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小D.将pH相等的CH3COONa和NaOH溶液稀释相同倍数,CH3COONa溶液的pH较小【答案】C11.25℃,下列有关电解质溶液的说法正确的是A.向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF)B.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大C.向氨水中加入NH4Cl固体,溶液中()()()324c NH?·cH O HNH++增大D.将CH3COONa溶液从20℃升温至30℃,溶液中()()()-3-3ccCH COOCH COOH OHg增大【答案】A12.室温下,将x mol·L-1NaOH溶液滴入10 mL 0.1 mol·L-1的醋酸溶液中,溶液的温度和pH变化如图所示。
下列说法正确的是A.x=0.1B.滴定过程中应该选择甲基橙作为指示剂C.c点对应的溶液中水的电离程度最大D.b点对应的溶液中c(H+)=(OH-)=C(Na+)=c(CH3COO-)【答案】C13.T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。
下列说法正确的是A.T℃时,CH3COOH电离平衡常数K a=1.0×10-3B.M点对应的NaOH溶液体积为20.0 mLC.N点与Q点所示溶液中水的电离程度:N>QD.N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)【答案】C14.溶液的酸碱性可用酸度(AG)表示AG=lg()()c Hc OH+-。
室温下,某化学兴趣小组的同学用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定结果如下图所示,下列有关叙述中正确的是A.水的电离程度A点小于B点B.A点时加入的氢氧化钠溶液的体积恰好为20.00 mLC.室温0.01 mol·L-1醋酸溶液的电离平衡常数K a=l0-5D.若B点时所加NaOH溶液的体积为40.00 mL,此时溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)【答案】C15.硫的多种化合物在工业中有重要应用。
(1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式______________。
(2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为_____________②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为_________________。
③Na2SO4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为____________。
(3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。
①写出Na2SO5参加反应的离子方程式_______________________。
②处理后的废水中Cr3+的物质的量浓度为____________________。
(4)氢硫酸和亚硫酸是两种弱酸,回答下列问题①0.1mol/L H2SO4与0.2mol/L H2S溶液等体积混合,所得溶液中S2-浓度为_____mol/L。
(已知氢硫酸Ka1=1.0×10-8、Ka2=1.0×10-15,忽略H2S和H2O电离产生的H+)②已知亚硫酸的Ka1=1.0×10-2、Ka2=6.0×10-13,设计实验证明亚硫酸第一步不完全电离。
(可用实验用品:0.1mol/L亚硫酸、0.1mol/L NaHSO3溶液、0.1mol/L Na2SO3溶液,广泛pH试纸、pH计)【答案】+3 HCOOH+2SO2+4NaOH=Na2S2O4+CO2+2H2O或HCOOH+2SO2+4NaOH=Na2S2O4+Na2CO3+3H2O 2Na2S2O4+O2+2H2O=4NaHSO33S2O42-+2CrO2-+10H+=4Cr3++6SO42-+5H2O 10-5mol/L 1.0×10-22用pH计测定0.1mol/L亚硫酸溶液的pH PH>116.氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与Al2O3的化学性质相似,ZnO 在NaOH 溶液中转化成[Zn(OH)4]2-的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:①上图中的“冷凝物”为________(填化学式)。
