流式细胞仪试验方法2
BDFACSCalibur流式细胞术标准操作规程

BD FACSCalibur流式细胞仪操作与维护程序目的:规范BDFACSCalibur流式细胞仪操作与维护程序,正确使用设备,保证实验顺利进行、操作人员人身安全和设备安全。
适用范围:本规程适用于BD FACSCalibur流式细胞仪的使用操作。
责任者:操作人员:负责按照本规程操作仪器设备,对仪器进行日常维护,并作使用记录。
保管人员:负责监管仪器操作是否符合规程,并对仪器进行定期维护、保养。
科室负责人:负责对仪器设备的综合管理。
内容:1.每日开机程序1.1在气压阀减压的状态下检查鞘液桶,确认:1.1.1鞘液充满状态,约3L1.1.2盖紧盖子1.1.3安上金属挡板1.1.4管路畅通,无扭曲1.2.检查废液桶,确认:1.2.1废液桶充满400ml漂白剂1.2.2管路畅通,无扭曲1.3打开流式细胞仪。
1.4打开电脑。
1.5气压阀置于加压位置,并排除管路中气泡。
1.6做Prime。
1.7等待机器预热5~10分钟后可开始试验。
2.每日关机程序2.1用3mlFACSCIean洗液加入样品管中上样,将样品支撑架置于旁位,以外套管吸入1ml。
2.2将样品支撑架置于中位,以HI RUN运行10分钟,使内管吸入约1ml。
2.3将样品管换成蒸馏水重复1-2步。
2.4放置盛有1ml蒸馏水的试管于样品支撑架上。
2.5选择Standby模式10分钟,将激光冷却后可关掉主机。
2.6退出所有应用软件,关闭电脑。
2.7将流式细胞仪的压力阀置于减压状态。
3.每月维护程序3.1将FACSClean洗液1~2L装入鞘液桶。
3.2旁路鞘液过滤器(过滤器上的快速接口从SANLINEFILTER端断开,将鞘液白色管路液路取下联到SANLINE FILTER 端口),以防伤害。
3.3将盛有3ml FACSClean 洗液的试管置于样品支架上,以HI RUN 30 分钟。
3.4将鞘液和样品换成蒸馏水重复步骤3,以HI RUN 60 分钟。
3.5将鞘液桶装满鞘液,恢复过滤器。
BD流式细胞仪操作说明
FACS101 Handbook
易生物-领先的生物医药商务平台
-1–
生物秀-专心做生物!
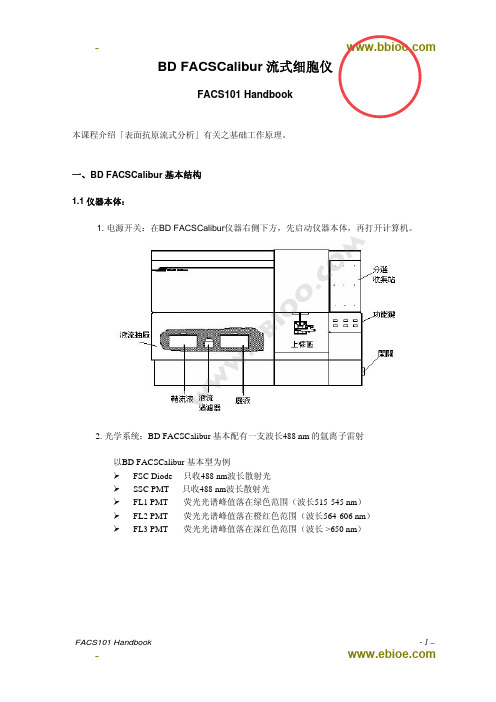
3. 仪器面板:
m 仪器前方面板的右下方有三个流速控制键、及三个功能控制键。 o 流速控制:
.c LO: 样品流速:12 μl /min
MED:样品流速:35 μl /min
雷射光源。) 7. 倒掉废液,并回填 200 ml漂白水。 8. 将减压阀放在「VENT 漏气」位置。将鞘流液筒充填至八分满。 9. 退出软件“File”Æ“Quit”(如有对话选项,选择“Don‘t save”)。确认退出
计算机中所有BD应用软件,所有数据数据已储存备份。 10. 关闭计算机。“Spheral Blood Mononuclear Cell Procedure
w • Leukemia and Lymphoma Procedure 1 w • Leukemia and Lymphoma Procedure 2, B-cell Clonality Assay
秀 • 间接免疫荧光染色
FACS101 Handbook
易生物-领先的生物医药商务平台
-5–
生物秀-专心做生物!
三、上机分析流程
建议首次试机避免进行大量试验,仅需准备下列样品。 (1)Negative Control(不加任何抗体)。 (2)CD3-FITC(FL1 单染)。 (3)CD19-PE(FL2 单染)。 (4)CD3-FITC /CD19-PE(FL1/FL2 双染)。
FACS101 Handbook
易生物-领先的生物医药商务平台
-3–
生物秀-专心做生物!
1.2 Macintosh 计算机与打印机:
流式细胞仪(Flow Cytometer)基本原理

FL-2(-)
FITC 单标
FL2 - %FL1
Before Compensation
FL-1(FITC)
FL-1(FITC)
PE 单标
FL-2(PE)
FL1 - %FL2
FL-2(PE)
After Compensation
FL-1(FITC)
FL-1(-)
什么样的补偿最合适?
单染管的阴性群体和阳性群体在所需调节通道的荧光Median 值相等时为最合适的补偿。
非特异性染色
抗体的Fc段可以与细胞表面的Fc受体非特异性结合; 抗体进入胞内,不容易洗脱,造成非特异性染色。
同型对照是指使用与实验抗体相同种属来源、相同剂量及同 种免疫球蛋白的相同亚型的抗体作为对照,用于消除抗体非 特异性结合到细胞上而产生的背景荧光。
实验抗体:FITC-CD3单克隆抗体为鼠IgG1亚型抗体; 同型对照:未免疫小鼠血清纯化的IgG1,并标记FITC,相同剂量。
侧向散射光SSC
SSC方向与激光束和液流形成的平面相垂直,亦称90度散射 光,其信号强度反映细胞内部颗粒度和精细结构的变化。
散射光的作用
实验中,常利用FSC和SSC这两种参数的组合,区分不同的细 胞群体,去除碎片、死细胞和粘连细胞的干扰。
粒细胞
单核细胞
淋巴细胞
红细胞、死细胞和碎片
通过FSC/SSC散点图,gate出目标细胞进行分析。
1、流式细胞术简介
流式细胞术(Flow Cytometry,FCM)是以流式细胞仪为检 测手段的一项能快速、精确的对单个细胞(或生物学颗粒)的 理化特性进行多参数定量分析和分选的技术。
流式细胞仪(Flow Cytometer )是集细胞与分子生物学、 流体力学、激光技术、光电子技术、计算机技术、细胞荧光 化学技术、单克隆抗体技术为一体的一种高科技仪器。
流式细胞仪

流式细胞仪的机型
1. 台式机 检测和分析 B.D. : FACSCalibur; LSRII; LSRI
2. 大型机 分选细胞 B.D. : FACSVantage ;FACSAria Beckman Coulter: MoFlo (DAKO)
荧光抗体的搭配
理论上,不同通道检测的参数可以同时进 行检测。但是如果进行3个荧光参数的检测, 尽可能的选择只需要调节一对参数之间的 补偿的荧光。 如,FL1+FL2+FL4; FL1+FL3+FL4; 注意:PE-Cy5和APC不能同时检测。
流式细胞仪的数据显示和分析
一维直方图、二维点阵图、等高线图和密度图。 1.单参数数据显示和分析— 一维直方图
90 Degree Light Scatter
Laser
FALS Sensor
SSC 与入射光成 90 ° 的光,与 细胞内部复杂度 相关,颗粒密度
90LS Sensor
根据FSC/SSC可以将全血中的淋巴细胞,单核 细胞和粒细胞分开
荧光参数 自发荧光:未经荧光染色,细胞内部的荧
光分子经激光照射后发出的荧光信号。 自发荧光的细胞成分: 核黄素,细胞色素等。 死亡细胞的自发荧光较高 需要设置阴性对照。
F/P FITC, PerCP: 2-9; APC, PE: 1; PE-Cy7, APC-Cy7: 1, N;
抗原密度 高丰度抗原:任何荧光素;低丰度抗原:PE,APC
染色指数 自发荧光
高:APC; 低:FITC 非特异形结合
FcR; 荧光自身
直接标记
ELISA 方法+流式细胞术

23
1.流式细胞仪的基本结构
(1) 液流系统 (2) 光学系统 (3) 数据处理系统
24
(1)液流系统
25
液流系统示意图
喷嘴 鞘液
Fluorescence signals
Focused laser beam
26
(2)光学系统
27
光学系统示意图
Flow Tip
SS and FL Detector
14
ELISA封闭原理
封闭(blocking)是继包被之后用高浓度的无关蛋白质溶液 再包被的过程。封闭就是让大量不相关的蛋白质充填这些 空隙,从而排斥ELISA后的步骤中干扰物质的再吸附。 常用封闭剂:0.05%-0.5%的BSA; 10%的小牛血清或1% 明胶;脱脂奶粉,比较价廉,可以高浓度使用(5%)。 所有的ELISA固相均需封闭。
19
ELISA数据分析方法
b。标本/阴性对照比值 在实验条件(包括试剂)较难保证恒定的情况下,这种判断 法较为合适。在得出标本( S)和阴性对照(N)的A值后,计算 S/N值。在早期的间接法ELISA中,有些作者定出S/N为阳性标准, 现多为各种测定所沿用。实际上每一测定系统应该用实验求出各 自的S/N的阈值。更应注意的是,N所代表的阴性对照是不含受检 物质的人血清。有的试剂盒中所设阴性对照为不含蛋白质或蛋白 质含量较底的缓冲液,以致反应后产生的本底可能较正常人血清 的本底低得多。因此 ,这类试剂盒规,如N<0.05(或其他数值), 则按0.05计算,否则将出现假阳性结果。
15
显色原理
HRP的底物 DH2+ H2O2 D+ 2H2O 上式中, DH2为供氢体, H2O2为受氢体。 DH2一般为无色化合物,经酶作用后成为有色的产 DH2如:邻苯二胺(OPD)、四甲基联苯胺(TMB)等 TMB TMB经HRP作用后共产物显蓝色,目视对比鲜明。 TMB性质较稳定,可配成溶液试剂,只需与H2O2 溶 液混和即成应用液,可直接作底物使用。另外,TMB 又有无致癌性等优点,酶反应用H2SO4终止后,TMB产 物由蓝色呈黄色,可在比色计中定量,最适吸收波长 为405nm。
流式细胞仪结果分析

CD4+Th细胞、CD4+/CD8+比例
六、自身免疫病相关HLA抗原分析
HLA-B27可出现在58%~97%的强直 性脊椎炎 As 患者
七、移植免疫中的应用
FCM作为一个强大的技术平台,已应用于多个领 域,其在移植免疫分析中的应用也越来越广泛, 目前移植免疫中的FCM应用主要包括流式细胞 术的交叉配型 Flow cytometry cross-matching, FCXM 和群体反应性抗体 Panel reactive antibody, PRA 检测,
样本来源:各种细胞 如外(ZHOU)血,骨 髓,实体组织、悬浮或贴壁培养的细胞 ,微生 物,人工合成微球等, 检测大小:一般是0.5um~40um
流式细胞仪的组成
液流系统 光学系统 数据处理系统
分选系统
分析型流式细胞仪
分选型流式细胞仪
液1 液流流系统
流动室
流动室 Flow cell 是液流系统的核心部件,流动室是由石英 玻璃制成,单细胞悬液在流动室里被鞘液流包绕通过流动 室内一定孔径的孔,检测区在该孔的中心,细胞在此与激光 垂直相交,
荧光染料的特性
•激发波长 EXCITING •发射波长 EMISSION
荧光补偿
四、细胞分选原理
通过流式细胞仪进行细胞分选主 要是在对具有某种特征的细胞需进 一步培养和研究时进行的,
一 分选基本原理
细胞悬液形成液流柱 压电晶体 产生机械振动
流动室振动
液流断裂成液滴
空白液滴 不充电
弃去
含细胞的液滴 充电
微小的乳胶微球分别染成上百 种不同的荧光色 固相芯片是用 探针在芯片上的坐标位置给基 因的特异性编码;而液相芯片 则是用颜色来编码
应用流式细胞仪检测细胞凋亡的4种方法的比较

应用流式细胞仪检测细胞凋亡的4种方法的比较范宁娟;项萍;段敏【摘要】[目的]比较4种测定细胞凋亡方法的优缺点.[方法]应用流式细胞仪,分别采用PI单染法、Annexin V-FITC/PI复染法、罗丹明123染色法及Fluo-3染色法测定细胞凋亡.[结果]每种分析方法均有自己优势和不足,在检测过程中应进行多参数分析.[结论]该研究可为后续研究提供试验方法支持.【期刊名称】《安徽农业科学》【年(卷),期】2014(042)032【总页数】3页(P11240-11242)【关键词】流式细胞仪;细胞凋亡;检测方法【作者】范宁娟;项萍;段敏【作者单位】西北农林科技大学生命科学学院,陕西杨凌712100;西北农林科技大学植物保护学院,陕西杨凌712100;西北农林科技大学生命科学学院,陕西杨凌712100【正文语种】中文【中图分类】S1088;G306.01972年,Kerr等[1]首次提出细胞凋亡(Apoptosis, APO)的概念,宣告对细胞凋亡探索的真正开始。
细胞凋亡是细胞在多重因素参与调控下正常的、自动死亡的生理过程。
它不同于一般意义上的细胞坏死。
异常凋亡状态的出现会导致多种疾病的发生[2-4]。
因此,细胞凋亡的检测在生物学研究中备受关注。
流式细胞仪(Flow cytometry,FCM)是20世纪70年代发展起来的高科技产品[5-7],在检测细胞凋亡方面具有简单、快速和敏感性高的特点,是研究细胞凋亡的主要手段[8-9]。
笔者使用PARTEC 流式细胞仪,通过比较PI单染法、Annexin V-FITC/ PI复染法、罗丹明123染色法及Fluo-3染色法4种测定细胞凋亡的方法,分析优缺点,以期为后续研究提供理论和试验支持。
1.1 试验材料人脐静脉内皮细胞(HUVEC)购自武汉细胞库,脂多糖(Lipopolysaccharides,LPS)购自sigma 公司,细胞周期与细胞凋亡检测试剂盒、Annexin V-FITC/PI 细胞凋亡检测试剂盒、罗丹明123膜电位检测试剂盒、Fluo-3钙离子浓度检测试剂盒均购自碧云天生物技术研究所。
流式细胞仪工作原理与应用范围

流式细胞仪工作原理与应用范围2008-11-01 10:30流式细胞仪就是进行流式细胞分析的仪器,它集电子技术、计算机技术、激光技术、流体理论于一体,是一种非常先进的检测仪器,被誉为试验室的“CT”。
流式细胞术(Flow CytoMeter,FCM)是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,与传统的荧光镜检查相比,具有速度快、精度高、准确性好等优点,成为当代最先进的细胞定量分析技术。
工作原理将待测细胞染色后制成单细胞悬液。
用一定压力将待测样品压入流动室,不含细胞的磷酸缓冲液在高压下从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样,鞘液就能够包绕着样品高速流动,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过检测区域。
流式细胞仪通常以激光作为发光源。
经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。
这两种信号同时被前向光电二极管和90°方向的光电倍增管接收。
光散射信号在前向小角度进行检测,这种信号基本上反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。
这些荧光信号的强度代表了所测细胞膜表面抗原的强度或其核内物质的浓度,经光电倍增管接收后可转换为电信号,再通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号。
计算机把所测量到的各种信号进行计算机处理,将分析结果显示在计算机屏幕上,液可以打印出来,还可以数据文件的形式存储在硬盘上以备日后的查询或进一步分析。
检测数据的显示视测量参数的不同由多种形式可供选择。
单参数数据以直方图的形式表达,其X轴为测量强度,Y轴为细胞数目。
一般来说,流式细胞仪坐标轴的分辨率有512或1024通道数,这视其模数转换器的分辨率而定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四部分流式细胞术分析血小板流式细胞术分析血小板血栓性疾病、出血性疾病、心血管疾病以及自身免疫性血小板减少症等疾病的病理生理过程与血小板相关。
血小板功能检测包括黏附、聚集和活化功能试验。
使用流式细胞仪检测全血中血小板表面相关标志物是一种新技术,它拓宽了血小板相关疾病的诊断与功能研究方法,丰富了血小板功能评估指标。
一、流式细胞仪血小板分析应用范围1.通过分析信号传递、细胞骨架结构、颗粒释放、糖蛋白构形、膜磷脂、与抗凝因子的结合和微粒形成,分析血小板活化,血小板对刺激物的反应性。
2. 通过分析受激后表面结合蛋白触发凝血链式反应和表面糖蛋白缺陷检测,分析血小板止血功能的获得性和遗传性缺陷。
3. 结合血小板大小,检测血小板RNA含量,分析血小板成熟度,计数网织血小板。
4. 发现血小板抗体,做定性和定量分析。
二、血小板分析的临床意义1. 血栓性疾病:活化血小板的检测能预测冠状血管成形术后发生急性缺血事件的危险性,非风湿性心房纤颤患者栓塞和栓塞前期均有血小板活化,胰岛素依赖性糖尿病,子痫前期,外周血管疾病等均可测出血小板活力增加和(或)循环中存在活化血小板,而早产儿的血小板对凝血酶、二磷酸腺苷(ADP)、TXA2的体外激活能力降低。
2. 血小板缺陷性疾病:全血法流式细胞术提供了一个简单、迅速的方法来诊断血小板膜糖蛋白缺陷性疾病,如巨大血小板综合征,血小板无力症等。
前者是由于GPIb-IX复合物先天缺陷所致的血小板形态巨大,功能异常的出血性疾病。
后者由于GPⅡb/Ⅲa复合物先天缺陷,导致血小板聚集功能障碍3. 贮存池疾病:原发性贮存池疾病(δ-SPD)常规用血小板聚集法检测,但特异性和灵敏度均不理想。
检测血小板致密颗粒的阿的平荧光显微镜法,主观性大,操作繁琐,而且一次检测的血小板数目有限。
全血法流式细胞术为δ-SPD的诊断提供了一个简单、迅速的方法,一次能定量检测5 000个以上阿的平染色的血小板。
与正常人相比,δ-SPD患者阿的平染色显著下降(从49%降至15%)。
常在骨髓增殖异常综合征和晚期肾衰中出现的获得性致密颗粒贮存池疾病,也能用全血法流式细胞术进行检测和诊断。
4. 血小板减少性疾病:破坏过多或生成减少均能导致血小板减少。
血小板相关抗体(PAIg)是反映血小板的破坏的指标,虽然其临床意义仍有争议。
PAIg的检测有多种方法,但流式细胞术法有其优越性。
流式细胞仪能测定单个血小板上的PAIg,只要测定104甚至103个血小板,在统计学上就能精确地得出PAIg的平均水平,因而用血量少,只要1 ml血液制备的血小板就足够。
流式细胞术还能同时测定其他一些反映血小板破坏的指标,如PAIgG、PAIgM、C3等。
血小板的生成与巨核细胞有关,全血法流式细胞术能像检测网织红细胞那样,检测分泌到循环中的“网织”血小板,来判断血小板的生成。
“5. 血小板储存与输注:用P-选择素(CD62)、CD63、GPⅡb/Ⅲa作分子标志物,发现血库中储存血小板有时间依赖性的活化现象。
储存5天以上,40%~60%血小板表达活化标志CD62。
虽然其形态改变、乳酸脱氢酶泄漏以及β-TG的释放也能反映其活化,但用CD62作为储存血小板的质量控制指标最理想。
活化的血小板在循环中的存活时间很短。
若血小板在储存时活化了,即使输注也不能很好地提高患者止血能力。
6. 抗血栓药物的监测:活化血小板的检测可以判断患者是否需要抗血栓药物治疗,也可以监测这些抗血栓药物的作用,避免毒副反应的发生。
7. 此外,全血法流式细胞术还可用于检测血小板聚集,研究其免疫表型HPA-Ⅰa,测定严重血小板减少患者的血小板数目。
三、流式细胞仪分析全血中血小板的优点1.全血中血小板更接近生理状态。
2. 操作简便,减少由于操作造成的血小板状态改变(如血小板活化试验)。
3. 同时检测血小板的多个标志物,结合FSC和SSC,评估多个参数,进行定量分析。
4. 多采用血小板特异抗体CD41或CD61画门,找出血小板,避免杂质碎片的干扰。
5. 检测血小板亚群灵敏度高。
6. 用血量少。
7. 无放射性污染。
四、全血样本的制备1.抽取抗凝全血:检测血小板功能时,应使用标准化的抽血规程。
做血小板活化试验时,应尽量减少人为造成的血小板活化。
2.Falcon管中加取全血和适量直标荧光抗体,充分混匀,室温避光处反应,通常放置15分钟。
3.1%多聚甲醛固定样本。
4.上机检测五、质控标本1.阴性对照(Isotype Control):非特异荧光的强弱取决于抗体浓度、单克隆荧光抗体特异性和纯度,应与试验管抗体相对应。
在多色分析时,同型对照应与其它抗体同时使用,以避免补偿造成的误差。
2. 血小板体外活化试验:使用正常人活化标本作为阳性质控。
使用正常人未活化标本作为阴性质控。
3. 血小板自身抗体检测:使用含有已知血小板抗体的血清与血小板孵育,作为阳性质控。
使用不含血小板抗体的血清与血小板孵育,作为阴性质控。
4. 血小板表面抗原缺失:如巨血小板症血小板表面CD42a/CD42b缺失,血小板无力症血小板表面gpIIb/IIIa,即CD41/CD61缺失或异常。
使用正常人标本做阳性对照,抗体的同型对照做阴性对照。
六、数据分析-设门:1.FSC-SSC点图中找出血小板,缺点是血小板较小,不易通过大小将碎片或杂质完全分开2. 从CD41或CD61-SSC点图中画出血小板门,由于特异性高,可以有效地去除碎片和杂质的干扰。
流式细胞仪分析血小板的活化血小板活化试验,对于血小板功能、心血管疾病的研究,有重要意义。
使用流式细胞仪进行多参数分析,可以特异灵敏地检测血小板表面标记,了解血小板的活化状态和反应性,并同时获得更多关于血小板的信息。
在疾病监测、抗血小板治疗病人的筛选及治疗监测、预测并发症等方面有良好的应用前景。
一、使用流式分析方法检测血小板活化的优点是:1.检测血小板的反应性。
2.了解血小板活化进程。
血小板先发生膜糖蛋白变化,然后是胞浆内颗释放到血小板外。
3. 同时检测多种血小板表面标志。
4. 高度灵敏。
5. 直接检测血小板的多种标志。
6. 使用全血,标本量少。
7. 操作简便快捷,将血小板人工激活减至最低。
二、全血中活化血小板的检测1. 血小板特异性膜糖蛋白:血小板膜糖蛋白已被深入研究,下表显示了血小板膜上主要的糖蛋白及其功能。
在这些膜糖蛋白中,仅在血小板膜表面表达主要有GPⅠb,GPⅡb,GPⅢa等有限的几种,根据这些特异性糖蛋白制备的荧光单抗,能在全血中特异性地识别血小板。
表1血小板膜上主要的糖蛋白及其功能注:vWF血管性假血友病因子;Fb纤维蛋白原;Fn纤维粘连蛋白;Vn体外粘连蛋;LRG富含亮氨酸家族2. 活化血小板的标志物:活化血小板与静息血小板相比,其质膜糖蛋白常发生显著的变化,这些变化的糖蛋白便成为活化血小板的检测标志物,这些标志物可分为三类:第一类是血小板颗粒膜上的糖蛋白。
血小板被激活时,其颗粒膜与质膜发生融合,颗粒膜蛋白,如CD62、CD63,在质膜上表达,成为活化血小板的分子标志。
第二类是血小板质膜表面变化的糖蛋白表位。
如GP Ⅱb/Ⅲa(CD41/61)的PAC1表位,它仅在血小板活化时才因构象变化而显露出来。
因此,使用这个表位的荧光单抗,我们能更精确地在更早阶段检测到血小板的活化。
另外,GPIV (CD36)虽然在静息血小板上也表达,但活化血小板上表达量更高;GPIb-IX-V复合物(CD42)则相反,与静息血小板相比,活化血小板上表达量显著降低。
第三类是出现在活化血小板上能与血小板表面受体相结合的一些抗原,包括纤维蛋白原,Xa因子和thrombospondin等。
这些抗原在血小板表面的出现和消失在临床检测上也是有意义的。
3. 除检测免疫性的分子标志物外,流式细胞术还能检测一些反映活化血小板功能的非免疫性指标。
如用Ca2+浓度敏感的荧光染料检测胞内Ca2+流,用能进入血小板致密颗粒的荧光染料阿的平来检测活化血小板的释放功能等。
4. 单抗的选择:与血小板有关的CD单抗有CD9,CD31,CD36,CD41a-b,CD42a-d,CD61(特异的泛血小板表面标记,既与活化血小板结合,也与未活化血小板结合。
CD61与CD41联合,即为血小板表面gpⅡb/Ⅲa复合物),CD62,CD63 ,CD107a-b等,。
活化血小板的检测需选择针对活化血小板标志物的CD单抗。
表2列举了活化血小板检测的一些代表性单抗。
表2活化血小板CD单抗简介三、操作步骤1. 标本采集:(1) 枸橼酸钠抗凝的真空采血管顺序编号。
(2) 抽取静脉血,采血管中注入2ml。
(3) 于10分钟之内完成血小板激活和染色步骤,操作时应注意减少人工激活。
2. 血小板激活:(1) 试管内加入50mlADP(也可选用其他激活剂,如PMA、纤维蛋白、TRAP),450μl全血,轻轻摇匀。
(2) 室温孵育5分钟。
(3) 立即染色。
3. 荧光抗体染色:(1) Falcon管编号。
(2) 在对照管中加入同型对照、CD61、PAC-1和RGDS(PAC-1的阻断剂)。
(3) 在试验管中加入CD62P、CD61和PAC-1。
(4) 在对照管和试验管中各加入未激活或激活的血标本5μl。
(5) 轻轻混匀,室温暗处孵育15-20分钟。
(6) 各管中加入1ml冷的固定液(2-8︒C),充分混匀,2-8︒C阴暗处放置30分钟。
(7) 24小时内上机分析。
4. 结果分析:在CD61 vs SSC点图中设门找血小板群。
CD61 vs SSC 点图显示有三群,CD61阳性/低SSC一群主要由单个血小板组成,CD61阳性/高SSC一群主要由黏附血小板的血细胞组成,CD61阳性/散射光更低的一群主要由血小板来源的碎片组成。
由于在生理和病理情况下,血小板群和红细胞群的大小、颗粒度会有交叉,因此,不建议使用FSC-SSC图设门。
在CD61 vs SSC点图中找出CD61 阳性的血小板群(单个血小板和黏附在WBC上的血小板),设门。
四、注意事项1. 采血时请用大号针管,抽出的前2ml血应弃去不用。
2. 尽量避免标本受到物理振动。
3. 取血后10分钟内完成染色操作。
4. 在Falcon管中加血标本5 l,管壁上不能有残留血,未染色的部分会影响试验结果。
5. 为了检测和控制血小板体外激活,建议使用正常未受激活的血标本平行做质量控制。
