化学动力学基础.
化学动力学基础知识点总结

化学动力学基础知识点总结
化学动力学是化学的一个分支,主要研究化学反应的速率和机理。
以下是一些化学动力学的基础知识点总结:
1. 反应速率:化学反应速率是指单位时间内反应物或生成物浓度
的变化量,可以用单位时间内反应物或生成物的摩尔数来表示。
2. 反应级数:反应级数是指化学反应速率与反应物浓度的幂次方
之间的关系。
一级反应的速率与反应物浓度的一次方成正比,二级反
应的速率与反应物浓度的二次方成正比,以此类推。
3. 活化能:活化能是指反应物分子从常态转变为能够发生化学反
应的活化态所需的能量。
活化能越高,反应速率越慢。
4. 催化剂:催化剂是一种能够加速化学反应速率而自身在反应过
程中不被消耗的物质。
催化剂通过降低反应的活化能来加速反应速率。
5. 反应机理:反应机理是指化学反应的具体步骤和过程,包括反
应物分子如何相互作用形成过渡态以及过渡态如何转化为生成物。
6. 碰撞理论:碰撞理论认为化学反应是反应物分子之间的碰撞导致的。
只有那些具有足够能量的分子在适当的取向下发生碰撞时,才能发生化学反应。
7. 阿伦尼乌斯方程:阿伦尼乌斯方程是描述反应速率与温度之间关系的经验公式。
它表明反应速率常数与温度成指数关系,活化能越高,温度对反应速率的影响越大。
8. 稳态近似:稳态近似是一种处理快速平衡反应的方法,假设反应中间物的浓度在反应过程中保持恒定。
这些是化学动力学的一些基础知识点,化学动力学在化学研究和实际应用中都有广泛的应用,例如在化学工程、药物研发、环境保护等领域。
物理化学第9章 化学动力学基础

速率方程必须由实验来确定
四、反应级数 若反应的速率方程可以表示为浓度的幂乘积形式:
r = k[A][B]…
则各浓度项的方次、、…分别称为组分A、B …的
例 1、P165例题
某金属钚的同位素进行β放射,14 d 后,同位
素活性下降了6.85%。试求该同位素的:
(1) 蜕变常数,(2) 半衰期,(3) 分解掉90%所需时间
解:
(1)
k1
=
1 t
ln
a
a
x
=
1 14d
ln
100 100 6.85
=
0.00507d-1
(2) t1/2 = ln 2 / k1 = 136.7d (3) t = 1 ln 1 = 1 ln 1 = 454.2d
例如:
例如,恒容反应器中,氯代甲酸三氯甲酯分解为光气
ClCOOCCl(g) 2COCl2(g)
t = 0 p0
0
t = t p酯
p光气=2( p0 – p酯)
p总 = p酯 + p光气 = 2 p0 –p酯
∴ p酯 = 2p0 – p总
或 p光气 = 2(p总– p0)
三、反应速率 r 的经验表达式
2、适用范围
ln k = Ea B RT
k = AeEa / RT
3、A意义:称指前因子
二、活化能的概念 1、对简单反应:
那些能量高到能发生反应的分子称为“活化分子” 活化能:活化分子的平均能量与反应物分子平 均能量之差值。
物理化学答案——第九章-化学动力学基础
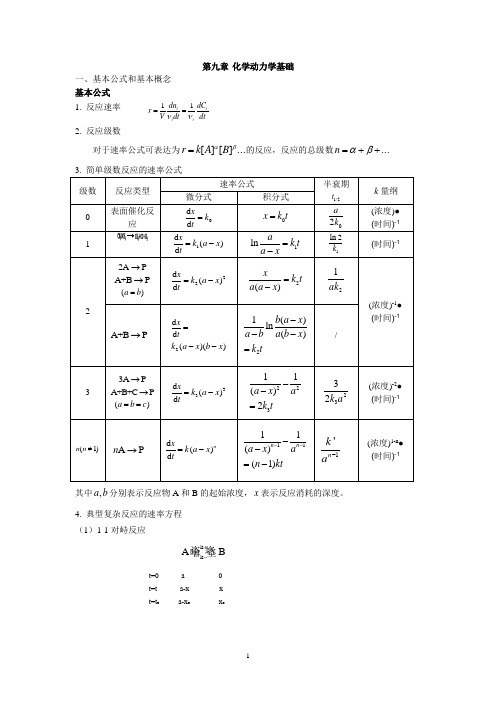
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
[课件]普通化学化学动力学基础PPT
![[课件]普通化学化学动力学基础PPT](https://img.taocdn.com/s3/m/ce645c4f1eb91a37f1115c4c.png)
Arrhenius方程式
反应速率方程
rk c c A B
影响反应速率的因素有两个: k和cB k与温度有关,T增大,一般k也增大,
但k~T不是线性关系。
2N O (CCl ) N O (CCl ) O (g) 不同温度 k 值 2 5 4 2 4 4 2
化学动力学基础
化学反应速率的概念
浓度对反应速率的影响 —速率方程式 温度对反应速率的影响 —Arrhenius方程式
反应速率理论和反应机理简介
催化剂和催化作用
化学反应速率的概念
定容反应的反应速率
平均速率与瞬时速率
定容反应的反应速率
如果体积不变:
d d n d c B r B V d t V d t d t B B
普通化学化学动力学基础
化学动力学是研究化学反应的速率和机理的 科学,是物理化学的一个重要组成部分。
在化学动力学中,要研究化学反应 的速率(reaction rate)以及反应条件 (例如浓度、压力、温度、辐射、介质、 催化剂等)对反应速率的影响,揭露反 应的具体过程,即反应机理(reaction mechanism)。
5 7 . 29 10 0.200 5 0.180 6 . 46 10 5 0.161 5 . 80 10 5 0.144 5 . 21 10 5 4 . 69 10 0.130 5 3 . 79 10 0.104 5 0.084 3 . 04 10 5 0.068 2 . 44 10 5 1 .59 10 0.044 5 0.028 1 .03 10 0.018 0.012 0.0000
普通化学——化学动力学基础PPT课件

(产物取正,生成物取负)
显然,两种方法定义的数值不一样,它们之间的关系为: r ri 1 dci vi vi dt
式中,vi为反应系数,符号一律取正)
||
||
5
3.1.2 反应动力学方程
1 积分形式的动力学方程
描述反应体系中某组分浓度与时间的关系的函数称为积分形式的动 力学方程:
ci = g(t)
||
||
10
3.2 简单级数的反应的动力学方程
常见的简单级数的反应有零级反应、一级反应和二级反 应,三级反应的例子不多。 零级反应(准)——气、固相催化反应,酶催化反应 一级反应——同位素衰变反应,部分取代反应 二级反应——水解反应,部分取代反应
||
||
11
3.2.1 一级反应
一级反应:A → P dc kc dt
t
图3.2 一级反应
||
||
13
一级反应计算示例
例3.1 从考古发现的某古书卷中取出的小块纸片,测得 其中 14C/12C 的比值为现在活的植物体内 14C/12C 的比值 的0.795 倍。试估算该古书卷的年代。
解: 已知 1 4 7 1 4 7 - 0 1 e - , t 12 5730a
可用式(2.34)求得此一级反应速率常数k
第三章 化学动力学基础
第三章 化学动力学基础
化学热力学为我们提供了判断反应能否自发进行的依据。 但是一个热力学自发的反应不一定能够进行,例如:
H2(g)+O2(g) = H2O(g) 298.15K时标准摩尔反应吉布斯函数变为–457kJ·mol-1,但 在此温度下,不点燃或无撞击的情况下几天甚至几月都 观察不到水分子的产生。
2 微分形式的动力学方程
北理无机化学第3章-化学动力学基础

基元反应
§3.2 浓度对反应速率的影响
NO2(g)+CO(g) NO(g)+CO2(g)
v=kc(NO2)c(CO)
反应级数 n = 2
基元反应 2NO(g)+O2(g)2NO2(g)
v=kc(NO)2c(O2)
反应级数 n = 3
第三章 化学动力学基础
3.注意
§3.2 浓度对反应速率的影响
或
lg{k}
Ea 2.303RT
lg{k0}
k: 反应速率常数,由反应的性质和温度决定;
Ea:实验活化能,单位为kJ·mol-1,是表示反应特性 的常数;
k0:指数前因子,频率因子,对指定反应为一常数。
第三章 化学动力学基础
§3.3 温度对反应速率的影响
3.3.2 Arrhenius 方程式的应用
vB ΔcB Δt
vC
ΔcC
t
vD ΔcD Δt
浓度的单位:mol·L-1 时间的单位:s(h、min)
第三章 化学动力学基础
例:
起始浓度/(mol·L-1)
§3.1 反应速率的意义
N2 + 3H2 → 2NH3
13
0
2秒后浓度/(mol·L-1)
0.8 2.4 0.4
同一反应,可用不同物质的浓度的变化表示反应速率,其 值可能不同。
vN2
-
(0.8-1) 2
0.1mol
L-1
S-1
vH2
-
(2.4- 3) 2
0.3 mol
L-1
S-1
vNH3
(0.42
0)
0.2 mol
L-1
S-1
第三章 化学动力学基础
大学无机化学第五版第三章化学动力学基础

aA(aq) + bB(aq)
yY(aq) + zZ(aq)
r dcA dcB dcY dcZ adt bdt ydt zdt
对于定容的气相反应:
r 1 dpB
B dt
§3.2 浓度对反应速率的影响 —速率方程
3.2.1 化学反应速率方程
3.2.2 由实验确定反应速率方程的 简单方法——初始速率法
反应速率—— mol·L-1·s-1等 分类:平均速率( r )、瞬时速率( r )
若以C1、C2代表时间t1、t2时,某反应物或生成物的 浓度则:
平均速率:化学反应在某一有限时段内浓度的变化量。
_
r= ±
C2 - C1 t2 - t1
△C =±
△t
为使反应速率为正值:若用反应物浓度表示 C2﹤C1,△C为负,则前面加负号;若用生成物浓度表 示 C2﹥C1,△C为正,则前面取正号。
答:各物质的系数不同;各数值除以系数后相等。
对于一般的化学反应: 0 BB
B
定容条件下,定义:r d
Vdt
r——定容条件下的反应速率(mol·L-1·s-1)
d dnB dt Bdt r d dnB 1 dcB Vdt V Bdt Bdt
溶液中的化学反应:
反应 级数
2
1+1
2NOg O2 g 2NO2 g r k[c(NO)]2c(O2) 2+1
2+1 2NOg 2H2 g N2 g H2Og r k[c(NO)]2 c(H2 )
S2O82 aq 3I aq 2SO24 aq I3 aq
t/ s
VSTP O2 /mL cN2O5 / mol L1
物理化学:第八章 化学动力学基础

三.化学动力学的研究方法
宏观方法与微观方法并用。
1)宏观反应动力学:以宏观反应动力学实验为基础,从宏观变量 的C、T、P 等出发,研究从复合反应到基元反应的动力学行为, 集中表现建立反应的速率方程。
一.化学反应转化速率的定义
1.瞬时速率
A B
dcA dt
dcB dt
A、B的消耗速率
Y Z
dcY dt dcZ dt
Y、Z的增长速率
8.1 化学反应速率的定义
一.化学反应转化速率的定义
2.反应进度 设反应为:
R P
t 0 nR (0)
t t nR (t)
nP (0)
np (t)
例如定容化学反应:N2+3H2=2NH3的反应速率为 dcN2 1 dcH2 1 dcNH3 dt 3 dt 2 dt
2、反应速率之间的关系 对反应aA+bByY+zZ
定容反应的反应速率 = 反应物的消耗速率 = 生成物的增长速率 反应物的化学计量数 生成物的化学计量数
即: A B Y Z
xA
def
nA,0 nA nA,0
8.2 化学反应速率方程
一. 化学反应速率与浓度关系的经验方程
在一定温度下,描述反应速率与反应物的物质的量浓度的 关系式叫化学反应的速率方程或叫化学反应的动力学方程. 对于反应:aA+bByY+zZ
A kAcA cB
(1) 速率方程有两种形式:r~c微分式 c~t 积分式 (2) 速率方程的作用:动力学学习,工程设计,机理研究。 (3) 速率方程的确定:实验。因此,速率方程是经验方程。 (4) 一般具有反应物浓度乘积关系,但不能直接由计量方程写出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第11章 化学动力学基础重点:基元反应的质量作用定律及其应用,速率方程的积分形式,速率方程的确定,温度对反应速率的影响,阿累尼乌斯方程的各种形式及其应用,指前因子k0、活化能Ea 的定义,典型复合反应及复合反应速率的近似处理法,链反应,气体反应的碰撞理论,势能面与过渡状态理论。
难点:由反应机理推导速率方程的近似方法(选取控制步骤法、稳态近似法和平衡态近似法)的原理及其应用。
重要公式2.a ln()k E k R T T =-211211 E k A RT=-+a ln 3.非基元反应的表观活化能:a a,1a,2a,3E E E E =++4. 1-1级对行反应:A,0A,11A A,ln()e ec c k k tc c --=+-B 1A 1,e c ,ec k K c k -==5. 1-1级平行反应:A,012Ac ln()k k tc =+1B2Ck c k c =6.平衡态近似法:C 1A B 1cc kK c c k -==7.稳态近似法:Bd 0d c t =化学动力学是物理化学的一个重要组成部分,其主要任务是(1)研究反应速率及其影响因素(2)揭示反应的历程,并研究物质结构和反应能力的关系。
动力学和热力学不同:平衡态热力学只讨论系统的平衡态,其性质不随时间而变化,因而不考虑时间这个因素;另外,热力学是用状态函数研究化学反应从始态到终态的可能性,即变化过程的方向和限度,并不涉及化学变化所经历的中间途径和中间步骤。
所以,热力学对化学反应的速率和具体反应历程不能给予回答,只能说明反应进行的可能性。
例:298K,101325Pa时,氢氧发生反应:H2(g)+ 1/2O2(g)H2O(l)Δr G mθ = -287.19 kJ/mol < 0,表明反应可自发进行,但在上述条件下,并没有观察到氢氧的变化。
这主要是因为在上述条件下,反应速率太慢,难以达到热力学平衡。
所以,这个反应在上述条件下,从热力学角度看,是可以进行的;但从动力学角度看,则没有实际意义。
但若改变反应条件,升温到1073K或加入合适的催化剂,反应可瞬间完成。
由此可看出,若一个反应仅从热力学角度判断是自发的,并不说明反应可以实际操作;若从动力学角度看,反应速率太慢,则没有实际意义。
因此,必须从动力学角度进行研究,改变不利状况,使反应能实现。
而且,从控制反应过程而言,动力学研究非常重要。
且动力学研究远比热力学复杂。
它不仅涉及反应速率和反应机理本身,反应条件如:催化剂、温度、压力等对反应速率和反应机理的影响也是很复杂的。
一般可以认为:热力学——反应的可能性;动力学——反应的可行性。
本章只讨论动力学基础,它包括以下三方面的内容:动力学基础:反应速率——与反应物浓度、温度的关系反应机理反应速率理论§11.1化学反应的反应速率及速率方程1.反应速率的定义表示一化学反应的反应速率与浓度等参数间的关系式,或浓度与时间等参数间的关系式,称为化学反应的速率方程式,简称速率方程或动力学方程。
根据IUPAC (国际纯粹与应用化学联合会)的规定: 反应进度:BBd d n ξν=转化速率——单位时间内发生的反应进度:BB d d 1d d n t tξξν•== 在密闭容器中反应,则其反应体积V 一定,则反应速率可表示为: 反应速率[2]——单位时间单位体积内发生的反应进度:c B ——反应组分B 物质的量的浓度(mol/dm 3),这个定义较实用。
对于任意一个化学反应 a A + b By Y+z Ztc t c vd d 1d d 1BB A A νν==t c t c d d 1d d 1Z Z Y Y νν== tc b t c a vd d 1d d 1B A -=-=t c z t c y d d 1d d 1Z Y == 式中,d c A 和d c B 为消耗掉的反应物浓度,为负值;d c Y 和d c Z 为生成的生成物浓度,为正值。
所以,v 始终为一正值,且与用来表示反应速率的反应组分的选择无关。
只与浓度变化有关。
通常研究中,只选择一种易于测定其浓度变化的反应组分来表示反应速率。
根据选择的组分不同,就有 反应物的消耗速率t c v A d d A -=,tcv B d d B -= 生成物的生成速率t c v d d Y Y =,tc vd d Z Z = B BB B d /d 1d 11 d d d n V c V V t t t ξξυνν====bva v v -=-=B A z v y v Z Y ==例:反应 H 2 + I 22HI1122I H --=--=v v v 2HIv =t c t c v d d 11d d 1122I H -=-=tc d d 21HI=对恒温恒容气相反应,B υυ、也可以分压表示,并加下标p 。
1p p tυν=BB d dA 的消耗速率:A,A d d p p tυ=- Z 的生成速率:Z,Z d d p p tυ= 且:,A ,ZA Zp p p υυυνν==-p RT υυ∴=2.基元反应和非基元反应一般情况下,我们所写的化学方程式并不代表反应的真正历程,只代表反应的总结果。
从微观角度看,在反应过程中,反应物分子总是经过若干个简单反应步骤,才能转化为生成物分子。
基元反应是反应过程中的每一个反应步骤。
复合反应是由多个基元反应组成的反应。
如: H 2 + I 2 2 HI ,不是由H 2和I 2直接碰撞生成HI ,而是经过了一系列的基元反应:(1)I 2 + M2I + MB B B /p n RT V c RT==B B d (d )p c RT=(2)H 2 + 2I 2 HI (3)2I + M2 + M每一步都是一个基元反应,三个基元反应加起来才是H 2和I 2 的加成反应。
所以,化学方程式只表示了反应过程中,各组分量的关系,而不代表反应历程。
而反应历程就是探讨反应由哪几个基元反应组成。
所以,基元反应是构成化学反应的基本单元。
3.基元反应的速率方程——质量作用定律,反应分子数质量作用定律——基元反应的速率与各反应物浓度的幂乘积成正比,其中各浓度的方次就是反应式中相应组分的分子个数。
如:单分子反应: AB + CA AA d d kc tc v =-= 双分子反应: 2AB + C2A A A d d kc tc v =-= A + BCB A AA d d c kc tc v =-= 多分子反应: a A + b B + c C + ….Pcb ac c kc tc v C B A A Ad d =-= 式中,k ——反应速率常数(或系数)[4],也称反应比速。
与反应物的本性、温度、溶剂的性质以及催化剂的存在等因素。
当组分浓度为单位浓度时,k 即为反应速率。
另外,用不同组分表示反应速率时,k 的数值不同:cb ac c c k tc v C B A A A Ad d =-= cb ac c c k tc v C B A B B Bd d =-= cb ac c c k tc v C B A C C Cd d =-= k A ≠ k B ≠ k Cb v a v v B A ==cv C=t c b t c a v d d 1d d 1B A -=-=tc cd d 1C-=b k a k B A =ck C=质量作用定律是19世纪50年代,挪威科学家Guldberg (古德贝格)和Waage (瓦格)在总结了大量实验的基础上提出的。
他们提出:化学反应速率和反应物的有效质量成正比,其中,有效质量为浓度。
当时,人们对基元反应和总反应之间的关系不是很清晰。
实际上,质量作用定律只适用于基元反应。
一般,基元反应按反应物分子数划分,可分为: (1) 单分子反应,例如:分解或异构化反应 (2) 双分子反应,例如:多数基元反应为双分子反应 (3) 三分子反应,例如:原子复合或自由基复合反应 四分子反应目前没有发现。
对于非基元反应,只有分解为几个基元反应后对每个基元反应运用质量作用定律,但是,如果一个物质同时出现在多个基元反应中,则对该物质应用质量作用定律时,其净的消耗速率或生成速率应是这几个基元反应的总和。
4. 化学反应速率方程的一般形式,反应级数 对于化学计量反应: aA + bB + cC + …. P它的经验速率方程可写成 γβαC B A A A d d c c kc tc v =-=k ——速率常数αβγ——不是反应式前的计量系数,而是由实验确定的。
称为反应级数。
其中,α为A 的分级数,β为B 的分级数,γ为C 的分级数。
n = α+β+γ为反应的总级数,简称为反应级数[5]。
2.反应级数与反应分子数:反应级数为浓度项的方次,所以,反应级数的大小表明了浓度对反应速率的影响程度。
反应级数越大,表明浓度对反应的影响越大。
一般,n = 1—— 一级反应——单分子基元反应 n = 2—— 二级反应——双分子基元反应 由基元反应的质量作用定律可以看出:基元反应为整数级反应,n = 1、2、3,即与反应分子数一致;但对于复合反应,反应级数却不一定。
(1) 反应级数不一定是整数。
n 为实验所得,可为正数、负数、小数,甚至为0。
a. H 2 + Cl 2 2HCl v 2/1Cl H 22c kc = n = 1.5 b. 金属氧化:1d d -==ky tyν(y 为氧化膜的厚度) n = -1;表示膜厚度的增加对反应起抑制作用。
c. 表面催化反应:NH 3在W 上的分解: 2NH 3 N 2 + 3H 2 ,因为反应在催化剂表面上进行,所以,v 仅与表面状态有关。
若W 的表面全部被已吸附的所饱和,再增加的浓度对v 不再影响,此时,为0级反应。
(2) n 由实验所得,不一定与反应式前的计量系数相同。
但对于基元反应,n = 反应式前计量系数之和 = 反应分子数 (3) 有些速率方程很复杂,不能明确表明反应级数。
如: H 2 + Br 22HBrv t c d d 21HBr=222BrHBr 21Br H 1c c B c Ac +=W(4) 实验所得的n 有时不一定显示在浓度项里,而隐藏在速率常数中。
C 12H 22O 11(蔗糖) + H 2OC 6H 12O 6(葡萄糖) + C 6H 12O 6(果糖)H 2O 为溶剂,其浓度基本不变,则v 1122122O H C O H c kc =112212O H C c k '=称为准一级反应,v 与c 的关系表现为一级反应的特征。
5. 用气体组分的分压表示的速率方程 对于气体反应,nRT pV =,T 、V 一定时,RT c RT Vn p A AA ==,1A A )(-=RT p c 1A A )(d d d d --=-RT t pt c 1A A A )(d d d d --==-RT tp c k t c nc np n n c n c n c p k RT p k RT RTp k RT c k t p A 1A A A A )()(d d ====-- 式中,n c p RT k k -=1)(所以,可以用-d p A /d t 代替-d c A /d t 表示气相反应的速率。
