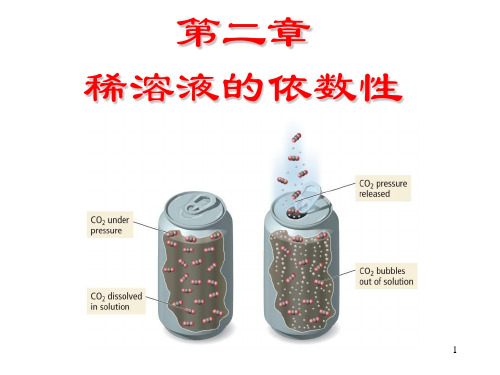
第2章 稀溶液的依数性-2016
稀溶液的依数性 ppt课件

根据Van’t Hoff 定律,在一定温度下,对
于任一稀溶液,Π 与c成正比。
因此可以用渗透活性物质的量浓度来衡量
溶液的渗透压大小。
46
PPT课件
渗透浓度(osmolarity): 所谓渗透浓度就是渗透活性物质的物
质的量除以溶液的体积。即渗透活性物质 的总浓度。
符号:cos 单位:mol·L-1或mmol·L-1
符号:p 单位:帕斯卡(Pa 或 kPa )
10
几种液体蒸气压与温度的关系
☆对于某一物 质,一定温度 下,其蒸汽压 是个定值。 ☆ 同一液体, 温度越高,蒸 汽压越大;蒸 汽压越大,越 易挥发
11
PPT课件
二、溶液的蒸汽压下降
数小时后
左水,右葡萄糖
PPT课件
实验结果: 在相同温度下,P水>P葡萄糖。
7
PPT课件
本章学习要求及重点
理解稀溶液依数性的概念。 掌握稀溶液的蒸气压降低、凝固点降低、
沸点升高、渗透压产生的原因及变化规律。 能够熟练应用稀溶液依数性的相关公式进
行计算。 了解稀溶液依数性在医学上的意义。
8
PPT课件
§2.1 溶液的蒸气压下降
一、液体的蒸气压
1.蒸发(evaporation)
当溶液组成改变时,溶液的某些性质将依 从稀溶液的依数性规律而发生改变。
稀溶液的依数性,对细胞内外物质交换与
运输、临床输液、水及电解质代谢等问题,
具有一定的理论指导意义。
5
PPT课件
难挥发非电解质稀溶液的依数性:
•蒸气压下降 •沸点升高 •凝固点下降 •渗透压
6
PPT课件
注意
稀溶液的依数性只适用于难挥发的非电 解质稀溶液(0.2 mol·kg-1以下),对电解 质溶液或浓度较大的非电解质溶液,由于 溶质的溶剂化及溶质微粒间存在着不可忽 视的作用力,溶液的依数性规律将发生偏 差。
第二章(第二节稀溶液的依数性)

饱和蒸气压与温度密切相关——蒸气压—温度曲线
温度升高,蒸气 压增大
2、什么是溶液的饱和蒸气压? 指的是溶液中,作为溶剂的那种物质,所具有的 饱和蒸气压(分压力)。
溶液的饱和蒸气压同样与温度密切相关:
3、 “溶液的蒸气压下 降”这句话是什么意思?
同一温度下,溶液 的蒸气压比纯溶剂的蒸 气压要小,它们之间的 差值,叫“溶液的蒸气 压下降”。
第二节:稀溶液的依数性
(Colligative properties of dilute solutions)
一、什么是“稀溶液的依数性 ”?
与溶解有关的性质分为两类: 溶液的颜色、比重、导电性等性质, 与溶质的本性有关;溶液的蒸气压、沸点、凝固点等性质,与溶质的本 性无关。
只与溶质的数量(摩尔分数)有关,而与溶质的本性 无关的性质,称为“依数性”。
四、溶液的渗透压
放置一段 时间后!
纯水
糖水
糖水的蒸气压低于纯水的蒸气压 空气中只有水分子能通过
糖水
胡罗卜
液柱产生的静压力阻止了水继续向管中渗透
阻止渗透所需要的外界静压力,叫渗透压,记作。
渗透压大小的计算——范特荷甫方程(van’t Hoff equation) 1886年,荷兰物理化学家J.H.van’t Hoff发现非电解质稀溶 液的渗透压的大小,可以用与理想气体状态方程(pV = nRT)形 式相似的方程式计算: V = nRT 式中: ——渗透压 V——m3 ( 体积) R——8.314 (Pa m3 mol-1 K-1) 溶液的渗透压与溶质的本性无关,只与溶质的浓度有关——依数性。
2、从蒸气压曲线理解:什么是纯液体的沸点和凝固点 3、从蒸气压曲线理解:什么是溶液的沸点和凝固点 4、为什么溶液的沸点上升、凝固点下降?
第二章稀溶液的依数性

第一节 溶液的蒸气压下降
一、蒸气压 二、溶液的蒸气压下降
5
一、蒸气压
1. 相:系统中物理性质和化学性质完全相同的 组成部分称为一相。 固相 s 液相 l
气相 g
均相
多相
相界面
6
一、蒸气压
2.蒸气压的定义、符号、单位
蒸发
H2O(l)
凝聚
H2O(g)
水的饱和蒸汽压,简称水的蒸汽压
用凝固点降低法测定溶质的 摩尔质量时,先测纯溶剂的 凝固点,再测溶液的凝固点 ,求出溶质的摩尔质量。测 定时,由于实验条件下做不 到无限慢的冷却,而是较快 速强制冷却,所以会出现过 冷现象。
24
例 从尿中提取出一种中性含氮化合物,将90mg 纯 品溶解在 12 g 蒸馏水中,所得溶液的凝固点比纯水 降低了 0.233 K, 试计算此化合物的相对分子质量。 解:Kf=1.86 K · · -1 kg mol 该中性含氮化合物的摩尔质量为:
5.渗透平衡
27
6.渗透压力(osmotic pressure)
1)定义: 将纯溶剂与溶液以半透膜隔开 时, 为维持渗透平衡所需要加给溶液 的额外压力。
2)符号:Π 3)单位:Pa 或 kPa P=Π浓-Π稀
P <Π
P =Π
P >Π
7.反向渗透(reverse osmosis):使渗透作用逆向进行的过程
T↑ p↑
表2—1 不同温度下水的蒸气压
p/kPa
P/kPa
19.9183 35.1574 47.3426 70.1001 101.3247 476.0262
8
一、蒸气压
4.固体也有蒸气压(升华)
一般情况下固体的蒸气压较小;固体的蒸气压也随T↑ p↑
稀溶液的依数性
解: △Tb=0.234K bB =0.1mol/kg
根据:△Tb= Kb bB
Kb
Tf bB
0.234 0.1
2.34K kg mol 1
MB
2.34 1000 2.830 0.41 63.00
=256g/mol
18
2.2 溶液的沸点升高和凝固点降低
凝固点 freezing point
27
2.2 溶液的沸点升高和凝固点降低
如AB型电解质(如KCl、KNO3、CaSO4等 其i 值趋近于2。
AB2或A2B型电解质(如MgCl2、CaCl2、 NaSO4等),其i 值趋近于3。
所以,对于电解质溶液:
△Tb=i Kb·bB
△Tf=i Kf·bB
28
2.3 溶 液 的 渗 透 压 力
Tf Kf bB
bB
20.0 1.86
10.75mol/kg
则根据题意:1000g水中应加入10.75mol甘油,
其质量为:10.75×92=989g
25
2.2 溶液的沸点升高和凝固点降低
思考题 为测定某多糖的相对分子质量,将其配
成质量浓度为5.9%的水溶液,测得其冰点下 降值为0.23K,已知水的冰点下降常数Kf = 1.86,求该多糖的相对分子质量。
7
2.1 溶 液 的 蒸 汽 压 下 降
p/ kPa
蒸气压下降曲线
纯溶剂
稀溶液
T/oC
8
2.1 溶 液 的 蒸 汽 压 下 降
纯溶剂
溶液
溶液的表面被一部分难挥发非电解质的分
子占据着,这样在单位时间内从溶液的液面逸
出的溶剂分子比纯溶剂减少。
第二章 稀溶液的依数性

17.1g nB 0.0500 mol 1 342g mol
100g nA 5.66mol 1 18.0g mol
5.56mol xA 0.991 5.56mol 0.0500 mol
p p xA 2.34k Pa 0.991
0
2.32k Pa
二、溶液的蒸气压下降
四、渗透压在医学上的意义
衡量溶液渗透压的大小:
Π~c Π ~ ic
(一) 渗透浓度:
渗透活性物质(溶质粒子包括分子、离子)的总浓度, 符号为c os,单位为mol· L-1 或mmol· L-1 。 非电解质溶液: c os=
二、Van’t Hoff 定律*
解: 首先计算该溶液的浓度:
cRT
1.33 4 1 c 5.37 10 mol L RT 8.31 298 Hb的摩尔质量:
35.0 4 1 M 6.52 10 g mol 4 5.37 10
二、Van’t Hoff 定律*
渗透(现象): 溶剂分子透过半透膜从纯溶剂进入溶液中的过程。 渗透现象产生的条件: (1)半透膜的存在 (2)半透膜两侧单位体积内溶剂的个数不等 稀 浓
非电解质溶液 :稀溶液和浓溶液之间也会产生渗透现象
一、渗透现象和渗透压
渗透方向:
溶剂净转移的方向
( 1 )溶剂分子总是从纯溶剂通过半透膜向溶 液渗透;(2)从浓度小的溶液向浓度大的溶液(非 电解质溶液)渗透 溶剂分子从单位体积内溶剂分子数目多的一侧 向溶剂分子数目少的一侧运动。
二、溶液的蒸气压下降
显然:溶液中难挥发的溶质浓度越大,Δ p下降越多
二、溶液的蒸气压下降
Raoult*(拉乌尔)定律:p = p0· xA xA为溶剂的摩尔分数。 在温度一定下,难挥发性非电解质稀溶液的蒸气压 等于纯溶剂的蒸气压与溶剂摩尔分数的乘积。 由于xA<1,所以p<p0 xA+xB=1 xB为溶质的摩尔分数。 xA = 1- xB p= p0(1- xB) △p= p0-p = p0xB 适用条件:1难挥发性2非电解质的3稀薄溶液*。
第二章稀薄溶液的依数性

二、溶液的 渗透压力与浓度、温度的关系 定义:为维持只允许溶剂通过的膜所 隔开的溶液与溶剂之间的渗透平衡而 需要的额外压力。 符号:∏
渗 透 压 力
单位: Pa(帕)或 kPa(千帕)
van’t Hoff 渗透压力方程式: ∏ = cB R T
注意: ∏的单位!
∏
cB
R
T
Pa
kPa
mol· m-3
H2O(l)
凝聚(condensation)
H2O (g)
蒸气压:与液相处于平衡时的蒸气所具
有的压力称为该温度下的饱和蒸气压。
蒸气压的符号:p;
单位:Pa(帕)或 kPa
易挥发性物质:相同温度下蒸气压大的物 质; 难挥发物质:相同温度下蒸气压小的物质。
蒸气压的特点: *与液体的本性有关;
*随温度的升高而增大;
(一)液体的沸点
定义:液体的蒸气压等于外界压力时的温 度。 正常沸点:在外压为101.325kPa下的液体 沸点称为正常沸点。 (二)溶液的沸点升高 定义:难挥发非电解质稀溶液的沸点高于纯 溶剂的沸点,这一现象称为溶液的沸点升高。
原因:溶 的蒸气 压低于纯 溶剂的蒸 气压。
pθ
纯溶剂 固态 纯溶剂
*固体的蒸发称为升华,多数固体的蒸 气压较小且也随温度升高而增大。
二、溶液的蒸气压下降——Raoult定律
实验结果:含有难挥发性溶质溶液的蒸气
压总是低于同温度纯溶剂的蒸气压。
原因:*动力学
*平衡移动原理
Raoult定律: p = p0 xA 因为xA = 1 - xB,则有: (1)
△ p = p 0 - p = p0 x B
血浆中的大分子物质形成的渗透压力。
由于间隔血液与组织液的毛细血管壁除了水分 子能通过外,各种盐类的离子也能通过,只有蛋白 质等胶体物质的大分子或大离子不能通过,所以胶
第2章稀溶液的依数性
1.测定体液渗透压有什么意义? 2.渗透压力的测定步骤: 了解血液透析的原理(自学)
60
练习
1、相同温度下,下列溶液中渗透 压最大的是 A、0.01mol/L CaCl2 B、0.2mol/L 蔗糖溶液 C、生理盐水 0.154 mol/L (NaCl)
6
重
蒸气压P (饱和蒸气压):
点
在一定温度下,液相和气相达到平 衡,此时,蒸气所具有的压力。
蒸气压的特点 P12:表2-1
T愈大,P愈大
7
重
纯固体的蒸气压
点
升华
H2O(s) 凝结 H2O(g)
冰
-25℃
与固相处于平衡时的蒸气所 具有的压力。
P.13.表2-2 T愈大,P愈大
8
重
蒸气压的特点
点
P12:表2-1,2-2
溶液的渗透压()
3
第二章 稀溶液的依数性 第一节 溶液的蒸气压下降 第二节 溶液的沸点升高和凝固点降低 第三节 溶液的渗透压
4
第一节 溶液的蒸汽压下降 钟罩实验
5
一、蒸汽压
蒸发
H2O(l) 凝结
H2O(g)
Po
H2O 25℃
溶液中有少数能量较大的分子有脱 离母体进入空间的倾向------逃逸倾向。
凝固点: Pb = Pf
0.610 0
T/ 0C
11
练习题
判断:
由于乙醇比水易挥发,故在相同温度
下,乙醇的蒸汽压大于水的蒸汽压。
12
重
三、溶液的蒸气压下降(△P) 点
难挥发性的溶质:本身并不产生 蒸气压(葡萄糖、尿素)
H2O
25℃
葡萄糖
第二章 稀溶液的依数性
应用
1、推算溶质的摩尔质量
Tf Kf bB
同理可推出
Kf
mB / M B mA
MB
Kf
mB Tf mA
MB
Kb
mB Tb mA
MB
K
mB P mA
凝固点降低 法 沸点升高法
溶液
溶剂
对于溶剂,形同虚设
溶液
溶剂
阻止了溶质的扩散
2、渗透现象:
溶剂分子通过半透膜发生的表面上单方向的迁移。
渗透方向:从稀溶液向浓 产生条件 溶液进行。
有半透膜 膜两侧有浓度差
额外的外压
P
P 溶液
溶剂
溶液
溶剂
渗透平衡
有半透膜 膜两侧有浓度差 膜两侧有合适的压力差
一种
渗透压力 外压
为了维持渗透平衡,必须在溶液液面上施加一超额的压力。
Raoult定律
在一定温度下,难挥发性非电解质稀溶液的蒸气压等于纯
溶剂的蒸气压(P0)乘以溶液中溶剂的摩尔分数(χA )。
p P0A
由于: A B 1
所以: 即:
p p0 1 B
p p0B
p0 p p0B
对于稀溶液 B bB
p KbB
表明 :
稀溶液的蒸气压下降与溶液的质量摩尔浓度成正比 。即 难挥发性非电解质稀溶液的蒸气压下降只与一定量的溶 剂中所含溶质的微粒数有关,而与溶质的本性无关。
是溶液蒸气压下降的直接结果
P (k Pa)
100
纯水
水溶液
△Tb
373
TB
稀溶液依数性
p p>
淡水
盐水
反渗透法净化水
例:海水在298K时的渗透压为1479kPa,采用反渗透 法制取纯水,试确定用1000cm3的海水通过只能使水透 过的半透膜,提取100cm3的纯水,所需要的最小外加
渗透现象在动植物的生命过程中有着重要的作用, 例 1、医学上输液必需输等渗溶液。 2、动物体内水份的输送。 3、植物从土壤中吸收水份和营养。 4、求算溶质的分子量。
输入高渗溶液
输入低渗溶液
实验证明: 1、同一温度下,溶液的渗透压与浓度成正比。 2、相同浓度时,渗透压与热力学温度成正比。 计算公式: πV = n(B)RT (溶液很稀时, c(B) ≈ b(B) ) c(B): 物质的量浓度
c(葡) = 709.275/8.314×(273.15+37) = 0.28 mol.L-1 w = c(葡) · M/1000· ρ
=0.28×180/1000×1.01= 0.05
例:
某蛋白质的饱和溶液含溶质5.18g.L-1,293.15K
时渗透压为0.413kPa,求此蛋白质的摩尔质量。
0.434 0.494 0.538
强电解质溶液也有依数性,但不遵守拉乌 尔定律故不可用稀溶液依数性的公式进行计算
不同物质溶液依数性的比较
① 0.1mol.L-1 NaCl 水溶液
②
③
0.1mol.L-1
0.1mol.L-1
蔗糖水溶液
甘油水溶液
④
⑤
0.1mol.L-1
0.1mol.L-1
Na2SO4水溶液
第2章 稀溶液的依数性_终稿
第二章 稀溶液的依数性1.溶液的蒸气压下降、沸点升高、凝固点降低和渗透压力等性质只与溶质、溶剂微粒数的比值有关,而与溶质的本性无关,因为这类性质的变化规律只适用于稀溶液,所以统称为稀溶液的依数性。
难挥发性非电解质稀溶液的四种依数性之间关系密切,知道一种依数性则可以求出另一种依数性:b f B b f T T p Πb K K K RT∆∆∆==== 2.蔗糖溶液中水的摩尔分数为()-12-1-1100g/18g mol H 00.991(17.1g/342g mol )(100g/18g mol )x ⋅==⋅+⋅ 蔗糖溶液的蒸气压为p = p 0 x (H 2O) = 2.338 kPa ×0.991= 2.32 kPa3.水的K f =1.86K ·kg ·mol -1,则-13-119.0g []=1.86K kg mol 1. 6110g mol 0.220K 0.100kgM ⋅⋅⨯=⨯⋅⨯生物碱 由计算结果可知,该生物碱的相对分子质量为1.61×103。
4.溶剂分子通过半透膜进入溶液的自发过程称为渗透作用,简称渗透。
渗透压力:为维持只允许溶剂分子通过的膜所隔开的溶液与溶剂之间的渗透平衡而需要在溶液液面上施加的超额压力等于渗透压力。
产生渗透现象的条件:(1)必须有半透膜存在;(2)半透膜两侧相同体积的液体中溶剂分子数目不相等。
5.葡萄糖溶液与海水等渗,П=3.00×106 Pa ,依据公式B Πc RT =得()3-1-1-13.0010 kPa 1.21mol L 8.314kPa L K mol 298.15KΠc RT ⨯===⋅⋅⋅⋅⨯葡萄糖 由计算结果可知,该葡萄糖溶液的浓度为1.21 mol ·L -1。
6.水的K f =1.86K ·kg ·mol -1,M (KNO 3)=101g·mol -1,M (Na 2SO 4)=142 g·mol -1,依据公式f f B T K b ∆=得()-1-1f 310.0g/101g mol KNO 1.86K kg mol 0.184K 1kg T ⋅∆=⋅⋅⨯= ()-1-1f 2410.0g/142g mol Na SO 1.86K kg mol 0.131K 1kg T ⋅∆=⋅⋅⨯= 根据计算结果,凝固点降低较多的应是KNO 3溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
L= (6.022 136 7±0.000 003 6)×10 23mol -1
——1986年修订
两个含义: 摩尔不是质量的单位; 基本单元要指明,可以是原子、分子、 离子以及其他粒子或这些粒子的特定组 合体。
物质B的物质的量可根据质量和摩尔质量求算:
nB = m B / M B
三、物质的量浓度(简称:浓度 ) (amount-of-substance concentration)
★定义:溶质的物质的量除以溶液的体积。
cB nB V
★符号:c(B) 或cB ★单位:mol·m-3。 常用mol·dm-3,mol·L-1、mmol·L-1 及 μ mol·L-1。
应用:
2. 抗凝剂:汽车冷却水中加入甘油或者乙二醇
3. 化合物纯度检验:存在杂质时,凝固点下降,
ΔTf ↗, 杂质↗,纯度↘
4.测定细胞汁液和土壤溶液的物质的组成量度
5.植物利用依数性进行自身调节对抗外界环境
如冬天,细胞中可溶物大量溶解,Tf下降; 夏天,蒸气压下降,减少水分散失。
判断对错
将相同质量的葡萄糖和尿素分别溶解
第二章 稀溶液的依数性
Colligative Properties of Diluted Solution
主要内容
分散系统与混合物的组成标度 稀溶液的依数性
溶液的蒸汽压下降 溶液的沸点升高 凝固点降低 溶液的渗透压力
第一节 分散系统与混合物的组成标度
分散系按分散相粒子的大小分类
粒子直径 <1nm 类型 分子分散系(溶液)
溶液的组成标度
物质的量 摩尔质量 五 个 概 念 物质的量 浓度 摩尔分数
符号:nB,单位:mol 符号:MB,单位:kg· mol-1 符号:cB,单位:mol· L-1
符号:xB,无单位 符号:bB,单位:mol· kg-1
质量摩尔 分数
一、物质的量 (amount of substance)
胶 体 分 散 系
粒子组成 小分子或小离子 胶粒(分子、离子、 原子的聚集体)
实例 生理盐水 氢氧化铁溶胶
溶胶
1~100nm >100nm
高分子溶液
高分子
粗粒子
蛋白质溶液
牛奶
粗分散系(悬浊液、 乳浊液)
溶液的组成标度
组成标度——描述溶质与溶剂的相对含量,
决定溶液的物理性质和化学性质。
百分比浓度:w/w, v/v 比例浓度:1:x ppm和ppb (part per million/billion) 物质的量浓度 质量摩尔浓度 摩尔分数
在100g水中,则形成的两份溶液在温度
相同时的Δp、ΔTb、ΔTf均相同。
( ×)
有下列水溶液:① 0.100 mol· kg-1的C6H12O6
② 0.100 mol· kg-1的NaCl ③ 0.100 mol· kg-1Na2SO4。 在相同温度下,蒸气压由大到小的顺序是 A. ②>①>③ B. ①>②>③ ( B )
溶液蒸气压的下降值Δp:
Δp = p o - p = po- po xA Raoult定律 xB为溶质的摩尔分数
= po (1- xA )
= po xB 稀溶液中,nA>> nB ,因而nA + nB ≈ nA,
xB nB nB nB mA nA nB nA MA
所以 xB ≈ bB MA 得Δp = po xB ≈ po MA bB = K b B
符号b.p. 或bp (boiling point) 正常沸点:指外压为101.3kPa时的沸点。
※不同物质,沸点不同
------ 蒸馏(distillation) ※同一物质,不同外压时,沸点不同 ------ 减压蒸馏、加压消毒、高压锅
稀溶液的沸点升高
溶液的沸点升高
boiling point elevation
148 g mol
1
持续低温与潮湿空气交织, 京广高速韶关湖南路段冰雪 严重,道路中断。
融雪剂
原理:融雪剂溶于水(雪)后,其冰点在零度以下,如, 氯化钠融雪剂溶于水后冰点在-10℃,氯化钙在-20℃左 右,醋酸类可达-30℃左右。
2008年1月17日 《楚天都市报》
聪明的你, 还可以举出更多例子吗?
CuSO4溶液
KMnO4溶液
由溶质的本性决定。如
颜色、相对密度、导电
性、粘度等
溶液的性质
溶质微粒数与溶剂微粒 数的比值
稀溶液的依数性
蒸气压下降,沸点升高,凝固点降低 ,渗透现象。 这些性质只与溶质与溶剂微粒数的比值有关,而
与溶质的本性无关,这一性质称为稀溶液的依数
性。 只适用于难挥发的非电解质稀溶液(0.1mol· kg-1 以下)。 对浓度较大的溶液,由于溶质的溶剂化及溶质微
思考题
难挥发性非电解质溶液在敞开容器中沸腾时, 沸点将会:( A)
A、不断升高 B、不断降低 C、恒定 D、不可预测
三、溶液的凝固点降低
freezing point depressing
凝固点与熔点: 固相与液相平衡共存时的温度, 该温度下固相与液相蒸气压相等 纯水的凝固点-冰点
Pl=Ps
稀溶液的沸点升高
C. ②>③>①
E. ①>③>②
D. ③>②>①
四、渗透现象(osmosis)
原始深林中,有的树木可达100m以上,其能够从 地表供给树冠养料和水分的动力是( C) A、因外界大气压引起的树干内导管的空吸作用 10.3m B、树干中微导管的毛细作用 30m C、树内体液含盐浓度大,渗透压大 人类不能直接饮用海水的原因是( C ),海鸥为 什么能直接饮用海水? A、不卫生 B、含有致癌物质 C、含盐量高 D、有苦味
溶液蒸气压的下降值Δp:
由溶剂的po蒸气压和MA决定; 定温下为常数
Δp = K b B
结论:温度一定时,难挥发性非电解质稀溶液的蒸 气压下降与溶质的质量摩尔浓度bB成正比,而与溶 质的本性无关。
二、沸点升高 (Boiling point elevat大,液面上升越多。
加入葡萄糖越多,蒸气压下降越多
纯溶剂、溶液蒸发和凝结的示意图
气 相 液 相 纯溶剂 含非电解质稀溶液
溶剂分子
溶质分子
P < P0
Raoult定律
对于难挥发性的非电解质 稀溶液,溶 质浓度愈大,溶剂的摩尔分数愈小,蒸 气压下降愈多。
p=
o p x
A
po — 纯溶剂的蒸气压, p — 稀溶液溶剂的蒸气压, xA — 溶液中溶剂的摩尔分数。
N0
N
溶剂的表面 溶剂分子
溶液的表面 难挥发溶质的分子
当平衡时,N < N0 ,有 p < p0 当溶液与气相实现平衡时,蒸气压小于 其饱和蒸汽压 p, 平衡右移,液体气化;蒸气压大于 p 时,平衡左移,气体 液化。
H2O 糖水
H2O 糖水
过程开始时,水和糖水均以蒸发为主。当蒸气压等 于p时,糖水与上方蒸气达到平衡。而p0>p ,即水并 未与蒸汽达到平衡,继续蒸发,以致于蒸气压大于 p,水蒸气分子开始凝聚到糖水中。这又使得蒸气压 不能达到p0 …… 于是, H2O 分子从水中蒸出而凝聚 入糖水。
溶剂中加入难挥发性溶质后,溶液的蒸气压下降, 要使溶 液蒸气压等于外压,必须提高温度。 沸点升高值ΔTb : ΔT b = T b - T b o = Kb bB
Kb-溶剂沸点升高常数,只与溶剂的本性有关,
不同溶剂,Kb不同。
结论:难挥发性的非电解质稀溶液的沸点升高只与 溶质的质量摩尔浓度有关,而与溶质的本性无关。
2、蒸气压与物质本性有关: 蒸气压越大,越易挥发,沸点越低。
H2O 糖水
H2O 糖水
水自动转移到糖水中去,为什么
?
纯溶剂的饱和蒸气压 ( p0 )
液体
蒸 发
气体
凝
聚
达到平衡后,若蒸气压小于 p0 时,平衡右 移,液体气化;蒸气压大于 p0 时,平衡左移,
气体液化。
譬如,改变上方的空间体积, 即可使平衡发生移动。
四、渗透现象(osmosis) 渗透现象
半透膜实例: 细胞膜、膀胱 膜、肠衣、鸡 蛋膜等
半透膜示意图
渗透现象产生的原因 c左 < c右
实验测定25 ℃时,水的饱和蒸气压:
组成 纯水 糖水 糖水 b (mol ·kg-1) 0 0.5 1.0 p (kPa) 3167.7 3135.7 3107.7
结论:
1. 溶液的蒸气压比纯溶剂低
2. 溶液浓度越大,蒸气压下降越多。
打开开关??
浓度越大??
U形管右边液面上升,左边液面下降。
加入葡萄糖,蒸气压下降
M B = K f m B / m AΔT f
凝固点降低测分子量
例 取0.749g谷氨酸溶于50.0g水,测得凝固 点为-0.188℃,试求谷氨酸的摩尔质量。
解: ΔTf = Kf b B = Kf(mB/MB)/mA
MB = Kf mB /mAΔTf
1.86 K kg mol 1 0.749 g MB 0.148kg mol 1 50.0 g 0.188K
气相
p低 p高
液相(水/溶液)
固相(冰)
水和溶液的冷却曲线 (1):纯水(理想);(2):纯水(实际); (3):溶液(理想);(4):溶液(实际);
凝固点降低的原因:溶液的蒸气压下降 凝固点下降值: ΔTf = Tfo – Tf = Kf b B
Kf -溶剂的凝固点降低常数
只与 溶剂本性有关。 应用: 1 .测定溶质的相对分子质量 ΔTf = Kf b B = Kf(mB/MB)/mA
