麦氏比浊法确定细菌浓度
麦氏比浊法确定细菌浓度的原理和操作步骤

麦氏比浊法确定细菌浓度的原理和操作步骤以麦氏比浊法确定细菌浓度的原理和操作步骤为标题一、原理麦氏比浊法是一种常用的确定细菌浓度的方法,其原理是利用细菌悬浮液对光的散射作用,通过测量光的透射度来确定细菌的浓度。
细菌悬浮液越浓,对光的散射就越强,透射度就越低。
二、操作步骤1. 准备工作a. 准备所需材料:细菌悬浮液、比色皿、比色计、移液器、离心机等。
b. 将比色皿用去离子水清洗干净,确保无杂质。
c. 打开比色计,进行预热,使其达到工作温度。
2. 准备细菌悬浮液a. 选择需要测定浓度的细菌液体培养物。
b. 用移液器取适量的细菌液体培养物,加入一定量的去离子水,制备一系列不同浓度的细菌悬浮液。
c. 将细菌悬浮液进行均匀摇匀,确保细菌分布均匀。
3. 开始测定a. 将比色皿放入比色计中,调整为透射模式。
b. 在比色皿中加入一定量的去离子水作为空白对照组。
c. 将细菌悬浮液加入另一个比色皿中,确保液面平整,避免气泡产生。
d. 将比色皿放入比色计,调整为透射模式,记录下透射度数值。
e. 重复上述步骤,分别测定不同浓度的细菌悬浮液的透射度。
4. 统计数据a. 将测得的透射度数值记录下来,建立细菌浓度与透射度之间的对应关系。
b. 绘制透射度-浓度曲线图,根据图像确定未知浓度细菌悬浮液的浓度。
5. 计算浓度a. 根据绘制的透射度-浓度曲线图,找到未知浓度细菌悬浮液对应的透射度数值。
b. 根据透射度和对应关系,计算出未知浓度细菌悬浮液的浓度。
6. 结果分析a. 根据计算结果,得到未知浓度细菌悬浮液的浓度。
b. 将测定结果与实际浓度进行比较,评估测定的准确性和可靠性。
总结:通过麦氏比浊法可以快速、简便地测定细菌悬浮液的浓度。
其原理是利用细菌悬浮液对光的散射作用,通过测量光的透射度来确定细菌的浓度。
操作步骤包括准备工作、准备细菌悬浮液、开始测定、统计数据、计算浓度和结果分析。
通过该方法可以得到准确的细菌浓度,为后续的实验和研究提供可靠的数据支持。
比浊法测定菌浓度的原理

比浊法测定菌浓度的原理比浊法是一种用于测定液体中菌量的有效方法,它经常被用于检测各种致病菌和乳酸菌的浓度。
比浊法的基本原理是利用菌产生的浊度来检测菌的数量,从而计算出菌的浓度。
比浊法的基本原理是,当添加细菌到液体中时,细菌将产生浊度,即颗粒性物质的浓度增加。
这将导致液体变得混浊,并且浊度与菌的数量成正比。
因此,可以通过测量液体的浊度,来推算出菌的数量。
比浊法的测定菌浓度的具体步骤如下:首先用液体中的细菌培养一定的时间,使细菌的数量及浊度达到一定的水平;其次,在灭菌的情况下,称取一定体积的液体;然后,根据液体的浊度,推算出菌的数量;最后,把结果乘以测试液体的体积,即可计算出菌浓度。
比浊法虽然简单,但是它的测定结果还是很可靠的。
它可以快速、准确、灵敏地检测出菌浓度,使得很多实验可以得到精确的测定结果。
比浊法能够快速检测各类致病菌和乳酸菌的浓度,为疾病的预防和控制提供了有效的技术手段。
比浊法的基本原理就是利用细菌产生的浊度来检测菌的数量,从而计算出菌的浓度。
比浊法可以快速、准确、灵敏地检测出菌浓度,使得很多实验可以得到精确的测定结果。
然而,比浊法有时也可能出现误差,比如细菌的浊度变化太小,以致计算出的浓度偏低,这时就需要借助其他方法进行检测,以保证检测结果的准确性。
综上所述,比浊法是一种用于测定液体中菌量的有效方法,它基本原理是利用细菌产生的浊度来检测菌的数量,来推算出菌的浓度。
它可以快速、准确、灵敏地检测出菌浓度,使得很多实验可以得到精确的测定结果,为疾病预防和控制提供了有效的技术手段。
然而,比浊法也存在一定的误差,所以除了比浊法,还可以借助其他方法来检测菌量,以确保检测结果的准确性。
比浊法测定菌浓度的原理

比浊法测定菌浓度的原理比浊法是一种常用的微生物检测方法,可用来测定微生物的菌浓度。
这种方法可以测出特定微生物的菌群数量,是比较有效的方法之一。
比浊法是利用菌群生长及其产生的悬浮液来测定菌浓度的方法,它基本上是建立在菌体能够因其自身存在而改变液体浊度和颜色的特性上。
一般来说,比浊法采用比较液体的浊度来测定菌浓度。
在比浊法的过程中,先用一定的消毒剂对样本中的微生物进行杀菌,然后在被杀菌的样品中添加测定菌的抗原,并将样品加入到特定的培养基中培养,直到浊度达到一定的数值。
在比浊法中,可以获得两种不同的样品,一种是未被杀菌的“原始样本”(原始浊度),一种是被杀菌后的“杀菌样本”(杀菌浊度)。
湮没样本(原始浊度)和杀菌样本(杀菌浊度)的浊度比值就是菌群数量的测定值。
比浊法可以用来测定菌群的菌浓度,它主要用于清洗送食物、准备食品添加剂或添加化学消毒剂时,检测出消融液中的细菌浓度,也可以用来检测水份或受污染的土壤中的微生物浓度。
比浊法测定菌浓度的原理是微生物的存在会改变液体的浊度和颜色。
其基本原理是,测定在一定条件下,杀菌前和杀菌后液体的浊度比值,可以用来测定菌浓度。
比浊法测定菌浓度还需要准备一些硬件设备,如:可以同时测定多种悬浮液浊度的浊度仪、溴化钾灯、温度控制器、细菌孢子夹及相关的实验室材料和装备。
比浊法测定菌浓度的步骤如下:1.准备样品:根据检测的内容,准备可检测的样本。
2.加入消毒剂:将消毒剂加入样本中,用于杀菌。
3.添加测定菌:将测定菌添加到样本中,以形成新的混合液。
4.培养:将混合液培养到一定浊度。
5.监控样品:定期监测样品,以定期比较原始样本和杀菌样本的浊度比值,从而获取悬浮液中菌浓度值。
以上是比浊法测定菌浓度的原理和步骤,比浊法是一种比较有效的微生物检测方法。
它可以用来测定水中、食物中和受污染的土壤中的细菌浓度,从而保证我们的饮食健康。
麦氏比浊法及麦氏比浊管配制

麦氏比浊法及麦氏比浊管配制在临床微生物学检验中,麦氏比浊法常用于细菌鉴定、药敏实验前配置菌液时大致判断菌液浓度的一种方法,通常认为,如将配菌液浓度配成0.5麦氏比浊管时,相当于1.5×108细菌数/ml,由于方法本身就是一种估计的方法,所以尽管不同细菌大小差异很大,除了真菌孢子,细菌的差别不大,结果不会有影响。
但是,标准比浊管的浓度,是药敏实验结果的影响因素之一。
K-B法药敏试验时接种物配制有两种方法,第一种是肉汤增菌法(对数生长法),是用接环挑取3-5个细菌菌落入肉汤增菌管中进行增菌4-6小时,然后用生理盐水或肉汤对增菌管中的培养物进行稀释校正使其浓度达到0.5麦氏比浊标准(因为经过增菌培养其培养物浓度一般都高于此标准)。
第二种方法是直接菌落法:从孵育18-24小时的非选择性培养基上,挑取3-5菌落,直接用肉汤或盐制成悬液作为接种,然后将浊度调整至0.5麦氏比浊标准。
此法是检测苛养菌(如嗜血杆菌、淋病奈瑟菌和链球菌)和潜在的对甲氧西林耐药的葡萄球菌的推荐方法。
0.5麦氏比浊管配制方法:(1)0.048M BaCL2 (1.17% W/V BaCL2 . 2H2O) 0.5ml0.36N H2SO4 (1%, V/V) 99.5ml(2)将二液混合,按每管4-6mL将硫酸钡悬液分装于带悬盖的管子中,管子尺寸应与培养或稀释接种菌所用的管子一致。
应密封并贮存于室温避光处。
保存有效期为6个月。
(3)每次使用前,应将浊度标准管置于旋转混匀器上剧烈振动,目测其外观浊度应均匀一致。
若有大颗粒出现,此标准管应更换。
(4)使用前核实其正确浓度,每个月都应证实或更换。
浊度标准的正确浓度应使用分光光度计测定吸光度核实。
该分光光度计光径为1cm,并配有合适的比色杯。
0.5号麦氏标准管在625nm处的吸光度值应为0.08-0.10。
(5)应用时,可目测或使用比浊仪即可。
抗菌药物最低抑菌浓度(MIC)的测定

抗菌药物最低抑菌浓度(MIC)的测定实验目的:通过采用常量稀释法, 检测几种抗菌药物对A8、A9、D5菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
【试剂与器材】1.试剂⑴主要仪器设备:三角烧瓶、高压灭菌器、内径90mm平皿、试管、0.5麦氏标准比浊管、天平、接种环、吸头、微量加样器、胶布、分光光度计、酒精灯等。
⑵试验药品:培养基基础粉(酸水解酪蛋白/酸水解酪素、牛肉浸膏粉、淀粉、琼脂)、纯水(蒸馏水)、电炉、牛皮纸、线、抗菌药物、无菌生理盐水、蒸馏水、pH6.0 0.1mol/L 磷酸盐缓冲液。
⑶试验菌株:A8、A9、D5菌株、标准株大肠杆菌。
在肉汤或琼脂中将抗菌药物进行一系列(对倍)稀释后定量接种待检菌,35℃孵育一定时间后,观察抑制待检菌肉眼可见生长的最低药物浓度,即为该药物对待检菌的最低抑菌浓度(MIC)。
【试验方法】肉汤稀释法试管稀释法(常量稀释法)【原理】用MH肉汤将抗菌药物作不同浓度的稀释,再接种待检菌,定量测定抗菌药物抑制或杀灭待检菌的最低抑菌浓度(MIC)。
【操作步骤】①抗菌药物原液制备:配制抗菌药物原液的溶剂和稀释剂大多采用蒸馏水、pH6.0,0.1mol/L磷酸盐缓冲液等。
抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
公式为:质量(mg)=溶剂(ml)x浓度(μg/mg)/分析效能(μg/ mg)表1 稀释法中常用的抗菌药物容积稀释法②药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
表2常用药敏纸片试验方法:1.用记号笔在培养基上标记待检菌名。
2.在已分纯的待检菌培养基上取4个~5个菌落,接种在4ml~5ml水解酪蛋白(MH)肉汤中,置35℃培养4h~6h,链球菌、嗜血杆菌等需用加血的肉汤增菌并孵育过夜。
麦氏比浊管 悬液中细菌浓度估计

麦氏比浊管悬液中细菌浓度估计麦氏比浊管是McFarland发明的一种用于微生物比浊的不同浊度的标准浊度管。
具体的配制方法是根据硫酸和氯化钡的比例来定的,有表可查,这样不同比例生成的硫酸钡沉淀的浓度不同,且都有定值。
麦氏比浊管的配比如下:这是传统的麦氏比浊管的配制方法,目前也有市售的商品化产品,不需要自己配制,并且还有由乳胶粒子悬浮液制成的麦氏比浊管,与传统的麦氏比浊管相比,保存时间更长也更稳定。
但麦氏比浊管具体应该怎么使用呢?麦氏比浊管估计悬液中的细菌浓度具体操作方法1、轻摇标准试管。
2、无菌操作将被测定的肉汤培养物加到与标准管相同直径(大小)的无菌试管中。
3、以无菌操作向被测定试管加入无菌生理盐水(NaCl),直到浓度与所要求的标准管的浓度相同。
4、直接用眼睛看(需要经验,误差较大)。
5、找张白纸,打上平行直线,然后观察读数(如图示,利用光在不同浓度液体折射不同)。
例如,需配大约100cfu/mL 的细菌菌液浓度:1.无菌操作用接种环挑取测试细菌的纯培养物到盛有一定量无菌生理盐水管中,混悬。
2.以比色卡作为背景目测,直到浊度与0.5 麦氏比浊标准管的浊度相一致,如上图所示。
3.0.5 号麦氏浊度标准管相当于1×108CFU/mL 浓度,以此为参照值,取1mL 浊度跟0.5 号麦氏浊度标准管相一致的菌悬液到9mL 无菌生理盐水管中,作10 倍梯度稀释107、106、105……,102 稀释度含菌量大约为100cfu/mL。
注:1. 测试菌的纯培养物可以是冻干菌株复苏后纯培养物。
2.本法仅供细菌液浓度的粗略计算。
注意事项:1、如果测定的肉汤培养物不澄清,由培养物的值减去未接种培养基的值来校正细菌浓度。
2、如果肉汤颜色很深,把未接种试管放在标准管的后面读数即可。
3、测定好的细菌,最好做一下梯度稀释涂布计数。
4、此种方法测定的准确性不是很高,如果是对细菌数量要求较精确的,请用紫外分光光度计。
麦氏比浊仪提高细菌悬液计数准确性研究

麦氏比浊仪提高细菌悬液计数准确性研究摘要:目的:为了解决灵敏度实验、促生长实验、无菌检查、培养基适用性检查及控制菌检查等实验过程中利用肉眼观察加入的菌液浓度所造成的误差。
方法:采用麦氏比浊法和平板计数的方法进行菌液浓度的比对。
结果:将菌悬液的麦氏浊度控制在0.17~0.34McF时,能够通过菌液稀释,控制菌液浓度在100cfu/ml左右。
结论:该法使得在洁净区实验中能够简单快捷的判断细菌菌液浓度。
关键词:麦氏比浊法;细菌;菌悬液浓度Study on Improving the Accuracy of Bacterial Suspension Counting by McFarland’s TurbidimeterWU Min, MO Jingyan, SONG RenjieQuality Inspection, Jiangsu Zilong Pharmaceutical Co., Ltd of Yangtze River Pharmaceutical Group, Changzhou, 213000ABSTRACT Objective: To resolve the deviation caused by visual inspection of the bacterial suspension concentration in the process of sensitivity test, growth promotion test, aseptic test, suitability test of culture medium and bacteria control test. Methods: The bacterial suspension concentration was c ompared by means of McFarland’s turbidimetry and plate counting. Results:When the turbidity of microbial suspensionis controlled at 0.17-0.34McF, the concentration of microbial suspension can be controlled at about 100cfu/ml by diluting the microbial suspension. Conclusion: This method makes it easy and fast to judge the concentration of bacterial suspension inthe experiment of cleaning area.KEY WORDS McFarland’s turbidimetry; bacterial; bacterial suspension concentration在2015年版《中国药典》中“1100生物检查法”中的灵敏度实验、促生长实验、无菌检查、培养基适用性检查及控制菌检查等均有“加菌量不大于100cfu/ml”的要求。
抗菌药物最小抑菌浓度的测定
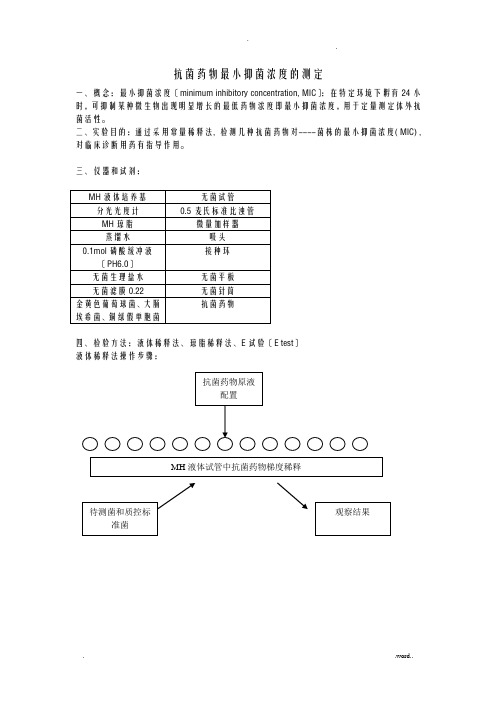
抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度〔minimum inhibitory concentration, MIC〕:在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:四、检验方法:液体稀释法、琼脂稀释法、E试验〔E test〕液体稀释法操作步骤:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进展计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平准确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:〔182.6 mg×750μg/ml〕/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度X围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度X围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton〔MH〕肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中参加2%〔W/V〕氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白〔MH〕肉汤中,35℃孵育2-6h。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
麦氏比浊法确定细菌浓度
麦氏比浊管是McFarland发明的一种用于微生物比浊的不同浊度的标准浊度管。
具体的配制方法是根据硫酸和氯化钡的比例来定的,不同比例生成的硫酸钡沉淀的浓度不同,且都有定值。
麦氏比浊管的配比如下:
操作方法
1、轻摇标准试管。
2、无菌操作将被测定的肉汤培养物加到与标准管相同直径(大小)的无菌试管中。
3、以无菌操作向被测定试管加入无菌生理盐水(NaCl),直到浓度与所要求的标准管的浓度相同。
麦氏比浊管使用技巧
1、直接用眼睛看(需要经验,误差较大)。
2、找张白纸,打上平行直线,然后看(利用光在不同浓度液体折射不同)。
麦氏比浊管使用注意事项:
1、如果测定的肉汤培养物不澄清,由培养物的值减去未接种培养基的值来校正细菌浓度。
4号管(肉汤培养物)-1号管(孵育过的未接种的肉汤管)=3号管(校正读数)。
2、如果肉汤颜色很深,把未接种试管放在标准管的后面读数即可。
