元素与物质的分类解析
元素与物质世界 第1节 元素与物质的分类

第2章 元素与物质世界
(3)元素与物质的关系 元素―组―成→单 化质 合: 物:_只_由__由__多__一__种__种__元__元__素__素____组组成成的的纯纯净净物物 (4)元素在物质中的存在形态 ①游离态:元素以_单__质__形式存在的状态。 ②化合态:元素以_化__合__物__形式存在的状态。 (5)混合物和纯净物 ①纯净物:_由__同__种__单__质__或__化__合__物__组__成__的__物__质__。 ②混合物:_由__几__种__不__同__的__单__质__或__化__合__物__组__成__的__物__质__。
栏目 导引
第2章 元素与物质世界
栏目 导引
第2章 元素与物质世界
题组 物质的组成与分类
1.(2019·福建质检)甲物质与强碱溶液反应只生成盐和水,甲一
定不属于( )
A.酸
B.盐
C.金属单质
D.氧化物
栏目 导引
第2章 元素与物质世界
解析:选 C。酸与强碱溶液发生中和反应,生成盐和水,A 项 不符合题意;NaHCO3 和 NaOH 溶液反应生成 Na2CO3 和 H2O, NaHCO3、Na2CO3 均属于盐,B 项不符合题意;能和碱反应的 金属为两性金属,其与碱反应生成盐和 H2,C 项符合题意;酸 性氧化物和强碱溶液反应生成盐和水,D 项不符合题意。
第2章 元素与物质世界
[自我检测] 判断正误,正确的打“√”,错误的打“×” (1)分子、原子、离子的概念及物质组成成分的判断 ①“天宫二号”使用的碳纤维是一种新型有机高分子材料。 (×) ②现在人们借助扫描隧道显微镜,应用 STM 技术可以“看”到 越来越细微的结构,并实现对原子或分子的操纵。 ( √ ) ③Na、NaCl、SiO2、H2SO4 都称为分子式。( × ) ④含有金属元素的离子不一定是阳离子。( √ )
高一化学必修一 2.1 元素与物质分类 讲义

2.1元素与物质分类考点1 元素与物质的关系1.根据元素组成对物质分类(1)元素具有相同核电荷数的一类原子的总称。
(2)元素组成物质元素――→组成⎩⎪⎨⎪⎧单质:同种元素组成的纯净物化合物:不同种元素组成的纯净物(3)纯净物与混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
③纯净物和混合物的区别纯净物 混合物 有固定的组成和结构 无固定的组成和结构 有一定的熔、沸点 无一定的熔、沸点 保持一种物质的性质保持原有物质各自的性质2.游离态与化合态元素以单质形式存在时,称为元素的游离态;元素以化合物形式存在时,称为元素的化合态。
3.“价-类”二维图主要表明氢化物、单质、氧化物、酸、碱、盐等类别的物质考点2 物质的分类与物质的性质1.酸性氧化物与碱性氧化物(1)酸性氧化物.(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)能与碱反应生成盐和水的氧化物叫酸性氧化物(注意只生成盐和水,不变价)。
注意:①酸性氧化物都能跟强碱反应,生成盐和水②大多数酸性氧化物能跟水化合生成酸(SiO2除外),不是全部。
③大多数酸性氧化物都可由非金属与O2化合生成点燃例如:①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3③C + O2CO2(2)碱性氧化物.(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)能与酸反应生成盐和水的氧化物叫碱性氧化物。
CaO、Fe2O3等大多数金属氧化物都是碱性氧化物(3)两性氧化物.既能与碱反应生成盐又能与酸反应生成盐和水的氧化物叫两性氧化物。
如Al2O3。
【注意】正确理解几个“一定”“不一定”(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
高中化学【元素与物质的关系 物质分类与物质性质】

1 2 3 4 5 6 41
5.下列物质中,与酸、碱、盐均能反应的物质是( )
A.K2O C.Na2CO3
B.CaCO3 D.CO2
C [K2O 不能与碱和盐反应,A 不符合题意;CaCO3 不能与碱和盐 反应,B 不符合题意;CO2 不能与酸反应,D 不符合题意。]
栏目导航
1 2 3 4 5 6 42
栏目导航
33
[解析] 据单质①能和酸②发生化学反应,推知①应为活泼金属单质 即为铁。酸只有稀硫酸,即②为稀硫酸,则氧化物④应为金属氧化物 CaO, 氧化物③为酸性氧化物,即 CO2。⑤属于盐且其溶液既能与 H2SO4 反应, 又能与 CaO 反应,则⑤应为 Na2CO3。
[答案] (1)Fe H2SO4 CO2 CaO Na2CO3 (2)Fe+H2SO4===FeSO4+H2↑ CaO+H2SO4===CaSO4+H2O Na2CO3+H2SO4===Na2SO4+CO2↑+H2O CO2+CaO===CaCO3
栏目导航
6
二、物质分类与物质性质 1.根据物质类别探究物质性质 (1)探究方法 ①判断陌生物质的物质类别,根据该类别物质的一般性质 及 相关反应规律预测该物质可能会与哪些类别的物质发生反应。 ②选择可能与该物质反应的各类物质的代表物,推断可能发生的具体 反应。 ③实验证明。
栏目导航
(2)探究示例
第2章 元素与物质世界
第1节 元素与物质分类 第1课时 元素与物质的关系 物质分
类与物质性质
2
学习目标:1.知道元素是物质的组成成分及元素的两种存在形态。2. 能从物质组成和性质的角度对物质进行分类,了解依据不同的分类标准对 物质进行分类。(重点)3.了解单质、氧化物、酸、碱、盐之间的相互转化 关系。(重点)
元素与物质的分类
第1节 元素与物质的分类一。
教材分析 (一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物—-单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
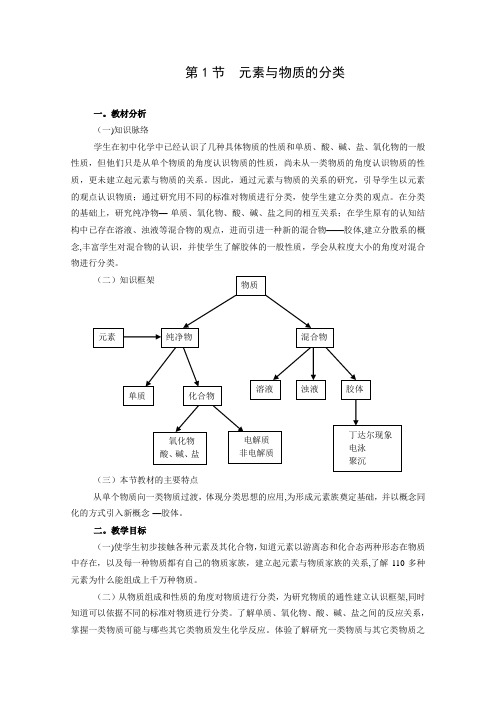
(二)知识框架(三)本节教材的主要特点从单个物质向一类物质过渡,体现分类思想的应用,为形成元素族奠定基础,并以概念同化的方式引入新概念-—胶体。
二。
教学目标(一)使学生初步接触各种元素及其化合物,知道元素以游离态和化合态两种形态在物质中存在,以及每一种物质都有自己的物质家族,建立起元素与物质家族的关系,了解110多种元素为什么能组成上千万种物质。
(二)从物质组成和性质的角度对物质进行分类,为研究物质的通性建立认识框架,同时知道可以依据不同的标准对物质进行分类。
了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与哪些其它类物质发生化学反应。
体验了解研究一类物质与其它类物质之物质元素纯净物混合物单质化合物溶液浊液胶体氧化物酸、碱、盐电解质非电解质丁达尔现象 电泳 聚沉间反应的关系的过程方法.(三)知道胶体是一种重要的分散系,了解胶体的丁达尔现象、电泳、聚沉等特性,能够列举生活中胶体的实例,了解胶体性质的简单应用.三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质.(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。
元素与物质的分类知识点总结优选版

选版知识点二元素与物质的分类一.元素与物质的关系:从本质上看,元素是物质的基本组成成分,物质都是由元素组成的;从数量上看,110多种元素组成了几千万种的物质。
二.元素的组成形式:(1)单质:相同一种元素自身组成的物质叫单质,有金属、非金属.(2)化合物:不同的元素之间组成的物质叫化合物。
①不同的元素之间可以形成不同的物质;②相同的元素之间可以形成不同的物质。
例如:O2和O3,CO和CO2三.元素的存在形态:(1)游离态:元素以自身形式结合成单质时的存在状态,此时的化合价为零价。
(2)化合态:元素与另外的元素之间结合成化合物时的存在状态,此时的化合价一般为正价或负价。
说明:同种元素在不同的化合物中可能呈现不同的价态。
例如CO中碳元素为+2价,但是CO2中碳元素为+4价。
四.物质分类的意义:物质的种类繁多、数量巨大,不可能逐一研究。
对物质进行科学分类,再分门别类地研究它们的结构、性质和用途,则容易找到有关规律,把握物质的本质属性和内在联系,来最大限度地服务于人类社会。
五.物质分类的方法:(1)按物质是否由同种物质(分子)组成,将物质分为纯净物和混合物。
由同种物质分子组成的物质叫纯净物;由不同物质的分子组成的物质叫混合物。
(2)按组成物质的元素的种类把纯净物分为单质和化合物。
(3)化合物的分类方法很多,如按化合物的性质分类,又把化合物分为酸、碱、盐、氧化物等;若按化合物在水溶液或在融化状态下是否导电,则可以分为电解质和非电解质;若按在化学反应中的表现,则分为氧化剂和还原剂。
(4)对于能与碱和酸反应的氧化物来说,又分为酸性氧化物和碱性氧化物。
能与碱反应生成盐和水的称为酸性氧化物,例如:CO2,SO2。
能与酸反应生成盐和水的氧化物称为碱性氧化物,例如:Na2O,CaO。
(5)按混合物中分散质粒子的直径大小可将混合物分类,分为溶液、胶体和浊液等。
6)总结:[思考题]:1. 只含有一种元素的物质一定是纯净物吗?2.盐一定含有金属元素吗?3.金属氧化物一定是碱性氧化物吗?碱性氧化物一定是金属氧化物吗?4.非金属氧化物一定是酸性氧化物吗?酸性氧化物一定是非金属氧化物吗?5.Na 2CO 3·10H 2O 、盐酸是混合物还是纯净物?例1:下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是( )A .石灰石B .Ca (OH )2C .CaCO 3D .CH 4解析:石灰石是混合物,主要成分是CaCO 3;Ca (OH )2是碱;CH 4是有机物。
元素与物质的分类

【重点难点】重点:物质的分类及胶体的概念、性质。
难点:物质的分类,单质、氧化物、酸、碱和盐之间的相互关系。
【知识讲解】一、元素与物质的关系:1、元素组成物质:自然界中形形色色的物质都是由元素组成的,由元素组成的物质可能是单质,也可能是化合物。
2、元素在物质中的存在形态元素在物质中的存在形态有两种:游离态和化合态。
(1)游离态:元素以单质存在的形态。
例如:氧气中的氧元素就是以游离态存在。
(2)化合态:元素以化合物存在的形态。
例如:NaOH、Na2CO3中的氧元素就是以化合态存在。
元素的游离态、化合态可以相互转化,如O2与C反应生成CO或CO2,游离态的氧元素变成了化合态氧元素,又如KClO3加热制O2,化合态的氧元素又变成了游离态氧元素。
3、物质种类繁多的原因:(1)同种元素可形成不同的单质。
氧元素能形成O2、O3两种不同单质;碳元素形成金刚石、石墨、C60、C70等多种单质;磷元素能形白磷、红磷等单质。
(2)不同种类的元素形成不同种类的化合物。
大的方面可以分为氧化物、酸、碱、盐,而每种类别物质又可以再细分。
以后还要对物质进行详细分类。
(3)元素种类相同时,也可以组成不同的化合物。
如氮元素、氧元素可以组成N2O、NO、N2O3、NO2、N2O4、N2O5 等多种氧化物,主要就是氮元素的化合价不同,组成了不同种类的氧化物。
另外,有机物中还要出现同分异构体(分子式相同而结构不同的物质)。
以上这些原因都决定了元素种类虽然不多,但可以组成多种多样的物质。
二、物质的分类1、物质分类的方法依据不同的分类标准,可以对物质进行不同的分类。
例如:依据物质中所含物质种类的多少,可以把物质分为混合物和纯净物。
混合物是由两种或多种物质混合而成的物质,纯净物则是由一种物质组成的物质。
对于纯净物,依据所含元素种类的多少,可以划分为单质和化合物,由同种元素组成的纯净物叫单质,由不同种元素组成的纯净物叫化合物。
单质可以再分为金属单质、非金属单质、稀有气体单质。
【中考化学 精准靶向】专题11 元素与物质的分类(原卷及答案)

专题11 元素与物质的分类考点01 物质分类 (1)考点02 元素 (2)题型01 物质分类 (4)题型02 元素 (5)题型03 元素周期表 (6)考点01 物质分类(一)基本概念1、混合物:宏观,由两种或两种以上物质组成的;微观,由两种或两种以上分子构成的。
举例:空气、溶液和合金等。
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净物或混合物。
2、纯净物:宏观,由一种物质组成的;微观,由一种分子构成的。
举例:蒸馏水、氧气和冰水混合物。
3、单质:由一种元素组成的纯净物。
举例:金、金刚石、氢气和氧气等。
注意:(1)分为:金属单质;非金属固体单质;稀有气体单质。
(2)由一种元素组成的物质,不一定是单质,有可能是混合物,有可能是单质。
4、化合物:由两种或两种以上元素组成的纯净物。
举例:过氧化氢、二氧化碳等。
5、有机物:含有碳元素的化合物叫做有机化合物,简称有机物。
举例:甲烷(最简单的有机物)、乙醇和醋酸等。
注意:但是CO、CO2、H2CO3和碳酸盐具有无机物的特点,通常把它们看做无机物。
6、无机物:除有机物以外的其他化合物统称为无机化合物,简称无机物。
举例:碳酸钠、硝酸银和硫酸钡等。
7、氧化物:由两种元素组成的化合物,其中一种元素是氧。
举例:二氧化碳、过氧化氢等。
注意:含氧化合物是含有氧元素的化合物,包含氧化物。
8、酸:电离时形成的阳离子全部是氢离子的化合物。
举例:盐酸、硫酸和碳酸等。
注意:酸溶液的pH值小于7,通常化学式的第一种元素是“H”,酸由氢和酸根离子组成,紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色。
9、碱:电离时形成的阴离子全部是是氢氧根离子的化合物。
举例:氢氧化钠、氢氧化钙和氢氧化钡等。
10、盐:由金属阳离子或铵根离子和酸根离子构成的化合物。
举例:硝酸铵、碳酸钙和硫酸钡等。
元素与物质世界知识点梳理
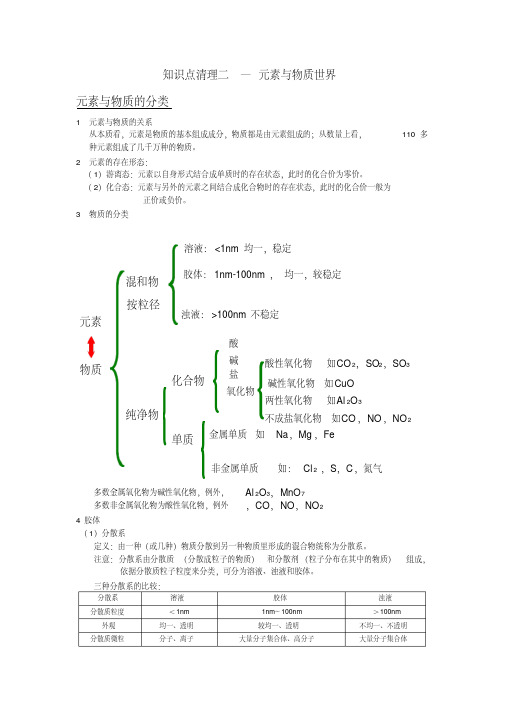
知识点清理二—元素与物质世界元素与物质的分类1 元素与物质的关系从本质看,元素是物质的基本组成成分,物质都是由元素组成的;从数量上看,110多种元素组成了几千万种的物质。
2 元素的存在形态:(1)游离态:元素以自身形式结合成单质时的存在状态,此时的化合价为零价。
(2)化合态:元素与另外的元素之间结合成化合物时的存在状态,此时的化合价一般为正价或负价。
3 物质的分类多数金属氧化物为碱性氧化物,例外,Al 2O 3,MnO 7多数非金属氧化物为酸性氧化物,例外,CO ,NO ,NO 24 胶体(1)分散系定义:由一种(或几种)物质分散到另一种物质里形成的混合物统称为分散系。
注意:分散系由分散质(分散成粒子的物质)和分散剂(粒子分布在其中的物质)组成,依据分散质粒子粒度来分类,可分为溶液、浊液和胶体。
三种分散系的比较:分散系溶液胶体浊液分散质粒度<1nm 1nm ~100nm >100nm 外观均一、透明较均一、透明不均一、不透明分散质微粒分子、离子大量分子集合体、高分子大量分子集合体物质混和物纯净物化合物单质金属单质如Na ,Mg ,Fe酸碱盐元素溶液:<1nm 均一,稳定胶体:1nm-100nm ,均一,较稳定浊液:>100nm 不稳定按粒径非金属单质如:Cl 2 ,S ,C ,氮气氧化物两性氧化物如Al 2O 3碱性氧化物如CuO 不成盐氧化物如CO ,NO ,NO 2酸性氧化物如CO 2,SO 2,SO 3能否透过滤纸能能不能能否透过半透膜能不能不能稳定性稳定较稳定不稳定实例食盐水、碘酒、蔗糖溶液肥皂水、氢氧化铁胶体、淀粉溶液、果冻、豆浆、血液、雾、云、烟泥水、牛奶(2)胶体及其性质A 胶体的分类:按分散剂状态不同,可分为气溶胶、固溶胶、液溶胶。
B 胶体的性质①丁达尔效应当可见光束通过胶体时,在入射光侧面可观察到光亮的通路,这种现象叫做丁达尔效应。
溶液没有丁达尔效应.因此,可用丁达尔效应来鉴别溶液和胶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
混 溶液 合 悬(乳)浊液 物 胶体
由 一种或几种 物质(分散质)
分散到另 一种 物质(分散剂)里形成的,
这样的混合物统称为 分散系。
分散质 分散剂
分散系
几种常见的分散系
(根据分散质颗粒大小分类)
分散系 溶液
迁移应用
通过那些反应可以生成盐?以 金属钠和硫单质及其化合物为例理 解上述关系。
Na Na2O NaOH
盐
Na2S Na2SO3 Na2SO3
S SO2 H2SO3
硫单质及其化合物
化合价
+6
SO3
H2SO4
Na2SO4
+4
SO2
H2SO3
Na2SO3
+2
0
S
-2
H2S(其水溶液为氢硫酸)
单质 氧化物 酸
丁达尔现象的原因:
胶体中分散质微粒对可见光(波长400-700nm)散射 而形成的。
丁达尔现象的应用:区别溶液和胶体
自然界中的云、雾、烟尘都是胶体,
分散质是微小的尘埃或液滴,分散剂是空气。
2、聚沉
向胶体中加入可溶性盐时,胶体形成沉 淀析出的现象称为胶体的聚沉。
解释:
可溶盐产生的中阳离子或阴离子所带电荷与胶体微粒 所带的电荷中和,从而使分散质聚集成较大的微粒,在重 力作用下形成沉淀析出。
粗心比无知更可怕! 习惯比聪明更重要!
元素与物质世界
第一节元素与物质的分类
(第2课时)
一.教学目标
(一)知识与技能: 1、初步接触各种元素及其化合物,知道元素以游离态和化合态两种形态在 物质中存在;了解110多种元素为什么能组成上千万种物质;元素与物质的 关系; 2、使学生能从物质的组成和性质对物质进行分类;了解物质简单分类法; 建立酸性氧化物和碱性氧化物概念;了解单质、酸、碱、盐之间的关系。
碱盐
物质类别
作业:
1、教材P38页第一题。
2、 请用图2-1-5所示的形式表示 你学习过的不同价态的氯元素与有关 类别代表物间的关系。
细节决定成败, 规范造就高分!
元素与物质世界
第一节元素与物质的分类
(第2课时)
日照二中 2009.11.1
联想 质疑
清晨当太阳升起时,你漫步在茂密的森林 里,会看到缕缕阳光穿过林木的枝叶铺洒 在地面上.你知道为什么会产生这美丽的 景象吗?
胶体
浊液
分散质粒子 的直径
1nm 1-100nm之间
100nm
外观 均匀、透明 比较均匀、透明 浑浊
分散质的微粒
分子、离子
较多分子或离 子的集合体
大量分子或离 子的集合体
稳定性 稳定
比较稳定 不稳定
胶体的性质
1、丁达尔现象
当可见光束通过胶体时,在入射光侧面可观察到明 亮的光区,这种现象称为丁达尔现象或丁达尔效应。
(二)情感态度与价值观:
让学生树立运用化学知识进行思考,依据不同的标准对物质进行分类, 体会分类的重要意义,分享自己或他人的学习成功。
二.教学重点 用分类的方法与观点,对物质进行研究。
三.教学方法
合作、探究
一、元素与物质的关系 【交流与研讨】
你已学过许多物质,如Na、Na2O、Na2O2、NaCl、 NaClO、 Cl2、HClO、Ca(ClO)2等
胶体
在水溶液中或熔化 状态下是否导电
酸性氧化物
氧化物
------多数非金属氧化物
碱性氧化物
----多数金属氧化物 根据化合物 的性质
2、根据物质类别研究物质性质
【活动探究】单质、氧化物、酸、碱和盐间的关系
单质
金属单质: 金属铁(Fe) 非金属单质:木炭(C) 、氧气(O2 )
元 素
氧化物 酸碱性性氧氧化化物物::二氧氧化化钙碳(C(aCOO)2、) 氧化铜(CuO)
提纯、精制胶体的操作称为渗析。
分散系
溶液 胶体
分散质微 粒的大小
小于
1nm
1nm~ 100nm
外观特征
均匀 透明
能否透过 滤纸
能
能否透过 半透膜
能
有无丁达 尔现 象
无
举例
食盐水
均匀 能 不能 有 透明或 半透明
蛋清 豆浆
Fe(OH)3
胶体
浊液 大于
浑浊 不能 不能 无
100nm 不均匀
不透明
泥水
氧化钙 (CaO) 4、酸性氧化物 代表物:二氧化碳(CO2)
二氧化碳 (CO2)
5、酸 代表物:HCl HCl
6、碱 代表物:NaOH NaOH
7、盐 代表物:CuSO4 CuSO4
实验反思:
试对以上探究分析,将下图可能发生反应 的物质类别用线连起来。
金属 碱性氧化物
碱
非金属 酸性氧化物
酸
盐
盐
方 加入可溶性盐 法 加热或搅拌
加入带异种电荷的胶体
应用:制豆腐
3、电泳
知识点击
胶体中的分散质微粒在直流电的作用
下产生定向移动的现象叫做电泳。
电泳现象说明胶体中的分散质微粒带有电荷。
想一想:为什么胶体比较稳定?
应用:1、电镀 2、静电除尘
知识点击 胶体与渗析
胶体的分散质微粒能够透过滤纸而不能穿过 半透膜,因而可以用它将胶体与分子或离子 分开。 利用半透膜分离胶体中的杂质分子或离子,
化合物
酸: HCl
H2SO4
碱: NaOH Ca(OH)2 盐:NaCl Na2SO4 AgNO3
CuSO4
思考: 金属、非金属、碱性氧化物、酸性氧化物、
酸、碱和盐分别可能与哪些类别的物质发生反应?
分组探讨:
1、金属单质 代表物:铁
2、非金属单质 代表物:碳
铁
碳
3、碱性氧化物 代表物:氧化钙(CaO)
(1)组成这些物质的元素都有哪些?
(2)这些元素还能组成哪些物质? (3)Cl元素常见的化合价为-1、0、+1。在以上物 质中,分别找出含有这些价态的该元素的物质?
交流:以上讨论对你认识元素与物质的关系有什么启发?
物质性质与元素化合价的的关系有什么启发?
通过上对物述质物性质质如的何研分究,类可?以请清同楚学的们认识交处流于。某一价态的元素的
性质;反过来通过对处于某一价态的元素的性质的研究, 可以更深刻的把握所对应物质的性质。
二、物质的分类
1、物质分类的依据
元素
物质是否由同 一种分子组成
单 是否由同种 质
纯
净
? 物
物
质
混
? 元素组成 化 合 物
合
物
被分散物质
? 颗粒的大小
根据化合 物的性质
?酸、碱、盐 氧化物
?电解质 非电解质
溶液
浊液
