妇科泡腾栓的溶出度考察_陈惠红
HPLC法测定妇科泡腾栓中蛇床子素的含量

HPLC法测定妇科泡腾栓中蛇床子素的含量陈惠红;吕建伟;廖玉香【摘要】目的:建立高效液相色谱法测定妇科泡腾栓中蛇床子素的含量.方法:采用Shimpack VP-ODS C18柱(150 mm×4.6mm,5μm),以乙腈-水(60:40)为流动相,流速为1.0mL·min-1,检测波长为323 nm.结果:蛇床子素在3.6~43.2 μg·mL-1范围内呈良好的线性关系(r=0.999 9),平均回收率为98.72%,RSD=1.42%.结论:所建方法准确可靠,操作简便,稳定性好,可用于妇科泡腾栓的质量控制.【期刊名称】《中国药物应用与监测》【年(卷),期】2010(007)001【总页数】3页(P24-25,39)【关键词】高效液相色谱法;妇科泡腾栓;蛇床子素【作者】陈惠红;吕建伟;廖玉香【作者单位】柳州市中医院药剂科,广西,柳州,545001;柳州市中医院药剂科,广西,柳州,545001;江西中医学院,江西,南昌,330004【正文语种】中文【中图分类】R927.2妇科泡腾栓是医院传统经验方妇科洗剂改进的制剂,由黄柏、苦参、蛇床子、鱼腥草、野菊花、忍冬藤等中药组成,具有清热燥湿、泻火解毒、杀虫止痒等功效,临床用于治疗妇科各种阴道炎。
原制剂质量标准已研究了薄层色谱定性鉴别和黄柏中盐酸小檗碱的含量测定方法[1],为进一步控制该制剂质量,对方中另一主药蛇床子的主要有效成分蛇床子素进行含量测定研究。
目前蛇床子素的含量测定方法有分光光度法[2]、薄层扫描法[3]、气相色谱法[4]和高效液相色谱法[5]等。
本文采用高效液相色谱法测定蛇床子素的含量。
1 仪器与试药LC-20A高效液相色谱仪(日本岛津公司),包括SPD-20A紫外检测器、LC-20AT输液泵、LCsolution工作站;AL204电子天平(瑞士梅特勒-托利多仪器有限公司);双频数控超声清洗器(昆山市超声仪器有限公司);UV-1601紫外可见分光光度计(日本岛津公司)。
栓剂质量控制研究的相关技术要点

栓剂质量控制研究的相关技术要点在《中国药典》2020年版四部通则增修订内容(第七批)0107栓剂(2020 版第一次征求意见稿)项下规定:栓剂系指原料药物与适宜基质等制成供腔道给药的固体制剂。
栓剂因施用腔道的不同,分为直肠栓、阴道栓和尿道栓。
直肠栓为鱼雷形、圆锥形或圆柱形等;阴道栓为棒状。
阴道栓可分为普通栓和膨胀栓。
阴道膨胀栓系指含药基质中插入具有吸水膨胀功能的内芯后制成的栓剂;膨胀内芯系以脱脂棉或粘胶纤维等经加工、灭菌制成。
栓剂作为一种非口服局部给药的固体制剂,克服了口服制剂中一些难以避免的不足,如药物不受或少受胃肠道pH值或酶的破坏,避免药物对胃黏膜的刺激性,避免肝脏首过效应,适宜不便口服给药的患者等。
近年来该剂型发展迅速,相继出现了中空栓剂、双层栓剂、泡腾栓剂、海绵栓剂、凝胶栓剂、微囊栓剂、渗透泵栓剂、缓释栓剂以及不溶性栓剂等新型栓剂。
随着新型栓剂的增加以及科学研究的不断深入,药典中收载的评价方法难以对栓剂进行全面的质量评价,本文对当前的研究进展和法规要求进行了简要整理分析,旨在为栓剂质量研究者提供一些思路和参考。
一、相关指导原则•中国药典2015年版四部通则0107栓剂•中国药典2020年版四部通则增修订内容(第七批)0107栓剂(2020 版第一次征求意见稿)•中国药典2015年版四部通则0922融变时限检査法•国家食品药品监督管理总局药品审评中心《局部作用阴道制剂(阴道片、阴道栓)仿制药的评价技术要求(征求意见稿)》20181024 •欧洲药典2.9.22 Softening time determination of lipophilic suppositories二、质量研究内容在仿制药研究中,根据目标产品的质量概况(QTPP)确立制剂的关键质量属性(CQA),阴道栓的CQA包括但不限于以下研究:性状(如形状、尺寸、硬度、重量、体积等)、融变时限(融变过程)、pH值(或酸度)、溶出度(或释放度)、有关物质、含量测定、微生物限度、抑菌剂及抗氧剂含量、原料的晶型和粒度等。
非诺贝特体外溶出度考察及其微粉化制剂的研究_施洁明

V ol.20 No.5 Sep.2003 p.317
非诺贝特体外溶出度考察及其微粉化制剂的研究
施洁明 , 何仲贵 , 孙淑英
(沈阳药科大学药学院 , 辽 宁 沈阳 110016)
摘要 :目的 考察不同厂家非诺 贝特固 体制 剂体外 溶出 度以 及微粉 化对 非诺贝 特溶 出度的 影响 。 方法 分别以 40 %(φ)乙醇溶液 、50 %(φ)乙醇溶液 、5 g/ L 十二烷基 硫酸钠溶 液 、10 g/ L 十二烷基 硫 酸钠溶液 为溶出介质 , 对 4 种市售非诺贝特固体制剂的体 外溶出度进 行考察 。 采用 球磨机制 备微 粉化非诺贝特 , 对其溶出度进行测定 。 结果 10 g/ L 十二烷基硫酸钠溶液中微粉化制剂的溶出 速率 明显快于 其余 3 种 非微粉化制剂 , 初步探讨了非诺贝特固 体制剂体外 溶出度标 准 。 用相似因 子法 对自制微 粉化胶囊和法国生产的微粉化胶囊的溶出实验数据进行 统计分析 , 结果表 明两者溶 出行 为相似 , 相似因子 f 2 =72.4(50 ≤ f2 ≤100)。 结论 不同 厂家 非诺 贝特 固体 制剂 的溶 出度 差异 较 大 , 微粉化工艺能显著提高非诺贝特的溶出度 。 关键词 :非诺贝特 ;溶出度 ;微粉化 中图分类号 :R 944 文献标识码 :A
非诺贝特(fenofibrat e)属于苯氧乙酸类降血 脂药 , 其降脂作用确切 , 主要用于治疗 Ⅱ , Ⅲ , Ⅳ型 高脂蛋白血症 。 作为难溶性药物 , 非诺贝特普通 固体制剂由于溶出度低而影响生物利用度 , 单次 口服该药普通固体制剂后仅 有 60 %的剂量被吸 收[ 1] , 而微粉化非诺贝特作为新剂型其吸收率可 提高 30 %, 且血药浓度稳 定[ 2] , 故提高该药的体 外溶出速率对于提高生物利用度和临床疗效具有 重要的意义 。对非诺贝特口服固体制剂溶出度标 准国内外药典均未有规定 , 对微粉化非诺贝特制 备工艺研究报道也很少 , 作者选用 4 种溶出介质 对 4 种国内外市售非诺贝特固体制剂的溶出度进 行考 察 , 初步探讨了非诺贝 特体外溶出度标准 。 采用微粉化工艺制备了非诺贝特胶囊 , 将其溶出 行为与国外同类产品进行了比较 , 结果令人满意 。
栓剂溶出度检查方法的研究

典( 诸如美国药典 ? 英国药典 & 日本药 0版 ’ _ _ 0年 版 ’ 局方第十三改正版和中国药典 ? 在栓剂项 7 7 7年版等 ( 下 只收载了h 融变时限i 检 查( 尚未对溶出度进行质量 控制 6 上世纪 A 德国 e8 7年代 ( f8 g R \ \ C I 9等提出了测 定疏水性基质栓剂中药物的溶出度测定方法的构
参考文献 &
(N OP Q 8 * C 9 D E + C 9 K R S R T G K R U 9G 9 D
T V G I G T K C I R W G K R U 9U SG9 U X C =V E <G 9 <G K I R Y <C K G = = U H C U K C R 9 G + CZR K V 8 & _ _ ‘ ( ? ‘ ? a ? A & D R + K I R \ E K R U 9 ]^ R U = 2 V C <( 杨 志 明( 解 慧 琪( 等8 人胎关节软骨细胞体外培养的生物学特 ? 王 跃( 征8 中华实验外科杂志 (? 7 7 7 ( & ‘ > 4 @ a 0 & _ 0
栓剂 > 为一种非 口 服 局 部 给 药 的 固 @ M E H H U + R K U I R C + 体 制 剂( 由于其克服了口服制剂中一些难以避免的不 足( 所 以 近 几 年 来 发 展 很 快( 相 继 出 现 了 缓 释 栓 剂’ 控 释栓剂及微囊栓剂等 6 栓剂中活性成分的释放和吸收 过程也逐渐被人们所重视 6 如何控制产品质量 ( 以保证 栓剂的安全有效是一个重要课题 6 目前现行版各国药
k l m n o p qr st o u u p v p s l t o q q r w m l o r sx p q l yp l z r n qu r v k m { { r q o l r v o p q ((# R EM V E T V E 9 R E|G 9 G 9] R S C 9 > (! 7 7 7 ‘ 7 @ ! R G 9 } R 9, 9 + K R K E K CS U Ig I E :2 U 9 K I U = R G 9 } R 90 a! 8! ! k x " ~ # x /\ } C T K R X C V CD R S S C I C 9 KD R + + U = E K R U 9K C + K<C K V U D +S U I+ E H H U + R K U I R C +ZC I C+ K E D R C D V CG H H G I G K E + C +ZC I C ~ 8g 88)C aM 8g ( D C X R + C D\ $g I R \ \ C I 9G 9 D\ $)I R EM V E T V E 9 K V U D K E D R C DU 9K V C<C K V U D + U S U Z9D C + R : 9 R 9 :G 9 Dg I R \ \ C I 9 % + 8j ag K V C 9+ C = C T K C DK V CT U <S U I K G \ = C<C K V U D C + E = K R \ \ C I 9 % +<C K V U DZG +T U 9 S U I <C DR K R +GE + C S E = <C G + E I R 9 :<C K V U DS U I D I E : 8, 8B S I C = C G + CS I U < G+ E H H U + R K U I $ K + I C H I U D E T R \ R = R K $U S K V C I C = C G + C T E I X C + ZG + G T T C H K G \ = C C ZU S S G T K U I + R 9T R I T E <+ K G 9 T C T U E = D 82 a, $T U 9 K I U = U S C S S C T KK V CI C + E = K U 9 T = E + R U 9 KR +R <H U I K G 9 KK UC + K G \ = R + VGD R + + U = E K R U 9K C + K<C K V U DS U IG<C G + E I CU S[ E G = R K 8 + E H H U + R K U I R C + (g &’ ( )* " t kM E H H U + R K U I R C + R + + U = E K R U 9
妇消宁泡腾栓最佳处方及质量控制的研究

妇消宁泡腾栓最佳处方及质量控制的研究目的:探索妇消宁泡腾栓制备的最佳基质处方及质量控制标准。
方法:以pH值为指标采用正交试验法对妇消宁泡腾栓的处方进行优化;薄层色谱法对制剂中的青黛、黄柏进行定性鉴别。
结果:优化处方以0.43 g酒石酸、0.16 g碳酸氢钠、2.00 g药物混合为最佳用量比,与基质S40制栓。
结论:制剂稳定,质量控制方法简便、准确。
[Abstract] Objective:To optimized the formula for the fuxiaoning effervescent suppository and establish its quality control standard. Methods:The formula of the fuxiaoning effervescent suppository was optimized by ortyogonal experiment with pH as index.Indigo Naturalis,Cortex Phellodendri were identified by TLC. Results:The optimized formula was as follows:The used level ratio of tartaric acid、baking soda and medica powder were 0.43,0.16,2.00 g and prepared were S40. Conclusion:The preparation is stationary and the quality control method were convenient and accurate .[Key words] Fuxiaoning effervescent suppository;Ortyogonal experiment;TLC;pH;Quality control阴道炎、宫颈炎是妇科常见病、多发病,严重影响妇女的身心健康和生活质量。
布洛芬泡腾片的研究
参
1 2
考
文
献
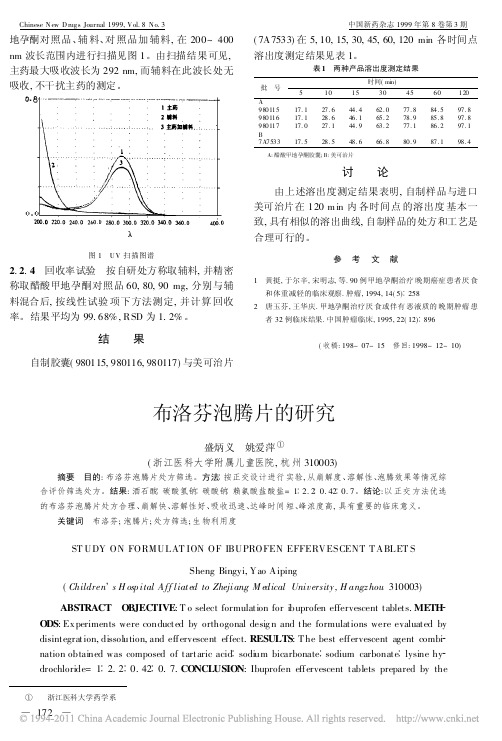
2. 2. 4 回收率试验
按自研处方称取辅料, 并精密
黄挺 , 于尔辛 , 宋明志, 等 . 90 例甲地孕酮治疗 晚期癌症患者厌 食 和体重减轻的临床观察 . 肿瘤 , 1994, 14( 5) 258 唐玉芬 , 王华庆 . 甲地孕酮治疗厌 食或伴有 恶液质的 晚期肿瘤 患 者 32 例临床结果 . 中国肿瘤临床 , 1995, 22( 12) 896 ( 收稿 : 198- 07- 15 修回 : 1998- 12- 10)
浙江医科大学药学系
172
Chinese N ew D rugs Journal 1999, V ol. 8 N o. 3
中国新药杂志 1999 年第 8 卷第 3 期
formulation select ed by the study has the feat ure of f ast absorpt ion, short T m ax , high Cmax and effec t ive in clinical use. KEY WORDS Ibuprofen; Ef fervescent tablet ; Prescript ion f ilt erat ion; Bioavailabilit y 布洛芬是临床上常用的解热镇痛药, 国外已广 泛作为非处方药 , 我国目前的布洛芬片由于普遍存 在溶出度问题, 在临床上未能得到广泛运用。我们 通过研究将布洛芬制成泡腾片 , 提高溶出度, 并作了 布洛芬泡腾片与市售布洛芬颗粒剂的人体相对生物 利用度试验。 2. 2. 2 B 粒: 取经过 80 目筛的赖氨酸盐、 无水碳酸
1
受体兴奋剂普瑞特罗注射 液 , 用 于心衰 、 冠状动脉 疾病以及 心脏外 科手术 后 左右 , 充 N2 罐封 。 结 论 : 普瑞 特罗注 射液经 稳
新型坤净栓中呋喃唑酮溶出度的测定
新型坤净栓中呋喃唑酮溶出度的测定刘杰;郭江涛;任娜;吴伦;田振坤【摘要】Objective:To establish a UV method to determine the dissolution of furazolidone in new Kunjing suppository in vitro.Methods:Choosing oar method,with 1.8%SDS as the dissolution medium,the speed is 100r·min-1,the temperature is 37℃,the detection wavelength is 340nm,using UV method to determine the dissolution of three batches ofsamples,calculating the cumulative dissolution rate and comparing the dissolution parameters in Weibull of each batch.Results:The results showed that the dissolution curve of uniformity of three batches of new Kunjing suppository is good.Conclusion:Showing that the preparation technology of new Kunjing suppository is reasonable,quality is reliable.The established method to determine the new Kunjing suppository dissolution is simple,rapid,accurate and reliable.%目的:建立紫外分光光度法测定新型坤净栓中呋喃唑酮体外溶出的方法.方法:选用桨法,以1.8%十二烷基硫酸钠为溶出介质,转速100r· main-1,温度37℃,检测波长340nm,采用紫外分光光度法对自制的3批新型坤净栓进行溶出度的测定,计算累积溶出率,并对各批次溶出度威布尔参数进行比较.结果:3批新型坤净栓溶出曲线的均一性良好.结论:表明新型坤净栓的制备工艺合理,质量可靠,建立的对新型坤净栓中呋喃唑酮溶出度测定的方法简便、快速、准确、可靠.【期刊名称】《化学工程师》【年(卷),期】2017(031)011【总页数】3页(P26-28)【关键词】新型坤净栓;紫外分光光发;溶出度【作者】刘杰;郭江涛;任娜;吴伦;田振坤【作者单位】贵阳中医学院药学系,贵州贵阳550000;贵阳中医学院药学系,贵州贵阳550000;山东大学淄博生物医药研究院,山东淄博255000;黑龙江中医药大学药学院,黑龙江哈尔滨150040;黑龙江中医药大学药学院,黑龙江哈尔滨150040【正文语种】中文【中图分类】R944.2+3近年来,随着栓剂在治疗局部病变的便利性的突显,栓剂中药物的释放和吸收也引起了重视,因此,为了更好的控制栓剂质量,栓剂溶出度检查也更加重要。
栓剂的质量评价项目
栓剂的质量评价项目栓剂是一种用于局部给药的制剂形式,广泛应用于治疗肛肠疾病、妇科疾病等领域。
栓剂的质量评价是确保其药效和安全性的重要环节。
本文将从药物含量、溶出度、理化性质、质量控制等方面对栓剂的质量评价项目进行详细介绍。
一、药物含量药物含量是评价栓剂质量的重要指标之一。
栓剂中所含药物的含量应与标签上标明的药物含量相符合。
药物含量的测试方法主要有高效液相色谱法、紫外分光光度法等。
通过对样品进行准确测量和分析,可以判断栓剂的药物含量是否符合规定要求。
二、溶出度溶出度是栓剂溶解在体液中的速度和程度,也是评价栓剂药效的重要指标之一。
溶出度的测试方法主要有离体溶出度法和体外溶出度法。
通过测量栓剂在一定时间内释放出的药物量,可以评估栓剂的溶出速度和溶出程度,进而判断其药效是否符合要求。
三、理化性质栓剂的理化性质对其质量评价也至关重要。
理化性质包括外观、溶解度、熔点、pH值等指标。
外观应无明显异物、颜色均匀一致;溶解度应符合药典规定;熔点应在一定范围内;pH值应在一定范围内。
这些指标的合格与否可以反映栓剂的制备工艺是否合理、药物是否稳定等方面的信息。
四、质量控制栓剂的质量控制是确保栓剂质量的关键环节。
质量控制包括原料药的质量控制和生产过程的质量控制。
原料药的质量控制主要包括对原料药的质量进行检查和鉴定,确保原料药的纯度和质量符合要求。
生产过程的质量控制主要包括生产工艺的控制、设备的检验和维护、环境的控制等,以确保栓剂在生产过程中不受外界因素的干扰,保证栓剂质量的稳定性。
总结:栓剂的质量评价是保证栓剂药效和安全性的重要环节。
药物含量、溶出度、理化性质和质量控制是栓剂质量评价的关键项目。
通过准确测量和分析栓剂的药物含量、溶出度以及理化性质,可以评估栓剂的质量是否符合要求。
同时,加强原料药的质量控制和生产过程的质量控制,也是确保栓剂质量的重要措施。
只有通过严格的质量评价和控制,才能保证栓剂的药效和安全性,为患者提供有效的治疗。
溶出度测定在药物制剂研发与质量评价中的应用进展
溶出度测定在药物制剂研发与质量评价中的应用进展郝利华;郭桂芳;于晓辉;杨星;杨秀玉【摘要】介绍了药物溶出度及溶出度试验的概念,并着重阐述了溶出度在新药研发的处方筛选、工艺设计、剂型选择和生物利用度预测以及在药物质量控制和再评价方面的应用.【期刊名称】《中国兽药杂志》【年(卷),期】2013(047)006【总页数】3页(P67-69)【关键词】溶出度;溶出曲线;质量控制;再评价【作者】郝利华;郭桂芳;于晓辉;杨星;杨秀玉【作者单位】中国兽医药品监察所,北京100081;中国兽医药品监察所,北京100081;中国兽医药品监察所,北京100081;中国兽医药品监察所,北京100081;中国兽医药品监察所,北京100081【正文语种】中文【中图分类】S851.66药物溶出度是指活性药物从片剂、胶囊剂或颗粒剂等制剂在规定条件下溶出的速率和程度[1],溶出度试验是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外简易试验方法。
溶出曲线是指不同时间点测得的溶出度按次序依次连接成为一条连续的曲线,是溶出度的表达形式之一,可直观反映溶出过程的规律。
一般认为必须测定溶出度的药物包括:一是水中难溶的药物;二是水中易溶但处方与工艺造成阻溶的制剂;三是治疗量与中毒量接近的药物;四是缓控释制剂、肠溶制剂、透皮贴剂等;五是用于治疗严重疾病的药物[2]。
随着生物利用度工作的开展,溶出度应用范围日趋广泛,包括药品研发阶段的处方筛选、工艺设计,常规质量控制,药品生产后和有效期内的质量评价,药品上市批准的生物等效性评价以及上市后药品组分改变和生产方法改变后的质量评价等。
药物溶出度应用已成为推动剂型研究和生产发展的重要手段。
1 新制剂的研发1.1 处方筛选和工艺设计体现在以下几个方面:利用溶出度试验测定制剂中有效成分的溶出速率;分析原料药与辅料的相容性,从而选择辅料的品种和用量;调整辅料用量以改善制剂质量;改变赋形剂以研究制剂的生产工艺,如改用或增加能促进崩解或有助溶解、增溶的辅料。
妇阴舒泡腾片发泡量检查方法探讨
妇阴舒泡腾片发泡量检查方法探讨目的:探讨妇阴舒泡腾片命名的规范性与发泡量检查依据的合理性。
方法:将妇阴舒泡腾片的命名与中国药典中有关“泡腾片”、“ 阴道泡腾片”命名原则进行比较、分析;并将其品种归属与所引用的发泡量检查方法进行分析。
结果:妇阴舒泡腾片命名不规范,发泡量检查标准引用与品种归属相互矛盾。
结论:应严格按照“泡腾片”、“阴道泡腾片”的定义与用途规范妇阴舒泡腾片的名称;按品种归属明确其发泡量检查方法或自行制订更严格的方法。
标签:妇阴舒泡腾片;泡腾片;阴道泡腾片;发泡量妇阴舒泡腾片由黄柏、大黄、紫草等中药提取加工精制而成,具有清热解毒、燥湿止带、杀虫止痒、消肿生肌等功效[1]。
该剂型为阴道泡腾片,其通过发泡剂所产生的泡沫将药用成分均匀推送至病位而发挥作用,对湿热蕴结型带下病、霉菌性阴道炎、滴虫性阴道炎等疾病疗效较好,并可以避免可能产生的一系列口服胃肠道不良反应。
作为该类剂型质量指标,发泡量是必不可少的检验项目之一,发泡量的多少,直接影响阴道泡腾片疗效的发挥。
笔者对该药品的这一项目进行检验时发现,由于种种原因,该药品的发泡量检查存在一定的不足之处,特对其检查方法进行探讨,旨在提高该药的质量标准。
1一般资料11妇阴舒泡腾片[2]发泡量应符合片剂项下阴道泡腾片剂的有关规定(《中国药典》2000年版二部附录IA)。
12检测方法[3]阴道泡腾片照下法检查:取25mL具塞刻度试管(内径15cm)10支,各精密加水2ml,置37℃±1℃水中水浴5min后,各管中分别投入供试品1片,密塞,20min内观察最大发泡量的体积,平均发泡体积应不少于6ml,且少于3ml《中国药典》一部规定发泡量少于4ml的不得超过2片。
经查实,《中国药典》二部2005年版[6]与2010年版[7]附录IA的相关内容与2000年版基本一致;《中国药典》一部2000年版及以前版本均未收载阴道泡腾片发泡量检查法。
2分析与建议21名称规范性探讨仅从字面表述上看,妇阴舒泡腾片为泡腾片,但不管是从其标准所标明的用法项下或使用说明书,还是检查项下的有关规定来看,均显示该药品应属于阴道泡腾片。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基金项目:柳州市科学研究与技术开发计划项目(2007020501)妇科泡腾栓的溶出度考察广西壮族自治区柳州市中医院(545001) 陈惠红【摘 要】 目的 测定妇科泡腾栓的溶出度,考察制剂质量。
方法 采用转篮法进行妇科泡腾栓体外溶出实验,用高效液相色谱法测定样品含量,计算累积溶出量,按Weibull 模型求得参数T d 、m ,并对参数进行相关性检验。
结果 实验操作方法简便,结果准确,3个批号栓剂组内、组间溶出参数差异均无统计学意义(P >0.05)。
结论 妇科泡腾栓的处方设计合理,制备工艺可行,质量可靠。
【关键词】 色谱法,高效液相; 妇科泡腾栓; 溶出度The dissolution rate of gynaecological effervescent suppository C HE N H ui -hong .L iuz hou Hosp ital o f T radition -al Chinese Medicine ,Guang xi 545001,China【A bstract 】 Objective T o deter mine the disso lutio n ra te o f g y naecological efferve scent suppo sitor y and to study its quality .Metho ds T he disso lutio n test w as car ried o ut w ith ro tating baske t me thod ,the main co nte nt of them wa s determined by HP LC .T he accumulativ e disso lutio n r ate wa s calculated and the Weibull 's equa tion w as used to calculate the dissolution par ame te rs .T he diffe rence be tw een different g roups w as statistically ev aluated by co rrelative analy sis .Results T he method is simple ,accura te and reliable ,and there w as no t significant difference in dissolution par ameters of three batches of samples (P >0.05).Conclusion T he design of gy naeco lo gical effe r -vescent suppo sitory is rea so nable ,the pr ocess o f prepa ratio n and the quality are reliable .【Key words 】 HP LC ; G y naecological efferv escent supposito ry ; Disso lutio n r ate 妇科泡腾栓是我院传统经验方妇科洗剂改进的制剂,由黄柏、苦参、蛇床子、千里光,鱼腥草、忍冬藤、野菊花等中药组成,具有清热燥湿、泻火解毒、杀虫止痒等功效,临床用于治疗妇科各种阴道炎症。
为进一步研究制剂质量,本文以高效液相色谱法对妇科泡腾栓中有效成分盐酸小蘗碱的溶出度进行测定。
1 仪器与试药LC -10A T V P 高效液相色谱仪,SPD -10AV P 紫外检测器,LC -10AV P 输液泵,SCL -10A V P 系统控制器(日本岛津公司);A L204电子天平(瑞士M ettler T o ledo 公司);Z RS -8G 型智能溶出仪(天津大学无线电厂)。
盐酸小檗碱对照品(中国药品生物制品检定所,批号为110713-200208供含量测定用),乙腈为色谱纯,试剂均为分析纯;妇科泡腾栓(本院制剂室自制,批号:20071010、20071119、20071123)。
2 方法与结果2.1 色谱条件色谱柱:Diamonsil C 18(250mm ×4.6mm ,5μm ),流动相:乙腈∶水∶三乙胺(35∶65∶1;pH =3.00),流速0.8mL /min ,检测波长346nm ,柱温30℃,理论塔板数按盐酸小檗碱峰计算应不低于4000。
2.2 对照品溶液的制备精密称取100℃干燥5h 的盐酸小檗碱对照品2.08mg ,置于50m L 量瓶中,加甲醇溶解并稀释至刻度,摇匀,再精密吸取0.5mL 置于10m L 量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
2.3 线性关系考察精密吸取浓度为2.08μg /mL 盐酸小檗碱对照品溶液1、2、5、10、15、20μL ,注入液相色谱仪,按“2.1”项下色谱条件测定盐酸小檗碱峰面积(Y ),并以其为纵坐标,同时以盐酸小檗碱进样量(X )为横坐标,进行线性回归,得回归方程为Y =5200685X -1975(r =0.9998),表明盐酸小檗碱进样量在0.00208~0.0416μg 范围内线性良好。
2.4 精密度试验精密吸取对照品溶液10μL ,重复进样6次,其峰面积的RSD 为0.95%,结果表明仪器精密度良好。
2.5 稳定性试验精密吸取同一供试品溶液,分别于0、1、2、4、6、8h 后测定盐酸小檗碱峰面积,结果RSD 为1.26%,表明供试品溶液8h 内稳定性良好。
2.6 加样回收率试验精密吸取6份已知含量的样品溶液,各精密加入盐酸小檗碱对照品,混匀后,进样10μL ,测得盐酸小檗碱峰面积,计算回收率,见第403页表1。
2.7 溶出度试验2.7.1 溶出度测定:使用转篮法,按照《中国药典》2005年版(二部)附录ⅩC 溶出度测定方法项下操作[1],溶出介质表1 加样回收试验结果样品含量(μg)对照品加入量(μg)测得量(μg)回收率(%)平均回收率(%)RSD(%)0.01090.008320.019198.560.01090.008320.019299.760.01090.01040.021299.0499.030.88 0.01090.01040.0213100.000.01090.01250.023197.600.01090.01250.023399.200.1mol/L HCl900mL,温度(37±0.5)℃,转速100r/min。
取栓剂6枚,分别投入6个溶出杯内,于5、10、20、30、45、60 min分别取样5mL,并立即补充同容积加热至37℃的介质,样品液用0.45μm的微孔滤膜过滤,冷却至室温后,量取10μL进样,记录峰面积,外标法计算各时间项下样品的浓度及校正后的累积溶出百分率。
结果见表2。
2.7.2 溶出参数的提取:在溶出度测定中,由于多次取样,药物溶出量会损失,因此,累积溶出量应予校正。
校正公式表2 妇科泡腾栓的平均累积溶出结果(x±RSD%,n=6)批号时间(min)510203045602007101020.8±2.044.1±1.091.8±1.297.9±0.799.00±0.4499.40±0.22 2007111920.9±2.245.0±1.790.1±0.896.9±0.899.20±0.1999.30±0.27 2007112321.5±2.145.4±1.289.9±1.197.8±0.599.40±0.2799.40±0.26如下[2]:X i校=X i+(X1+X2+X3+……X i-1)V2/V1(V1为溶出介质总体积,V2为每次取样体积,X i为第i点取样时测得的累积溶出百分率,X i校为经校正后的第i次累积溶出百分率)。
根据W eibull模型,用Ex ce l计算药物溶出度Weibull分布参数[3]T d、m、r,结果见表3。
表3 妇科泡腾栓的W eibu ll分布模型溶出参数(x±RSD%,n=6)批号T d(min)m r 2007101012.2±1.61.2±4.20.9875 2007111912.4±1.11.2±3.50.9916 2007112312.3±1.11.2±2.70.9905 2.7.3 参数的方差分析:将3个批号的妇科泡腾栓剂的溶出参数进行方差分析,结果见表4。
表4 妇科泡腾栓溶出参数的方差分析参数方差来源离均差平方和自由度均方差F值P值T d组间0.17520.0883.0280.079组内0.434150.029m组间0.00620.0031.7870.201组内0.023150.0023 讨 论考虑到妇女阴道内pH值呈酸性,故溶出度测定选用0.1mol/L H Cl作为溶出介质,使实验环境更贴近体内溶出环境。
应用多点检测方法进行溶出试验时,由于多次取样,药物溶出量的损失可超过样品总量的5%,也使中间测定的各次溶出量降低,甚至出现累积溶出量逐次下降[4]。
本实验所得累积溶出百分率均经过校正处理,使获得的制剂溶出数据更加准确、可靠。
用Weibull分布函数处理溶出数据时,为简化计算过程,常常将位置参数α假设为0,而实际上大多数固体药物制剂溶出须经过吸水、崩解、溶出等过程,即药物溶出存在时滞,位置参数α≠0,如果人为假设α=0,获得的参数可能偏差很大[4]。
本实验采用Ex cel求算位置参数α[3],使获得的制剂溶出参数更加接近实际溶出。
溶出度检查是评价制剂质量和工艺水平高低的一种有效手段,本实验对3个批号栓剂溶出参数进行了方差分析,各批号组内、组间Td、m差异均无统计学意义(P>0.05),表明妇科泡腾栓的处方设计合理,制备工艺可行,产品质量可靠。
参考文献1国家药典委员会.中华人民共和国药典(二部).北京:化学工业出版社,2005.2蒋亦飞.溶出度试验中累积溶出量应予校正.中国医院药学杂志,1990,10(12):571.3张莉,夏运岳.电子表格Excel计算药物溶出度W eibu ll分布参数.药学进展,2002,26(1):48.4陈幼飞.威布尔分布函数处量溶出数据应注意的问题.中国医院药学杂志,1998,18(9):419.(收稿日期:2008-12-08)作者简介:陈惠红,女,1963年8月生,副主任中医师,广西壮族自治区柳州市中医院,545001。
