共价键及分子间作用力
化学键分子间作用力汇总

化学键分子间作用力汇总分子间作用力是指分子之间的相互作用力,包括化学键和非化学键。
化学键是指原子之间通过共用或转移电子而形成的强力相互作用力,而非化学键是指分子间的弱力相互作用力。
本文将对各种化学键和分子间作用力进行详细介绍。
一、共价键共价键是指两个原子通过共享电子而形成的键。
共价键的形成是靠原子之间的电子重新排布来完成的,形成的键通常是比较强的。
共价键通常有以下几种类型:1.单共价键:两个原子共享一个电子对,形成一对电子。
单共价键通常是较强的键,常见于碳、氢、氧、氮等元素之间的化学键。
2.双共价键和三共价键:当两个原子之间的电子不能通过单共价键满足,还可以通过双共价键或三共价键来共享更多的电子对。
双共价键和三共价键常见于含碳的有机化合物中。
3.金属键:金属键是指金属元素之间的共价键。
金属键通常是非常强大的键,具有很高的熔点和电导率。
二、离子键离子键是指通过正负离子之间的吸引力而形成的键。
离子键的形成通常发生在金属与非金属元素之间,非金属元素通常会通过转移电子成为带电离子,金属元素通常会失去电子成为带正电离子。
离子键通常是很强的键,因此离子化合物具有高熔点和良好的导电性。
三、金属键金属键是指金属元素之间的共价键。
金属键的形成是由于金属元素的特殊电子结构导致的,金属元素没有固定的价电子,而是形成了电子云。
这种电子云的形成使得金属元素之间的共价键成为了金属键。
金属键通常是非常强大的键,有很高的熔点和电导率。
四、氢键氢键是一种特殊的化学键,是指一个带有氢原子的分子与另一个带有强电负性原子(如氮、氧、氟等)的分子之间的相互作用力。
氢键比较弱,通常只有3-10%的共价键强度,但由于氢原子的小尺寸和高电荷密度,使得氢键对分子间的相互作用有很大的贡献。
氢键是生物和化学体系中很重要的分子间作用力,它对于分子的几何构型、物理性质和化学反应具有重要影响。
除了上述的化学键外,还有一些非化学键的分子间作用力:1.范德华力:范德华力是非极性分子之间的相互作用力,是由于分子中存在的临时性偶极引起的。
医用基础化学共价键和分子间作用力

共价键的概念和原理
概念
共价键是指通过共享电子,形成两个非金属原 子之间的化学键。它决定了分子的结构和性质。
原理
共价键的形成是原子为了完成最外层电子的稳 定,共同贡献电子形成的。它的长度和强度决 定于关联原子的尺寸和电负性之间的差异,越 小的差异和越小的原子,如氢,就越容易形成 共价键。
医用基础化学共价键和分 子间作用力
本演示将向您介绍医用基础化学中的共价键和分子间作用力,以及它们在药 物研发中的作用,是一次深入探讨化学原理的旅程。
化学的定义和重要性
1 定义
化学是一门研究物质结构、性质和变化的科学,不仅能帮助我们理解自然界中的现象, 还是研制医药和提高生活质量的重要基石。
2 重要性
3
微观世界的探索
最新技术和准确的分子计算方法,使我们可以深入探索分子的微观世界并开发具有高度 定制化的分子。
医用基础化学中的研究现状和未来发展趋 势
ห้องสมุดไป่ตู้
研究现状
随着药物研发中新的技术和方法的兴起,共价键和 分子间作用力的研究正在变得越来越重要。
未来趋势
新的计算机模拟和理论方法的发展,将加速我们对 分子之间细微交互的理解,这将有助于实现更好、 更安全和更高效的药物研发。
分子间作用力与生物学
从病毒的感染到人类DNA的复制,生物化学发现了 许多重要的分子间作用力。
共价键和分子间作用力在药物研发中的 作用
1
药效和毒性研究
药效和毒性,大多数药物的目标和副作用研究涉及到分子间相互作用力的调整和使用。
2
药物的发现与研发
通过这些知识,药物研发人员可以更好地设计药物分子,以便在人体内精确定位和交互, 提高药效并减少毒性。
第十章 共价键和分子间作用力

第十章共价键和分子间作用力本章教学要求掌握现代价键理论、杂化轨道理论熟悉共价键的本质、特征和类型,分子间作用力了解价层电子对互斥理论、分子轨道理论(chemical bond)。
化学键分为离子键(ionic bond)、共价键(covalent bond)和金属键(metallic bond)。
本章依据量子力学阐述共价键的现代理论,同时要介绍物质分子与分子之间比较弱的相互作用力,即分子间作用力(intermolecular force),它包括范德华力(van der Waals force)和氢键(hydrogen bond)。
第一节现代价键理论1916年美国化学家路易斯(G.N. Lewis)*提出经典的共价键电子理论。
该理论认为两个或多个原子可以相互“共用”一对或多对电子,以便达到稀有气体原子最外层2或8电子层结构(路易斯结构),而生成稳定的分子。
例如:H·+ ·H →H∶H 或H-H分子中通过共用电子对连接的化学键称为共价键,也可用短横线表示。
该理论初步揭示了共价键与离子键的区别,能解释共价键的饱和性。
但不能解释一些分子的中心原子最外层电子数虽然少于或多于8仍能稳定存在的事实,如:也无法说明为什么共用互相排斥的两个带负电荷的电子能使原子成为稳定分子的本质原因。
直到量子力学建立以后,共价键的理论才开始发展。
一、氢分子的形成和共价键的本质* G.N. Lewis加州大学伯克利分校教授,Lewis提出共价键的电子理论对发展化学价理论奠定了基础;他还创造性地提出了酸碱电子理论。
他的研究生中先后有5人获得诺贝尔奖。
图氢分子是最简单的典型共价键分子。
1927年德国化学家海特勒(W. Heitler )和伦敦(F. London )把氢分子看成是两个核和两个电子组成的系统,用量子力学近似求解其薛定谔方程。
结果得到H 2分子形成的势能曲线,见图10-1。
当两个H 原子彼此远离时没有相互作用,它们的势能为零。
共价键与分子间作用力

共价键与分子间作用力共价键和分子间作用力是化学中两个重要的概念,它们对物质的性质和行为起着决定性的作用。
本文将重点介绍共价键和分子间作用力的概念、类型、特点以及它们在化学反应和物质性质中的应用。
共价键是两个非金属原子间由电子对共享而形成的一种化学键。
在共价键中,原子不会失去或得到电子,而是共享电子,以满足各自的外层电子壳。
共价键的形成能力取决于原子的电负性差异。
电负性是一个原子吸引其共享电子的能力,与原子核的吸引力有关。
共价键分为偶极共价键和非极共价键两种类型。
偶极共价键是指共价键中的电子对更多地靠近一个原子,使其带有相对正电荷,另一个原子则带有相对负电荷。
非极共价键是指共价键两端的原子相对电荷均相等,电子对靠近两个原子中间。
具体来说,如果两个原子电负性相等,那么形成的是非极共价键;如果两个原子电负性差异较大,那么形成的是偶极共价键。
除了共价键,分子间作用力也是分子间相互作用的重要力量。
分子间作用力指的是靠近的两个分子之间的相互作用力。
它是由于分子间的静电相互作用、分子之间的取向相互作用和分子之间的诱导相互作用所导致的。
静电相互作用是一种非共价相互作用力,其中相互作用的分子带有正电荷或负电荷。
根据库仑定律,两个带电荷的物体之间的引力或斥力与它们之间的距离和电荷量成正比。
因此,静电相互作用力对于离子之间的相互作用是非常重要的。
取向相互作用是由于两个极性分子之间的分子极性导致的相互吸引。
极性分子的极性取决于分子中的原子电负性差异。
在这种情况下,正极和负极之间的相互作用力具有较大的分子之间作用力。
诱导相互作用是由于无极性分子中的电子云的瞬间分布的改变而引起的。
当一个原子或分子靠近另一个无极性原子或分子时,它的电子云会更集中地分布在远离相互作用区域的一侧。
这将导致另一个原子或分子的电子云在与之相对的另一侧更加分散。
因此,在周围电子云的引导下,两个无极性分子之间会发生诱导相互作用,由此产生相互作用力。
除了静电相互作用、取向相互作用和诱导相互作用外,范德华力也是一种分子间作用力。
第十一章 共价键和分子间作用力习题解析
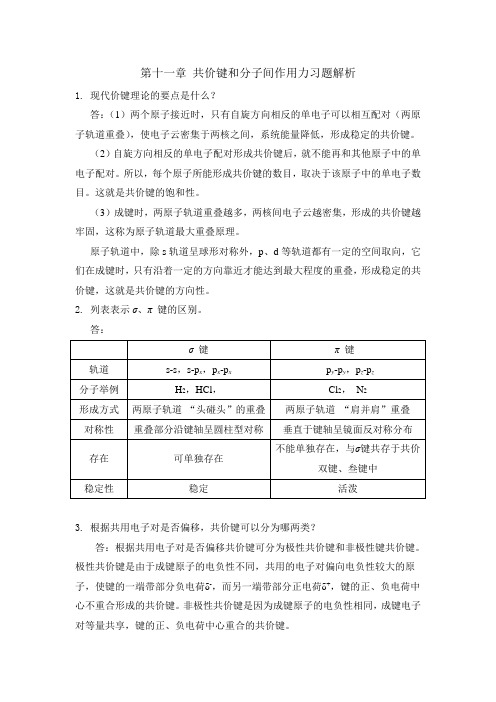
第十一章共价键和分子间作用力习题解析1.现代价键理论的要点是什么?答:(1)两个原子接近时,只有自旋方向相反的单电子可以相互配对(两原子轨道重叠),使电子云密集于两核之间,系统能量降低,形成稳定的共价键。
(2)自旋方向相反的单电子配对形成共价键后,就不能再和其他原子中的单电子配对。
所以,每个原子所能形成共价键的数目,取决于该原子中的单电子数目。
这就是共价键的饱和性。
(3)成键时,两原子轨道重叠越多,两核间电子云越密集,形成的共价键越牢固,这称为原子轨道最大重叠原理。
原子轨道中,除s轨道呈球形对称外,p、d等轨道都有一定的空间取向,它们在成键时,只有沿着一定的方向靠近才能达到最大程度的重叠,形成稳定的共价键,这就是共价键的方向性。
2. 列表表示σ、π 键的区别。
答:3. 根据共用电子对是否偏移,共价键可以分为哪两类?答:根据共用电子对是否偏移共价键可分为极性共价键和非极性键共价键。
极性共价键是由于成键原子的电负性不同,共用的电子对偏向电负性较大的原子,使键的一端带部分负电荷δ-,而另一端带部分正电荷δ+,键的正、负电荷中心不重合形成的共价键。
非极性共价键是因为成键原子的电负性相同,成键电子对等量共享,键的正、负电荷中心重合的共价键。
4.共价键的极性及极性大小用什么来判断?共价分子的极性及极性大小用什么来量度?答:共价键的极性大小根据成键原子的电负性来判断,因为共用的电子对偏向电负性较大的原子,使键的一端带部分负电荷δ-,而另一端带部分正电荷δ+,故成键原子的电负性差别越大,共价键的极性越强。
双原子分子的极性与键的极性一致。
多原子分子的极性不仅与键的极性有关,也与分子构型有关,虽然是极性键,只要键型相同,分子构型对称,其分子中各个键的极性就能相互抵消,正、负电荷重心重合。
分子的极性可用电偶极矩(electric dipole moment)μ来衡量。
它是分子中正、负电荷中心的距离d 与正或负电荷中心上的电量q 的乘积,即μ= q·d ,单位为10-30 C·m 。
共价键及分子间作用力
243
N---N 110
946
Br- Br 228
193
C- H 109
414
I- I 267
151
O- H 96
464
4、键角(bond angle)
键角:分子中同一原子形成的两个化学键间的夹角。
: : :
C l 124 o 21 '
111 o18 ' C = O Cl
N
H
H F 107o18'
l/pm E/(kJ·mol-1)
l/pm E/(kJ·mol-1)
H- F 92
570
H- H 74
436
H- Cl 127
432
C- C 154
346
H- Br 141
366
C--C 134
602
H- I 161
298
C---C 120
835
F- F 141
159
N- N 145
159
Cl- Cl 199
核间距 R0为74 pm。
共价键的本质——原子轨道重叠,核间电子概率密度大吸引原 子核而成键。
二、价键理论基本要点与共价键的特点
1、价键理论基本要点:
(1)两原子靠近时,自旋方向相反的未成 对的价电子可以配对,形成共价键
(2)自综旋方上向所相反述的,单电价子健配对理形论成共认价为键后共,价就不键能是再和 通其过他自原子旋中相的单反电的子配电对子。 配对和原子轨道的 最原大子重中单叠电而子数形决成定了的共,价键使的体数目系—达共价到键能的饱量和最性。
大 大
较低,较稳定
π键 ““肩碰肩””
与轨道对称轴相互平行方向 两块冬瓜状,节面对称
共价键分子间作用力

注意:发生物理变化需克服分子间作用力 (如碘的升华),发生化学变化需破坏化学 键,因为化学变化的本质是旧键的断裂,新 键的形成,如 水的分解需破坏共价键
离子键和共价键的比较
离子键
共价键
成键微粒
阴、阳离子
原子
成键本质
静电作用
共用电子对
表示法
以NaCl为例
Na+ [ ··Cl··]-
成键元素 活泼金属元素、活泼 的非金属元素之间
范德瓦耳斯,荷兰物理学 家。他首先研究了分子间 作用力,因此,这种力也将水加热到100℃,水便会沸腾;而要使水 分解成氢气和氧气,却需要将水加热至1000℃这样的高温 才会有水部分分解。由此我们能得出什么结论?
H-O-H分解需要破坏共价键;而水沸腾需要克 服分子间作用力,它们所需的能量不同,说明 了分子间作用力比化学键弱
球棍模型
H2O V型
比例模型
NH3 三角锥型 CH4 正四面体
CO2 直线型
P14 “观察与思考”
有机化合物中碳原子的成键方式
4 4
成键
碳碳单键、 碳碳双键和碳碳叁键
决定
碳链 碳环
返回
我们知道,分子内相邻原子之间存在着强 烈的相互作用。那么,分子之间是否也有相 互作用呢?
三、分子间作用力
1、概念:分子间存在将分子__聚__集__在__一__起__的作用力 2、特点:比化学键_弱___得多 3、对物质性质的影响:分子间作用力影响由分子构 成的物质的_熔__、__沸__点___和__溶__解__性_____。
二、电子式的写法:
(各原子最外层一般都要达到2个或8个电子的稳定结构) 注意:差多少个稳定就配多少对,少的原子写在中间
结构式:在化学上常用一根短线来表示一对共用电子
分子间作用力的四种形成方式

分子间作用力的四种形成方式分子间作用力是分子之间相互作用的力量,它是物质存在和物质性质产生的基础。
分子间作用力的形成方式有四种,分别是范德华力、氢键、离子键和共价键。
一、范德华力范德华力是分子间最常见的一种作用力,它是由于分子内部电子的运动导致的。
分子中的电子在空间中的运动会引起电荷分布的不均匀,从而形成一种瞬时的偶极矩。
这种偶极矩会与附近的分子偶极矩相互作用,产生吸引力,即范德华力。
范德华力的大小与分子的极性有关,极性越大,范德华力越强。
二、氢键氢键是指分子中氢原子与氧、氮、氟等高电负性原子之间的相互作用。
氢键的形成需要具备三个条件:①氢原子与较电负的原子之间的键能较强,如氢原子与氮原子之间的键能;②氢原子与较电负的原子之间的距离适当,一般在1.5-2.5埃之间;③氢键的形成需要在分子中存在较为稳定的空间构型。
氢键的强度介于共价键和离子键之间,它对物质的性质起到重要的影响。
三、离子键离子键是指由正离子和负离子之间的静电作用力形成的化学键。
在离子键中,正离子和负离子之间相互吸引,形成离子晶体的结构。
离子键的强度较大,使离子晶体具有高熔点、高硬度和良好的导电性等性质。
离子键的形成需要具备两个条件:①正离子和负离子之间的电荷差异较大;②正离子和负离子之间的距离较近。
四、共价键共价键是指由两个非金属原子共享电子而形成的化学键。
在共价键中,原子之间通过电子的共享而相互吸引。
共价键的强度较大,使得共价化合物具有较高的熔点和沸点。
共价键的形成需要满足两个条件:①原子之间的电负性差异较小;②原子之间的距离适当。
共价键的形成可以是单一共价键、双键或者三键,共价键的类型决定了化合物的性质。
分子间作用力的四种形成方式分别是范德华力、氢键、离子键和共价键。
这些作用力对物质的结构和性质具有重要的影响,深入了解分子间作用力的形成方式有助于我们更好地理解物质的性质和相互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
叁键中必须也只能有一个键。
2021/2/6
19
重叠方式 重叠方向 重叠形状 重叠程度 键能 电子能量
σ键与π键的对比
σ键 “头碰头” 沿键轴方向 圆柱形对称
大 大
较低,较稳定
π键 ““肩碰肩””
与轨道对称轴相互平行方向 两块冬瓜状,节面对称
小 小
较高,较活泼
构成分子的骨架
2021/2/6
π键较易断开,化学活泼性
1、价键理论基本要点:
(1)两原子靠近时,自旋方向相反的未成 对的价电子可以配对,形成共价键
(2)自综旋方上向所相反述的,单电价子健配对理形论成共认价为键后共,价就不键能是再和 通其过他自原子旋中相的单反电的子配电对子。 配对和原子轨道的 最原大子重中单叠电而子数形决成定了的共,价键使的体数目系—达共价到键能的饱量和最性。
2021/2/6
12
三、共价键的类型
掌握
1.σ键:
原子轨道沿核间联线方向进 行同号重叠(头碰头)。
2021/2/6
13
例:HF
1H:1s1 9F:1s22s22p5
+
++
+
最大重叠(头碰头) 非最大重叠
2021/2/6
14
例: H2O 1H: 1s1 8O: 1s22s22p4
+ +
++
H
OH
24
1、键级: 键级越大,键的强度越大,分子越稳定(略)。
2s 2p
C
O
2s 2p
π配键→
σ键 ··
π键→
:C—O: ··
:C: O C = O
价键结构式
电子式 分子结构式
2021/2/6
22
说明
为区别于正常共价键,配位键用“→” 表示,箭头从提 供电子对的原子指向接受电子对的原子(A→B)。
配位键形成条件: 1. 成键原子一方有孤对电子(lone pair electron) 2. 另一方的价电子层有空轨道 。
2021/2/6
例: Cl2 17Cl:[Ne]3s23p5
- ++ -
px
px
Cl-Cl
15
2.π键:
两原子轨道垂直核间联线并相互平行进行同号重
叠(肩并肩)。
zz
对xy平面具有反对称性
yy
即重叠部分对xy平面 x 的上、下两侧,形状
相同、符号相反。
2021/2/6
16
例如:O2成键情况 8O:1s22s22p4
bond),化学键的成键能量约为几十到几百千焦每摩; (2) 分子中的原子在空间的排列,即空间构型 (geometry
configuration)。
2021/2/6
2
物质的 性质 取决于
分子的性质---由分子的内部结构决定 分子间的作用力
相邻的分子间还存在一种较 弱的相互作用,其作用能约 比化学键小一、二个数量级。
20
δ键:两个原子相匹配的d轨道以“面对 面”的方式重叠所形成的键
z
dxy
x
y
x
dxy y
2021/2/6
21
3. 配位键(coordination bond)
正常共价键-- 如果共价键是由成键两原子各提供1个电子配对 成键的,称为正常共价键。
配位共价键-- 如果共价键的形成是由成键两原子中的一个原子 单独提供电子对进入另一个原子的空轨道共用而 成键,这种共价键称为配位共价键,简称配位键。
Chapter X
第八章 分子结构
2021/2/6
1
Introduce
分子是由原子组合而成的,是保持物质基本化学性质的最 小微粒,并且又是参与化学反应的基本单元。
分子的化学组成
分子的性质 取决于 分子的结构 离 共 金 子价 属 键键 键
分子的结构通常包括两方面内容: (1) 分子中直接相邻的原子间的强相互作用即化学键 (chemical
研究分子中的化学键及分子间的作用力对于 了解物质的性质和变化规律具有重要意义。
2021/2/6
3
共价键的本质与特点 化学键:
分子或晶体中相邻原子(或离子)之间强烈的吸引作用。
化学键理论:
金属键理论
2021/2/6
4
【内容提要】
共价键理论
第一节 现代价键理论 第二节 杂化轨道理论 第三节 价层电子对互斥理论 第四节 分子轨道理论简介 第五节 分子间的作用力
3d
3s 3p
3d
FF
[¨·S·] + 6¨[·F:] → F –\ S/ – F
¨
2021/2/6
¨
/\ FF
9
共价键特征
方向性:为满足最大重叠原理,成键时原 子轨道只能沿着轨道伸展的方向重叠。
+ -+
+ -+
- ++
2021/2/6
10
原子轨道的重叠
原子轨道重叠的对称性原则 只有当原子轨道对称性相同的部分重叠,
共价双键: 键 +π键
2021/2/6
:
:
:
:
O
17
O
问:N2中的N原子是怎样成键的?
7N: 1s22s22p3
++ + +
++
px pY pz
:N N:
共价叁键: 键 +2π键
2021/2/6
18
成键规律分析: 单键: 键
重键: 双键 键+π键 叁键 键+ 2π键
一般地, 键只能与键同时存在,在双键或
原子间的概率原密子度轨才道会增的大重,叠形成化学键。
当两原子轨道以对称性相同的部分(即”+” 与”+”、”-”与”-”)重叠。
+
2021/2/6
11
原子轨道重叠的对称性原则 只有当原子轨道对称性相同的部分重叠, 原子间的概率密度才会增大,形成化学键。
当两原子轨道以对称性不同的部分(即“+” 与“-”)重叠,原子间的概率密度几乎等 于零,难以成键。
(3低)因原状此子态,轨共道价最键大具程有度方地向重性叠。。
(最大重叠原理)
2021/2/6
8
共价键特征
饱和性:原子有几个未成对的价电子, 一般
只能和几个自旋方向相反的电子配对成键。
ห้องสมุดไป่ตู้
例
N N
共22pp价键特N2征 :N≡N:
在特定的条件下,有的成对的价电子能 被拆开为单电子参与成键。
例S
3s 3p
2021/2/6
5
第一节 现代价键理论
共价键的本质与特点 共价键的类型 杂化轨道
2021/2/6
6
一、H2分子的形成
---量子力学处理H2分子的结果
↑
↓
↓↓
H
H
↓↑
H2
核间距 R0为74 pm。
共价键的本质——原子轨道重叠,核间电子概率密度大吸引原 子核而成键。
2021/2/6
7
二、价键理论基本要点与共价键的特点
配位键的形成方式虽和正常共价键不同,但形成以后,两 者是没有区别的。
2021/2/6
23
四、键参数(bond parameter) 键级(bond order) 键能(bond energy) 键长(bond length) 键角(bond angle) 键的极性(bond angle)
2021/2/6
