苯丙氨酸解氨酶的纯化及活性测定-(word可编辑)
苯丙氨酸解氨酶_PAL_的研究进展_崔建东

食品工业科技
ScienceandTechnologyofFoodIndustry
综 述
苯丙氨酸解氨酶 (PAL)的研究进展
崔建东 , 李 艳 , 牟德华 (河北科技大学生物科学与工程学院 , 河北石家庄 050018)
苯丙氨酸解 氨酶 (Phenylalanineammonialyase, PAL, EC.4.3.1.5)广泛存在于各种植物和少数微生物 中 , 是植物体内次生代谢的关键酶和限速酶 , 在微生 物中可催化 L-苯丙氨酸脱氨生成肉桂酸和氨 。 纯化 后的 PAL可以用于治疗某些肿瘤 [ 1] , 监控苯丙酮尿 患者血浆中的苯丙氨酸含量 , 治疗苯丙酮尿患者[ 2] , 但其主要用途是催化反式肉桂酸转化合成 L-苯丙氨 酸 (L-phenylalanine, L-phe)。 L-phe是合成阿斯巴 甜 (aspartame, APM)的主要原料 , 随着 APM的全球 热销和反式肉桂酸生产成本的降低 , 利用 PAL转化 反式肉桂酸合成 L-phe的方法成为当前生物化工领 域研究的热点 。本文就 PAL的基本特点及近几年的 研究进展作简要介绍 , 重点介绍微生物 PAL的研究 进展 。
3 微生物 PAL研究
1966年 , Ogata等 [ 9] 在研究芳香族氨基酸的微生 物代谢时发现 , 红酵母属中的某些种能以 L-苯丙氨 酸为唯一碳 、氮源生长 , 并在培养基中积累肉桂酸 。 随后 , 该酶相继在其它微生物中被发现 , 主要有霉菌 与酵母菌 。包括[ 10] :链霉菌属 (Streptomyces)、枝孢霉 属 (Cladosporium)、粘 滑 菇 属 (Hebeloma)、鳞 伞 属 (Pholiola)、 鬼 伞 属 (Coprinus)、 共 头 霉 (Symcephalasilrum)、烟熏离褶伞属 (Lyophyllum)、内 孢霉 属 (Endomuces)、曲 霉属 (Asperhilllus)、地霉 属 (Geotricum)、 从 梗 孢 属 (Monilella)、 小 丛 壳 属 (Glomerella)、卵 孢酵母 属 (Oosporidium)、类酵 母属 (Saccharomycodes)、掷酵母属 (Sporidiobolus)。 目前 , 对微生物 PAL的研究主要集中在菌种选育以及提高 PAL活性和稳定性方面 。
苯丙氨酸脱氨酶实验报告

一、实验目的1. 了解苯丙氨酸脱氨酶(Phenylalanine Dehydrogenase,简称PAH)的基本性质和作用。
2. 掌握苯丙氨酸脱氨酶活性的测定方法。
3. 通过实验验证不同条件下苯丙氨酸脱氨酶活性的变化。
二、实验原理苯丙氨酸脱氨酶是一种参与生物体内氨基酸代谢的酶,其活性对于许多生物学过程至关重要。
本实验采用邻苯二胺法测定苯丙氨酸脱氨酶活性。
该方法原理是:苯丙氨酸脱氨酶将苯丙氨酸脱氨后,产生苯丙酮酸,苯丙酮酸在反应中与邻苯二胺反应,生成深蓝色化合物。
该化合物的蓝色深浅与苯丙酮酸的浓度成正比,可以通过分光光度计测量吸光度来测定苯丙酮酸的生成速率,从而计算苯丙氨酸脱氨酶的活性。
三、实验材料1. 实验试剂:苯丙氨酸、邻苯二胺、氢氧化钠、三氯化铁、蒸馏水等。
2. 实验仪器:分光光度计、恒温水浴锅、移液器、试管等。
四、实验方法1. 配制苯丙氨酸溶液:称取苯丙氨酸0.1g,用蒸馏水溶解,定容至100ml,配制成1mg/ml的苯丙氨酸溶液。
2. 配制邻苯二胺溶液:称取邻苯二胺0.1g,用蒸馏水溶解,定容至100ml,配制成1mg/ml的邻苯二胺溶液。
3. 氢氧化钠溶液:称取氢氧化钠0.5g,用蒸馏水溶解,定容至100ml,配制成5%的氢氧化钠溶液。
4. 三氯化铁溶液:称取三氯化铁0.1g,用蒸馏水溶解,定容至100ml,配制成1%的三氯化铁溶液。
5. 样品处理:取适量样品,用蒸馏水溶解,定容至100ml,配制成一定浓度的样品溶液。
6. 实验步骤:a. 取试管一支,加入苯丙氨酸溶液2ml。
b. 加入样品溶液2ml。
c. 加入邻苯二胺溶液2ml。
d. 加入氢氧化钠溶液2ml。
e. 混匀,置于恒温水浴锅中,在特定温度下反应一定时间。
f. 取出试管,加入三氯化铁溶液1ml。
g. 混匀,用分光光度计在特定波长下测定吸光度。
h. 根据吸光度计算苯丙氨酸脱氨酶活性。
五、实验结果与分析1. 苯丙氨酸脱氨酶活性随温度升高而升高,在50℃时达到峰值,随后随温度升高而降低。
茶鲜叶苯丙氨酸解氨酶的提取及其活性测定

茶鲜叶苯丙氨酸解氨酶的提取及其活性测定
刘鸿年;刘发敏
【期刊名称】《中国茶叶》
【年(卷),期】1989(000)001
【摘要】苯丙氨酸解氨酶(PAL)是植物次生代谢中三个关键酶之一,它催化L-苯丙氨酸形成反-肉桂酸这一不可逆反应,因此它是一种限速酶。
该酶在进入芳香族二级代谢的起始酶的生物合成中起着关键的作用。
茶树具有很强的生物合成酶类化合物的能力,使幼叶中积累的可溶性多元酚含量高达35%(干重)。
由于酶类化合物及其衍生物与茶的品质,即滋味、香气、色泽等关系密切,而且该酶又与茶树品种、生育条件等有关,研究茶叶的PAL就有其重要的意义。
【总页数】2页(P4-5)
【作者】刘鸿年;刘发敏
【作者单位】不详;不详
【正文语种】中文
【中图分类】S571.1
【相关文献】
1.酶解法提取大别山苦荆茶鲜叶茶汁的工艺 [J], 项俊;王晓玲;方元平;钟玉林
2.茶鲜叶萎凋中苯丙氨酸解氨酶活性的研究 [J], 刘鸿年;刘发敏
3.固相萃取和分散固相净化-串联质谱测定茶鲜叶和干茶中的农药残留 [J], 杨洁; 周利; 余焕; 孙荷芝; 王新茹; 张新忠; 杨梅; 陈宗懋; 罗逢健
4.茶与茶制品紧密堆积密度测定仪和茶鲜叶氟素快速测定仪介绍 [J],
5.酸化茶鲜叶原料对鲜茶汁压榨提取的作用 [J], 龚淑英;张堂恒
因版权原因,仅展示原文概要,查看原文内容请购买。
苯丙氨酸解氨酶的测定

苯丙氨酸解氨酶的测定一、实验目的利用无土栽培技术培育不同pH下水芹,使用离心技术粗提取苯丙氨酸解氨酶,用分光光度计测不同的吸光值。
二、实验原理无土栽培是用人工配制的培养液,供给植物矿物营养的需要。
离心技术的应用是将样品放入离心机的离心管内,离心机驱动时,样品液就随离心管做匀速圆周运动,于是就产生了一向外的离心力。
由于不同颗粒的质量、密度、大小及形状等彼此各不相同,在同一固定大小的离心场中沉降速度也就不相同,由此便可以得到相互间的分离。
分光光度法则是通过测定被测物质在特定波长处或一定波长范围内光的吸收度,对该物质进行定性和定量分析。
三、仪器与试剂仪器:高速离心机、分光光度计、玻璃瓶、研钵、烧杯、量筒、试管、剪刀和纱布等。
试剂:霍格兰营养液,磷酸缓冲液,0.02mol/L苯丙氨酸,硼酸缓冲液,高锰酸钾材料:水芹幼苗,0.1mol/LNaOH溶液四、操作步骤一、水芹的无土栽培1.配好无土栽培营养液,准备7个玻璃瓶,分别加入15ml营养液。
再加NaOH溶液把玻璃瓶中pH值调成5,5.5,6,6.5,7,7.5,8,贴上标签。
2.把水芹幼苗从玻璃瓶中取出经过洗净,用高锰酸钾消毒处理后,分别移入盛有营养液的玻璃杯中,放在光照培养箱培养3.定期观察并注意加霍格兰营养液和NaOH溶液使玻璃瓶中pH保持不变。
二、水芹中苯丙氨酸解氨酶的粗提取1.等到水芹大概张到20cm左右,就把它们分别从玻璃瓶中取出,在30℃暗中培养5小时。
然后分别把同一pH值的水芹分别剪成根,茎,叶,根茎,根叶,叶茎,根茎叶七个部分均为0.5g。
2.加预冷的pH7.2磷酸缓冲液5mL,冰浴下充分研磨,均匀混合,用4层纱布过滤。
4000rpm 离心15min,弃沉淀。
获上清液用磷酸缓冲液稀释5倍,作为酶测定的粗提液,置于冰浴下保存备用。
三、水芹中苯丙氨酸解氨酶的吸光度测定设计对照试验:A:取粗水芹酶液0.1mL,加入2.5mL 0.02mol/L苯丙氨酸B:取0.1mL硼酸缓冲液,加入2.5mL 0.02mol/L苯丙氨酸(对照)。
苯丙氨酸解氨酶(PAL)检测试剂盒(苯丙氨酸比色法)
苯丙氨酸解氨酶(PAL)检测试剂盒(苯丙氨酸比色法)简介:苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL)是催化直接脱掉L-苯丙氨酸上的氨而生成反式桂皮酸的酶。
该酶多存在于高等植物、酵母、菌类可溶性部分物质,是1961年J.Koukol在大麦中发现的,推测其分子量约为,这是一个可把苯丙氨酸用于酚类化合物合成的酶。
在组织中的活性可随外界因素而发生显著变化,用光照、病伤害、植物激素处理等会使活性显著增加。
在多数情况下,在组织中活性增加时,酶发生失活作用,这时组织中具有活性酶的量很快就会减少,据认为这种失活是与类蛋白质物质作用有关。
测定细胞木质素合成途径中间代谢物及关键酶活性,可以探讨多种生物细胞发育过程中木质素沉积的代谢机理,为减少水果石细胞含量提高其品质提供依据。
Leagene苯丙氨酸解氨酶(PAL)检测试剂盒(苯丙氨酸比色法)检测原理是以苯丙氨酸作为底物,在酶促反应的最适条件下采用每隔一定时间测定产物生成量的方法,于分光光度计检测吸光度,以吸光度变化所需酶量进行计算。
该试剂盒主要用于植物组织的裂解液或匀浆液、血清等样品中内源性的苯丙氨酸解氨酶活性,尤其适用于检测水果中苯丙氨酸解氨酶活性。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
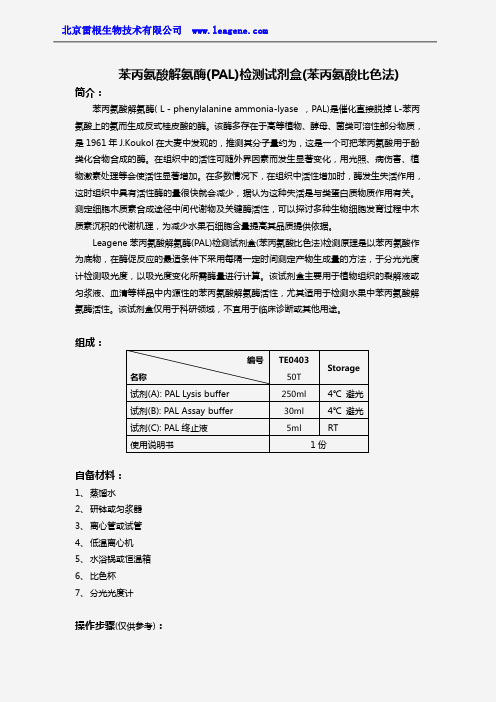
组成:自备材料:1、蒸馏水2、研钵或匀浆器3、离心管或试管4、低温离心机5、水浴锅或恒温箱6、比色杯7、分光光度计操作步骤(仅供参考):编号名称TE040350TStorage试剂(A):PAL Lysis buffer250ml4℃避光试剂(B):PAL Assay buffer30ml4℃避光试剂(C):PAL终止液5ml RT使用说明书1份1、准备样品:①植物样品:取植物组织或水果中层果肉,加入PAL Lysis buffer,冰浴情况下充分捣碎研磨或匀浆,离心,留取上清液,冻存,用于苯丙氨酸解氨酶的检测。
②血浆、血清和尿液样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的测定,冻存,用于苯丙氨酸解氨酶的检测。
苯丙氨酸解氨酶(PAL)活性检测试剂盒说明书__紫外分光光度法UPLC-MS-4456

苯丙氨酸解氨酶(PAL)活性检测试剂盒说明书紫外分光光度法货号:UPLC-MS-4456规格:50T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件提取液液体60mL×1瓶4℃保存试剂一液体40mL×1瓶4℃保存试剂二粉剂×3瓶4℃保存试剂三液体5mL×1瓶4℃保存溶液的配制:1、试剂二:临用前取1瓶加入4mL蒸馏水充分溶解待用;现配现用。
4℃可以保存2周。
产品简介:PAL(EC4.315)广泛存在于各种植物和少数微生物中,是植物体内苯丙烷类代谢的关键酶,与一些重要的次生物质如木质素、异黄酮类植保素、黄酮类色素等合成密切相关,在植物正常生长发育和抵御病菌侵害过程中起重要作用。
PAL催化L-苯丙氨酸裂解为反式肉桂酸和氨,反式肉桂酸在290nm处有最大吸收值,通过测定吸光值升高速率计算PAL活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:紫外分光光度计、水浴锅、台式离心机、可调式移液器、1mL石英比色皿、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
10000g,4℃离心10min,取上清,置冰上待测。
二、测定步骤1、分光光度计预热30min以上,调节波长至290nm,蒸馏水调零。
2、操作表试剂名称测定管(μL)空白管(μL)样本20试剂一780800试剂二200200混匀,30℃准确水浴30min试剂三4040混匀,静置10min后,在290nm处记录测定管吸光值A1和空白管吸光值A2,ΔA=A1-A2。
(空白管只需做1-2次)三、PAL活性计算(1)按样本蛋白浓度计算:单位的定义:每mg组织蛋白在每mL反应体系中每分钟使290nm下吸光值变化0.1定义为一个酶活力单位。
苯丙氨酸解氨酶(PAL)在植物中的作用及其活性测定方法

苯丙氨酸解氨酶(PAL)在植物中的作用及其活性测定方法生命科学实验117篇原创内容公众号苯丙氨酸解氨酶(PAL)催化 L-苯丙氨酸解氨生成反式肉桂酸,是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的酶,也是苯丙氨酸代谢途径的关键酶和限速酶。
莽草酸途径产生的莽草酸通过分枝酸、预苯酸经转氨作用生成苯丙氨酸,从而进入苯丙烷类代谢途径,苯丙烷类代谢可生成反式肉桂酸、香豆酸、阿魏酸、芥子酸等中间产物,这些中间产物可进一步转化为香豆素、绿原酸,也可以形成 CoA酯,再进一步转化为木质素、黄酮、异黄酮、生物碱、苯甲酸酯糖苷等次生代谢产物。
一切含苯丙烷骨架的物质都由该代谢途径直接或间接生成。
在生物次生物质代谢中具有防紫外线伤害、抵抗病原体的侵害、保持花粉生活力及形成植物花青素等多种重要作用。
该酶在不同组织中、不同的内外因素调节下,含量水平及其基因表达的时空方式均有所不同。
1.PAL对植物生理代谢的意义植物的代谢分为初级代谢和次级代谢。
植物的次级代谢有多条途径,苯丙烷类代谢途径是其中很重要的一条。
苯丙烷类途径生成的黄酮、异黄酮、生物碱等次生代谢产物在植物的生长发育过程中起着重要的作用,所以PAL对植物的生理意义非常重大。
1.1在木质化中的作用在植物的木质化组织中含有较高的PAL活性。
用分离的百日草叶肉细胞研究了苯丙烷类代谢酶类与木质素、管状分子形成和细胞分化的关系,发现在百日草细胞分化过程中,木质素的合成及管状分子形成与PAL 活性的增加成正相关,细胞溶质中的 PAL 活性在木质化之前迅速上升,微粒体和细胞壁的 PAL 活性在木质化期间快速增加。
1.2在植物色素形成过程中的作用花色素是植物花朵、果实和叶片颜色的重要组成部分,花色素等的合成可由苯丙烷类产物反香豆酰 CoA 经过类黄酮途径生成,该过程与 PAL 密切相关。
如苋红素是中央种子目植物所特有的色素,当用白光、蓝光或红光照射尾穗苋黄化苗后,发现 PAL活性均有不同程度地上升,并有苋红素的积累。
柠条幼苗苯丙氨酸解氨酶的纯化

林业科学研究 2008,21(2):154~160F orest Resea rch 文章编号:100121498(2008)022*******柠条幼苗苯丙氨酸解氨酶的纯化邱枫1,2,许雷2,高洪文1(1.中国农业科学院北京畜牧兽医研究所,北京 100094; 2.中国农业科学院研究生院,北京 100081)摘要:用离子交换层析和分子筛层析分离纯化了真叶期柠条根、速生期柠条叶、茎中的苯丙氨酸解氨酶(P AL ),并测定了PAL 全酶的分子量。
用S DS 2P AGE 鉴定了全酶的组成,测定了各亚基的分子量。
结果表明:柠条叶中存在306K D 和222K D 两种PA L ,前者是由82K D 和74K D 亚基组成的异聚体,后者是由74K D 亚基组成的同聚体;而柠条根和茎中仅存在74K D 亚基组成的222K D 全酶。
该研究为p al 基因的克隆及应用奠定了基础。
关键词:柠条;苯丙氨酸解氨酶;分离纯化中图分类号:S793.3文献标识码:A收稿日期6225, 修回日期262基金项目国家“63”现代农业主题“抗旱耐盐碱生态环境建设用林灌木柠条、沙棘等新品种选育”()作者简介邱枫(6—),女,辽宁沈阳人,博士。
研究方向生物化学与分子生物学2yq f @63Pur if i ca ti on of Phenyl a l an i n e Amm on i a 2lya se i n C aragan a ko rsh insk ii J uven ileQ IU Feng 1,2,X U Lei 2,G AO Hong 2wen1(1.Institute of Ani mal Sci ences ,Ch i nes e A cademy of Agricu ltural Sciences,B eiji ng 100094,China;2.Graduat e School,C hines e Acade m y of A gricul t u ral Sci ences,B eijing 100081,C hina)Abstrac t:Phenylalanine a mmonia 2lyase (P AL;EC 4.3.1.5)of r oot in leaf stage,leaf and branch in r ap id gr ow th stage of Ca ragana korsh insk ii ,was purified by ion exchange chr om at ogr aphy and gel filtration chr oma t ography .The subunits of P AL by S D S 2PAGE were analyzed .The results sho wed tha t when purified by i on exchange chr om at ogr aphy and gel filtrati on chr om atography,there were t wo kindsof P AL ,one MW wa s 306K D and the other was 222K D,fr om leaf and one P AL which MW wa s 222K D fr om ste m and r oot .B y S DS 2P A G E,it could conclude tha t the P AL,MW 306K D ,was composed of t wo polypep tides which MW m ight be 82K D and t wo polypeptide s which MW m ight 74K D ,and the 222K D 2MW P AL wa s composed of f our homol ogy subunits,which MW was 74K D .Key wor ds:Ca ragan a korsh inskii ;phenylalanine a mmonia 2lyase;purify柠条(Ca ragana ko r shinskii K om.)具有较强的适应性和抗逆性,是纤维素、蛋白质等含量较高的多年生灌木。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苯丙氨酸解氨酶的纯化及活性测定-(word可编辑)苯丙氨酸解氨酶的纯化及活性测定一、目的
掌握纯化酶的基本操作和方法;学习一种常用的酶活力测定法。
二、原理
苯丙氨酸解氨酶( L-phenylalanine : ammonia lyase, 简称 PAL ; EC4 . 3 .
1 .
5 )是植物体内苯丙烷类代谢的关键酶,与一些重要的次生物质如木质素、异
黄酮类植保素、黄酮类色素等合成密切有关,在植物正常生长发育和抵御病菌侵害过程中起重要作用。
PAL 催化 L- 苯丙氨酸裂解为反式肉桂酸和氨,反式肉桂酸
在 290nm 处有最大吸收值。
若酶的加入量适当, A290 升高的速率可在几小时内
保持不变,因此通过测定 A290 升高的速率以测定 PAL 活力。
规定 1h 内 A 290 增加 0 . Ol 为 PAL 的一个活力单位。
三、试剂和材料
(1) 0.l mol 硼酸一硼砂缓冲液 (pH8.7)
(2) 酶提取液 0 .1 mol/ I 硼酸一硼砂缓冲液(含 1 mmol/ I, EDTA,
20mmol/ L β
一巯基乙醇)
( 3 ) 0 . 6m.ol/ I- L 一苯丙氨酸溶液
( 4 ) 6 mol/ l HCl
(5 )固体硫酸铵
(6 ) 0. 02mol/l- 磷酸盐缓冲液( pH8.0, 含 0 . 5 mmol/ L EDTA, 2.5% 甘油,20nlmol/ l . β - 巯基乙醇)
( 7 ) Sephadex G 一 25
( 8 ) DEAE 纤维素 52
( 9 )标准蛋白质溶液( 100ug/ ml ):准确称取 10 mg 牛血清自蛋自于烧杯内,用蒸馏水溶解,完全转移到 100 ml 容量瓶内,定容至刻度,混匀。
( 10 )考马斯亮蓝 G-250 蛋白质染色液:称取 10 mg 考马斯亮蓝 G - 250, 溶于 5ml 95 `% 乙醇中,加入 85 ,( W/V )磷酸 loml ,混匀后即为母液。
用时,按 15ml 母液加 85m1 蒸馏水的比例稀释,混匀后过滤即为稀释液。
( 11 )滴管(l2) 止水夹
材料:供试植物材料
四、操作步骤
( 1 )酶液提取植物材料 lg ,剪成小段,加入 5 倍体积的酶提取液,于冰
浴上研钵研磨。
(2) 将已匀浆的酶液用三层纱布过滤。
滤液转入离心管, 10000g 冷冻离心
30 分钟。
(3) 取离心后的上清液(酶粗提液),量出其体积,放置冰浴中备用。
( 4 )硫酸铵分级沉淀酶蛋白
从酶粗提液中吸出 0. 5m1 ,以作后面活力测定用。
余下酶液根据实际体积、温度和硫酸铵饱和度用量表,算出达到 38% 饱和度应加入酶液中的硫酸铵量,并称硫酸铵。
将酶液倒入烧杯内,边缓慢搅拌边缓慢加入称好的固体硫酸铵,待全部加完后,再缓慢搅拌 10min ; 然后于 10 000 g 下冷冻离心 l0 min, 保留上清液于烧杯内。
根据硫酸安饱和度用量表,算出从 38 ,到 75 ,饱和度所需硫酸铵用量。
按上述同法处理,离心后,弃去上清液,保留沉淀。
将沉淀溶于 1 ml 酶抽提液中。
Sephadex G 一 25 层析脱盐 ( 5 )
凝胶溶胀:称取 Sephadex G 一 25 5g, 加入适量 0 . 02mol/ I. 磷酸盐缓冲液,在室温下溶胀。
待溶胀平衡后,虹吸去除上清液中的细小凝胶颗粒,这样处理2 一 3 次。
装柱:固定好层析柱,柱保持垂直,将 20m1 蒸馏水装入柱内,打开止水夹赶
去出口内气泡,当柱内保留 1 ml 左右水层时,把处理好的 Sephadex G2 5 用玻璃棒搅匀,尽量一次加入柱内,待胶床表面仅有 1 - 2 cm 液层时,旋紧止水夹、。
装好的胶柱应无气泡、无节痕、床面平正,床面铺 1 张圆形滤纸片。
上样:让胶床表面几乎不留液层,将 l ml 酶液小心注入胶床而中央,注意不要冲坏床面,吸取 lm ~磷酸盐缓冲液,把吸附在玻璃壁上的沉淀液洗入柱内,在床表面仅有 lml 左右液层时,再小心地用滴管加入 5 - 6 cm 高的磷酸缓冲液洗脱。
洗脱收集:取刻度试管 5 支(包括上面一支),编号,柱床上面不断加磷酸盐缓冲液洗脱,出水口不断用刻度试管收集洗脱液,每管收集 3m1 。
测定每管的 PAL 酶活力,合并 PAL 活力高的试管,记为酶洗脱液。
( 6 ) DEAL 纤维素柱梯度洗脱
称取 DEAE 纤维素 52 干粉 1 一 1.5g ,加 20m1 的 0.02mol/ I. 磷酸盐缓冲液 (pH8 . 0) 浸泡 4h 以上(或浸泡过夜)。
装柱:把预处理的 DEAE 纤维素 52 装柱(方法及要求同凝胶层析柱)。
装柱完
成后,用 2 一 3 个床体积的 0 . 02 mol/ I_ 磷酸盐缓冲液( PH8.0 ) 平衡该柱。
上样:把所得的酶洗脱液小心地注入柱床面中央,所有注意点和方法也与凝胶
层析中上样相似。
上样结束后,在床面以上小心地加入 0.02 niol / I_ 磷酸盐缓冲液 2-3cm 厚液层。
注意上样开始就收集流出液。
洗柱:约用 2 倍床体积的 0.02mol/ L 磷酸盐缓冲液洗柱,收集洗柱液。
按洗脱管编号,每隔 3 管(如 1,4,7 等)取其洗脱液 0.1m1 ,测各管中 PAL 的活力;合并主要含有 PAL 活力的各管洗脱液,并量出其总体积( ml )。
(7) 酶活力测定取试管 3 支,按表中所述加样 (0 号为调零管, 1 号为测定管, 2 号为对照管 )
1 2 3 试管编号
4 3.9 4.9 0.01mol/l 硼酸缓冲液
0.1 0.1 酶液
1 1 0.6mmol/l 苯丙氨酸 (ml)
将各管混匀,放入 40 度恒温水浴保温 1h ,到时加 0.2ml 2mmol/1. HCl 终止反应。
紫外分光光度计预热 lOmin, 于波长 290nm 处测定各管的 A 290 。
(8) 蛋白质测定(考马斯亮蓝染色法)
取酶液 0.I ml ,用蒸馏水稀释至 5ml.
取试管 8 支,按下表加入各溶液:
0 1 2 3 4 5 6 7 试管编号
0 0.2 0.4 0.6 0.8 1.0 标准蛋白质溶液
( ml )
1 1 稀释酶液( mI )
2 1.8 1.6 1.4 1.2 1 蒸馏水( ml )
2 2 2 2 2 2 2 2 考马斯亮蓝 (ml)
将上述各管混匀,静置 2min, 测定各管的 A 595 , 五、结果处理
PAL 总活力、比活力、蛋自质含量的计算
比活力
蛋白质含量
步骤体积( ml ) 总活力( m ) ( m/mg ( mg )
protein )
粗提
硫酸铵沉淀
凝胶层析
离子交换层析
注:( 1 )绘制蛋白质测定的标准曲线:以 1~ 5 号管溶液的 A 59 5 值为纵坐标,相应管中的蛋自质微克数为横坐标,作图。
(2) PAL 比活力计算:
六、注意事项
1. 往酶液中加固体硫酸铵时,注意不能有大颗粒,加的速度也不能过快。
2. 层析柱要保持与地面垂直,往柱内加样品时要小心,避免冲坏床面。
七、思考事项
1. 在 PAL 活力测定中,设置 0 号管和对照管的目的是什么,
2. 如何确定硫酸钱沉淀某所需酶蛋白质的最佳饱和度的范围, 3 . Sephadex G 一 25 柱层析脱盐成功的关键有哪些,
4. 如果改变 DEAE 纤维素为 CM 纤维素(阳离子交换剂),其他条件均一不变,问各蛋白的洗脱行为有何变化,。
