人教高中化学选修三课后限时作业:第2章 第3节 第2课时 范德华力和氢键 含解析
2018-2019学年人教版化学选修3第2章第3节分子的性质第2课时作业

第二章第三节第2课时范德华力、氢键及其对物质性质的影响与溶解性知识点一范德华力与氢键的考查1.卤素单质从F2到I2在常温常压下的聚集态由气态、液态到固态的原因是()A.原子间的化学键键能逐渐减小B.范德华力逐渐增大C.原子半径逐渐增大D.氧化性逐渐减弱2.图L2-3-5中每条折线表示周期表ⅣA族~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是()图L2-3-5A.H2SB.HClC.PH3D.SiH43.下列物质的结构或性质与氢键无关的是()A.乙醛的沸点B.乙醇在水中的溶解度C.氢化镁的熔点D.DNA的双螺旋结构知识点二溶解性的考查4.根据物质的溶解性及“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中的溶解度大。
下列关于原因的叙述正确的是()A.溴、碘单质和四氯化碳中都含有卤素原子B.溴、碘是单质,四氯化碳是化合物C.Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子D.以上说法都不对5.[2018·河南三门峡模拟]下列说法不正确的是()A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关B.H2O的熔、沸点高于H2S是由于H2O之间存在氢键C.I2易溶于CCl4可以用相似相溶原理解释D.甲烷可与水形成氢键这种化学键6.[2017·山西太原模拟]下列事实与氢键有关的是()A.水加热到很高的温度都难以分解B.水结成冰体积膨胀,密度变小C.CH4、SiH4、GeH4、SnH4熔点随着相对分子质量的增加而升高D.HF、HCl、HBr、HI的热稳定性依次减弱7.二甘醇可用于溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。
二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。
下列有关二甘醇的叙述正确的是()A.符合通式C n H2n O3B.分子间能形成氢键C.分子间不存在范德华力D.能溶于水,不溶于乙醇8.[2018·福建三明二中段考]下列说法中错误的是()A.卤化氢中,以HF沸点最高,是由于HF间存在氢键B.H2O的沸点比HF的高,可能与氢键有关C.氨水中存在分子间氢键D.氢键X—H…Y的三个原子总在一条直线上9.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。
人教版高中化学选修3第二章 第三节 第二课时 范德华力和氢键 课件(共20张PPT)

12.1
568
462.8
390.8
4. 氢键强弱
氢键强弱与X和Y的吸引电子的能力有关, 即与X和Y的电负性有关.它们的吸引电子能力越 强(即电负性越大),则氢键越强,如F原子得电 子能力最强,因而F-H…F是最强的氢键; 原子吸 引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N C原子吸引电子能力较弱,一般不形成氢键。
(2)相对分子质量 相同 或 相近 时,分子的极性 越 大 ,范德华力越 大 ,熔、沸越 高 。
3. 影响范德华力大小的因素
(1)结构 相似 的分子,相对分子质量越 大 ,范德 华力越 大 ,熔、沸越 高 。
(2)相对分子质量 相同 或 相近 时,分子的极性越 大 , 范德华力越 大 ,熔、沸越 高 。
4.氢键的存在 (1)分子间氢键 (2)分子内氢键
邻羟基苯甲醛(熔点:-7℃)
对羟基苯甲醛 (熔点:115-117℃)
甲醇
例如 (1)分子间氢键: (2)分子内氢键:
5. 氢键对物质物理性质的影响:
(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)物质的溶解性
思考:NH3为什么极易溶于水?NH3溶于水是形成NH…O还是形成O-H…N?
PH3
SiH4×
H2Se AsH3
HB×r
GeH4
H2Te SbH3
HI
×
SnH4
-150 CH4×
2
3
4
5 周期
一些氢化物的沸点
非金属元素的氢化物在固态时是分子晶 体,其熔沸点与其分子量有关.对于同一主 族非金属元素而言,从上到下,分子量逐渐 增大,熔沸点应逐渐升高.而HF、H2O、NH3却 出现反常,为什么?
课时作业3:2.3.2范德华力、氢键及其对物质性质的影响与溶解性

第2课时范德华力、氢键及其对物质性质的影响与溶解性一、选择题1.下列事实与氢键有关的是()A.水加热到很高的温度都难以分解B.水结成冰体积膨胀,密度变小C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高D.HF、HCl、HBr、HI的热稳定性依次减弱2.有下列两组命题BA.Ⅰ①B.Ⅱ②C.Ⅲ③D.Ⅳ④3.下列叙述正确的是()A.同主族金属的原子半径越大,熔点越高B.稀有气体原子序数越大沸点越高C.分子间作用力越弱,分子晶体的熔点越低D.同周期元素的原子半径越小,越易失去电子4.你认为下列说法不正确的是()A.氢键存在于分子之间,不存在于分子之内B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大C.NH3极易溶于水而CH4难溶于水的原因是NH3是极性分子,CH4是非极性分子D.冰熔化时只破坏分子间作用力5.固体乙醇晶体中不存在的作用力是()A.极性键B.非极性键C.离子键D.范德华力6.2007年9月,美国科学家宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现,有望解决用水作人类能源的重大问题。
无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。
上面所述中“结合力”的实质是()A.分子间作用力B.氢键C.非极性共价键D.极性共价键7.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。
根据氨水的性质可推知NH3·H2O的结构式为()二、非选择题8.在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。
极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。
分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。
试回答以下问题:(1)HCl、CS2、H2S、SO2四种分子中μ=0的是__________________;(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,3种分子的偶极矩由大到小的排列顺序是:__________________;(3)实验测得:μ(PF3)=1.03、μ(BCl3)=0。
【高中化学】选修三 第二章 第3节 分子的性质 第二课时学案
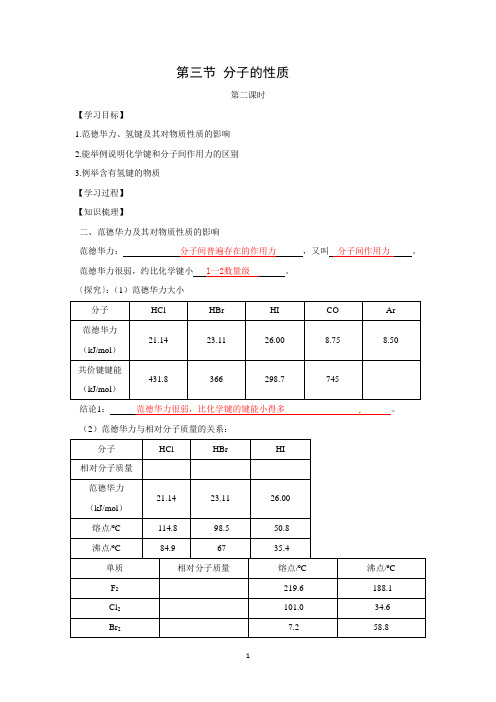
第三节分子的性质第二课时【学习目标】1.范德华力、氢键及其对物质性质的影响2.能举例说明化学键和分子间作用力的区别3.例举含有氢键的物质【学习过程】【知识梳理】二、范德华力及其对物质性质的影响范德华力:分子间普遍存在的作用力,又叫分子间作用力。
范德华力很弱,约比化学键小l一2数量级。
〔探究〕:(1)范德华力大小分子HCl HBr HI CO Ar范德华力21.14 23.11 26.00 8.75 8.50(kJ/mol)共价键键能431.8 366298.7 745(kJ/mol)结论1:范德华力很弱,比化学键的键能小得多。
(2)范德华力与相对分子质量的关系:分子HCl HBr HI相对分子质量范德华力21.14 23.11 26.00(kJ/mol)熔点/ºC -114.8 -98.5 -50.8沸点/ºC -84.9 -67 -35.4单质相对分子质量熔点/ºC 沸点/ºCF2-219.6 -188.1Cl2-101.0 -34.6Br2-7.2 58.8I2113.5 184.4结论2:相对分子质量越大,范德华力越大。
(3)范德华力与分子的极性的关系:分子相对分子质量分子的极性熔点/ºC 沸点/ºCCO 28 -205.05 -191.49N228 -210.00 -195.81结论3:分子的极性越大,范德华力越大。
三、氢键及其对物质性质的影响非金属元素的氢化物在固态时是分子晶体,其熔沸点和其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?说明在HF、H2O、NH3分子间还存在除分子间作力之外其他作用.这种作用就是氢键。
1. 氢键:(1)氢键的表示:氢键可以用A—H…B表示。
(2)形成氢键的一般条件:电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(3)分子内氢键和分子间氢键2. 氢键对物质性质的影响(1)分子间氢键,使物质的熔、沸点升高:(2)分子间内氢键,使物质的熔、沸点降低:思考:氢键是否属于“化学键”?它与化学键、分子间作用力(范德华力)有什么关系?化学键>氢键>范德华力【典题解悟】例1. 下列物质的沸点,从高到低的顺序正确的是()A.HI>HBr>HCl>HFB.CI4>CBr4>CCl4>CF4C.NaCl>Na Br>KBrD.Na>Mg>Al解析:HI、HBr、HCl三个分子结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小,而HF中还存在氢键,故HF的熔、沸点反常,为最大,则沸点大小顺序为HF>HI>HBr>HCl;而CI4、CBr4、CCl4、CF4结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小;NaCl、NaBr、KBr中存在离子键,离子所带电荷相同,离子间距依次变大,故离子键的作用力依次变小,沸点依次变小;Na、Mg、Al是金属,它们的原子最外层价电子数依次为1、2、3,Na+、Mg2+、Al3+半径依次变小,故金属键的作用力依次增大,沸点依次变大。
【教育资料】20182019学年高中化学选修3练习:第二章第三节 第2课时范德华力学习专用

第二章第三节第2课时范德华力、氢键及其对物质性质的影响与溶解性知识点一范德华力与氢键的考查1.卤素单质从F2到I2在常温常压下的聚集态由气态、液态到固态的原因是()A.原子间的化学键键能逐渐减小B.范德华力逐渐增大C.原子半径逐渐增大D.氧化性逐渐减弱2.图L2-3-5中每条折线表示周期表ⅣA族~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是()图L2-3-5A.H2SB.HClC.PH3D.SiH43.下列物质的结构或性质与氢键无关的是()A.乙醛的沸点B.乙醇在水中的溶解度C.氢化镁的熔点D.DNA的双螺旋结构知识点二溶解性的考查4.根据物质的溶解性及“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中的溶解度大。
下列关于原因的叙述正确的是()A.溴、碘单质和四氯化碳中都含有卤素原子B.溴、碘是单质,四氯化碳是化合物C.Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子D.以上说法都不对5.[2019·河南三门峡模拟]下列说法不正确的是()A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关B.H2O的熔、沸点高于H2S是由于H2O之间存在氢键C.I2易溶于CCl4可以用相似相溶原理解释D.甲烷可与水形成氢键这种化学键6.[2019·山西太原模拟]下列事实与氢键有关的是()A.水加热到很高的温度都难以分解B.水结成冰体积膨胀,密度变小C.CH4、SiH4、GeH4、SnH4熔点随着相对分子质量的增加而升高D.HF、HCl、HBr、HI的热稳定性依次减弱7.二甘醇可用于溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。
二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。
下列有关二甘醇的叙述正确的是()A.符合通式C n H2n O3B.分子间能形成氢键C.分子间不存在范德华力D.能溶于水,不溶于乙醇8.[2019·福建三明二中段考]下列说法中错误的是()A.卤化氢中,以HF沸点最高,是由于HF间存在氢键B.H2O的沸点比HF的高,可能与氢键有关C.氨水中存在分子间氢键D.氢键X—H…Y的三个原子总在一条直线上9.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。
高中化学人教版选修三课时作业2-3-1键的极性和分子的极性范德华力和氢键

课时作业9键的极性和分子的极性范德华力和氢键[练基础]1.下列叙述中正确的是()A.离子化合物中不可能存在非极性键B.非极性分子中不可能既含极性键又含非极性键C.非极性分子中一定含有非极性键D.不同非金属元素原子间形成的化学键都是极性键2.下列化学键中,键的极性最小的是()A.C—N B.C—FC.C—O D.C—C3.下列分子中,属于极性分子的是()A.CO2B.BeCl2C.BBr3D.COCl24.下列分子中,属于含有极性键的非极性分子的是()A.PCl3B.H2SC.P4D.C2H45.下列各组物质中均为属于含有极性键的非极性分子的是() A.CO2、H2S B.C2H4、CH4C.、C2H2D.NH3、HCl6.下列化合物中,化学键的类型和分子的极性(或非极性)皆相同的是()A.CO2和SO2B.CH4和SiO2C.BF3和NH3D.HCl和HI7.当干冰升华时,下列各项中发生变化的是()A.分子内化学键B.分子间距离C.分子构型D.氢键8.下列物质中不存在氢键的是()A.冰醋酸中醋酸分子之间B.液态氟化氢中氟化氢分子之间C.一水合氨分子中的氨分子与水分子之间D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间9.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是()10.如图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是() A.H2S B.HClC.PH3D.SiH411.有下列两组命题,其中乙组命题正确且能用甲组命题正确解释的是()①Ⅰa②Ⅱb③Ⅲc④Ⅳ dA.①③B.②③C.①④D.②④[提素养]12.美国科学家宣称:普通盐水在无线电波照射下可燃烧,有望解决用水作人类能源的重大问题。
无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。
上述中“结合力”实质是()A.分子间作用力B.氢键C.非极性共价键D.极性共价键13.CO2的资源化利用是解决温室效应的重要途径。
高中化学选修3练习:第二章第三节第2课时范德华力
高中化学选修3练习:第二章第三节第2课时范德华力知识点一范德华力与氢键的考察1.卤素单质从F2到I2在常温常压下的聚集态由气态、液态到固态的缘由是()A.原子间的化学键键能逐渐减小B.范德华力逐渐增大C.原子半径逐渐增大D.氧化性逐渐削弱2.图L2-3-5中每条折线表示周期表ⅣA族~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是()图L2-3-5A.H2SB.HClC.PH3D.SiH43.以下物质的结构或性质与氢键有关的是()A.乙醛的沸点B.乙醇在水中的溶解度C.氢化镁的熔点D.DNA的双螺旋结构知识点二溶解性的考察4.依据物质的溶解性及〝相似相溶〞的普通规律,说明溴、碘单质在四氯化碳中比在水中的溶解度大。
以下关于缘由的表达正确的选项是()A.溴、碘单质和四氯化碳中都含有卤素原子B.溴、碘是单质,四氯化碳是化合物C.Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子D.以上说法都不对5.[2021·河南三门峡模拟]以下说法不正确的选项是()A.HCl、HBr、HI的熔、沸点依次降低与分子间作用力大小有关B.H2O的熔、沸点高于H2S是由于H2O之间存在氢键C.I2易溶于CCl4可以用相似相溶原了解释D.甲烷可与水构成氢键这种化学键6.[2021·山西太原模拟]以下理想与氢键有关的是()A.水加热到很高的温度都难以分解B.水结成冰体积收缩,密度变小C.CH4、SiH4、GeH4、SnH4熔点随着相对分子质量的添加而降低D.HF、HCl、HBr、HI的热动摇性依次削弱7.二甘醇可用于溶剂、纺织助剂等,一旦进入人体会招致急性肾衰竭,危及生命。
二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。
以下有关二甘醇的表达正确的选项是()A.契合通式C n H2n O3B.分子间能构成氢键C.分子间不存在范德华力D.能溶于水,不溶于乙醇8.[2021·福建三明二中段考]以下说法中错误的选项是()A.卤化氢中,以HF沸点最高,是由于HF间存在氢键B.H2O的沸点比HF的高,能够与氢键有关C.氨水中存在分子间氢键D.氢键X—H…Y的三个原子总在一条直线上9.假定不时地降高温度,完成〝雪花→水→水蒸气→氧气和氢气〞的变化。
高中化学人教版选修三范德华力和氢键word版含解析
键的极性和分子的极性范德华力和氢键1.用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是() A.苯B.二硫化碳C.氯水D.四氯化碳2.下列物质中,由极性键形成的非极性分子是()A.CO2B.Br2C.CaCl2D.SO23.下列关于粒子结构的描述错误的是()A.CS2、C2H2、BeCl2都是直线形分子B.CCl4和CH2Cl2均是四面体构型的非极性分子C.H2S和NH3均是由极性键构成的极性分子D.HCl和HS-均是含有一个极性键的18电子粒子4.下列物质的性质可用范德华力的大小来解释的是()A.HF、HCl、HBr、HI的热稳定性依次减弱B.F2、Cl2、Br2、I2的熔、沸点依次升高C.、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱D.CH3—O—CH3、C2H5OH的沸点依次升高5.下列叙述与分子间作用力无关的是()A.气体物质加压或降温时能凝结或凝固B.干冰易升华C.氟、氯、溴、碘单质的熔、沸点依次升高D.氯化钠的熔点较高6.下列物质中不存在氢键的是()A.冰醋酸中醋酸分子之间B.液态氟化氢中氟化氢分子之间C.氨水中氨分子与水分子之间D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间7.下列说法正确的是()A.氢键是化学键B.甲烷可与水形成氢键C.乙醇分子跟水分子之间不只存在范德华力D.碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键8.下列说法正确的是()A.乙硫醇(CH3CH2—SH)比乙醇(CH3CH2—OH)熔点低,原因是乙醇分子间易形成氢键B.氯化钠易溶于水是因为形成了氢键C.氨易液化与氨分子间存在氢键无关D.H2O是一种非常稳定的化合物,这是由于氢键所致9.已知各种硝基苯酚的性质如下表:名称结构式25 ℃,水中溶解度/g熔点/ ℃沸点/ ℃邻-硝基苯酚0.2 45 100间-硝基苯酚 1.4 96 194对-硝基苯酚 1.7 114 295A.邻-硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚B.间-硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键C.对-硝基苯酚分子间能形成氢键,使其熔沸点较高D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小10.在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键结合的非极性分子是________。
高中化学 2.3.2 范德华力和氢键课时作业 新人教版选修3
第2课时 范德华力和氢键[目标要求] 1.掌握范德华力的实质及对物质性质的影响。
2.掌握氢键的实质、特点、形成条件及对物质性质的影响。
一、范德华力及其对物质性质的影响1.含义范德华力是________之间普遍存在的相互作用力,它使得许多物质能以一定的凝聚态(固态和液态)存在。
2.特征(1)范德华力约比化学键键能____1~2个数量级。
(2)无________性和________性。
3.影响因素(1)分子的极性越大,范德华力________。
(2)结构和组成相似的物质,相对分子质量越大,范德华力________。
4.对物质性质的影响范德华力主要影响物质的________性质,如熔点、沸点;化学键主要影响物质的________性质。
范德华力越大,物质熔、沸点________。
思考 CO 2和CS 2结构和组成相似,常温下CO 2是气体、CS 2是液体的原因是:_______。
二、氢键及其对物质性质的影响1.概念氢键是一种______________。
它是由已经与____________很强的原子(如N 、F 、O)形成 共价键的____________与另一个分子中或同一分子中____________很强的原子之间的作用力。
2.表示方法氢键通常用________表示,其中A 、B 为____、____、____中的一种,“—”表示____________,“…”表示形成的________。
3.特征(1)氢键不属于化学键,是一种分子间作用力。
氢键键能较小,约为________的十分之 几,但比____________强。
(2)氢键具有一定的________性和________性。
4.类型氢键—⎪⎪⎪→分子间氢键→分子内氢键5.氢键对物质性质的影响(1)当形成分子间氢键时,物质的熔、沸点将________。
(2)当形成分子内氢键时,物质的熔、沸点将________。
(3)氢键也影响物质的电离、________等过程。
人教版高中化学选修3课时规范练 第二章 键的极性与分子的极性 范德华力和氢键及其对物质性质的影响
第三节分子的性质第一课时键的极性与分子的极性范德华力和氢键及其对物质性质的影响课后篇素养形成A组定向巩固定向巩固一、键的极性与分子的极性1.在下列物质中,分子中电荷的空间分布是对称的是( )①CO2②CCl4③NH3④H2O ⑤HBrA.①②④B.②④⑤C.③⑤D.①②,空间结构对称的分子,其电荷的空间分布对称,如直线形的CO2、正四面体形的CCl4。
2.现有6种物质:①N2②NaOH ③C2H4④Na2O2⑤H2O2⑥NH4Cl。
下列说法正确的是( )A.既存在单键又存在双键的分子只有③B.既存在非极性键又存在极性键的极性分子是③⑤C.既存在σ键又存在π键的分子只有①D.既存在离子键又存在极性共价键的是②④⑥(是非极性键)又有碳氢单键(是极性键),A正确;③分子为非极性分子,B错误;③中既有碳碳双键(是非极性键)又有碳氢单键(是极性键),碳碳双键由一个σ键和一个π键构成,C错误;④含有离子键和非极性共价键,D错误。
3.下列说法正确的是( )A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.分子的极性与键的极性无关,如H2O2;非极性分子中不一定含有非极性键,如CH4、CO2均是非极性分子,却仅有极性键;分子的极性不仅与键的极性有关,还与分子立体构型有关。
4.X、Y为两种不同的元素,下列化学式一定为极性分子的是( )A.XYB.XY2C.XY3D.XY4项中在XY分子中X、Y是不同的原子,吸引电子能力不同,正、负电荷中心不重合,一定是极性分子;B项中三原子在同一条直线上时就是非极性分子,如CO2;C项中四原子若在同一平面内就是非极性分子,如BF3,不在同一平面内就是极性分子,如NH3;D项中该分子无论是四面体结构还是平面结构都是对称性分子,是非极性分子。
5.下列关于粒子结构的描述错误的是( )A.CS2、C2H2、BeCl2都是直线形分子l4和CH2Cl2均是四面体构型的非极性分子C.H2S和NH3均是由极性键构成的极性分子D.HCl和HS-均是含有一个极性键的18电子粒子C—H键的键长小于C—Cl键的键长,故CH2Cl2的立体构型不是对称的正四面体构型,因而属于极性分子,B错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章第三节第2课时(建议用时:35分钟)知识点基础训练能力提升1.范德华力2,4,5,6,8,912,13,14,15,16,17,182.氢键1,3,7,10,11[基础训练]1.水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。
下列关于水的说法正确的是()A.水是弱电解质B.可燃冰是可以燃烧的水C.氢、氧两种元素只能组成水D.0 ℃时冰的密度比液态水的密度大A解析可燃冰是指甲烷水合物,它的外形像冰而不是冰,B项错误;氢、氧两元素可组成H2O、H2O2等物质,C项错误;0 ℃时,水结成冰,冰中由于氢键的作用使其密度比水的密度小,D项错误。
2.下列说法不正确的是()A.分子间作用力是分子间相互作用力的总称B.分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响C.范德华力与氢键可同时存在于分子之间D.氢键是一种特殊的化学键,它广泛存在于自然界中D解析氢键不是化学键,二者之间不是包含与被包含的关系。
3.下列物质中,分子内和分子间均可形成氢键的是()A.NH3C.H2O D.CH3CH2OHB解析形成氢键的分子含有N—H、H—O或H—F键,NH3、H2O、CH3CH2OH有氢键,但只存在于分子间;中—O—H间可在分子间形成氢键,—O—H与可在分子内形成氢键。
4.下列物质的变化,仅破坏范德华力的是()A.碘单质的升华B.NaCl溶于水C.将水加热变为水蒸气D.NH4Cl受热A解析A项,碘升华破坏的是范德华力;C项,液态水变成水蒸气,既破坏了氢键又破坏了范德华力;B、D项破坏的是化学键,NaCl溶于水破坏了离子键,而NH4Cl受热既破坏了离子键又破坏了共价键。
5.下列物质发生变化时,所克服的粒子间的相互作用属于同种类型的是()A.液态HF与液态HBr分别受热变为气体B.氯化铵与苯分别受热变为气体C.氯化钠与氯化氢分别溶解在水中D.碘与干冰分别受热变为气体D解析A项,液态HF存在范德华力和氢键,液态HBr分子之间只存在分子间作用力,错误;B项,氯化铵是离子晶体,受热变为气体破坏的是离子键,而苯是分子晶体,受热变为气体克服的是分子间作用力,错误;C项,氯化钠是离子化合物,溶解破坏的是离子键,氯化氢溶解在水中破坏的是共价键,错误。
6.下列关于范德华力影响物质性质的叙述,正确的是()A.范德华力是决定由分子构成的物质的熔、沸点高低的唯一因素B.范德华力与物质的性质没有必然的联系C.范德华力能够影响物质的化学性质和物理性质D.范德华力仅影响物质的部分物理性质D解析范德华力是一种分子间作用力,因此范德华力不会影响物质的化学性质,只影响物质的部分物理性质。
7.比较下列化合物的沸点,前者低于后者的是()A.乙醇与氯乙烷B.邻羟基苯甲酸与对羟基苯甲酸C.对羟基苯甲醇与邻羟基苯甲酸D.H2O与H2TeB 解析 氢键分为两类:分子间氢键、分子内氢键。
同类物质相比,分子内形成氢键的物质的熔、沸点要低于分子间形成氢键的物质的熔、沸点。
如邻羟基苯甲酸、邻羟基苯甲醇等容易形成分子内氢键,沸点较低,而对羟基苯甲酸、对羟基苯甲醇则容易形成分子间氢键,沸点较高,B 项正确,C 项错误;A 项,由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点;同理,D 项H 2O 的沸点高于H 2Te 的沸点。
8.水星大气中含有一种被称为硫化羰(化学式为COS)的物质。
已知硫化羰与CO 2的结构相似,但能在O 2中完全燃烧,下列有关硫化羰的说法正确的是( )A .硫化羰的电子式为··S ······C ······O ······ B .硫化羰分子中三个原子位于同一直线上C .硫化羰的沸点比二氧化碳的低D .硫化羰在O 2中完全燃烧后的产物是CO 2和SO 3B 解析 由题中已知条件,COS 的电子式为,A 项错误;CO 2和COS 都是直线形分子,B 项正确;二者的相对分子质量不同,故硫化羰的沸点较高,C 项错误;硫化羰在O 2中完全燃烧后的产物是CO 2和SO 2,D 项错误。
9.下列现象与氢键有关的是( )①NH 3的熔、沸点比PH 3的高②小分子的醇、羧酸可以和水以任意比例互溶③冰的密度比液态水的密度小④水分子在高温下也很稳定A .①②③④B .①③④C .①②③D .①②④C 解析 ①氨分子间形成氢键而使其熔、沸点比PH 3的高;②小分子的醇、羧酸分子能与水分子形成分子间氢键,其溶解性较大;③冰中水分子间形成氢键;每个水分子与4个水分子形成氢键,从而增大了分子间的空隙,因而使其密度减小;④氢键只影响物质的物理性质,不影响物质的化学性质,所以水分子在高温下也很稳定与氢键无关。
10.下列物质性质的变化规律与分子间作用力无关的是( )A .在相同条件下,N 2在水中的溶解度小于O 2B .HF 、HCl 、HBr 、HI 的热稳定性依次减弱C .F 2、Cl 2、Br 2、I 2的熔、沸点逐渐升高D .CH 3CH 3、CH 3CH 2CH 3、(CH 3)2CHCH 3、CH 3CH 2CH 2CH 3的沸点逐渐升高B解析B项,HF、HCl、HBr、HI的热稳定性与其分子中的氢卤键的强弱有关,而与分子间作用力无关。
11.请写出下列物质性质的变化规律与哪种作用力有关并作简要解释。
(1)He、Ne、Ar、Kr、Xe、Rn等稀有气体单质的熔点和沸点逐渐升高:________________________________________________________________________。
(2)沸点::________________________________。
(3)熔点::_________________________________。
答案(1)与范德华力有关,且范德华力逐渐增强(2)与范德华力有关,且范德华力逐渐减弱(3)与氢键有关,邻硝基苯酚形成分子内氢键,间硝基苯酚和对硝基苯酚形成分子间氢键[能力提升]12.2017年5月18日,我国在南海神狐海域成功开采可燃冰,是全球第一个实现连续稳定获得天然气水合物的国家。
可燃冰是天然气与水在低温高压下形成的类冰状的晶体。
下列关于可燃冰中两种分子的描述不正确的是()A.都存在极性键B.都是极性分子C.H2O分子间能形成氢键,CH4分子间不能形成氢键D.甲烷不易溶于水B解析H2O、CH4分子中均存在极性键,A项正确;H2O是极性分子,CH4是非极性分子,B项错误;H2O分子间能形成氢键,CH4分子间不能形成氢键,C项正确;根据“相似相溶”的规律,甲烷不易溶于水,D项正确。
13.有下列两组命题,其中乙组命题正确且能用甲组命题正确解释的是()甲组乙组Ⅰ.H—I键的键能大于H—Cl键的键能A.HI比HCl稳定Ⅱ.H—I键的键能小于H—Cl键的键能B.HCl比HI稳定Ⅲ.HI分子间的范德华力大于HCl分子间的范德华力C.HI的沸点比HCl的高Ⅳ.HI分子间的范德华力小于HCl分子间的范德华力D.HI的沸点比HCl的低A.①③B.②③C.①④D.②④B解析键能的大小影响物质的热稳定性,键能越大,物质越稳定。
H—Cl键的键能大于H—I键的键能,所以HCl比HI稳定。
范德华力影响物质的熔、沸点的高低,范德华力越大,熔、沸点越高。
由于HI分子间的范德华力大于HCl分子间的范德华力,所以HI的沸点比HCl的高。
14.共价键、离子键、范德华力和氢键都是微观粒子之间的不同作用力,下列物质:①Na2O2②冰③金刚石④碘单质⑤CaCl2⑥白磷,其中只含有两种作用力的组合是() A.①④⑥B.①③⑥C.②④⑥D.①②③⑥A解析①中既含有离子键又含有共价键;②中含有共价键、范德华力和氢键;③中只含有共价键;④中含有共价键和范德华力;⑤中只含有离子键;⑥中含有共价键和范德华力。
15.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。
根据氨水的性质可推知NH3·H2O的结构式为()B解析从氢键的成键原理上讲,A、B都成立。
但从空间构型上讲,由于氨分子是三角锥形,易于提供孤对电子,所以,以B方式结合空间阻碍最小,结构最稳定;从事实上讲,依据NH3·H2O NH+4+OH-,可知B项正确。
16.如图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是()A.H2S B.HClC.PH3D.SiH4D解析在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA元素氢化物不存在反常现象,故a点代表的应是SiH4。
17.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最多的元素,Q的核电荷数是X与Z 的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:(1)X、Y的元素符号依次为________、________。
(2)XZ2与YZ2分子的立体构型分别是___________________和______________。
(3)Q的元素符号是__________,它属于第________周期,它的核外电子排布式为_____________________________________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键_______________________________________________。
解析由题知X的价电子排布图为,则X为S;Y为C;Z为O;Q的核电荷数为S和O的和,因此Q为24号元素Cr;在元素周期表中电负性最大的是F。
(3)Q为Cr,处于第四周期,它的核外电子排布式为1s22s22p63s23p63d54s1,其价电子为3d54s1,因此它的最高化合价为+6。
(4)E为F,HF的水溶液中,存在HF分子之间的氢键,HF分子和H2O分子之间的氢键,H2O分子之间的氢键。
答案(1)S C(2)V形直线形(3)Cr 四1s22s22p63s23p63d54s1或[Ar]3d54s1+6(4)F-H…F、F-H…O、O-H…F、O-H…O18.水分子间存在一种叫做“氢键”的作用(介于范德华力与化学键之间),彼此形成(H2O)n。
在冰中,每个水分子被4个水分子包围,形成变形的四面体,通过“氢键”相互连接成庞大的冰。
