钒的物化性质
钒

钒钒:元素符号V,银白色金属,在元素周期表中属VB族,原子序数23,原子量50.9414,体心立方晶体,常见化合价为+5、+4、+3、+2。
钒的熔点很高,常与铌、钽、钨、钼并称为难熔金属。
有延展性,质坚硬,无磁性。
具有耐盐酸和硫酸的本领,并且在耐气-盐-水腐蚀的性能要比大多数不锈钢好。
于空气中不被氧化,可溶于氢氟酸、硝酸和王水。
1. 3~6mm 小颗粒状产品牌号化学成分,%V含量不小于杂质含量,不大于Fe Cr Al Si O N CV199.95 0.005 0.006 0.005 0.004 0.025 0.006 0.01 V299.5 0.10 0.10 0.05 0.05 0.08 ——V399.0 0.15 0.15 0.07 0.09 0.10 ——钒钒2. 枝状结晶名称产品牌号 化 学 成 份 %V 含量(不小于)杂质含量(不大于) FeCrAlSiOV a 99.9 0.025 0.025 0.01 0.004 0.036 V b990.150.150.080.080.13. 金属钒粉名称 产品牌号状态粒度 (目) 化 学 成 份 %V 含量(不小于)杂质含量(不大于) FeCrAlSiO高纯 V 200 -200 99.9 0.032 0.025 0.01 0.004 0.05 V 325-32599.90.032 0.025 0.01 0.004 0.05名称 牌号 状态粒度 化学成分% 核 用 钒 V h枝 状 结 晶V Fe Si Al O C 99.9 0.004 0.004 0.01 0.025 0.01 N CuCdCo Nb Mo 0.010.006 0.0050.0050.010.005V 锭99.9% 杂质ImpurityFe 0.01Ni 0.001Cu 0.001Al 0.05Si 0.019Ca 0.001Mg 0.005Mo 0.001P 0.0053C 0.01O 0.015N 0.01H 0.001Ti+Zr+Hf 0.01 W 0.002B 0.001Sn 0.005Ta 0.005Mn 0.0001K 0.001Na 0.001Li 0.001Cr 0.002Nb 0.005%物理状态:钒熔点1890℃,有良好的耐蚀性、延展性和可锻性。
钒的性质及用途简介解析

钒的性质及用途简介解析2篇钒(vanadium)是一种化学元素,原子序数为23,化学符号为V。
它是一种过渡金属,具有一些独特的性质和广泛的应用。
本文将分别对钒的性质和用途进行简要解析。
1. 钒的性质钒是一种银白色的金属,具有较高的熔点和沸点。
其密度较高,硬度适中。
钒在常温下具有良好的耐腐蚀性,可以抵御空气、水和大多数常见的溶液的侵蚀。
它具有良好的导电和导热性能,是一种良好的强化剂和合金元素。
钒具有多种氧化态,包括+2、+3、+4和+5价态。
这使得钒能够参与多种化学反应,并在多个领域中发挥作用。
钒在高温下能够与氧气反应,形成氧化钒。
这种氧化物在陶瓷和染料工业中有一定的应用。
2. 钒的用途2.1 钒的应用于钢铁工业钒是钢铁中的重要合金元素之一。
它可以提高钢的强度、耐磨性和耐腐蚀性。
钒合金钢在造船、汽车制造、建筑和机械工程等领域中得到广泛应用。
钒还可以改善钢的焊接性能,使得钢结构具有更好的可塑性和可焊性。
2.2 钒的应用于化学工业钒在化学工业中有多种应用。
首先,钒氧催化剂广泛应用于硝酸和芳香烃的生产中。
这些催化剂可以提高生产效率和产物质量。
其次,钒化合物在生产乙烯、硫酸、硝酸和过氧化合物等化学品中起到重要作用。
此外,钒化合物还被用作染料和颜料的制造。
2.3 钒的应用于能源存储钒在能源存储领域具有广泛的应用前景。
钒氧化物可以作为锂离子电池正极材料,具有较高的电化学性能和循环稳定性。
这使得钒氧化物成为一种潜在的替代材料,用于传统的锂离子电池中的钴和镍。
此外,钒还可以作为钠离子电池和液流电池中的电极材料,有望应用于大规模能源存储系统中。
2.4 钒的应用于钢铁催化剂钒作为钢铁催化剂的应用也非常广泛。
在炼油工业中,钒可以催化硫的氧化和脱硫反应,使燃料更加清洁。
此外,钒还可以催化氨的合成、二氧化碳的还原以及有机物的氧化等反应。
这些反应对于化学工业和环境保护具有重要意义。
以上是钒的性质和用途的简要解析。
钒作为一种重要的过渡金属,具有多种独特的化学性质和应用价值。
钒研究新型材料的重要元素

钒研究新型材料的重要元素钒是一种重要的过渡金属元素,具有广泛的应用领域。
在材料科学中,钒的研究对于发现和制备新型材料具有重要意义。
本文将探讨钒在研究新型材料中的重要性,并介绍一些钒在材料领域的应用。
一、钒的物理性质钒是一种具有金属光泽的银白色金属元素,化学符号为V,原子序数为23,原子量为50.9415。
它具有较高的熔点和热导率,且具有良好的韧性和抗腐蚀性能。
此外,钒还表现出较高的硬度和耐磨性,使其成为制备高强度、高耐磨材料的理想选项。
二、钒在新型材料研究中的应用1. 钒合金钒与其他金属元素合金化可以改变金属的性能和结构。
例如,钛合金中添加适量的钒可以提高其强度和耐腐蚀性能。
此外,钒还可以用于制备高熔点合金,如钒铌合金和钒钛铁矿合金等。
这些合金在航空航天、汽车制造和核工业等领域有着重要应用。
2. 钒氧化物钒氧化物是一类重要的材料,具有宽电子带隙和良好的导电性能。
它们在电池、电子器件和光电器件等领域被广泛应用。
例如,钒氧化物可用于制备高性能锂离子电池的正极材料,其高容量和优异的循环稳定性使之成为一种具有潜力的动力电池材料。
3. 钒基超导材料钒在超导材料领域也具有重要的应用价值。
一些钒基超导体,如钒钛矿结构的钒硫化物和钒氧化物等,显示出较高的临界温度和较好的输运性能。
这些材料对于研究超导机制和应用于超导电器件具有重要意义。
4. 钒基催化剂钒及其化合物在催化领域也表现出良好的性能。
例如,钒基催化剂可用于氧化反应、还原反应以及有机合成中的氧化脱氢等反应。
钒基催化剂具有高催化活性、良好的选择性和较好的耐久性,对于实现清洁能源和高效催化过程具有重要意义。
三、结语钒作为一种重要的元素,在新型材料研究中扮演着重要角色。
它的物理性质和化学特性使得钒在合金、氧化物、超导材料和催化剂等各个领域都具备广泛应用的潜力。
通过深入研究钒的性质和应用,我们可以进一步推动新型材料的发展,推动科技进步和社会发展。
金属钒的性质
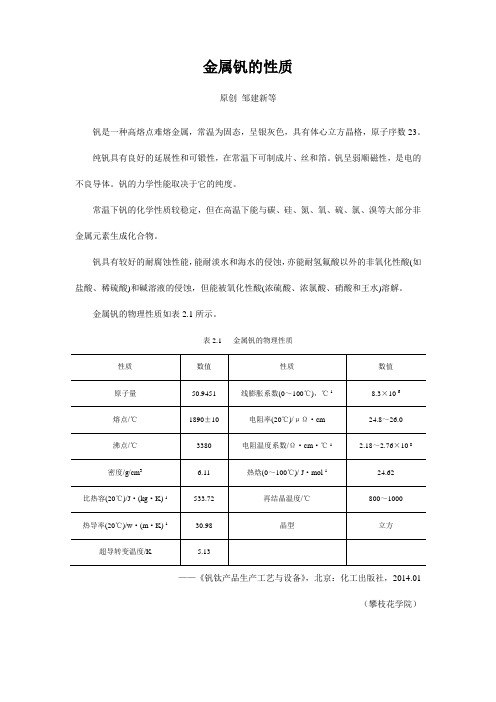
金属钒的性质
原创邹建新等
钒是一种高熔点难熔金属,常温为固态,呈银灰色,具有体心立方晶格,原子序数23。
纯钒具有良好的延展性和可锻性,在常温下可制成片、丝和箔。
钒呈弱顺磁性,是电的不良导体。
钒的力学性能取决于它的纯度。
常温下钒的化学性质较稳定,但在高温下能与碳、硅、氮、氧、硫、氯、溴等大部分非金属元素生成化合物。
钒具有较好的耐腐蚀性能,能耐淡水和海水的侵蚀,亦能耐氢氟酸以外的非氧化性酸(如盐酸、稀硫酸)和碱溶液的侵蚀,但能被氧化性酸(浓硫酸、浓氯酸、硝酸和王水)溶解。
金属钒的物理性质如表2.1所示。
表2.1 金属钒的物理性质
——《钒钛产品生产工艺与设备》,北京:化工出版社,2014.01
(攀枝花学院)。
钒的性质及用途简介解析

钒的性质及用途简介解析钒的性质及用途简介钒是一种神奇的金属,化合价有2+、3+ 和5+ ,金属单质钒很少,其主要形态有:VO(氧化钒),V2O3(三氧化二钒),V2O5(五氧化二钒),FeV(钒铁)及偏钒酸铵等,工业上使用最多的是V2O5和FeV,主要用于冶金的添加剂,增强钢铁的强度和韧性。
一、性质1、钒的性质钒(Vanadium),化学符号V,元素周期表中序数为23,原子量为50.94。
钒是银白色略带蓝色的金属,具有延展性;含有氧、氮、氢时则变脆、硬。
钒在较高的温度下与原子量较小的非金属形成稳定的化合物;在低温下有良好的耐腐蚀性。
钒进入合金后可增强合金的强度,降低热膨胀系数。
钒在地壳中的丰度约为0.02%,比铜、锌、镍、铬都高。
按地壳中元素丰度排列第13位。
可以说,在地壳中含有非常丰富的钒金属。
但钒金属有一个特点,很难形成独立的矿床,伴生性非常明显,因此在自然界非常分散,通常和其他金属伴生,如:钒钛磁铁矿。
因此,不太容易单独对钒金属进行开采和提炼,钒产品多作为冶金业的副产品生产。
2、五氧化二钒的性质五氧化二钒(V2O5)为褐色固体,有两种形态:粉状和片状,因在富氧和缺氧的加热条件下而得到不同的形态。
五氧化二钒有毒性。
在国际化学剧毒品名录中排名第43位。
其毒性主要是对呼吸道有刺激,引起鼻粘膜充血。
如果过多的吸入了粉状的五氧化二钒,有头昏、恶心等感觉,擤鼻涕时可能会带有血丝。
如果五氧化二钒中毒,离开了现场症状自然缓解,休息一两天一般自然恢复,不需治疗。
在国内没有对五氧化二钒毒性检测的规程,但中华人民共和国国标中也明确列示其为剧毒物质,生产过程需要在省级安监部门办理安全生产许可证。
3 、偏钒酸铵偏钒酸铵(NH4VO3)为白色结晶体,既是一种独立的产品,也是制造五氧化二钒的上一道工序的中间产品,其性质与五氧化二钒相似,其生产也需要办理安全生产许可证。
4 、钒铁的性质工业上使用的钒,主要是元素钒。
五氧化二钒(V2O5)中,钒的原子量仅占56%,其余为氧原子量。
钒最稳定的化合价

钒最稳定的化合价一、介绍钒(Vanadium)是一种过渡金属元素,其原子序数为23,在化学元素周期表中位于第5周期。
它具有蓝灰色的外观,高熔点,硬度较高,具有良好的化学稳定性。
由于其稳定性和特殊的化学性质,钒在许多重要的工业和科学领域中有着广泛的应用。
在化合物中,钒可以形成不同的化合价。
化合价是指元素在化合物中的化学价值或者价态。
在许多元素中,化合价是不确定的,但在钒中,有一些特定的化合价被认为是最稳定的。
二、钒的化学性质钒是一种高活性的元素,可以与许多其他元素形成化合物。
钒的最常见化合价分别为+2、+3、+4和+5。
它可以与氧、硫、卤素和非金属元素形成氧化物、硫化物、卤化物和氮化物等化合物。
钒的化学性质在不同的化合价下有所不同。
例如,钒的+2化合物通常是较稳定的,而+5化合物则具有较高的氧化能力。
这些化合价的变化使得钒在不同的化学反应中具有不同的作用。
三、钒的最稳定化合价钒的最稳定化合价取决于许多因素,包括氧化剂和还原剂的存在、配位环境以及反应条件等。
根据实验和理论计算的结果,可以得出以下结论:1. +2化合价钒的+2化合价是其中最稳定的一种,也是最常见的一种化合价。
+2化合物通常具有较低的氧化能力,可以与许多非金属元素形成化合物,如氧化物(VO)、硫化物(VS)和卤化物(VCl2)等。
2. +3化合价+3化合价是钒的另一种常见化合价。
与+2化合物相比,+3化合物具有较高的氧化能力,在一些氧化反应中表现得更加活泼。
+3化合物可以与氧、硫和氮等形成氧化物、硫化物和氮化物等。
3. +4化合价+4化合价的稳定性较低,因而相对较少见。
+4化合物通常具有较高的氧化能力,在一些氧化反应中会表现出较强的活性。
4. +5化合价+5化合价是钒中最高的化合价,也是最不稳定的一种。
+5化合物具有极强的氧化能力,可以与许多其他元素形成化合物。
例如,钒的+5氧化物(V2O5)是一种重要的工业材料,广泛用于催化剂、电池材料和颜料等方面。
试讨论钒副族元素的物理性质化学性质的变化规律

试讨论钒副族元素的物理性质化学性质的变化规律物理性质钒是一种银灰色的金属。
熔点1890±10℃,属于高熔点稀有金属之列。
它的沸点3380℃,纯钒质坚硬,无磁性,具有延展性,但是若含有少量的杂质,尤其是氮,氧,氢等,能显著降低其可塑性。
原子体积(立方厘米/摩尔)8.78相对原子质量50.94莫氏硬度7声音在其中的传播速率(m/s)4560密度(g/cm3)5.96熔点1890±10℃沸点3000℃原子序数23质子数23中子数37电子数23晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
[5]晶胞参数:a = 303 pmα= 90°b = 303 pmβ= 90°c = 303 pmγ= 90°化学性质基本性质钒的性质和钽以及铌相似,英国化学家罗斯科研究了它的性质,确定它与钽和铌相似,这为它们三个在元素周期表中共建一个分族建立了基础。
钒属于中等活泼的金属,化合价+2、+3、+4和+5。
其中以5价态为最稳定,其次是4价态,五价钒的化合物具有氧化性能,低价钒则具有还原性。
钒的价态越低还原性越强。
电离能为6.74电子伏特,具有耐盐酸和硫酸的本领,并且在耐气、耐盐、耐水腐蚀的性能要比大多数不锈钢好。
钒空气中不被氧化,可溶于氢氟酸、硝酸和王水。
[6]所属周期4所属族数VB电子层分布2-8-11-2电子层2-8-11-2价电子排布K-L-M-N氧化态V+3, V+4, V+5 ,V-3, V-1, V0, V+1, V+2外围电子层排布3d3 4s2核电荷数23电离能(kJ /mol):M - M+ 650650M+ - M2+1414M2+ - M3+2828M4+ - M5+6294M5+ - M6+12362M6+ - M7+14489M7+ - M8+16760M8+ - M9+19860M9+ - M10+22240化合物钒能分别以二、三、四、五价于氧结合,形成四种氧化物,一氧化钒,三氧化二钒,二氧化钒,五氧化二钒。
钒化合物的化学性质和应用

添加标题
钒化合物的酸碱性
钒化合物在水中的溶解度
钒化合物的氧化还原反应
钒化合物与其他化合物的反应
钒化合物的热稳定性与其结构有关
钒化合物的热稳定性使其在冶金、化工等领域有广泛应用
钒化合物的热稳定性与其它性质相结合,使其成为重要的工业原料
钒化合物在高温下不易分解,具有较高的热稳定性
添加标题
添加标题
添加标题
添加标题
钒化合物在精细化工中的催化作用
钒化合物在石油化工中的催化作用
钒化合物在环保领域的催化作用
钒化合物在其他工业领域的应用
钒电池:一种新型电池,具有高能量密度、长寿命、环保等特点
钒电池的工作原理:利用钒离子在正负极之间的迁移实现电能的储存和释放
钒电池的应用领域:可应用于电动汽车、储能系统、可再生能源等领域
风险控制策略:加强环境监测,制定排放标准,推广清洁生产技术
钒化合物的环境影响:对土壤、水体、大气的污染
钒化合物的安全性:对人体健康的影响,如致癌、致畸等
安全防护措施:加强个人防护,提高安全意识,加强应急处理能力
钒化合物的环境影响:对环境造成的污染和破坏
钒化合物的安全性:对人体健康和生态环境的影响
反应原理:利用化学反应在液相中进行合成
反应条件:温度、压力、催化剂等
反应产物:钒化合物的生成和纯化
应用领域:钒化合物在化学、材料、能源等领域的应用
钒化合物对生物体的抗肿瘤作用
钒化合物对生物体的抗病毒作用
钒化合物对生物体的抗氧化作用
钒化合物对生物体的免疫调节作用
钒化合物在生物体内的生理功能
钒化合物在生物体内的吸收和分布
,
汇报人:
钒化合物的氧化还原反应:钒离子与氧气、水、酸等反应生成不同价态的钒化合物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钒--碳系中只有V2C和VC两个中间相在1320℃以上的温度下稳定,两种碳化钒均系非化学计量化合物,其物理性能均与其实际组成有依赖关系。
一、钒的物理性质
钒属于元素周期表第VB族。它与其他VB族金属一样,具有体心立方结构,没有任何晶型变化,致密钒的外观呈浅灰色,熔点较高,在冶金分类上与同一副族的铌和钽同属于稀有高熔点金属。琪硬度和抗拉强度极限与加工和热处理状况及杂质含量有密切关系。纯钒具有良好的可塑性,在常温下可轧成片、箔和拉成丝。少量的杂质,特别是碳、氧、氮和氢等间隙元素,可使钒的可塑性降低,硬度和脆性增加。
不同价态的钒离子在酸性溶液中具有不同的颜色。因此,可以根据离子的颜色和颜色的深浅初步鉴别酸性溶液中钒离子的价态和离子浓度。
室温下金属钒较稳定,不与空气、水和碱作用,也能耐稀酸。高温下,金属钒很容易与氧化氮作用。当金属钒在空气中加热时,钒氧化成棕黑色的三氧化二钒、铁红色的四氧化二钒,并最终成为桔黄色的五氧化二钒。钒在氮气中加热至900~1300℃会生成氮化钒。钒与碳在高温下可生成碳化钒,但碳化反应必须在真空中进行。当钒在真空下或惰性气氛中与硅、硼、磷、砷一同加热时,可形成相应的硅化物、硼化物、磷化物和砷化物。
3、3、2、钒酸铵
偏钒酸铵在钒的湿法冶金中占有重要地位。偏钒酸铵为白色或微黄色的晶体粉末,微溶于水和氨水,难溶于冷水。它在不同温度下在水中溶解度也不尽相同。
当水溶液中有铵盐存在时,因共同离子效应,偏钒酸铵的溶解度下降。这一现象在钒的湿法冶金中被广泛应用。偏钒酸铵在常温下稳定,加热时易分解。它在空气中的分解反应为:
3、3、钒酸盐
通常说的钒酸盐多指含(V)V的钒酸盐。钒酸盐分偏矾酸盐MVO3、正钒酸盐M3VO4、和焦钒酸盐M4V2O7,式中M代表一价金属。Bi、Ca、Cd、Cr、Co、Cu、Fe、Pb、Mg、Mn、Ni、K、Ag、Na、Sn和Zn均能生成钒酸盐。碱金属和镁的偏矾酸盐可溶于水,得到的溶液呈淡黄色。其他金属的钒酸盐不大能溶于水。
0.109、V2+0.092、V3+0.077、
V4+0.067、V5+0.059
密度kg·m-3
6110
熔点/C
1910
沸点/C
3409
蒸汽压对数值/Pa(25~1910 C)
-26900/+0.33LgT -0.265×10-2T+12.245
二、钒的化学性质
钒原子的价电子结构为3d34s2,五个价电子都可以参加成健,能生成+2、+3、+4、+5氧化态的化合物,其中以五价钒的化合物较稳定。五价钒的化合物具有氧化性能,低价钒则具有还原性。钒的价态越低还原性越强。
6NH4VO3=(NH4)2O·3V2O5+4NH3+2H2O
2NH4VO3=V2O5+2NH3+H2O
即在较低温度时,分解的固体产物中仍含有部分氨;温度较高时,分解的固体产物为V2O5。
3、4、钒的卤化物
钒能与各种卤素生成二价、三价和四价的卤化物。五价钒的纯卤化物已知的只有VF5。对同一种卤素,随着钒原子价的增加,钒卤化物的化学稳定性减弱。对同一价态的钒,其卤化物的化学稳定性由氟到碘依次递减。这说明钒与氟、氯容易发生反应,而与溴、碘则较困难。
1750分解
蒸汽压
V2O5(液)= V2O5(气)
△H298/kJ·mol-1
-1550.6
-713.37
-1218.8
-431.8
S298/J·K·mol-1
130.5
51.46
98.07
38.91
△G298/kJ·mol-1
-1420.0
-659.4
-1139.5
-404.4
3、2、钒酸
VO2是两性氧化物,能与碱形成四价钒的钒酸盐。五价钒的氧化物是酸性较强的两性氧化物,它与碱形成的钒酸盐的趋势更为明显。钒在溶液中的聚合状态不仅与溶液的酸度有关,而且也与其浓度关系密切。
二价钒卤化物的热稳定性好,是强还原剂,易吸湿,在水中能形成V(H2O)6离子。三价钒卤化物的热稳定性较差。四价钒卤化物的稳定性差,其中四氯化钒相对说比较稳定。五价钒的卤化物中仅VF5被确认。VF5是白色固体,在19.5℃融化成淡黄色液体,是强氧化剂和氟化剂。五价钒的卤氧化物较多,VOCl3、VOBr、VO2F、VO2Cl。
三、钒的主要化合物
3、1、氧化物
钒与氧形成众多的氧化物,但公认的主要氧化物为V2O5、V2O4、V2O3和VO,他们的主要性质见下表:
性质
V2O5
V2O4
V2O3
VO
颜色
橙黄
蓝
黑
淡绿
结构
斜方
单斜
刚玉
面心平方
密度/kg·m-3
3357
4339
4870
5758
熔点/C
678
1542
1957
1790
沸点/C
对钒冶金而言,最重要的钒酸盐是钒酸钠和偏钒酸铵。
3、3、1、钒酸钠
偏钒酸钠(NaVO3)、焦钒酸钠(Na4V2O7)和正钒酸钠(Na3VO4)比较常见,它们在水中易溶解,生成水合物。以偏钒酸钠为例,在35℃以上时它能从其溶液中结晶出无水结晶,而在35℃以下则析出NaVO3·2H2O。偏钒酸钠的溶解度随温度升高而增加。
钒的物理性质
原子序数
23
原子量
50.9415
外层电子结构
3d3s2
稳定同位素及所占百分数
50,0.25%51,99.75%
晶型结构
体心立方
晶型常数/nm
a=0.30240
原子半径/nm(20C)
0.13112
配位数
8
原子体积/cm3·mol-1
9.1
电负性
1.45
电子价
+2、+3、+4、+5
离子半径
