固体药用聚烯烃塑料瓶质量标准及检验规程
固体药用聚烯烃塑料瓶质量标准及检验规程

目的:明确固体药用聚烯烃塑料瓶的质量标准和规范药用聚烯烃塑料瓶的检验。
适用范围:适用于包装非芳酸性、非油酸性、非挥发性及易氧化的固体药品(片剂、胶囊、制剂)的塑料瓶。
责任者:化验员。
引用标准:YY0057-91 GB28281、材料高密度聚乙烯树脂或聚丙烯树脂为主要原料。
2、技术要求2.1药用塑料瓶的外观质量:应具有均匀一致的乳白色泽,不得有明显的色差。
瓶的表面应光洁、平整、不允许有变形和明显的擦痕。
不允许有砂痕、油污、气泡。
瓶口应平整、光滑。
2.2物理性能应符合表1规定:表12.3化学性能符合表2规定:表22.4菌检验应符合以下规定:小于108ml的塑料细菌总数不超过1500个/瓶,霉菌总数不得超过150个/瓶;100ml至250ml的塑料瓶细菌总数不超过3000个/瓶,霉菌总数不得超过300个/瓶;大于250ml的塑料瓶细菌总数不得超过3500个/瓶,霉菌总数不得超过350个/瓶。
所有规定的塑料瓶大肠肝菌均不得检出。
2.5异常毒性:无异常毒性3、试验方法3.1外观在自然光线明亮处目测检验。
3.2密封性试验每个瓶装进一定量的玻璃球,紧盖后(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表3)置于带有抽气装置的容器内,用水浸没,抽真空到26.67kpa维持2min, 瓶内不得有进水或冒泡现象。
表33.3振荡试验每个瓶装入酸性水为标示剂、紧盖后(带有螺旋盖的试瓶用测力扳手将盖与瓶旋紧,扭力见表3)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率每分钟200次土5%振荡30min后,溴酚蓝试纸不变色为合格。
3.4水蒸气渗透量试验每个试瓶用绸布擦净,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4目筛过细粉,置110C干燥1h),20ml或20ml以上的试瓶,加干燥剂量为13mm 高,小于20ml的试瓶,加入干燥剂量为容积2/3 ;如试瓶高度超过63mm加入干燥剂量为50mm高,立即将盖盖紧。
固体药用聚烯烃塑料瓶检验标准操作规程
固体药用聚烯烃塑料瓶检验标准操作规程版次:□新订□替代:制定:年月日审核:年月日批准:年月日生效日期:年月日复制:份共页颁发部门:分发部门:1 引言制订本标准的目的是规范硬脂酸镁检验的标准操作规程。
2 依据国家食品药品监督治理局«药品生产质量治理规范»〔1998年修订〕第七十五条。
«中华人民共和国药典»2020版二部1234页。
3 适用范畴本标准适用于硬脂酸镁的检验。
4 责任QC检验人员对本操作规程的实施负责,QC负责人对本规程的有效执行承担监督检查职责。
5 程序本品为以硬脂酸镁(C36H70MgO4)与棕榈酸镁(C32H62MgO4)为要紧成分的混合物。
5.1 性状本品为白色轻松无砂性的细粉;微有特臭,与皮肤接触有滑腻感。
本品在水、乙醇或乙醚中不溶。
5.2 鉴别5.2.1仪器及用具:天平、电炉、干燥箱、烧杯、硅油、温度计、酒精喷灯、铂丝、试管、纳氏比色管、量筒等。
5.2.2 试剂及试液:纯化水、稀硫酸等。
5.2.3 测定法5.2.3.1 取本品5.0g,置圆底烧瓶中,加无过氧化物乙醚50ml、稀硝酸20ml 与水20ml,加热回流至完全溶解,放冷,移至分液漏斗中,振摇,放置分层,将水层移入另一分液漏斗中,用水提取乙醚层2次,每次4ml,合并水层,用无过氧化物乙醚15ml清洗水层,将水层移至50ml量瓶中,加水稀至刻度,摇匀,作为供试品溶液,应显镁盐的鉴别反应〔中国药典2020年版二部附录Ⅲ〕。
5.2.3.2 在硬脂酸与棕榈酸相对含量检查项下记录的色谱图中,供试品溶液两主峰的保留时刻应分别与对比品溶液两主峰的保留时刻一致。
5.3检查5.3.1仪器及用具:天平、电炉、干燥箱、电阻炉、纳氏比色管、刻度吸管、试管、量筒、锥形瓶等。
5.3.2试剂及试液:纯化水、硝酸、标准氯化钠溶液、盐酸溶液(9→100)、标准硫酸钾溶液、过硫酸铵、醋酸盐缓冲液(pH3.5)、标准铁溶液、硝酸银、25%氯化钡溶液、30%硫氰酸铵溶液硫代乙酰胺试液、标准铅溶液等。
药用聚烯烃塑料瓶质量标准

上海标准文件
标题:药用聚烯烃塑料瓶质量标准
分发部门:总经理室、质量技术部、生产制造部、物资部、行政部(存档)
药用聚烯烃塑料瓶质量标准
【来源】固体药用聚烯烃塑料瓶必须符合YY0057-91质量标准。
【外观要求】 1.1 应具有均匀一致的乳白的色泽,不得有明显的色差,瓶的表面应光洁、平整、不允许有变形和明显的皱痕,不允许有砂眼、油污、气泡。
瓶口应平整光滑,不应有飞边和缺陷。
(不合格率允许≤2.0%)
1.2 瓶盖和瓶口吻合严密,保险圈与瓶体咬合准确到位,且保险圈应随瓶盖的旋开而断裂分离。
(注:瓶盖不合格率允许≤
2.0%)
1.3 瓶盖及瓶体的文字、商标、规格刻印清晰无误。
【微生物限度】细菌总数不得超过1000个/瓶
霉菌总数不得超过25个/瓶
【原辅料生产厂报告单检验项目】生产厂家提供的出厂检验报告上必须符合本质量标准所有项目。
【原辅料进厂检验项目】感官、微生物限度。
医药瓶塑料塞验收标准

医药瓶塑料塞验收标准
药用塑料瓶质量标准技术要求共有12个小项,1、其中外观质量:口服固体药用瓶一般为白色,口服液体药用塑料瓶一般为棕色透明,也可按客户要求生产其他颜色的产品。
色泽应均匀一致,无明显色差,表面应光洁,平整,无明显变形和擦痕,无砂眼、油污、气泡,瓶口平整光滑。
口服固体药用高密度聚乙烯塑料瓶
2、鉴别
(1) 红外光谱:英语对照图谱一致
(2) 药用塑料瓶的密度为:
口服固体和液体高密度聚乙烯瓶为0.935-0.965(g/cm³)
口服固体和液体聚酯瓶应为1.31-1.38(g/cm³)
口服液体药用聚酯瓶T001-60ml
口固体和液体聚丙烯瓶应为0.900-0.915(g/cm³)
3、密封性:抽真空,维持2分钟,瓶内不得进水或冒泡
4、水蒸气渗透
按试验条件口服液体药用塑料瓶重量损失不得过0.2%。
按试验条件口服固体药用塑料瓶水蒸气渗透量不得过
1000mg/24HL
5、抗跌性
按试验条件自然跌落至水平刚性光滑表面,不得破裂、此试验仅限于口服液体药用塑料瓶。
6、震荡实验
此试验仅限于口服固体药用塑料瓶,按试验条件应合格。
口服固体药用高密度聚乙烯瓶质量标准2015年版
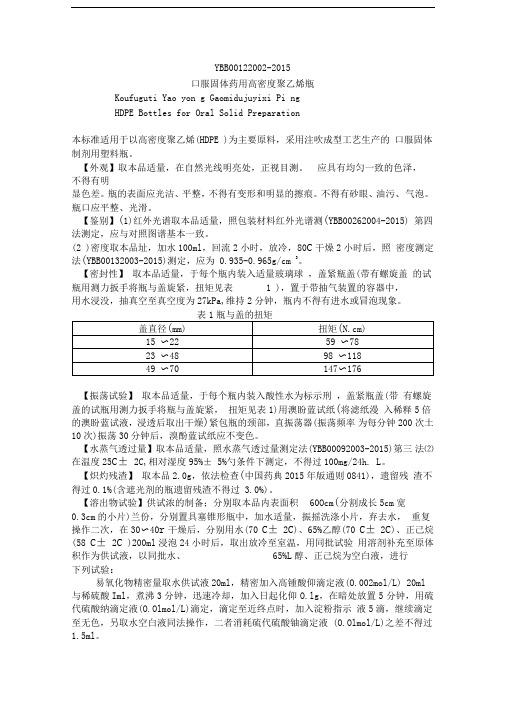
YBB00122002-2015口服固体药用高密度聚乙烯瓶Koufuguti Yao yon g Gaomidujuyixi Pi ngHDPE Bottles for Oral Solid Preparation本标准适用于以高密度聚乙烯(HDPE )为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测(YBB00262004-2015) 第四法测定,应与对照图谱基本一致。
(2 )密度取本品址,加水100ml,回流2小时,放冷,80C干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为 0.935-0.965g/cm 3。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表 1 ),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1瓶与盖的扭矩【振荡试验】取本品适量,于每个瓶内装入酸性水为标示刑,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1)用澳盼蓝试纸(将滤纸漫入稀释5倍的澳盼蓝试液,浸透后取出干燥)紧包瓶的颈部,直振荡器(振荡频率为每分钟200次土10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法⑵在温度25C± 2C,相对湿度95%± 5%勺条件下测定,不得过100mg/24h. L。
【炽灼残渣】取本品2.0g,依法检查(中国药典2015年版通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过 3.0%)。
口服固体药用高密度聚乙烯瓶质量标准
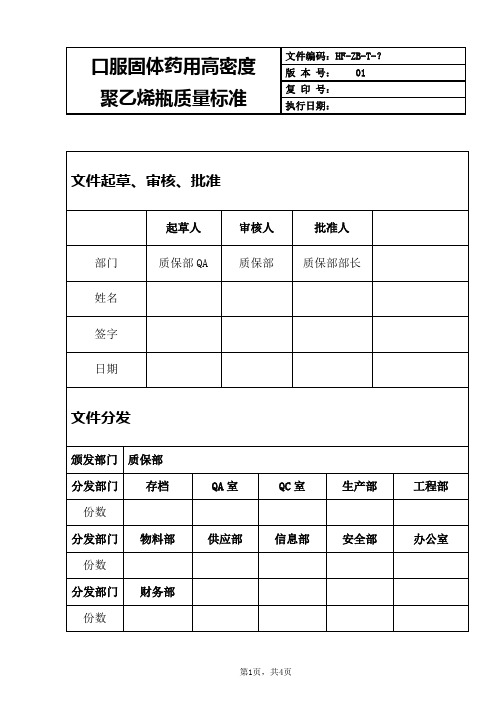
瓶盖:成型饱满,结构完整,色泽一致,无污点、缺损。
57.5g±0.9g/瓶不渗漏Fra bibliotek≤100cfu/瓶
≤10cfu/瓶
≤10cfu/瓶
检验项目
检验水平
合格质量水平
(AQL)
外观
一般检查水平Ⅰ
4.0
瓶身重
一般检查水平Ⅰ
4.0
密封性
特殊检查水平S-3
4.0
微生物限度
特殊检查水平S-1
1.5
外包装用纸箱,内包装为聚乙烯塑料袋密封,保存于清洁、干燥处。
12个月
2.1 外观
2.2瓶身重
2.3密封性
2.4 微生物指标
2.4.1菌落总数
2.4.2霉菌
2.4.3酵母
3取样规则与接收规则
4贮存
5复验期
YBB00122002( 口服固体药用高密度聚乙烯瓶 国家药品
包装容器标准)
GB/T 5009.60-2003(食品包装用聚乙烯等成型品卫生标准)
瓶口:端面应平整,螺纹圆滑无崩缺;
文件起草、审核、批准
起草人
审核人
批准人
部门
质保部QA
质保部
质保部部长
姓名
签字
日期
文件分发
颁发部门
质保部
分发部门
存档
QA室
QC室
生产部
工程部
份数
分发部门
物料部
供应部
信息部
安全部
办公室
份数
分发部门
财务部
份数
文件变更记载及原因
版本号
执行日期
变更原因、依据及主要变更内容
关于药用固体瓶检测的项目与标准
关于药用固体瓶检测的项目与标准
在药用固体瓶的检测项目中,溶出物试验是非常重要的一项理化性能检测,主要是模拟药包材和容器使用中的状态,天和医塑包装用各种溶剂溶出物试验检测结果来控制产品质量的检测方法。
国家标准药品包装材料溶出物试验中通常使用的溶剂有水、65%乙醇和正己烷3种。
溶出物试验中比较重要的一项就是不挥发物的检测,不同材质的塑料制品蒸发残渣有差异,其中聚乙烯(PE)材质正己烷不挥发物不合格风险最大,应当结合实际情况对药用固体瓶正己烷不挥发物测量不确定度进行评定。
药品包装用口服固体药用高密度聚乙烯瓶取其平整部分内表面积600cm2(分割长5cm,宽0.3cm的小片),置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作1次。
在30~40℃ 干燥后,用正己烷(58±2)℃200mL浸泡24h后,取出放冷至室温,用同批试验用溶剂补充至原体积作为浸出液,以同批正己烷为空白液。
分别精密量取正己烷浸出液与空白液各50mL,置于已恒重的蒸发皿中,水浴蒸干,105℃干燥2h,冷却后,精密称定。
药用固体瓶正己烷不挥发物测量过程中,主要的不确定度来源于质量、体积、取样面积、取样均匀性和测量结果的重复性(取样均匀性并入重复性中考虑)。
药用塑料瓶质量标准
药用塑料瓶质量标准药用塑料瓶是药品包装中常用的一种材料,其质量直接关系到药品的安全性和稳定性。
因此,药用塑料瓶的质量标准显得尤为重要。
在国家药典和相关标准的规范下,药用塑料瓶的质量标准主要包括以下几个方面:一、原料选择。
药用塑料瓶的原料应选择优质的医用级塑料颗粒,如聚丙烯(PP)、聚乙烯(PE)、聚对苯二甲酸乙二醇酯(PETG)等。
这些原料应符合国家相关标准,且不得含有对人体有害的物质,如重金属、荧光增白剂等。
二、外观质量。
药用塑料瓶的外观应无明显的气泡、缺陷、变色、污染等现象,瓶口应平整,无毛刺。
瓶身应平整光滑,无明显的凹凸和变形。
瓶身上的标识和文字应清晰、完整,不易磨损。
三、物理性能。
药用塑料瓶的物理性能包括抗拉强度、耐冲击性、耐压性等指标。
瓶身应具有一定的抗拉强度和耐冲击性,不易变形、破裂。
在一定的温度和压力下,瓶身应能保持稳定的形状,不发生变化。
四、化学性能。
药用塑料瓶的化学性能是指其在药品填充过程中不与药品发生化学反应,不释放有害物质。
因此,药用塑料瓶应具有良好的耐药品溶剂、酸碱的性能,不易吸附药品成分,不易释放有害物质。
五、密封性能。
药用塑料瓶的密封性能直接关系到药品的保存期限和质量。
瓶口和瓶盖应能够完全密封,不得有渗漏现象。
在一定的压力下,瓶口和瓶盖应能保持稳定的密封性能。
六、生产工艺。
药用塑料瓶的生产工艺应符合相关的规范要求,生产过程中应严格控制温度、压力、速度等参数,确保瓶体的一致性和稳定性。
生产过程中应定期对设备进行维护和检修,确保生产设备的正常运行。
综上所述,药用塑料瓶的质量标准涉及到原料选择、外观质量、物理性能、化学性能、密封性能和生产工艺等多个方面。
只有严格按照相关标准要求进行生产和质量控制,才能确保药用塑料瓶的质量达到国家标准,保障药品的安全性和有效性。
希望生产厂家和监管部门能够共同努力,加强对药用塑料瓶质量标准的监督和管理,为人民群众的用药安全保驾护航。
BCJB-ZL-01802口服固体药用高密度聚乙烯瓶内控质量标准
应成正反应
细菌数 应≤1000(个/片) 应≤900(个/片)
微生物 霉菌、酵母
应≤100(个/片) 应≤90(个/片)
限度
菌数
大肠杆菌 不得检出
不得检出
1 目的:建立口服固体药用高密度聚乙烯瓶内控质量标准,以确保本公 司口服固体药用高密度聚乙烯瓶质量。
2 范围:适用于口服固体药用高密度聚乙烯瓶质量控制。 3 职责:质控部QA、QC 4 依据:国家药品包装容器(材料)标准(试行)YBB00122002
检验项目
法定标准
内控标准
外观
应符合规定
应符合规定
鉴别
红外光谱 密度
应符合规定
应为0.935~ 0.965(g/cm3)
应符合规定
应为0.935~ 0.965(g/cm3)
密封性 应符合规定
应符合规定
振荡试验 应成正反应
应成正反应
检查 水蒸气渗透 应≤100mg/24h·L
应≤95mg/24h·L
炽灼残渣 应≤1.0%
应≤0.8%
பைடு நூலகம்
溶出物试验 应成正反应
口服固体药用聚丙烯瓶检验操作规程
目的:为检验口服固体药用聚丙烯瓶规定一个标准的程序,以便获得准确的实验数据.范围:适用于口服固体药用聚丙烯瓶的检验。
职责:检验室主任、检验员规程:1.外观:取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
2.鉴别2.1 红外光谱取本品适量,敷于微热的溴化钾片上,照分光光度法(SOP-QC-302-00)测定,应与对照图谱基本一致。
2.2 密度取本品2g,加100ml水,回流2小时,放冷,80℃干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算:Wa——————×dWa – WsPP的密度应为0.900~0.915(g/㎝3)。
3.检查3.1 密封性取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力3.2 振荡试验取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200次±次)振荡30分钟后,溴酚蓝试纸不得变色。
3.3 炽灼残渣取本品2.0g,依法检查(SOP-QC-327-00),不得过0.1%。
(含遮光剂的瓶炽灼残渣不得过3.0%)3.4 溶出物试验3.4.1 溶出物试液的制备分别取本品内表面积600㎝2(分割成长5㎝,宽0.3cm的小片)三份置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作二次。
在30℃~40℃干燥后,分别用水(70℃±2℃)、65%乙醇(70℃±2℃)、正已烷(58℃±2℃)200ml 浸泡24小时后,取出放冷至室温,用同批试验用溶剂补充至原体积作为浸出液,以同批水、65%乙醇、正已烷为空白液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目的:明确固体药用聚烯烃塑料瓶的质量标准和规范药用聚烯烃塑料瓶的检验。
适用范围:适用于包装非芳酸性、非油酸性、非挥发性及易氧化的固体药品(片剂、胶囊、制剂)的塑料瓶。
责任者:化验员。
引用标准:YY0057-91 GB2828
1、材料
高密度聚乙烯树脂或聚丙烯树脂为主要原料。
2、技术要求
2.1 药用塑料瓶的外观质量:应具有均匀一致的乳白色泽,不得有明显的色差。
瓶的表面应光洁、平整、不允许有变形和明显的擦痕。
不允许有砂痕、油污、气泡。
瓶口应平整、光滑。
2.2 物理性能应符合表1规定:
表1
2.3 化学性能符合表2规定:
2.4 菌检验应符合以下规定:小于108ml的塑料细菌总数不超过1500个/瓶,霉菌
总数不得超过150个/瓶;100ml至250ml的塑料瓶细菌总数不超过3000个/瓶,霉菌总数不得超过300个/瓶;大于250ml的塑料瓶细菌总数不得超过3500个/瓶,霉菌总数不得超过350个/瓶。
所有规定的塑料瓶大肠肝菌均不得检出。
2.5 异常毒性:无异常毒性
3、试验方法
3.1 外观
在自然光线明亮处目测检验。
3.2 密封性试验
每个瓶装进一定量的玻璃球,紧盖后(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表3)置于带有抽气装置的容器内,用水浸没,抽真空到26.67kpa维持2min,瓶内不得有进水或冒泡现象。
表3
3.3 振荡试验
每个瓶装入酸性水为标示剂、紧盖后(带有螺旋盖的试瓶用测力扳手将盖与瓶旋紧,扭力见表3)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率每分钟200次±5%)振荡30min后,溴酚蓝试纸不变色为合格。
3.4 水蒸气渗透量试验
每个试瓶用绸布擦净,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4目筛过细粉,置110℃干燥1h),20ml或20ml以上的试瓶,加干燥剂量为13mm高,小于20ml的试瓶,加入干燥剂量为容积2/3;如试瓶高度超过63mm,加入干燥剂量为50mm高,立即将盖盖紧。
另取两个试瓶装入与干燥剂相等量的玻璃小球,作对照用。
试瓶紧盖后分别称定重量,然后将试瓶量相对湿度为100%,温度达25±2℃,放置72h,取出,室温放置45min,分别称量。
按式(1)计算水蒸气渗透量。
1000
水蒸气渗透量(mg/24h.L)=————[(T
2-T
1
)-(C
2
-C
1
)] (1)
3V
式中:V——试瓶的容积,ml;
T
1
——试瓶试验前的重量,mg;
C
——对照试瓶试验前的平均重量,mg;
1
T
——试瓶试验后的重量,mg;
2
C
——对照试瓶试验后的平均重量,mg。
2
3.5 溶出物试验
3.5.1 试验溶液的制备:取试瓶表面积180cm2,切成约长5cm,宽0.3cm的小片。
一式三份置具塞烧瓶中,加水约150ml,振摆洗涤小片,弃去水,重复操作一次,在30-40℃干燥后,分别用水(70℃)、乙醇(70℃),正己烷(58℃)60.0ml浸泡24h,放冷至室温,浸出液作下列试验,以同批水、乙醇、正己烷为对照液。
3.5.2 还原性物质,清密置取上述水浸液20 .0ml,清密加入0 .02 mol/L高锰酸钾液3.0ml,稀硫酸5ml,煮沸10min。
放冷后,精密加入0.05mol/L草酸钠5 ml,置水浴上加热至75-80℃,用0.02mol/L高锰酸钾滴定至溶液呈微红色,持续15S不褪色为终点,用对照液作空白校正,两者消耗0.02mol/L高锰酸钾液之差不得超过1.0ml.
3.5.3 重金属:精密量取水浸液20.0ml,置纳氏比色管中,用乙酸1mol/L或氢氧化铵6mol/L调节PH到3.0-
4.0之间,有水稀释到35ml,摇匀,加硫代乙酰胺试液2ml,用水稀释到50ml,摇匀,与2.0ml标准铅溶液按同法处理后,在暗处放置10min,同置白纸上,自上方观察,样品管显出的颜色与标准管比较不得更深。
3.5.4 标准铅液的制备:精密称取在105℃干燥至恒温的硝酸铅0.1598g,置1000ml 溶量瓶中,加硝酸5ml与水50ml溶解后,用水稀释到刻度,摇匀,作为贮备液(每1ml 相当于0.1mg的pb)。
临用前精密量取贮备液10.0ml,置100ml容量瓶中,加水稀释至刻度,摇匀,即得(每1ml相当于10μg的pb)。
3.5.5 不挥发物:精密量取上述水、乙醇、正己烷浸出液50.0ml置已恒重的蒸发器中,在水浴中蒸干后,105℃干燥2h,称量,遗留残渣与对照液之间的差,水浸液不得超过12.0mg,乙醇浸液不得超过50.0mg,正己烷浸液不得超过75.0mg。
3.6 菌检试验
每个试瓶加入试瓶容积1/3量的无菌生理盐水,将盖逆紧,振摇1min后取1ml,依法检验。
3.7 异常毒性试验
取试瓶用水清洗干净后,剪碎,每500cm表面积加入去热原的生理盐水50ml,置高压灭菌器内,110℃灭菌30min取出,放冷备用,同时以同批生理盐水灭菌后作对照液。
取17-20g同一来源的健康水白鼠(做过本试验的小白鼠不得重复使用)5只,以尾静脉注射上述试液1ml,用4-5秒匀速注射完毕,全部小白鼠48h内不得有死亡,如有死亡应另取10只健康小白鼠,体重为18-19g,重复试验,全部小白鼠在48h内不得有死亡。
4、检验规则
4.1 抽样方案、检查水平及合格质量水平,见表4
表4 抽样方案、检查水平、合格质量水平表
4.2 异常毒性试验和化学性能应在首批进厂或改变厂家作一次分析,合格后方可投产。
化学性能在正常情况下,每二个月检验一次,合格率100%。
4.3 药用塑料瓶外观质量、物理性能及菌检必须每批进行检验。
4.4 药瓶的尺寸应与盖子相配套。
