第四节 几种重要的盐
几种重要的盐4浙教版(201908)

练习:
1.碱溶液具有相似的化学性质的原因是在其水
溶液中含有相同的 OH- ,常见的溶于水的
碱
、
、
;微溶于水的碱
有
;不溶于水的碱有
、
等。
2.长时间暴露于空气中的石灰水,瓶壁上会形
成一层白色的物质。其形成原因可以用化学方程
式表为 Ca(OH)2 +CO2 = CaCO3↓+H2O 。要洗去它, 最好的方法是先用 盐溶酸解,再用水冲洗。化学
方程式: CaCO3+2HCl =CaCl2 + CO2 +H。2O
盐:由金属离子(或铵根)与酸
根构成的化合物。
美丽的盐的晶体:
硫酸亚铁 硫酸铜
FeSO4 CuSO4
பைடு நூலகம்
硝酸钾 重铬酸钾
KNO3 KCrO4
; 好评返现:https://
;
俊靡 况存之有义 又云 日戴者 青黄晕 行星三十二度六百四十一万九百六十七分 为烁 法度轨则 此元以天正建子黄钟之月为历初 如和对辞 桓玄逼帝东下 今五星悉经天 车气乍高乍下 户三千一百 广兴惠帝分桂阳 入太微 远近兵乱 有不尽效 新安〔函谷关所居 其九月丁未 〕 先月蚀 后交会者 《乾象》七近二中 在轸 转为次历变衰也 有河水祠 户一万二千 春秋之初 太白犯东井 二百万六千七百二十三 涂衅周密 岳云 以许昌置东豫州 君若不改 荧惑绕填星成钩己 及魏武已后言音律度量者 大疫 又以毗陵郡封东海王世子毗 孝武宁康三年七月 太白奄右执法 王后帅 内外命妇蚕于北郊 逆 大水 〕九原 帝废为齐王 季秋气至 屯留 先上验日蚀 班固采以为志 汶山 宜都 甲士三人 《三统》 加通周 天子亡 因而九三之 月犯房南第二星 间限千二百四十五小寒十二月节 仓粟少 〕 尚书
盐shao

侯德榜
知识小结
请你评理
鉴别氢氧化钠是否变质:
甲的做法:取样品加入蒸馏水,配成溶液,滴入酚酞试 液,试液变红则说明没变质,试液不变色证明已变质. 乙的做法:加入盐酸,产生气泡证明变质,不产生气泡 证明没变质.
思考:你还有什么方法证明它变质呢?
若有变质如除去杂质?
第四节 几种重要的盐
盐
山
新闻事件回放
1. 2007年6月2日早晨,早餐店老板做早餐时,发现店内的 食盐没了,当时街上的商店门还没开,于是老板到邻居家去 抓了一把盐放到辣糊汤里,“他没想到这盐是亚硝酸盐,结 果就导致了27人中毒的事件发生。他邻居家是做卤菜的,亚 硝酸盐一般用作添加剂,放在卤菜里,不知情的早餐店老板 抓来用了,结果导致不幸发生。” 2. 2007年4月26日,云南发生一起亚硝酸盐中毒导致的食 物中毒事件,有56人中毒,其中1人死亡。据初步了解,销 售红烧牛肉的业主在煮牛肉时,临时发现没有盐巴,便在 自家门后找到一袋和食盐很相似的东西,尝后发现是咸的, 遂将这种东西当成了食盐。 工业盐含有大量亚硝酸钠,NaNO2有剧毒,食用会中毒。
几种常见的盐晶体
氯化钠晶体
碳酸钠晶体
硫酸铜晶体
硫酸亚铁晶体
一、准备知识 1、概念 电离时产生金属阳离子(或铵根离子)和酸根阴离子的化合物。 2、形成 盐是酸和碱中和反应的产物。
HCl
NaOH
H2SO4
Ca(OH)2 24
H
+
Cl
-
Na
+
OH
-
H
+
SO
Ca2+ OH -
H2 O
NaCl
盐 HCl + NaOH= NaCl + H2O
第4节几种重要的盐

共享交流
• 谈收获 • 小结:同学们,经过讨论和思想的碰撞,我们通过实验探究检验
出了这包干燥剂的成分,走完了探究之旅,我想每位同学都不虚 此行,请说一说你的收获,让大家一起分享你的成功吧。
Байду номын сангаас
说课
化学实验探究 ——探究久置生石灰干燥剂的成分
太和三中 付松峰
创设情境,引入课题
开启探究之旅
1、提出问题 久置生石灰干燥剂的成分有哪些? 2、猜想与假设
3、收集资料 (1)CaO能和水反应,放出大量的热; (2)Ca(OH)2是碱,可以使无色酚酞溶液变红,通 入CO2溶液会变浑浊; (3)CaCO3与稀盐酸反应,生成CO2,会有气泡产生。
开启探究之旅 4、设计实验方案
实验方案 预测实验现象 预测结论
开启探究之旅
• 5、进行实验
• 6、解释与结论
这包久置的生石灰干燥剂没有
,有
。
• 7、反思与交流
讨论:检验氢氧化钙的小组检验出了Ca(OH)2是不是说这包干燥剂 原来就有Ca(OH)2呢?
牛刀小试
投影题目,及时练习。
题目的设计恰好和今 天的探究内容相符, 结合探究内容和过程, 学生很容易正确解答 本题,即巩固了知识, 又让学生体会到亲历 实验探究活动在解题 中的价值!
几种重要的盐
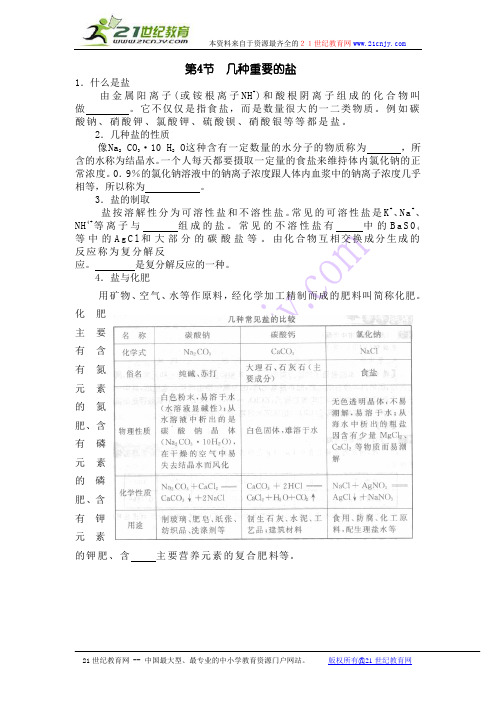
第4节几种重要的盐1.什么是盐由金属阳离子(或铵根离子NH+)和酸根阴离子组成的化合物叫做。
它不仅仅是指食盐,而是数量很大的一二类物质。
例如碳酸钠、硝酸钾、氯酸钾、硫酸钡、硝酸银等等都是盐。
2.几种盐的性质像Na2 CO3·10 H2O这种含有一定数量的水分子的物质称为,所含的水称为结晶水。
一个人每天都要摄取一定量的食盐来维持体内氯化钠的正常浓度。
0.9%的氯化钠溶液中的钠离子浓度跟人体内血浆中的钠离子浓度几乎相等,所以称为。
3.盐的制取盐按溶解性分为可溶性盐和不溶性盐。
常见的可溶性盐是K+、Na+、NH4+等离子与组成的盐。
常见的不溶性盐有中的B a S04等中的A g C l和大部分的碳酸盐等。
由化合物互相交换成分生成的反应称为复分解反应。
是复分解反应的一种。
4.盐与化肥用矿物、空气、水等作原料,经化学加工精制而成的肥料叫简称化肥。
化肥主要有含有氮元素的氮肥、含有磷元素的磷肥、含有钾元素的钾肥、含主要营养元素的复合肥料等。
例1 若有一块岩石,你怎样证明它含有碳酸盐?例2 医生检查胃部疾病时,方法之一就是让病人口服硫酸钡,若误服碳酸钡就会中毒,已知可溶性的钡盐有毒。
上述中毒的原因是: (用化学方程式表示),若误服碳酸钡后可立即服用硫酸镁(泻药)解毒,其原因是: (用化学方程式表示)。
)属于()。
例3氯酸钾(K C I O3A.氧化物B.盐C.酸D.碱例4 20℃时,物质的溶解度在O.1g~1 g范围内为微溶。
已知CaS0的溶解度4如表所示:气体,你认为下列措施可行若要用硫酸溶液和石灰石反应,来持续较快产生C02的是( )。
A.将石灰石研成粉末状慢慢加入足量硫酸溶液中B.将块状石灰石加到热的硫酸溶液中C。
将少量的块状石灰石加到过量的硫酸溶液中D.将块状石灰石加到冷的硫酸溶液中例5精盐(NaCl)和纯碱(Na2 C03)是两种常见之物。
(1)用化学方法区别这两种固体,可以选择下列哪一种物质?答:()A.白酒B.米醋C.纯净水D.酱油(2)王军同学不慎在精盐中混入了少量纯碱,他想重新得到精盐,设计了以下两个实验方案:你认为合理的实验方案是。
几种重要的盐s

§1—4 几种重要的盐教学目标:1、使学生理解碳酸钠、碳酸钙、氯化钠等重要盐的主要性质和用途;学习物质的鉴定和检验方法;从元素分析角度了解某些无机盐(化肥)对农作物生长的作用。
2、学习物质的鉴定和检验方法;学会理论联系实际解决实际问题的方法。
3、学会合作与交流;体验探究成功的乐趣;体验理论联系实际;结合我国盐的资源和生产、侯德榜的事迹对学生进行国情教育和爱国主义教育。
教学重难点:1、重点:三种盐的性质和用途,碳酸根离子和氯离子的鉴别方法;记住一些盐的溶解性。
2、难点:碳酸根离子和氯离子的鉴别方法。
课前准备:碳酸钠,碳酸钙,食盐,酚酞试液,氢氧化钙溶液,稀盐酸,氯化钙溶液,硫酸铵浓溶液,氢氧化钠溶液,红色石蕊试纸,烧杯、玻璃棒、试管若干。
教学手段和建议:师生共同参与讨论、探究;氯化钠在生活中的用途很多,教材中只列举了一些最常见的例子。
教学中可以发动学生结合课后习题多列举一些,如盐水漱口防治口腔炎症、预防感冒等,以开扩学生思路,活跃课堂气氛教学过程:第一课时复习酸和碱的定义,将NaOH、H2SO4、Cu(OH)2、HNO3、HCl、NaCl、NaHCO3、Cu2 (OH) 2CO3进行分类。
由此引出“盐”,盐是酸和碱中和反应的产物。
观察这几种盐,请给盐下一个定义。
板书:一、盐酸和碱中和反应的产物能电离出金属阳离子(铵根NH4+ )和酸根阴离子的化合物。
认识几种常见的盐盐不一定是食盐,而是一类化合物的总称。
补充:工业盐里含有亚硝酸盐的成分,外观和食盐差不多但是有毒性,若误食会导致食物中毒,严重会危及生命。
板书:二、几种重要的盐1、碳酸钠 Na 2CO 3 (俗名:纯碱、苏打)纯碱又称苏打,是一种很常见的物质,那么纯碱的性质和用途有哪些呢?Na 2CO 3·10H 2O 是碳酸钠晶体,带10个结晶水。
问:碳酸钠晶体属于混合物还是化合物?在干燥的空气中,碳酸钠晶体容易失去结晶水,变成碳酸钠粉末(Na 2CO 3·10H 2O →Na 2CO 3)这个过程叫风化,属于物理变化还是化学变化?板书:①碳酸钠晶体易风化——化学变化碳酸钠还有什么性质呢?实验:用试管取适量的碳酸钠溶液,向试管中滴加酚酞试液。
浙教版科学九年级上册_知识总结:几种重要的盐

盐的复习一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明: 盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离: 以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐: 只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32- 电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。
九年级上 科学 课课练 第4节 几种重要的盐(一)

第4节 几种重要的盐(一)基础训练1.下列物质属于盐的是 ( )A.CuOB.Cu(OH)2C. (NH 4)2SO 4D.H 2SO 42.2007年,我国首次调整饮用水标准。
新《标准》规定,饮用水的pH 在6.5-8.0之间,符合健康标准。
由于受酸雨影响(在我国酸雨中一般含有少量的硫酸),目前我国天然水体大多呈弱酸性。
要使pH 低于6. 5的天然水达到饮用水的酸碱度范围,下列处理方法最可行的是 ( )A .加热B .加入适量纯碱C .加入适量氯化钡D .加入适量烧碱3.欲除去NaCl 溶液中的Na 2CO 3杂质,可加入适量的 ( )A .水B .Ca(OH)2溶液C .硫酸D .稀盐酸4.下列物质的名称、俗名与化学式完全对应的是 ( )A .碳酸钠 纯碱 NaCO3B .碳酸氢钠 苏打 NaHCO3C .氢氧化钙 生石灰 Ca(OH)2D .氢氧化钠 烧碱 NaOH5.鱼胆弄破后会使粘上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是 ( )A.氢氧化钠B.纯碱C.食盐D.食醋6.下列反应属于复分解反应的是 ( ) A .2KClO 32KCl+3O 2 ↑ B .Zn+H 24+H 2↑ C .CuSO 4+2NaOH=Cu (OH )2 ↓+Na 2SO 4 D .2Cu+O 27.下列说法正确的是 ( )A .氯化钠易潮解,所以食盐应密封保存B .纯碱的水溶液呈碱性C .碳酸钠晶体在空气中发生风化现象,是物理变化。
D .纯碱属于碱8.下列各组物质的溶液,不能发生复分解反应的是 ( )A .HCl 和Ca (OH )2B .Na 2CO 3和H 2SO 4C .AgNO 3和BaCl 2D .KCl 和CuSO 49.生活中常有发生亚硝酸钠中毒事件的报道,这是因为亚硝酸钠外观酷似食盐且有咸味;工业用盐中常混有亚硝酸钠,有关氯化钠和亚硝酸钠的部分资料如下表: 如要检验食盐中有无亚硝酸钠,下列判定方法错误的是 ( )A.在食盐中加人盐酸,观察有无红棕色气体放出B.蒸干100克100℃食盐饱和溶液,称量溶质的质量是不是39. 12克C.用pH 试纸测定食盐溶液的酸碱性D.把食盐加热到3200C 以上观察有无刺激性气体放出210.有下列物质:a.盐酸 b.熟石灰 c.纯碱 d.食盐,请选择合适的标号(a ~d)填空。
几种重要的盐11解读

食盐有什么用途?
0.9%的氯化钠溶液称为生理盐水
收集一些汗液盛放在试管中,滴入几滴硝 酸银溶液,有什么现象产生? 有白色沉淀生成。 化学方程式: NaCl+AgNO3=AgCl +NaNO3 。
参照酸和碱性质的推断方法, 你能否说说盐有哪些性质?
Na2CO3溶液 酚酞
碳酸钙(CaCO3):汉白玉、大理石、 石灰石、贝壳、水垢、鸡蛋壳、骨骼 等的主要成分。
说一说:碳酸钙的用途是什么?
思考:怎样证明一块岩石是碳酸盐?
食盐主要来自 于海水、井水、 盐湖水等
从海水中析出粗盐中因含有MgCl2、 CaCl2等物质而易潮解。
小知识:
最大的是青海柴达木盆地的察 尔汗盐池,据统计,仅这一盐池开 采出来的岩盐,足够我国十三亿人 口食用四千多年!
第4节 几种重要的盐(1)
硫酸亚铁 FeSO4
硫酸铜 CuSO4٠5H2O
硝酸钾 KNO3
重铬酸钾 KCrO4
Na2CO3·10H2O 结晶水合物 结晶水
Na2CO3·10H2O = Na2CO3+10H2O 候德榜
用试管取适量碳酸钠溶液,向试管中 滴加酚酞试液。现象_无__色_酚__酞__试__液_变__红__色。 可见,碳酸钠的水溶液呈_碱___性。
1、盐与酸的反应:
Ba(NO3)2+H2SO4 =BaSO4 +2HNO3 Na2CO3+H2SO4 =Na2SO4+H2O+CO2
2、盐与碱的反应 2NaOH+CuCl2 =2NaCl+Cu(OH)2 Ca(OH)2+Na2CO3 =CaCO3 +2NaOH 3、盐与盐的反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.如何除去热水瓶中的水垢?
CaCO3+2HCl=CaCl2+H2O+CO2↑ MgCO3+2HCl=MgCl2+H2O+CO2↑
3.长期盛放石灰水的试剂瓶会有一层白色物质, 请问这是什么物质?怎么形成的?如何除去? CO2+Ca(OH)2==CaCO3↓+H2O
3· 氯化钠
俗称食盐
白色固 体 、 易 溶于水 。
能和酸反应,晶体会风化
用途
调味剂,生理盐水 0.9%
作农药,炼铜,检水的存 在
食品工业,洗涤剂,制 NaOH
注意点
粗盐,盐与食盐的区别
盐的通性 化学性质
盐+金属1→盐+金 属2
注意
举例
盐+酸→ 新盐+新酸
盐+碱→ 新盐+新碱
盐+盐→ 新盐+新盐
盐的通性 化学性质 注意 举例
Fe+CuSO4=FeSO4+Cu Cu+Hg(NO3)2= Hg+Cu (NO3)2
Ca(OH)2 + CO2
==== CaCO3↓ + H2O
思考: 1.将鸡蛋放入盐酸中,鸡蛋为什么会上浮?
由于鸡蛋外壳的主要成分是碳酸钙,遇到稀盐酸 时生化学反应而生成二氧化碳气体。 CaCO3+2HCl ===CaCl2+H2O+CO2↑ 二氧化碳气体附在鸡蛋外面,增大了鸡蛋排开液 体的体积,从而使鸡蛋受到的浮力增大,当浮力大 于重力时,鸡蛋便上浮. 会发
D.MgCl2
3.下列物质中不属于盐的是( D )
A.CuSO4 B.Na2S C.CaCl2 D.Ba(OH)2
4.已知可溶性钡盐有毒,而在医院里做胃镜透视时, 要用BaSO4 造影,俗称“钡餐”,吃下BaSO4 无毒是 因为( BaSO4不溶于水,也不与酸反应式 )。 但如果无意中误服了BaCO3 则会引起中毒,这是因 为 ( 用 化 学 方 程 式 表 示 , 下 同 ) ( BaCO3+ 2HCl ==== BaCl2 + H2O +CO2↑ ),误服 后 , 应 立 即 用 泻 盐 MgSO4 解 毒 , 这 是 因 为 ( BaCl + MgSO ==== BaSO ↓ + MgCl )。
2)、碳酸钠与酸反应: Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ Na2CO3 + 2 HCl===2 NaCl + H2O + CO2↑ 用途:做馒头时可除去酸味,且使馒 头多孔松软.
3)、与碱反应:
Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH
制造烧碱
应用:碳酸钠可制造玻璃、肥皂、 洗涤剂、以及在纺织工业上都利用 它的碱性。
2 4 4 2
第2课时 盐的制取
有些盐是天然存在的。如:食盐、纯 碱等,但有些是用化学方法制取。
根据酸的共性和碱的 共性,以及盐的有关性质,你 知道可以用哪些方法制取盐?
一、制取盐的途经:
1、酸+碱=盐+水 2、酸+盐=新酸+新盐 3、酸+金属氧化物=盐+水 4、酸+金属=盐+氢气
1、碱+酸=盐+水
电离时能产生金属阳离子(或铵根离子)和酸 根阴离子的化合物,叫做盐。
二、几种盐的性质
二、几种盐的性质
1、碳酸钠
俗名:纯碱、苏打 纯碱晶体 1).是一种白色粉末,易溶于水. 2).从水溶液中析出时,晶体含有结晶水,化学 式是Na2CO3.10H2O 。
结晶水合物:含有结晶水的化合物
风化:结晶水合物在常温下,放在干燥 的空气里逐渐失去结晶水的现象叫风化。
四、化肥的作用与制取
氮肥
磷肥
钾肥
氮肥 能促使农作物的茎叶生长茂盛,含有 (1)作用:
组成叶绿素的重要元素(“叶肥”)
常用酸与氨气 (2)氮肥(铵盐)的制取: 反应制取 NH3+H2O+CO2=NH4HCO3(碳铵)
2NH3+H2SO4=(NH4)2SO4(硫铵)
(3) 铵盐的性质:
铵盐能与碱反应,生成氨气
(2)家庭饮用水。经检验其PH略小于7,说 明溶液显__性,这是因为溶有______原因, 该水是___(填纯净物或混合物)
(3)把生石灰、食盐、浓盐酸、浓硫酸,浓硝酸、 苛性钠、碳酸钙长期露置于空气中,则质量会增 加的是______,质量减小的是_______,会变质的是 _____.
(4)我国古代纺织常用氢氧化钾做漂洗的洗涤 剂。前人用贝壳(主要成份是碳酸钙)煅烧后的 固体与草木灰(主要成份是碳酸钾)在水中相互 作用,便可得到氢氧化钾,上述反应方程式: _____________,____________,_______
(5)A、B、C、D分别是盐酸、碳酸钠、硝酸 银、氯化钙四种溶液中的一种,将它们两两混 合后,观察到的现象如到表,请回答: 1)A、B、C溶液中溶质的化学式 ____,____,___ 2)C和D反应的化学方程式_________
A
B C D
(6)有一包白色固体A,可能含有氯化铁、碳酸钙、 氢氧化钠、氢氧化钡、氯化钡、硫酸钠中的几种,做 如下实验:(用化学式填空)
好大的一座盐山
海水晒盐、井水制盐。
海 水
蒸 发
粗 盐
溶解、过滤、蒸发
精 盐
食盐在自然中分布广,但主要存 在于海水中。
食盐的用途
1)食盐是一种重要的化工原料,化工厂制取 苛性钠、盐酸、氯气、纯碱、硫酸钠、杀虫剂 和漂白粉等。
2)、制生理盐水(0.9% NaCl)
3)日常生活中,可用食盐水 清洗伤口,具有杀菌作用。 4)食用。
思考: “潮解”和结晶水合物的“风化” 相同吗?为什么?
答:风化:结晶水合物在干燥的空气中失去 部分或全部结晶水的现象,属化学变化。 潮解:一些固体物质在空气中会吸收空气 中的水蒸气,在固体表面逐渐形成溶液的 现象—在初中范围内主要是物理变化。
B.化学性质
1)、碳酸钠与酸碱指示剂反应
探究实验:往碳酸钠溶液中滴入酚酞试剂, 发现什么现象? 溶液变红 可见:碳酸钠的水溶液呈碱性。这是纯碱名 称的由来.
用途:冶炼金属铜,生产波尔多液,游 泳池消毒剂
总结
俗名
物理性质
几种常见的盐性质比较
氯化钠 硫酸铜 碳酸钠
化学性质
用途
注点
几种常见的盐性质比较
氯化钠 硫酸铜 碳酸钠
俗名
物理性质
食盐
白色固体,能溶于水
晶体叫胆矾等
白色粉未.晶体蓝色
纯碱,苏打,口碱
白色粉味,能溶于水
化学性质
能与硝酸银反应
能与可溶性碱,可溶性钡 盐反应,能和水反应
在农村,人们常取少量白色粉 末状的化肥和消石灰一起放在手掌心搓, 通过闻气味来检验是否是氮肥,这是根 据什么原理?
铵盐与碱(强碱)混合加热,都会产生 有刺激性气味的氨气放出。此法用于铵盐的 检验。
磷肥
作用:促进农作物根系发达,增强吸收养份和
抗寒抗旱能力,促进作物穗数增多,籽 粒饱满等。 钾肥
作用:促进农作物生长旺盛,茎杆粗壮,增强
HCl+AgNO3= AgCl↓+HNO3 Na2CO3+H2SO4=Na2SO4+h2O+ CO2↑
盐+金属1→新盐+金 1比2活泼,盐要可溶 属2
盐+酸→ 新盐+新酸
生成物应有水,气体或沉 淀
盐+碱→ 新盐+新碱
反应物可溶,生成物有沉 淀
Na2CO3+Ca(OH)2= 2NaOH+CaCO3 ↓
2、碱+盐=新碱+新盐 3、碱+酸性氧化物=盐+水 1、盐+盐=新盐+新盐 2、盐+金属=新金属+新盐
盐的溶解性(见溶解性表)
可溶性盐
钾(K+)、钠(Na+)、铵 (NH4+)盐和硝酸盐(NO3-)
盐
不可溶性盐
BaSO4、AgCl
碳酸盐(CO32-)
二、盐与化肥
1.什么是化肥?
化学肥料是用矿物质、空气、水等作原料, 经过化学加工精制而成的肥料。(人工合成的 盐)
抗病虫害能力,促进糖和淀粉的生成。
注意: 长期使用会造成土壤板结,破坏
土壤结构!
课堂练习
(1)某学生家乡出现水禾苗倒伏现象,他通 过研究,发现主要原因是缺少了____肥(填 元素名称),建议农民施用草木灰(其化学式 为_____)或_____(填化学式,下同),但是 过多会使土壤的PH大于7,显__性,不利于 禾苗生长,此时可在土壤中施用适量的____
第四节 几种重要的盐
一、什么是盐?
写出下列物质的化学式及其电离方程式: 氯化钠、氯化钡、硫酸钠、硝酸钾、 碳酸钠、氯化铵 NaCl === Na+ + ClBaCl2 === Ba2+ + 2Cl+ 2 Na2SO4 === 2Na + SO4 KNO3 === K+ + NO3- Na2CO3 === 2Na+ + CO32- NH4Cl === NH4+ + Cl-
共存问题
(7)下列各组物质,能在酸性溶液中大量共存,且溶液是无 色透明的是( D ) A、Na2CO3 B、CuSO4 C、Na2SO4 MgSO4 KCl BaCl2 NaCl NaNO3 NaNO3 K2SO4 CaCl2 NaOH
D、Na2SO4
CO32-(或碳酸氢根离子)检验方法
滴加盐酸,如果能产生一种能使澄清的石灰 水变浑浊的无色气体,则该物质中含有CO32Na2CO3 + 2 HCl===2 NaCl + H2O + CO2↑ CaCO3 + 2HCl=== CaCl2 + H2O + CO2↑ 而且所放出的气体能使澄清的石灰水变浑浊.
