生物工程酶工程实验
酶工程实验教学的改革与实践

①教改 项 目 : 国家大 学生 创新 基金 ( 同编号0 1 5 3 8 ; 西大学 实验 教改 项 目(9 3 1; 世纪 广西 高等 教 育改革 工程 项 目(0 0 G 0 3 。 合 9 0 9 1 )广 0 2 0 )新 2 1J B 0 )
2 2
中 国科 教创新 导刊 Chn E u a in n ov to H r l ia d c to In a in e ad
从 目 前 酶 工 程 实 验 课 的 教 学 现 状 来 看 , 论 是 教 学 内 容 , 学 理 念还 是 教 学 方 无 教
法, 都需 要 部 分 调 整 和 创 新 , 适 应 制 定 的 以 实验 教 学是 创新 人 才培 养过 程 不可 缺 少
效 果 和 总 结 经 验 后 , 铺 开 至 其 它 研 究 项 再
摘 要 : 工程 实 验 课 具 有很 强 的 专 业 性 和 实 践 性 。 充 分 调 动 学生 自主 学 习 的 积 极 性 , 宽 学 生 获 取 知 识 的 空 闽 , 养 学生 的 创 新 能 力 , 酶 为 拓 培 体现教 学 与科研 结合 . 学 与科研 并举的 高校 办学理念 , 们采取整合教 师科研 成果 , 教 我 开设开放 型 实验 选修课 的方 式, 对酶 工程 实验教 学 进 行 改 革 。 践 证 明 ,它克 服 了 以 验 证 性 实 验 为 主 的 传 统 教 学 模 式 固 有 的 诸 多 弊 端 ,实 施 后 成 效 显 著 。 实 关键 词 : 酶工程 实验 酶 工程 教 学改革
酶工程1-3影响酶催化作用的因素详解

四点假设: ①、②、③ 同“快速平衡法”; ④中间复合体[ES]在一开始浓度增高后,可在相当一段 时间内保持浓度的恒定;在这段时间里,[ES]的生成速度 和[ES]消失(包括分解成 E+S 和 E+P)的速度相等,达 到动态的平衡,即“拟稳态”。
c[ES]不随时间而变化
dc[ES ] dt
k1cE cS
k1c[ES ]
k2c[ES ]
0
c
cE0 cE c[ES ]
vP
dcP dt
k2c[ES ]
cS c[ ES ]
c[ E ]
拟稳态
cp t
vP
k2cE0 cs Km cs
vP ,max cs Km cs
Km
k1 k2 k1
为米氏常数(mol/L)
Km
Ks
k2 k1
当k+2远小于k-1时,Km=Ks
每一种酶的催化反应都有其最适宜的温度范围及最 适温度。
添加酶的作用底物或者某些稳定剂可以适当提高酶 的热稳定性。
4、pH值的影响
在不同的pH值条件下,酶分子和底物分子中的基 团的解离状态发生改变,从而影响酶分子的构象以 及酶与底物的结合能力和催化能力。 在极端的pH值条件下,酶分子的空间结构发生改 变,从而引起酶的变性失活。 每种酶都有其各自的适宜pH值范围和最适pH值。
k1cEcS k1c[ES ]
cE0 cE c[ES ]源自vPdcP dtk2c[ES ]
vP
k2cE0 cs Ks cs
vP ,max cs Ks cs
Ks
k 1 k 1
为解离常数(mol/L)
M-M 方程的修正
1925年,Brigg 和 Haldane 认为:许多酶有很大的催化 能力,当[ES]形成后,即迅速转化成产物P而释放出酶, 即当k+2>k-1时,M-M 方程不成立。
酶工程4

组分(酶、溶剂、底物和产物)的а
• 最佳水活度与溶剂的极性几乎无关
w
是相同的。
华东理工大学 ECUST
表征必需水作用的参数---热力学水活度
华东理工大学 ECUST
获得恒定水活度的方法:
• 向反应体系中直接加水。 ×
• 用一个饱和盐水溶液分别预平衡底物溶液和酶制剂。 • 直接向反应体系加入水合盐:Na2HPO4(二、七、十 二水合盐)
华东理工大学 ECUST
3 专一性
枯草杆菌蛋白酶催化在水溶液中催化N-乙酰-L-丝氨酸乙酯和N-乙酰-L
苯丙氨酸乙酯与丙醇的转酯反应,在二氯甲烷或苯中:丝氨酸>苯丙氨
酸;在吡啶或季丁醇中:苯丙氨酸>丝氨酸 原因:溶剂改变底物分配系数
有些在水中不能实现的反应途径,在有机介质中却成为主 导反应。
华东理工大学 ECUST
华东理工大学 ECUST
酶活性丧失的可能原因:
有机溶剂与底物或产物相互作用
• 直接作用:氯仿显著减少过氧化物酶催化苯酚的氧化,原因在于氯仿 是苯酚基的淬灭剂; • 影响底物或产物的分配
华东理工大学 ECUST
2 活性
在反向微团体系中,微团效应使某些酶活性增加 超活性:凡是高于水溶液中所得酶活性值的活性称为超活性 (Super-activity)。 表面活性剂刚性壳层能缓冲酶结构波动性,保证酶结构的稳定; 保护酶避免与有机溶剂直接接触; 为酶催化反应提供巨大相界面,减小传质阻力
剂(如吡啶或二甲基甲酰胺) 例:在己烷中聚苯酚氧化酶的催化反应,极性的苯醌产物不溶于己烷,
导致在酶周围的水层发生不需要的聚合,该聚合物缠住酶,降低酶活,
“酶工程”_暑期科研实践_实习_报告_总结 2100字 - 总结范文

三一文库()〔“酶工程”_暑期科研实践_实习_报告_总结 2100字 - 总结范文〕“酶工程”暑期科研实践总结报告生物科学与工程学院生物工程2班黄义林20xx30742333这次暑期科研实践,我和李洋、黄文潘都参加了有张俊辉师兄所负责的酶分子改造的项目,实际参加实验的时间是7月13至29号,以及8月16至19号。
在此之前,我们还参加了有郑穗平老师和林影老师讲授的关于酶的发展、现状以及前景的讲座,以及内容为负责各个项目的师兄对其项目讲解的培训。
参加实践前的讲座和培训都让我对酶的发展概况、研究方向有了更深刻全面的认识。
实验中,张俊辉师兄让我们从实验的开头开始,逐步学习实验过程中各阶段的实验操作,同时对专业知识进行讲解,让我们更好地掌握实验操作的原理。
在实验流程中,我们的操作都没有出现能直接导致实验失败的失误,但实验最后并没有得到想要的产物,原因应该是多方面的,也和我们的实验操作有很大关系。
实验没有得到很好的成果,但在实践过程中,我学习和掌握了一些基本实验操作技能及操作规范,并对实验室内的规章制度有了更多的了解。
下面说一下我在实验中学到的知识和其他心得体会。
首先是酶分子改造实验的思想:获得待改造酶分子的三维结构后,对其进行分析,从而确定可能改善酶某一方面性能的突变位点,通过反编译获得改造后的酶的基因,把这段基因再表达出来,就得到改造后的酶分子。
思想比较直接,但是实际操作却比较迂回,因为某些步骤看起来不复杂,但在现实中要实现就没有那么简单,比如要确定突变位点和突变的方向,目前的理论对蛋白质结构和功能的研究还达不到可以直接指导酶分子改造的那个层次,所以在改造的时候需要结合理性突变和随机突变,即理性确定突变位点,然后在那个位点进行全突变,或者增加突变位点;要获得反编译后的酶的基因,直接合成成本太高(1bp 要几块钱),所以需要对原来的基因进行操作(设计引物,通过PCR对酶基因进行全突变);对改造后的酶的基因进行表达,需要利用基因工程技术,我们在实际操作中是先把基因和质粒连接,先转化大肠杆菌以增殖质粒,再从大肠杆菌中提取质粒,转化毕赤酵母进行最终的表达;因为设置多个突变位点以及每个突变位点都有二十种氨基酸,所以需要进行大量的筛选(筛选量随着突变位点的增长而呈指数增长);基因既看不见有摸不着,在实验过程中需要对每一步的成果进行检测,比较多的就是依靠跑胶来检测DA分子的长度,确定是否得到目的基因,与突变后的酶基因进行连接的质粒上面要有抗生素抗性标记,转化后的大肠杆菌或毕赤酵母要用含抗生素的平板进行培养,以筛选出成功转化的菌落。
《酶及实验设计》课件

酶的专一性是由酶的活性中 心决定的
酶的专一性是酶的重要特性 之一,决定了酶在生物体内
的作用和功能
酶的活性调节
酶的活性调节 酶的合成调节: 酶的降解调节: 酶的修饰调节:
机制:包括酶 包括基因表达 包括酶的降解、 包括酶的磷酸
的合成、降解、 调控、转录后 清除和回收等 化、乙酰化、
修饰、激活和 调控和翻译后
酶的分类
氧化还原酶:催 化氧化还原反应
的酶
水解酶:催化水 解反应的酶
转移酶:催化转 移反应的酶
裂解酶:催化裂 解反应的酶
合成酶:催化合 成反应的酶
修饰酶:催化修 饰反应的酶
酶的结构和功能
酶的功能:催化生物化学反 应,提高反应速率
酶的结构:由氨基酸组成的 蛋白质,具有特定的空间结 构
酶的活性:受温度、pH值、 离子强度等因素影响
温度:温度越高,反应速率越快
激活剂:激活剂可以提高酶活性,从而提 高反应速率
酶促反应的动力学方程式
米氏方程:描述酶促反应的速率与底物浓度的关系 汉密尔顿方程:描述酶促反应的速率与酶浓度的关系 米氏-汉密尔顿方程:综合考虑底物浓度和酶浓度对酶促反应速率的影响 酶动力学参数:包括Km、Vmax等,用于描述酶促反应的动力学特性
实验结果:酶活性、反应速率、产物生成量等
数据分析:使用统计方法,如t检验、方差分析等
结果解释:根据实验结果,分析酶的活性、反应速率、产物生成量等 结论:根据数据分析,得出实验结论,如酶的活性、反应速率、产物生成 量等与实验条件的关系。
实验结论和讨论
实验结果:酶活性与反应条件之间的关系 讨论:酶活性的影响因素及优化方法 结论:酶在生物体内的作用及应用前景 建议:进一步研究酶的催化机制和酶工程在生物技术中的应用
酶工程实验
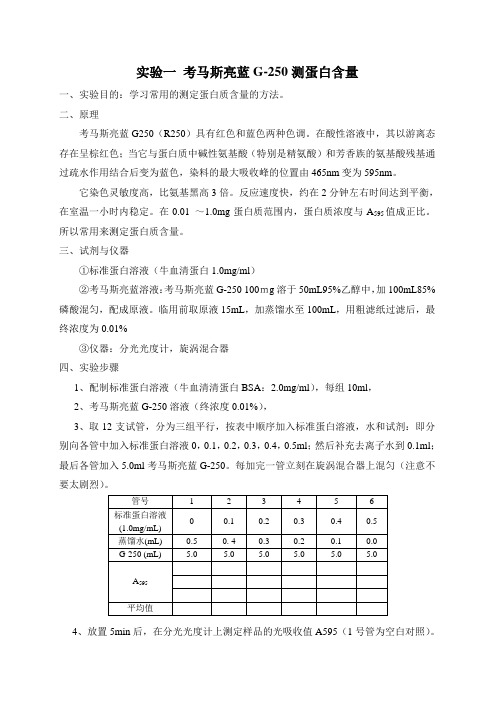
实验一考马斯亮蓝G-250测蛋白含量一、实验目的:学习常用的测定蛋白质含量的方法。
二、原理考马斯亮蓝G250(R250)具有红色和蓝色两种色调。
在酸性溶液中,其以游离态存在呈棕红色;当它与蛋白质中碱性氨基酸(特别是精氨酸)和芳香族的氨基酸残基通过疏水作用结合后变为蓝色,染料的最大吸收峰的位置由465nm变为595nm。
它染色灵敏度高,比氨基黑高3倍。
反应速度快,约在2分钟左右时间达到平衡,在室温一小时内稳定。
在0.01 ~1.0mg蛋白质范围内,蛋白质浓度与A595值成正比。
所以常用来测定蛋白质含量。
三、试剂与仪器①标准蛋白溶液(牛血清蛋白1.0mg/ml)②考马斯亮蓝溶液:考马斯亮蓝G-250 100mg溶于50mL95%乙醇中,加100mL85%磷酸混匀,配成原液。
临用前取原液15mL,加蒸馏水至100mL,用粗滤纸过滤后,最终浓度为0.01%③仪器:分光光度计,旋涡混合器四、实验步骤1、配制标准蛋白溶液(牛血清清蛋白BSA:2.0mg/ml),每组10ml,2、考马斯亮蓝G-250溶液(终浓度0.01%),3、取12支试管,分为三组平行,按表中顺序加入标准蛋白溶液,水和试剂:即分别向各管中加入标准蛋白溶液0,0.1,0.2,0.3,0.4,0.5ml;然后补充去离子水到0.1ml;最后各管加入5.0ml考马斯亮蓝G-250。
每加完一管立刻在旋涡混合器上混匀(注意不要太剧烈)。
4、放置5min后,在分光光度计上测定样品的光吸收值A595(1号管为空白对照)。
5、用标准蛋白的量为横坐标,用A595为纵坐标,作标准曲线图,由此曲线,根据后续试验测出的未知样品的A595值,可查出未知样品的蛋白质含量。
6、实验结果分析:误差分析,为什么出现这样的结果,什么原因导致的?实验二3,5-二硝基水杨酸(DNS)法测定酶活力一、实验目的:学习DNS测定还原糖的方法二、实验原理:还原糖的测定是糖定量测定的基本方法。
酶工程实验报告三( 纤维素酶最适反应pH值的测定)

实验方式 小组合作
小组成员 XX XX XX XX
掌握酶最适 pH 值的测定方法及原理。
2、 实验仪器、试剂和溶液:
A 2 仪器: 紫外分光光度计、比色皿(3个)、恒温水浴锅(4台)、试管架(1个)、1ml移液管(1 根)、10ml移液管(1根)、玻璃棒(1根)、1000ml烧杯(1个)、500ml烧杯(2个)、 1000ml容量瓶(1个)、洗耳球(1个)、标签(若干)等。
本科学生实验报告
学号 104120440 姓 名
孙永升
学院 生命科学学院 专业、班级 10 生物技术
实验课程名称
酶 工 程 <实验>
教师及职称
李俊俊 <讲师>
开课学期 2012 至 2013 学年 第二学期
填报时间 2013 年 月 24 日
云南师范大学教务处编印
1
实验名称 实验三 纤维素酶最适反应 pH 值的测定
5 实验处理
A 5 葡萄糖标准曲线如 图 1:
OD540nm值
0.7 0.6 0.5 0.4 0.3 0.2 0.1
0 0
y = 0.7023x - 0.0747
葡萄糖标准曲线
R2 = 0.9992
系列1 线性 (系列1)
0.2
0.4
0.6
0.8
1
1.2
葡萄糖浓度(mg/ml)
图 1 标准曲线 葡萄糖标准曲线如上图所示,得回归直线方程 y=kx-0.0747,k=0.7023, R2=0.9992>0.99,该标准曲线相关性很好。式中 Y 表示表示测定的吸光度(OD)值,X 表示还原糖的浓度, 0.0747 表示补偿参数。
pH 与酶活性关系的测定是在其它条件(如底物浓度、酶浓度、反应温度等)恒定的 最适情况下,选用一系列变化的 pH 环境中进行初速度测定,其图形一般为钟形曲线。
酶工程实验指导

酶工程实验指导西南农业大学农学与生物科技学院2009年3月实验一产蛋白酶菌株的分离一、实验目的学习胞外生产微生物菌种的分离选择,熟悉分离菌种的基本操作。
二、实验原理工业上常用的生产酶的微生物有许多,重要的有枯草杆菌和真菌中的曲霉等等,它们都能产生耐热的芽孢或分生孢子,分离这类菌种时可采取先进行一定的热处理杀灭其它营养细胞,提高该菌株的相对数目。
根据胞外酶能分泌到培养基的特点,采用一定的方法在培养基上形成单菌落分泌的酶形成的“水解透明圈”,可对产酶的微生物的产酶能力(活力)进行初步估计、分离高产酶的微生物。
三、试剂、仪器高压灭菌锅,天平,无菌超净工作台,培养皿(8套/组)、试管(2支/组)、三角瓶、烧杯、酵母膏,蛋白胨,NaCl、琼脂粉,奶粉三、操作步骤1、带菌土壤的热处理称取1g带菌土壤湿润后放入80℃烘箱处理30min。
2、分离选择培养基的配制,各组按下列比例配制120ml培养基:奶粉2g ,自来水50ml,装入50ml三角瓶琼脂1.8g ,NaCl 0.5g,自来水70ml,装入100ml三角瓶自来水50ml,装入50ml三角瓶取50ml烧杯一个,放入5支带帽5ml离心管,灭菌备用。
分别封口,常规灭菌(121℃、20min),灭菌后待冷却至不太烫手时混合上述液体,按无菌操作要领迅速倒平板8个,其中4个加有0.2ml不同稀释倍数(操作5)的样品液(菌悬液),迅速混合冷却形成平板,余4个平板冷却后用于涂布筛选。
3、稀释制备菌液,取5支灭菌带帽5ml离心管,各加入无菌水3.6ml备用;将热处理过的土壤放入无菌50ml烧杯中,加入无菌水10ml,搅拌后静置片刻,上层液体为微生物悬液,按下法稀释微生物悬液:在第一支试管中加入0.4ml微生物悬液,混合均匀后再取0.4ml到第二支试管中混合,从第二支试管中再取0.4ml到第三支试管中,以此类推。
4、斜面培养基配制:配制100ml LB培养基,加入1.5g琼脂粉、蛋白胨1.0g、酵母膏1.0g、NaCl、1.0g加水到100ml,调节pH=7,加热融化后,各组倒斜面培养基2 支,灭菌备用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶工程
预实验报告
授课班级:12生物工程
授课教师:孙万里
2015-05-02
实验一淀粉酶产生菌的筛选
1 实验目的:
学习从环境中筛选产酶微生物的基本步骤
2 实验基本原理:
淀粉酶能水解淀粉生成葡萄糖、麦芽糖、糊精等还原性糖,可以利用淀粉的消耗或糖的生成来进行淀粉酶的筛选。
初筛:淀粉可与碘反应生成兰色化合物,而葡萄糖不能,可利用此反应可判断淀粉是否被水解而从样品中筛选出可产淀粉酶的微生物。
复筛:淀粉酶可水解淀粉生成葡萄糖、麦芽糖、麦芽三糖、糊精等还原糖,这些还原糖能使3,5-二硝基水杨酸还原,生成棕红色的3-氨基-5-硝基水杨酸,其反应如下:
3 实验试剂:
分离培养基(100mL):可溶性淀粉0.5g,蛋白胨0.5g,酵母膏0.5g,KH2PO4 0.05g,MgSO4 0.01g,Cacl2 0.05g,琼脂3g,pH 5.0
发酵培养基(100mL):可溶性淀粉2.0g,蛋白胨0.5g,酵母膏0.5g,KH2PO4 0.05g,MgSO4 0.01g,Cacl2 0.05g,(NH4)SO4 0.1g,pH 6.0
pH6.0缓冲液:磷酸氢二钠(0.2mol/L)12.6mL与柠檬酸(0.1mol/L)7.4mL混合。
Lugol碘液(鉴别平板筛选用):碘化钾2g,用水溶解,加入碘1g,定容300mL(棕色瓶保存)
1%淀粉:取1g淀粉,用水加热沸腾至充分溶解,定容至100mL,当天使用当天配。
3,5-二硝基水杨酸钠:精取称取1g 3,5-二硝基水杨酸,溶于20ml 2mol/L氢氧化钠溶液中,加入50ml蒸馏水,再加入30g四水酒石酸钾钠(C4H4KNaO6·4H2O),待溶解后用蒸馏水定容100mL,盖紧瓶塞,勿使CO2进入。
4 实验步骤:
4.1 初筛
取不同地点的土样(5~10cm深)5g,放入45mL带有玻璃球的无菌水中,震荡约5~10min,制成10-1稀释液,然后再梯度稀释至10-210-310-4,从10-210-310-4稀释液中分别取0.1mL涂布,过夜培养,加入适量Lugol碘液观察,并从中挑选出三株形态不同且具水解圈的单菌落。
4.2 复筛
挑取单菌落,接种液体培养基中,37℃ 200rpm 72h,取发酵液测定酶活力。
4.3 酶活测定
分别取发酵液约5mL,10000rpm离心10min得上清液。
在比色杯中加入1%淀粉1mL,再加入pH 6.0缓冲液3mL,60℃预保温5min,加入发酵液1mL,60℃反应15min,反应完毕取出加入3,5-二硝基水杨酸钠2mL,沸水中5min使显色完全,定容到25mL,于540nm处进行比色。
空白1:考虑到发酵液中可能含有的糖,故只加入发酵液而不加淀粉。
(每发酵液对应一空白)
空白2:不加发酵液,也不加入淀粉作为调“0”用。
(每小组对应一空白)
5 实验结果:
结果比较理想。
但复筛中有时会出现空白值比测定值还高的结果,原因暂不明。
3,5-二硝基水杨酸钠大约只能使用一周,存放时间太久显色不完全。
6 实验问题:
为何要进行复筛?
为何本实验没有经过富集培养?
7 实验安排:
第一天取样,涂布
第二天加碘液,初筛,接种发酵72h
第五天测定发酵液酶活
实验二淀粉酶的提取
1 实验目的:
学习从盐析法粗提取酶的步骤
2 实验原理:
盐离子破坏蛋白质表面的水化膜,使疏水基团暴露,引起蛋白质间疏水区域聚集而沉淀,表面疏水基团越多,其蛋白质越容易发生沉淀。
3 实验试剂:
使用的酶:1g溶解在200ml水中,离心去渣。
(约20U/mL)
硫酸氨:用前先碾成小颗粒,用30%,50%,80%饱和度的硫酸氨进行沉淀。
25度下100mL分别加入克数为17.6g、31.3g、56.1g;加入时候需要注意慢慢加入,使得盐全部溶解。
过夜沉淀。
4 实验步骤:
1. 加硫酸氨:用前先碾成小颗粒,加入4mL酶液中,加入的时候需要注意慢慢加入(否则局部浓度提高,造成不需要的酶沉淀),使得盐全部溶解,过夜沉淀。
2. 次日离心收集沉淀10000rpm 10min,用4mL水溶解沉淀。
3. 计算回收率:沉淀液/原液
5 实验问题:
如何提高沉淀效果? 增加蛋白浓度,调pH至等电点。
请结合该实验思考如果进行分步盐析?
6 实验安排:
第一天加硫酸氨
第二天测定酶活
实验三淀粉酶的固定化
实验目的:
学习海藻酸钙包埋法固定酶的操作步骤
实验原理:
把游离态的水溶性酶限制在某一局部空间或固定载体上称为酶的固定化,固定化酶可以使酶重复利用,并且有利用产物分离;
海藻酸钙包埋法是其中应用最为广泛、研究最多的一种包埋固定化方法,方法是在海藻酸钠溶液中加入Ca离子,通过Ca离子取代Na离子而形成凝胶网络,从而实现酶的包埋。
加入试剂量的多少可以决定采用何种孔径大小的固定化凝胶
实验试剂:
海藻酸钠(2%、3%、4%)
酶:制备20U/mL的酶液(1g+200mL水)
Cacl2:2%
实验步骤:
制备不同浓度海藻酸钠,高温蒸汽灭菌,过夜消泡。
取不同浓度的海藻酸钠与酶混合,比例为3:1(3mL+1mL)。
将海藻酸钠酶混合液放入50mL的大头针里,慢慢滴入2%Cacl2中,使成为凝胶小球,继续浸泡约20min,润洗几遍,
将制备成的固定化酶全部加入比色管中,测定酶活。
实验结果:
海藻酸钠浓度太高,比较粘稠,不易进行操作。
其中有一个浓度的酶活会比较大。
实验讨论:
请分析什么原因造成不同浓度海藻酸钠所制备的固定化酶会有不同的酶活?。
