衡水中学高考化学一轮复习
河北衡水中学2021届高考化学一轮复习名师讲解课件(新课标通用版):第17讲《化学反应中的能量变化》

能量差值,在图6-17-2中:
a表示活化能。
b表示活化分子结合成生成物所释放的能量。
c表示反应热。
提醒 加入催化剂可使 a 减小,b 随之而减小,而 c 保持 不变。
返回目录
第17讲 化学反应中的能量变化
❖考 向 互 动 探 究
3.化学反应中的能量变化也可用图6-17-3表示。
返回目录
第17讲 化学反应中的能量变化
解反应;②C和CO2、C和H2O(气)在高温下的反应; ③Ba(OH)2·8H2O与NH4Cl反应。
(2)放热反应:反应物总能量___>_____生成物总能量。该过 程中__化__学____能转化为___热_____能。常见的放热反应:①所有 的__燃__烧____反应;②酸碱中和反应;③金属与酸反应。
返回目录
第17讲 化学反应中的能量变化
❖考 向 互 动 探 究
4.燃烧热与中和热的比较
燃烧热
相 能量 同 变化
点 ΔH
放热 ΔH__<______0
反应物 的量
__1__m_ol___(O2不限量)
中和热 不限量
生成物 的量
不限量
_1__m_o_l___H2O
不 同 点 反应热 的 含 义
1 mol反应物完全燃烧时 放出的热量;不同反 应物燃烧热_不_同______
生成1 mol H2O时放出的 热量;不同的反应物
的中和热大致相同, 均约为57.3 kJ·mol-1
返回目录
第17讲 化学反应中的能量变化
❖考 向 互 动 探 究
5.中和热的测定 (1)装置如图6-17-1所示
(2)注意事项 ①碎泡沫塑料(或纸条)及泡沫塑料板的作用是 __保__温__、__隔__热__、__减__小__实__验__过__程__中__热__量__的_ 损失 。 ②为保证酸、碱完全中和,常使___碱_____稍稍过量。 ③实验中若使用弱酸或弱碱,会使测得数值__偏__低____。
06 衡水中学高三化学一轮复习资料——化学反应与能量
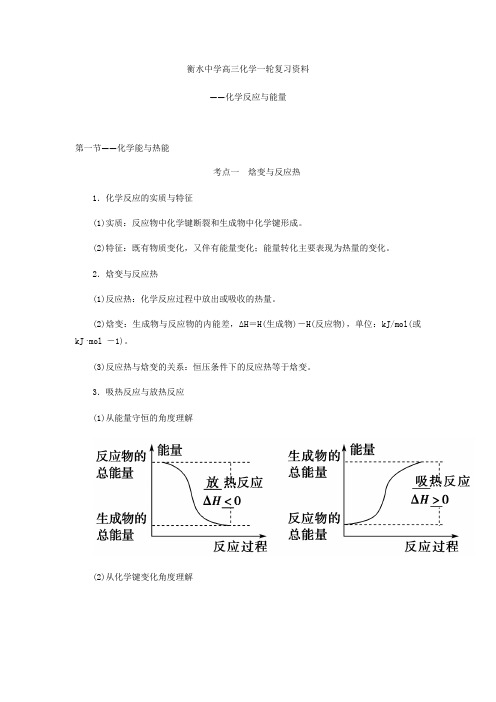
衡水中学高三化学一轮复习资料——化学反应与能量第一节——化学能与热能考点一焓变与反应热1.化学反应的实质与特征(1)实质:反应物中化学键断裂和生成物中化学键形成。
(2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化。
2.焓变与反应热(1)反应热:化学反应过程中放出或吸收的热量。
(2)焓变:生成物与反应物的内能差,ΔH=H(生成物)-H(反应物),单位:kJ/mol(或kJ·mol -1)。
(3)反应热与焓变的关系:恒压条件下的反应热等于焓变。
3.吸热反应与放热反应(1)从能量守恒的角度理解(2)从化学键变化角度理解4.中和反应的反应热(简称中和热)(1)含义:酸与碱发生中和反应生成1_mol H2O(l)时所释放出的热量,其值为-57.3 kJ ·mol -1。
(2)中和反应反应热的测定 ①装置(请在横线上填写仪器名称)②计算公式 ΔH =-0.418t2-t10.025kJ/mol 。
t1——起始温度,t2——终止温度。
③注意事项a .泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量损失。
b .为保证酸完全中和,采取的措施是使碱稍过量。
考点阐释:1.正确理解活化能与反应热的关系催化剂能降低反应所需活化能,但不影响焓变的大小。
2.反应热答题规范指导(1)用“焓变(ΔH)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH 后所跟数值需要带“+”、“-”符号。
(2)描述反应热时,无论是用“反应热”、“焓变”表示还是用ΔH 表示,其后所跟数值需要带“+”、“-”符号。
3.利用键能计算反应热,其关键是算清物质中化学键的数目在中学阶段要掌握常见单质、化合物中所含共价键的数目。
原子晶体:1 mol 金刚石中含2 mol C —C 键,1 mol 硅中含2 mol Si —Si 键,1 mol SiO2晶体中含4 mol Si -O 键:分子晶体:1 mol P4中含有6 mol P -P 键,1 mol P4O10(即五氧化二磷)中,含有12 mol P —O 键、4 mol P===O 键,1 mol CH3CH3中含有6 mol C —H 键和1 mol C —C 键。
河北衡水高中化学高三一轮复习Na及其重要化合物知识点汇总

河北衡水高中化学高三一轮复习Na 及其重要化合物知识点汇总钠及其化合物知识点N A:1、 2Na2O2-----2CO2/2H 2O-----O2------2e-Na2O2----KMnO 4 1 Na 2O2----2 e-Na2O2----SO2 1 Na 2O2----2 e-2、将 CO2通过过氧化钠使其增重ag 时,反应转移电子数为aN A/283、 120gNaHSO4和 KHSO4组成的混合物中共有3N A的阴阳离子×NaHSO4晶体或熔融态存在钠离子和硫酸氢根,水溶液中存在钠离子、氢离子、硫酸根。
4、电解 1L 氯化钠溶液至氢氧根浓度为0.2mol/L时,转移电子数为0.4N A×5、钠和氯气的反应中,当有0.2mol 电子转移时生成的NaCl 分子数目为0.2N A。
×6、 1molNaCl 中,所有Na+的最外层电子总数为8N A。
×7、等 n 的 Na2O2和 Na2O含阴离子均为N A。
化学与生活:1、纯碱、小苏打都可用作食用碱。
2、泡沫灭火器是碳酸氢钠和硫酸铝反应,硫酸铝放玻璃筒,碳酸氢钠放铁桶。
3、阿司匹林乙酰水杨酸中毒可静脉注射碳酸氢钠溶液。
4、钠镁着火只能用沙子扑灭,不能用水灭火。
酒精灯着火可用湿布盖灭。
5、氢氧化铝、碳酸氢钠、碳酸钙、碳酸镁、氢氧化镁都可以治疗胃酸过多。
6、食盐白糖可用作调味剂,也可用作食品防腐剂。
7、焰色反应用铁丝或铂丝,用稀盐酸清洗,检验的是金属元素的性质。
8、亚硝酸钠能防腐、增色。
9、不能用纯碱洗矿物油油污,可以洗油脂油污。
10、冶炼 Na 不能用热还原法。
11、高铁酸钠既能杀菌消毒又能净水。
12、炉火纯青与焰色反应无关,火树银花与焰色反应有关。
化学与实验 :1、Na+的检验:焰色反应,洗烧蘸烧洗烧2、不能用 PH试纸测 NaClO溶液的 PH3、将过氧化钠加入到红色石蕊溶液中,先变红后褪色4、碳酸钠溶于水和水发生反应生成Na2CO3.XH2O 放热。
河北衡水中学2021届高考化学一轮复习名师讲解课件(新课标通用版):第21讲《化学平衡》(56ppt)

两次平衡时各组分百分 含量、c相同,n同 比例变化―→等效 平衡
返回目录
第21讲 化学平衡
❖考 向 互
•
►
探究考向二
化学平衡常数
动
• —— 知 识 梳 理 ——
探 究
•1在.一概定念温度下,一个可逆反应达到_化__学__平__衡___状__态__时,生成
物_浓__度__幂__之__积_____与反应物_浓__度__幂__之__积_____的比值是一个常数,
状态间要互为等效平衡满足四点:①同一条件;
②同一可逆反应;③仅仅由于初始投料不同(即
建立平衡的方向可以不同);④平衡时相应物质
在各自平衡体系中的体积分数(或物质的量分数)
相同。
返回目录
第21讲 化学平衡
❖考 向 互 动 探 究
—— 核心突破 ——
1.化学平衡状态的判断
举例反应
mA(g)+nB(g) pC(g)+qD(g)
3D(g)[Δn(g)≠0]
恒温恒容:反应前后
气体分子数相等 A(g)+B(g) 2C(g)[Δn(g)=0]
投料换算成相同物质 表示时等比例。 即“极值等比即 等效”
两次平衡时各组分百分 含量相同,n、c同 比例变化―→等效 平衡
恒温恒压:所有气体 可逆反应
投料换算成相同物质 表示时等比例。 即“极值等比即 等效”
返回目录
第21讲 化学平衡
❖ 考向互三类2等 :.效等平效衡平根衡据的外类界型温度、压强和体积的变化情况,可以分为
动
条件
等效条件
结果
探 究
恒温恒容:反应前后 气体分子数不相等
2A(g)+B(g)
C(g)+
投料换算成相同物质 表示时量相同。 即“极值等量即 等效”
02 衡水中学高三化学一轮复习资料——化学物质及其变化
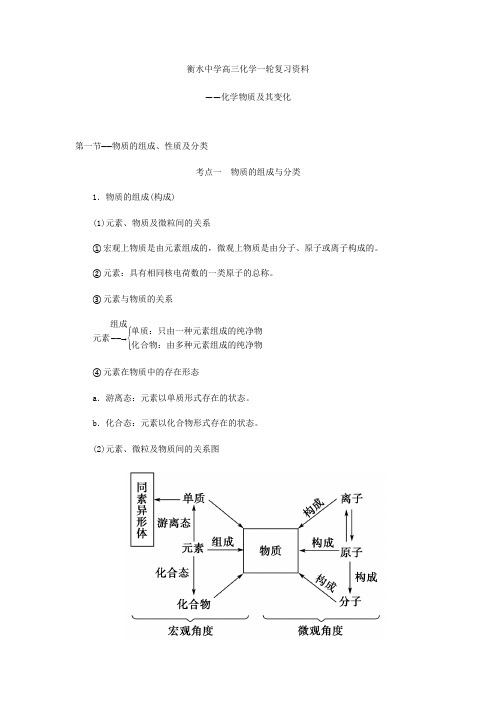
衡水中学高三化学一轮复习资料——化学物质及其变化第一节——物质的组成、性质及分类考点一 物质的组成与分类1.物质的组成(构成) (1)元素、物质及微粒间的关系①宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
②元素:具有相同核电荷数的一类原子的总称。
③元素与物质的关系元素――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物④元素在物质中的存在形态a .游离态:元素以单质形式存在的状态。
b .化合态:元素以化合物形式存在的状态。
(2)元素、微粒及物质间的关系图(3)同素异形体①由同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:a.原子个数不同,如O2和O3;b.原子排列方式不同,如金刚石和石墨。
②同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化。
2.简单分类方法及其应用(1)分类方法常用的两种方法是交叉分类法和树状分类法。
①交叉分类法示例②树状分类法示例(2)分类方法的应用Ⅰ.认识物质间的转化和性质③、④的化学方程式分别为: Ca(OH)2+CO2===CaCO3↓+H2OC +O2=====点燃CO2Ⅱ.认识化学反应的分类依据分解反应 置换反应 吸热 放热考点阐释:规避物质分类的“三大误区”误区一 误认为由相同元素组成的物质一定是纯净物。
(1)若某物质是由一种元素的单质混合而成,如O2、O3组成的混合气体就是混合物,由12C 和13C 组成的石墨则是纯净物。
(2)分子式相同的化合物可能存在同分异构体,最简式相同的化合物不一定是同一物质。
如C4H10的结构有正丁烷和异丁烷,二者组成混合物;C2H2与C6H6最简式相同,但前者为乙炔,后者为苯。
误区二误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。
(1)NaHSO4、CuSO4、NH4Cl溶液呈酸性,这些物质均属盐。
(2)Na2CO3、NaHCO3溶液呈碱性,这些物质均属盐。
2025版高考化学一轮总复习提升训练第8章电离平衡常数及应用微考点3电离平衡常数的相关计算(含答案)

高考化学一轮总复习提升训练:微考点3 电离平衡常数的相关计算1.(2023·河北衡水中学模拟)25 ℃时,用0.1 mol·L -1CH 3COOH 溶液滴定20 mL 0.1mol·L -1NaOH 溶液,当滴加V mL CH 3COOH 溶液时,混合溶液的pH =7。
已知CH 3COOH 的电离平衡常数为K a ,忽略混合时溶液体积的变化。
下列关系式正确的是( A )A .K a =2×10-70.1V -2B.V =2×10-70.1K a -2C .K a =2×10-7V +20D.K a =2×10-8V[解析] 当pH =7时,溶液中c (CH 3COO -)=c (Na +)=2V +20mol·L -1,由物料守恒知c (CH 3COOH)=0.1V V +20 mol·L -1-2V +20 mol·L -1=0.1V -2V +20mol·L -1,再根据K a =c H +·c CH 3COO -c CH 3COOH ,代入相关数据可得K a =2×10-70.1V -2。
2.(2023·湖南邵阳模拟)常温下,联氨(N 2H 4)在水溶液中分步发生电离:①N 2H 4+H 2O N 2H +5+OH -K a1;②N 2H +5+H 2ON 2H 2+6+OH -K a2。
该溶液中的微粒的物质的量分数δ(X)随pOH[pOH =-lg c (OH -)]变化的关系如图所示。
下列叙述错误的是( B )A .给N 2H 4的水溶液中加水稀释,电离程度逐渐增大B .电离常数K a1:A<B =D<C C .据图中A 点可求:K a1=10-6D .图D 点溶液的c (OH -)=10-10.5 mol·L -1[解析] 给N 2H 4的水溶液中加水稀释,电离平衡正向移动,故电离程度逐渐增大,A 正确;电离常数只与温度有关,与溶液的酸碱性无关,故电离常数K a1:A =B =D =C ,B 错误;题图中A 点δ(N 2H 4)=δ(N 2H +5),pOH =6,此时c (N 2H 4)=c (N 2H +5)、c (OH -)=10-6mol·L -1,则N 2H 4的电离常数K a1=c N 2H +5·c OH -c N 2H 4=c (OH -)=10-6,C 正确;同理,据题图中C点计算电离常数K a2=c OH -·c N 2H 2+6c N 2H +5=c (OH -)=10-15,题图中D 点溶液中δ(N 2H 4)=δ(N 2H 2+6),则有K a1·K a2=10-6×10-15=c 2(OH -),解得c (OH -)=10-10.5 mol·L -1,D 正确。
03 衡水中学高三化学一轮复习资料——金属及其化合物
衡水中学高三化学一轮复习资料——金属及其化合物第一节——钠及其重要的化合物考点一 钠的主要性质及其应用1.物理性质(1)与非金属单质(如O2、Cl2)的反应与O2反应⎩⎪⎨⎪⎧常温下:化学方程式为4Na +O2===2Na2O 。
加热时:化学方程式为2Na +O2=====△Na2O2。
(2)与水的反应①化学方程式:①2Na +2H2O===2NaOH +H2↑。
②与滴加酚酞的水反应的现象与解释3.钠的制取及保存4.焰色反应(1)概念:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
属于物理变化,是元素的物理性质。
(2)常见元素焰色反应的颜色:钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃)。
5.钠的用途考点阐释:1.金属钠露置在空气中的变化过程银白色金属钠Na ――→O2表面变暗生成Na2O ――→H2O 出现白色固体生成NaOH――→H2O 表面变成溶液NaOH 潮解――→CO2白色块状物质―→生成Na2CO3·10H2O――→风化白色粉末状物质生成Na2CO32.钠与水、酸、盐溶液的反应(1)钠与水、酸的反应实质上均是和H +反应钠与稀硫酸、盐酸等非氧化性酸反应时,首先是钠直接跟酸反应,过量的钠再与水反应,而不能认为是钠先跟水反应,生成的NaOH 再跟酸中和。
钠投入足量盐酸中反应的化学方程式:2Na+2HCl===2NaCl+H2↑离子方程式:2Na+2H+===2Na++H2↑(2)钠与盐溶液的反应先考虑Na与水反应生成NaOH,再考虑NaOH是否与盐发生复分解反应①投入NaCl溶液中,只有H2放出。
2Na+2H2O===2NaOH+H2↑②投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变)。
③投入NH4Cl溶液中,有H2和NH3逸出。
④投入CuSO4溶液中,有H2放出和蓝色沉淀生成。
2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑考点二氧化钠和过氧化钠1∶21∶2考点阐释:Na2O2与某些氧化物反应的规律1.过氧化钠的强氧化性2.Na2O2与CO2、H2O反应的重要关系(1)气体体积差的关系2Na2O2+2CO2===2Na2CO3+O2 气体体积差①2 1 ΔV=12Na2O2+2H2O(g)===4NaOH+O2↑气体体积差②2 1 ΔV=1由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的12,即为生成氧气的量。
2020届衡水高中化学一轮复习全套课件 最全面
例:一个苯环上连接一个烃基(-R)和3个-X基的有机物, 结构式共有( )种。
一种一种的来;个数多的那种先考虑。
⑧常见同分异构:
烯烃/环烷烃;
炔烃/二烯烃/环烯;
苯的同系物/多烯烃; 醇/醚/(酚);
醛/酮/(烯醇); 酸/酯/羟基醛;
果糖/葡萄糖;蔗糖/麦芽糖;氨基酸/硝基化合物 例:分子式为C3H6Cl2的同分异构体共有(不考虑立体异构):B A.3种 B.4种 C.5种 D.6种
④双键不能旋转→顺反异构 当R1≠R2且R3≠R4时才有顺反异构;无提示时不考虑。 3.化学性质 ①燃烧:火焰明亮、黑烟
②氧化反应(得氧去氢):
Ag可催化生成环氧乙烷
思考:实验室里制备的乙烯中常含有 SO2,试设计一实验,检验SO2的存在 并验证乙烯的还原性。 ③加成: Br2(无需催化剂)/X2/H2/HX/H2O;
④热分解(了解):CH₄→C+2H₂ 隔绝空气并加热至1000℃
4.制备(了解):
三、烷烃
1.概念: 单键、链状(锯齿形)、可支链、饱和 环烷烃不是烷烃。
2.物理性质:
通式:CnH2n+2
①C↑:熔沸点↑,密度↑
②C相同,支链↑,熔沸点↓,密度↓
③直链:≤4气体,5-16液体(新戊烷:气体)
3.化学性质:
该有机物的分子式为:
C3H8O
五、有机化合物分子式、结构式的确定
2.确定分子式的规律
(1)最简式(实验式)规律
CH:乙炔和苯
CH2:烯烃和环烷烃
CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖、果糖
(2)常见相对分子质量相同的物质
①同分异构体 ②其他常见的:
28:C2H4、N2、CO 30:C2H6、NO、HCHO 44:C3H8、CH3CHO、CO2、N2O 46:C2H5OH、HCOOH、NO2 (3)“商余法” 例:写出相对分子质量为128的烃的分子式。
河北衡水中学高考化学一轮复习名师讲解课件(新课标通用版):第12讲《硫及其重要化合物(涉及绿色化学)》(
返回目录
第12讲 硫及其重要化合物(涉及绿色化学)
❖考 向 互 动 探 究
(3)典型的归中反应
2H2S+SO2===3S↓+2H2O 2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O (4)含硫物质的连续氧化
❖考 向 互 动 探 究
❖典 型 易
第12讲
硫及其重要化合物
错 必
(涉及绿色化学)
纠
❖教 师 备 用 习 题
返回目录
知识梳理
返回目录
第12讲 硫及其重要化合物(涉及绿色化学)
❖ 考向• ► 探究考向一 硫的性质
互 动
• —— 知 识 梳 理 ——
探 究
1.自然界中硫元素的存在 硫元素广泛存在于自然界中,游离态的硫存在于
氧化
S+2H2SO4(浓)==△===3SO2↑+2H2O
氧化
还原
返回目录
第12讲 硫及其重要化合物(涉及绿色化学)
❖考 向 互 动 探 究
问题导思 ①如何洗涤附着在试管内壁上的硫? ②哪些事实能说明硫的氧化性比 Cl2 的氧化性弱?
返回目录
第12讲 硫及其重要化合物(涉及绿色化学)
❖考
向 互
[答案] ①硫单质易溶于 CS2 且可以与热的浓碱液反应
②氧化性
将 SO2 通入到氢硫酸(H2S 溶液)中: A.反应的化学方程式为___2_H_2_S_+__S_O__2=_=_=__3_S_↓_+__2_H_2_O_____; B.实验现象:_产__生___淡__黄__色__沉__淀____________________。
衡水中学金榜高三一轮化学第9讲氧化还原反应的规律及应用课件
淀,则消耗NaOH溶液的体积是( )
A.60mL
B.45mL
C.30mL
D.15mL
返回导航
衡中金榜 大一轮复习 · 化学
[解析] 由题意可知,
,则Cu失去的电子数与O2得到的电
子数相等。即n(Cu)=2n(O2)=2×
1.68 L 22.4 L·mol-1
=0.15
mol。根据质量守恒及
NaOH和Cu(NO3)2的反应可得关系式:n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3
mol,则V(NaOH)=50m.3oml·Lo-l 1=0.06 L=60mL。
[答案] A
返回导航
衡中金榜 大一轮复习 · 化学
[解析] 由题意可知,
,则Cu失去的电子数与O2得到的电
子数相等。即n(Cu)=2n(O2)=2×
1.68 L 22.4 L·mol-1
=0.15
mol。根据质量守恒及
试剂是( )
A.Cl2 C.FeCl3
B.KMnO4 D.HCl
返回导航
衡中金榜 大一轮复习 · 化学
[解析] 本题是寻找一种氧化剂,其氧化性应大于I2的氧化性,而小于Cl2和
Fe3+的氧化性(也可等于Fe3+的氧化性)。由①知氧化性:Fe3+>I2,还原性:I-
>Fe2+;由②知氧化性:Cl2>Fe3+,还原性:Fe2+>Cl-;由③知氧化性:MnO
A.+2
B.+3
C.+4
D.+5
返回导航
衡中金榜 大一轮复习 · 化学
[解析] 题目中指出被还原的物质是Cr,则得电子的物质必是K2Cr2O7,失 电子的物质一定是Na2SO3,其中S元素的化合价从+4→+6;而Cr元素的化合价 将从+6→+n(设化合价为+n)。根据氧化还原反应中得失电子守恒规律,有0.05 mol·L-1×0.024 L×(6-4)=0.02 mol·L-1×0.020 L×2×(6-n),解得n=3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
——
一.重基础,重主干,重细节
NA有关过氧化物考查---2015四川卷5题 研 究 篇 明 确 方 向
• 5 、设 NA 为阿伏加德罗常数的值,下列说法 正确的是( A) • A、2.0gH218O与D2O的混合物中所含中子数为 NA • B 、常温常压下 4.4g 乙醛所含 σ 键数目为 0.7NA • C 、标准状况下, 5.6LCO2 与足量 Na2O2 反应 转移的电子数为0.5 NA • D 、 50ml 12mol/L 盐酸与足量 MnO2 共热,转 10 移的电子数为0.3NA
11
——
一.重基础,重主干,重细节
NA有关重水的考查
研 究 篇 明 确 方 向
12
——
一.重基础,重Βιβλιοθήκη 干,重细节NA有关重水的考查
研 究 篇 明 确 方 向
【2015四川理综化学】设NA为阿伏加德罗常数的 值,下列说法正确的是( A ) A.2.0gH218O与D2O的混合物中所含中子数为NA B.常温常压下,4.4g乙醛所含σ键数目为0.7NA C.标准状况下,5.6LCO2与足量Na2O2反应转移 的电子数为0.5 NA D.50ml 12mol/L盐酸与足量MnO2共热,转移的 电子数为0.3NA
选项 A. B. 实验 现象 结论
将稀硝酸加入过量铁粉中, 有气体生成,溶液 稀硝酸将Fe氧化 充分反应后滴加KSCN溶液 呈血红色 为Fe3+ 将铜粉加1.0 mol· L-1 Fe2(SO4)3溶液中 溶液变蓝、有黑色 金属铁比铜活泼 固体出现 熔化后的液态铝滴 金属铝的熔点较 落下来 低
——
用坩埚钳夹住一小块用砂 C. 纸仔细打磨过的铝箔在酒 精灯上加热
明 确 方 向 科 学 备 考 和 谐 共 赢
衡水中学 2016高考化学一轮复习 备考研讨会
明确方向 科学备考 和谐共赢
河北衡水中学——苏玉钗
1
明 确 方 向 科 学 备 考 和 谐 共 赢
交流内容
第一部分 研究篇——明确方向 第二部分 策略篇——科学备考 第三部分 协作篇——和谐共赢
2
明 确 方 向 科 学 备 考 和 谐 共 赢
重主干
重细节
7
一.重基础,重主干,重细节
研 究 篇 明 确 方 向
1.重基础点 多省份重复考 查同一基础点
——
8
一.重基础,重主干,重细节
研 究 篇 明 确 方 向 NA有关过氧化物考查---2015新课标一卷8题
8.NA为阿伏伽德罗常数的值。下列说法正确的是 ( C ) A.18gD2O和18gH2O中含有的质子数均为10NA B.2L0.5mol/L亚硫酸溶液中含有的H+两种数为2NA C.过氧化钠与水反应时,生成0.1mol氧气转移的 电子数为0.2NA D.密闭容器中2molNO与1molO2充分反应,产物的 分子数为2NA
——
一.重基础,重主干,重细节
NA有关过氧化物考查---2015江苏卷11题 研 究 篇 明 确 方 向 • 11.下列说法正确的是( C ) • A. 若 H2O2 分解产生 1molO2, 理论上转移的电 子数约为4×6.02×1023 • B. 室温下, pH=3 的 CH3COOH 溶液与 pH=11 的 NaOH溶液等体积混合,溶液pH>7 • C. 钢铁水闸可用牺牲阳极或外加电流的阴 极保护法防止其腐蚀 • D. 一定条件下反应 N2 + 3H2 2NH3 达到平衡 时,3v正(H2)=2v逆(NH3)
①中物 选项 质 A. 稀盐酸 ②中物质 碳酸钠与氢氧化钠 的混合溶液 用砂纸打磨过的铝 条 浓氢氧化钠溶液 高锰酸钾酸性溶液 预测②中的现象 立即产生气泡
B. 浓硝酸
氯化铝 C. 溶液
产生红棕色气体
产生大量白色沉 淀 溶液逐渐褪色
20
草酸溶 D. 液
14
——
一.重基础,重主干,重细节
研 究 篇 明 确 方 向
2.重基础实验
——
图 表
15
一.重基础,重主干,重细节
研 究 篇 明 确 方 向
16
2015重庆4. 下列实验中,所使用的装置(夹持装置略)、试剂和操作 方法都正确的是( A )
——
一.重基础,重主干,重细节
研 究 篇 明 确 方 向
17
2015安徽8 下列有关实验的选项正确的是( B )
——
一.重基础,重主干,重细节
研 究 篇 明 确 方 向
18
2015四川3. 下列操作或装置能达到实验目的的是( C )
——
一.重基础,重主干,重细节
研 究 篇 明 确 方 向
【2015新课标Ⅰ卷理综化学】下列实验中,对应的现象以 及结论都正确且两者具有因果关系的是( )
4
明 确 方 向 科 学 备 考 和 谐 共 赢
研究哪些省份的考题 ?
全国一卷 全国二卷 是基础和必需.
其它省份的考题 是重要的参考和参照.
5
考题分析
研 究 篇 明 确 方 向 一.重基础,重主干,重细节 二.重能力 三. 不回避同一内容,不回避以往考题
——
6
研 究 篇 明 确 方 向
——
重基础
13
——
一.重基础,重主干,重细节
NA有关重水的考查
研 究 篇 明 确 方 向 【2015海南化学】下列指定微粒的数目相等 的是( BD )
A.等物质的量的水与重水含有的中子数 B.等质量的乙烯和丙烯中含有的共用电子对数 C.同温、同压同体积的CO和NO含有的质子数 D.等物质的量的铁和铝分别于足量氯气完全反 应时转移的电子数
第一部分
研究篇——明确方向
高 考 题
教材和考纲的 结合结晶, 备考范围的最 小缩影,
直接体现了 我们的备考 方向
3
明 确 方 向 科 学 备 考 和 谐 共 赢
回顾新课标卷的发展过程:
• 全国新课标卷源自于自07年就开始新课标 高考的宁夏卷。 • 10年宁夏新课标卷改为全国新课标卷 • 12年河北第一次使用全国新课标卷 • 13年出现新课标一卷和新课标二卷。
将0.1mol· L-1MgSO4溶液 Cu(OH)2的溶度 滴入NaOH溶液至不再有沉 先有白色沉淀生成 D. 积比Mg(OH)2的 淀产生,再滴加0.1mol· L- 后变为浅蓝色沉淀 小 1CuSO 溶液 4 19
一.重基础,重主干,重细节
【2015新课标Ⅱ卷理综化学】用右图所示装置进行 下列实验:将①中溶液滴入②中,预测的现象与实 际相符的是( )
