以物质的量为核心的相关计算【解析版】
(完整版)以物质的量为中心的综合计算含答案

以物质的量为中心的综合计算差量法的类型及应用(1)质量差法1.为了检验某含有NaHCO 3杂质的Na 2CO 3样品的纯度,现将w 1 g 样品加热至质量不再减少,其质量变为w 2 g ,则该样品的纯度(质量分数)是( )。
A.84w 2-53w 131w 1 B.84(w 1-w 2)31w 1 C.73w 2-42w 131w 1 D.115w 2-84w 131w 12.(1)把过量的铁粉投入到CuCl 2和FeCl 3组成的混合溶液中,充分反应后,过滤清洗并干燥不溶物,称得其质量与加入铁粉的质量相同,求原混合物中两种溶质的物质的量之比。
(2)向50gFeCl3溶液中投入一定量的钠,待反应完毕后,过滤,得到仍有黄色的溶液45.9g ,则投入 钠的质量为( )A.4.6gB.4.1gC.6.9gD.9.2g(2)体积差法3.一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )。
A .16.7%B .20.0%C .80.0%D .83.3%4.在一定的温度、压强下,向100 mL CH 4和Ar 的混合气体中通入400 mL O 2,点燃使其完全反应,最后在相同条件下得到干燥气体460 mL ,则反应前混合气体中CH 4和Ar 的物质的量之比( )。
A .1∶4B .1∶3C .1∶2D .1∶15.白色固体PCl 5受热即挥发并发生分解:PCl 5(g)PCl 3(g)+Cl 2(g)。
现将5.84 g PCl 5装入2.05 L 真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa ,经计算可知平衡时容器内混合气体的物质的量为0.05 mol ,求平衡时PCl 5的分解率。
关系式法6.取KI 溶液25 mL ,向其中滴加0.4 mol·L-1的FeCl 3溶液135 mL ,I -完全反应生成I 2:2I -+2Fe 3+===I 2+2Fe 2+。
高考化学考点微专题02 以物质的量为中心的计算(解析版)
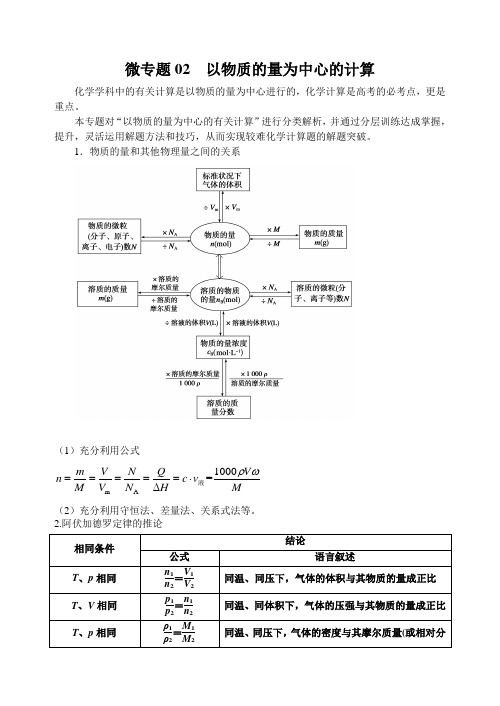
微专题02 以物质的量为中心的计算化学学科中的有关计算是以物质的量为中心进行的,化学计算是高考的必考点,更是重点。
本专题对“以物质的量为中心的有关计算”进行分类解析,并通过分层训练达成掌握,提升,灵活运用解题方法和技巧,从而实现较难化学计算题的解题突破。
1.物质的量和其他物理量之间的关系(1)充分利用公式m A 1000=m V N Q V n c v M V N H Mρω=====⋅∆液 (2)充分利用守恒法、差量法、关系式法等。
2.阿伏加德罗定律的推论 相同条件结论 公式 语言叙述 T 、p 相同n 1n 2=V 1V 2 同温、同压下,气体的体积与其物质的量成正比 T 、V 相同p 1p 2=n 1n 2 同温、同体积下,气体的压强与其物质的量成正比 T 、p 相同 ρ1ρ2=M 1M 2 同温、同压下,气体的密度与其摩尔质量(或相对分3.解题要点(1)对气体来说,在解题时要特别注意气体所处的外界条件,因温度、压强不同,气体体积不同,注意运用阿伏加德罗定律的推论。
当涉及NO2气体时,还要考虑2NO 2N 2O 4的转化。
(2)对于混合物中各物质进行分析,既要考虑反应,还要考虑反应进行的程度和过量问题。
(3)影响因素:V m 的数值不是固定不变的,它决定于气体所处的温度和压强。
一、与物质的量有关的计算1.根据AN n N =进行相关的计算 【典例精析】下列叙述不正确的是A .1molH 2O 的质量为18g/molB .N A 个H 2SO 4分子的质量与H 3PO 4的摩尔质量在数值上相等C .3.01×1023个SO 2分子的质量为32gD .18gNH 4+含有电子数为10N A【答案】A【解析】A .1molH 2O 的质量为18g ,故A 错误;B .N A 个H 2SO 4分子的质量为98g ,H 3PO 4的摩尔质量为98g/mol ,两者在数值上相等,故B 正确;C .3.01×1023个SO 2分子的物质的量为23233.01106.0210⨯⨯=0.5mol ,质量为0.5mol×64g/mol=32g ,故C 正确;D .18gNH 4+的物质的量为1mol ,1个NH 4+中有10个电子,则1mol NH 4+中含有电子数为10N A ,故D 正确;【基础题】1.(2021学年广西象州县高一月考)1.6g 物质中含有3.01×1022个分子,该物质的相对分子量是A .16B .16gC .32D .32g/mol【答案】C【解析】 1.6g 物质中含有3.01×1022个分子,则其物质的量为22233.01106.0210⨯⨯mol=0.05mol ,所以摩尔质量为 1.6g 0.05mol=32g/mol ,则相对分子质量为32; 故答案为C 。
以物质的量为中心的计算

6.
根据m=ρV计算氯化((Mg2+)计算镁离子质量,再
根据
计算镁离子的物质的量,根据电荷守恒
氯化镁溶液中n(Cl-)=2n(Mg2+) 故选D
第8题:体积为V、密度为ρ的某溶液中,含有摩尔质 量为M的溶质mg。若此溶液中溶质的物质的量浓度 为c,溶质的质量分数为ω,则下列各表达式中正确 的是()
第7题:实验是解决化学问题的基本途径,下列有关 实验的叙述不正确的是( ) A. 240mL0.2mol⋅L−1的NaCl溶液配制:需要使用天 平、250mL容量瓶等仪器 B. 向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可 制备Fe(OH)3胶体 C. 将10mL18.4mol⋅L−1的浓硫酸加水稀释至1L,稀释 后溶液中H2SO4的物质的量浓度为0.184mol⋅L−1 D. 用苯萃取碘水中的碘时,萃取后的油层不能从分 液漏斗下端放出
D. 球和B球同理, CO由2原子组成,但 CO2由3原子组 成,所以不一定和 气球原子数相等,故D错误。
正确答案:C
第2题:人造空气(氧气 与氦气 的混合气)可用于
减轻某些病痛或供深水潜水员使用。在标准状况下
,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的
质量比是( )
A. 1:1 B. 1:4 C. 2:1 D. 2:3
【解析】
由题意知5.6L气体的物质的量为
设其中含氧气的物质的量为x,氦气的物质的量是y
则,
解得
其质量之比
故选:C。
第3题胞嘧啶是DNA水解产物之一,是精细化工的重要 中间体,胞嘧啶可由5−巯基甲脲嘧啶、浓氨水和氯乙酸 在一定条件下合成,如下图,则反应时NH3和5−巯基甲脲 嘧啶的物质的量之比为( )
微题型10 以物质的量为中心的计算(解析版)

微题型10 以物质的量为中心的计算时间:30分钟 1.下列各组物质中含氧原子的物质的量相同的是A .9.6 g O 2和5.4 g H 2OB .0.1 mol H 2SO 4和3.6 g H 2OC .0.1 mol MgSO 4·7H 2O 和0.1 mol C 12H 22O 11(蔗糖)D .6.02×1023个CO 2与0.1 mol KMnO 4【答案】C【详解】A .n(O)分别为0.6 mol 和0.3 mol ,错误;B .0.1 mol H 2SO 4中,n(O)=0.4 mol ,3.6 g H 2O 中n(O)= 3.6g 18g/mol×1=0.2 mol ,错误; C .0.1 mol MgSO 4·7H 2O 中,n(O)为1.1 mol ,0.1 mol C 12H 22O 11中,n(O)也为1.1 mol ,正确;D .6.02×1023个CO 2中,n(O)=23A 6.0210N ×2=2 mol , 0.1 mol KMnO 4中n(O)=0.4 mol ,D 错误。
故选C 。
2.下列说法正确的是A .同温同压下,N 2和CO 2的密度相同B .质量相同的H 2O 和CO 2所含的原子数相同C .物质的量相同的CH 3CH 2OH 和CH 3CHO 所含共价键数相同D .室温下,pH 相同的盐酸和硝酸中,溶质的物质的量浓度相同【答案】D【详解】A .同温同压下,N 2和CO 2的体积相同时,物质的量相同,其质量之比为28∶44,则密度之比为28∶44,不相同,A 说法错误;B .质量相同的H 2O 和CO 2的物质的量之比为44∶18,分子中均含有3个原子,则所含的原子数之比为44∶18,不相同,B 说法错误;C .CH 3CH 2OH 分子中含共价键数为8条,CH 3CHO 分子中含共价键数为7条,则物质的量相同的CH 3CH 2OH 和CH 3CHO 所含共价键数不相同,C 说法错误;D .室温下,pH 相同的盐酸和硝酸中,氢离子的浓度相等,硝酸和盐酸均是一元强酸,能完全电离出一个H +,故pH 相同的盐酸和硝酸的物质的量浓度相同,D 说法正确; 故答案选D 。
【人教版】高中化学必修第一册第三章 拓展与归类-专题研析以物质的量为中心的化学计算

①n=M
m g·
g mol-1
=Mm
mol;
②所含原子总数为M
m g·
g mol-1
×NA
mol-1×2=2mMNA ;
③V=M
m g·
g mol-1
×22.4 L·
mol-1=22M.4m
L。
(3)由Mm
=V(Vmg)
可知,M=1.6
g×22.4 0.56
L·mol-1 L
=64 g· mol-1。
(4)假设溶液质量 100 g,则含有溶质 NaOH 的质量是 14 g,
则 14%的 NaOH 溶液的物质的量浓度
c=100
14 g÷40 g·mol-1 g÷1.14×10-3 g·L-1
≈4.0
mol·L-1;
从瓶中取出 20 mL 该溶液中含有溶质
的质量为 m=4.0 mol·L-1×20×10-3 L×40 g· mol-1
=3.2 g。故 A 正确。
例2把6.5 g Zn放入足量盐酸中,锌完全反应。 计算:
(1)6.5 g Zn的物质的量。 (2)参加反应的HCl的物质的量。 (3)生成H2的体积(标准状况)。 答:(1)0.1 mol (2)0.2 mol (3)2.24 L
【解析】(1)Zn 的摩尔质量是 65 g·mol-1。
m ①该气体的物质的量为__M_____ mol。
2mNA ②该气体所含原子总数为__M_____个。
22.4m ③该气体在标准状况下的体积为__M_______L。
(2)如果a g某气体中含有的分子数为b,则c g该气体在标准状
22.4bc 况下的体积是___a_N__A_______L。 (3)标准状况下,1.6 g某气态氧化物RO2的体积为0.56 L。该气 体的摩尔质量是___6_4_g_·_m_o_l_-_1___。 (4)如图是实验室配制好的两瓶NaOH溶液的标签(14%的 NaOH溶液的密度为1.14 g·cm-3)。
高考化学二轮专题复习30个考点 第六版块 化学计算 考点28 以物质的量为中心的计算(含解析)(20

高考化学二轮专题复习30个考点第六版块化学计算考点28 以物质的量为中心的计算(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高考化学二轮专题复习30个考点第六版块化学计算考点28 以物质的量为中心的计算(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高考化学二轮专题复习30个考点第六版块化学计算考点28 以物质的量为中心的计算(含解析)的全部内容。
考点28 以物质的量为中心的计算【考点28】以物质的量为中心的计算 物质的量及气体摩尔体积的计算附:常用公式: (1)n =A N N n =Mmn =m V V n =1molL 22.4-⋅V(标准状况) n =c ·V n =M ρV ω⋅⋅ (2)M =n mm =M ·nV =ρm V m =n V cB =VnBc 1V 1=c 2V 2 (浓溶液稀释)附:式量关系28CO 30 NO 46 NO 2 N 2 C 2H 6 C 2H 5OH C 2H 4HCHOHCOOH44CO 2 78 C 6H 6 100 CaCO 3 N 2O Na 2O 2 KHCO 3 C 3H 8 Na 2S Mg 3N 2CH 3CHOAl (OH )3120FeS 2 32 O 2NaHSO 4CH 3OHCaSO3/KHSO3N2H4MgSO4【考点29】相对原子质量、相对分子质量及确定化学式的计算物质的量是连接宏观和微观的桥梁,与它相关联的化学计量有较多:阿佛加德罗常数、微粒数、相对分子质量、体积、质量、密度、浓度、反应热。
化学计量在化学计算中得到广泛的运用。
高中化学 考点过关(上)考点2 以物质的量为中心的化学

考点过关(上)考点2 以物质的量为中心的化学计算在初中化学计算中仅仅涉及物质质量的计算,而高中的计算除了涉及物质的质量,还涉及物质的量、气体体积、溶液体积、溶质物质的量浓度、多步反应的计算等。
“物质的量”是国际单位制7个基本物理量之一,是中学化学教学内容的重要组成部分,是化学计算的基础,是学生思维转变的重要支撑点,对高中阶段的化学学习起着至关重要的作用。
以“物质的量”为中心的基本概念和有关计算,贯穿于高中化学的始终,是化学计算的基础和核心。
“物质的量”是宏观与微观之间连接的桥梁,把微观粒子数目和宏观的质量、气体体积等联系起来,大大方便了对物质的定量计算和分析。
物质的量与其他化学常用计量间的相互求算,是重要的基本化学计算。
其解题关键是熟练掌握下列恒等式:n =m M =V g V m =N N A=c·V(aq),式中n 为物质的量,单位为mol ;m 为物质的质量,单位为g ;M 为摩尔质量,单位为g·mol -1;V(g)为气体体积,单位为L ;V m 为标准状况下气体摩尔体积,单位为L·mol -1;N 为粒子个数;N A 为阿伏加德罗常数;c 为物质的量浓度,单位为mol·L -1;V(aq)为溶液体积,单位为L 。
【例1】(1)某双原子分子构成的气体,其摩尔质量为Mg·mol -1,该气体的质量为mg ,阿伏加德罗常数为N A ,则:①该气体在标准状况下的体积为L ;②该气体在标准状况下的密度为g·L -1;③该气体所含的原子总数为个;④该气体一个分子的质量为g 。
(2)如果ag 某气体中含有的分子数为b ,则cg 该气体在标准状况下的体积是。
(3)标准状况下,1.6g 某气态氧化物RO 2的体积为0.56L 。
该气体的摩尔质量是。
【解析】(1)根据n =m M =V g V m =N N A 及ρ=m V 等公式进行计算。
①V=m g M g·mol -1×22.4 L·mol -1=22.4m ML ;②ρ=m V =M V m =M g·mol -122.4 L·mol -1=M 22.4g·L -1;③N=m M ·N A ,则所含原子总数为m g M g·mol -1×N A mol -1×2=2mN A M;④一个分子的质量为M g·mol -1N A mol -1=M N A g 。
考点07 以物质的量为中心的多角度计算-高考化学二轮复习专题练(通用版) (解析版)

考点07 以物质的量为中心的多角度计算1.以物质的量为中心的各物理量的换算关系2.与物质的量浓度有关的五个公式c=nV,n=mM=VV m,ρ=m溶液V溶液,w=m溶质m溶液×100%,c=1 000ρwM。
每个公式中均可“知二求一”。
3.三个守恒应用考点导航一轮回顾:强基固本专题二化学常用计量1.必须掌握的“四”个定义式c =n /V ,n =m /M =V /V m ,ρ=m (溶液)/V (溶液),w =m (溶质)m (溶液)×100%。
每个公式中均可“知二求一”。
2.熟练推导“三”种换算关系(1)物质的量浓度与溶质质量分数之间的换算 c =n V =m /M V =m (aq)w MV =1 000ρw M ,w =cM 1 000ρ 。
(ρ:g·cm -3) (2)物质的量浓度与溶解度(S )的换算(饱和溶液) c =n V =S /M 100+S 1 000ρ= 1 000ρS M (100+S ),S =100cM 1 000ρ-cM 。
(ρ:g·cm -3) (3)气体溶质溶于水中制得溶液,其物质的量浓度和质量分数的计算 在标准状况下,1 L 水中溶解某气体V L ,所得溶液密度为ρ,则:c =nV=V /22.41 000×1+V22.4×M1 000ρ= 1 000ρV 22 400+MV (ρ:g·cm -3),w =m (溶质)m (溶液)×100%=V 22.4×M 1 000×1+V 22.4×M=MV 22 400+MV×100%。
3.灵活利用“三”个守恒关系(1)稀释前后“溶质的物质的量守恒”:c (浓溶液)·V (浓溶液)=c (稀溶液)·V (稀溶液)。
(2)溶液中“粒子之间电荷守恒”(溶液呈电中性)。
(3)质量守恒:反应前后同种原子的质量相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
以物质的量为核心的相关计算(解析版)一、单选题(本大题共28小题,每题3分,共84分)1.N A代表阿伏加德罗常数的值。
下列说法正确的是( )A.100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目为0.1N AB.pH=1的H3PO4溶液中,含有0.1N A个H+C.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2N AD.1 L 0.1 mol·L-1的NaHCO3溶液中H2CO3、HCO-3和CO2-3粒子数之和为0.1N A【解析】解答此类题,首先看能否套用cV=n公式,求其电解质的物质的量,再根据强、弱电解质的性质及水解的相关情况求题目具体要求的相关粒子数。
套用公式可计算FeCl3的物质的量为0.1N A,又因FeCl3为强酸弱碱盐,存在水解平衡:Fe3++3H2O Fe(OH)3+3H+,故含有Fe3+的数目小于0.1N A,A项错误;由于H3PO4溶液的体积未知,无法套用公式求其H+的数目,B项错误;套用公式可计算亚硫酸的物质的量为1 mol,但由于亚硫酸为弱酸,仅电离出部分H+,故H+数小于2N A,C项错误;套用公式可计算n(NaHCO3)=0.1 mol,再根据物料守恒知,H2CO3、HCO-3和CO2-3粒子数之和为0.1N A,D项正确。
2. N A代表阿伏伽德罗常数的值,下列叙述正确的是( )A.标准状况下,11.2 L气体氘气(D2)中含有0.5N A个中子B.1 L 0.1 mol·L-1醋酸溶液中含有0.1N A个氢离子C.电解精炼铜时,若电路中转移0.2N A个电子,则阳极质量一定减少6.4 gD.NO2和H2O反应每生成2 mol HNO3时被还原的NO2分子数为N A个【解析】]1 mol D2中含有2 mol中子,标准状况下,11.2 L气体D2中含有N A个中子,A项错误;醋酸为弱电解质,部分电离,1 L 0.1 mol·L-1醋酸溶液中含氢离子数目远小于0.1N A,B项错误;电解精炼铜时,因阳极有杂质不断溶解,所以电路中转移0.2N A个电子时,阳极质量减少不一定为6.4 g,C项错误;3 mol NO2和1 molH2O反应生成2 mol HNO3和1 mol NO,通过分析化合价变化可知起还原作用的NO2为2 mol,被氧化生成硝酸,起氧化作用的NO2为1 mol,被还原生成一氧化氮,所以被还原的NO2为1 mol,分子数为N A,D项正确。
3.阿伏加德罗常数的值为N A。
下列说法正确的是()A.1L0.1mol·1L-NH4Cl溶液中,4NH+的数量为0.1N AB.2.4gMg与H2SO4完全反应,转移的电子数为0.1 N AC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 N AD.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 N A【解析】A、NH4+是弱碱根离子,发生水解:NH4++H2O NH3·H2O+H+,因此NH4+数量小于0.1NA,故A错误;B、2.4gMg为0.1mol,与硫酸完全反应后转移的电子的物质的量为2.4×2/24mol=0.2mol,因此转移电子数为为0.2N A,故B错误;C、N2和O2都是分子组成,标准状况下,2.24L任何气体所含有的分子数都为0.1N A,故C错误;D、H2+I22HI,反应前后系数之和相等,即反应后分子总物质的量仍为0.2mol,分子数为0.2NA,故D正确。
4.由C16O和C18O组成的气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是( )A.气体中C16O与C18O的分子数之比为14∶15B.气体中C16O与C18O的物质的量之比为1∶1C.气体中C16O与C18O的质量之比为15∶14D.气体中C16O与C18O的密度之比为1∶1【解析】:选B C16O的相对分子质量为28,C18O的相对分子质量为30,它们的平均相对分子质量为29,利用十字交叉法求出气体中二者的物质的量之比为1∶1。
A项,分子数之比应为1∶1;B项正确;C项,质量之比应为28∶30=14∶15;D项,同温、同压下气体密度与摩尔质量成正比,应为28∶30=14∶15。
5.N A为阿伏伽德罗常数的值,下列说法正确的是 ( )A.30 g丙醇中存在的共价键总数为5N AB.密闭容器中2 mol NO与1 mol O2充分反应,转移的电子数为2N AC.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子总数为2N AD.2.8 g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6N A【解析】30 g丙醇的物质的量为0.5 mol,而1 mol丙醇中含11 mol共价键,故30 g丙醇中存在的共价键总数为5.5N A,A项错误;NO与氧气反应生成二氧化氮,N 化合价变化为2,即转移电子数是4N A,B项错误;常温常压下,22.4 L氯气的物质的量小于1 mol,转移电子数小于2N A,C项错误;2.8 g乙烯和环丁烷的最简式均为CH2,混合物中含有0.2 mol CH2,故含有0.2 mol碳原子,混合气体中含有的原子总数为0.6N A,故D项正确。
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,22.4L四氯化碳分子数为NAB.常温下,16gO2和O3组成的混合气体中所含有的原子数为NAC.常温下,1mol/L的AlCl3溶液中含有的Cl-离子数为3NAD.18gNH4+离子中所含的电子总数为12NA【解析】A.标况下,四氯化碳为液体,不能使用气体摩尔体积,选项A错误;B.氧气和臭氧均是由氧元素形成的不同单质,则常温下,16gO2和O3的混合气体中氧原子的物质的量是16g16g/mol=1mol,含有的氧原子数为NA,选项B正确;C.由n=cV可知,计算溶质的物质的量还需知道溶液的体积,则体积未知,无法计算Cl- 个数,选项C错误;D.18g铵根离子的物质的量为1mol,1mol铵根离子中含有10mol电子,所含的电子总数为10NA,选项D错误。
7.设N A为阿伏加德罗常数的数值,下列说法正确的是()A.常温常压下,8 g O2含有4N A个电子B.1 L 0.1 mol·L-1的氨水中有0.1 N A个NH4+C.标准状况下,22.4 L盐酸含有N A个HCl分子D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A【解析】选A。
8 g O2的物质的量是0.25 mol,1 mol O2含有16 mol电子,8 g O2含有的电子的物质的量是0.25 mol×16=4 mol,A正确;氨水中存在:NH3·H2ONH4++OH-,NH4+的数目小于0.1NA,B错误;标准状况下盐酸是HCl的水溶液,且盐酸是强酸,完全电离,无HCl分子存在,C错误;不是标准状况下,D错误。
8.设N A代表阿伏伽德罗常数的数值。
则下列有关叙述正确的是( )A.1 mol FeI2与足量氯气反应时转移的电子数为2N AB.在1 L 0.1 mol·L-1的Na2CO3溶液中,阴离子总数小于0.1N AC.7.8 g过氧化钠用于呼吸面具中完全反应时转移电子总数为0.1N AD.将1 L 2 mol·L-1的FeCl3溶液加入沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2N A【解析】]1 mol FeI2与足量氯气反应时Fe2+和I-都要被氧化,转移的电子数为3N A,A错误;碳酸钠属于能够水解的盐,水解后阴离子总数增多,B错误;7.8 g过氧化钠的物质的量为0.1 mol,用于呼吸面具中完全反应时过氧化钠既是氧化剂,又是还原剂,转移电子总数为0.1N A,C正确;胶体中的粒子是多个简单粒子的聚合体,将1 L 2 mol·L-1的FeCl3溶液加入沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数少于2N A,D错误。
9.家用管道煤气的主要成分是CO、H2、CH4,取1 L管道煤气充分燃烧需要同温同压下的空气5 L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能是( )A.1∶1∶1 B.1∶1∶2 C.2∶4∶3 D.1∶3∶2【解析】:发生反应:2CO+O2=====点燃2CO2,2H2+O2=====点燃2H2O;CH4+2O2=====点燃CO2+2H2O,由方程式可知,2V(CH4)+0.5V(CO+H2)=5 L×20%,则2V(CH4)+0.5V(CO+H2)=5 L×20%;V(CH4)+V(CO+H2)=1 L,解得V(CH4)=1/3,V(CO+H2)=2/3,故满足V(CO+H2)∶V(CH4)=2∶1即可,故不可能为B。
10.设NA代表阿伏加德罗常数的值,N表示粒子数。
下列叙述正确的是()A.在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NAB.将1mol Cl2通入水中,则N(HClO)+N(Cl−)+N(ClO−)=2NAC .将CO 2通过Na 2O 2使其质量增加a g 时,反应转移的电子数为aN A /14D .3.0g 含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4N A【解析】A. 在标准状况下,CCl 4是液体,2.24LCCl 4的物质的量远大于0.1mol ,C —Cl 键数远大于0.4N A ,故A 错误;B. 氯气与水反应可逆,将1mol Cl 2通入水中,则N(HClO)+N(Cl −)+N(ClO −)<2N A ,故B 错误;C. 将CO 2通过Na 2O 2使其质量增加a g 时,参加反应的Na 2O 2的物质的量是xmol 。
则2CO 2+2Na 2O 2= 2Na 2CO 3+O 2 △m 2mol 56g xmol ag256mol gxmol ag= x=28a ,反应转移的电子数为28A aN ,故C 错误;D.甲醛、冰醋酸的最简式都是CH 2O ,3.0g 含甲醛(HCHO)的冰醋酸中含有的原子总数为3/430/⨯⨯=A gN g mo mol l 0.4N A ,故D 正确。
11.N A 表示阿伏加德罗常数的值。
下列说法不正确的是 ( ) A.标准状况下,22.4 L 氩气中含有的原子数约为N A B.44 g CO 2、N 2O 组成的混合气体中所含有的原子数为3N A C.标准状况下,22.4 L H 2O 所含原子个数大于3N A D.分子数为N A 的CO 和C 2H 4混合气体的体积约为22.4 L【解析】选D 。
