《二氧化碳和一氧化碳》PPT教案 (同课异构)2022年人教版化学五四制 (2)
二氧化碳和一氧化碳ppt课件

随堂练习
4.对比是学习化学的重要方法。下列关于 CO2 与 CO 的比较中错误的是 ( C )
A.CO2 可用于灭火,CO可用作燃料 B.CO2 能溶于水,CO难溶于水 C.CO2可用于光合作用,CO可用于人工降雨 D.CO2 会造成温室效应,CO易与血液中的血红
蛋白结合引起中毒
? 生成CaC污O染3 空气
CO2+Ca(OH)变2 浑浊CaCO3↓+H2O
你观察到什么现象?生成了什么物质?能写出化学方程式吗?
一氧化碳的性质
CO+CuO △ Cu+CO2
化学 性质
还原性
你能3C写O出+FCeO2O与3 高氧温化铁2F反e+应3C的O化2 学方程式吗?
知识小结
物理 一 性质 氧 化 碳 化学
性质
1.无色、无味的气体 2.难溶于水
1.毒性 2.可燃性:2CO+O2点燃2CO2
3.还原性:CO+CuO △ Cu+CO2
知识延伸:一氧化碳的用途
作燃料
冶炼金属
1.毒性 2.可燃性:2CO+O2点燃2CO2
性质决定用途,你能3.还说原出性一:氧CO化+碳Cu有O 哪△些Cu用+C途O吗2 ?
知识延伸:一氧化碳与二氧化碳
随堂练习
5.将 N2,CO 和 CO2的混合气体先通入足量的石灰 水中,再通过足量灼热的氧化铜后冷却到室温,剩
余气体是 ( D )
A.CO
B.CO 和 N2
C.N2
D.CO2 和 N2
随堂练习
6.写出除去下列物质中所含杂质所采用的方法以 及化学方程式。 (1)CO中混有少量的CO2
二氧化碳和一氧化碳ppt课件

课堂检测
4.[2020 苏州]利用如图所示实验装置模拟工业炼铁。下列说
法正确的是( C )
6.3 二氧化碳和一氧化碳
A.实验时应先点燃酒精灯后通 CO B.充分加热,a 处固体由黑色变为红色 C.b 处可用澄清石灰水检验生成的 CO2 D.可用 NaOH 溶液吸收尾气中的 CO
课堂检测
6.3 二氧化碳和一氧化碳
课本精讲
课本第 117 页
6.3 二氧化碳和一氧化碳
课本精讲
观察二氧化碳与一氧化碳的分子区别在哪里?
二氧化碳分子
一氧化碳分子
课本第 117 页
6.3 二氧化碳和一氧化碳
碳的氧化物有二氧化碳和一氧化碳两种
1个CO2分子比1个CO分子多1个氧原子
这就使得它们的性质有很大不同
课本精讲
课本第 117 页
全球变暖已使人类的使生海存平环面境升遭高受严重的威胁。 淹没部分沿海城市
全球变暖将可能: 使土地沙漠化 造成农业减产
引起暴雨、洪水
课本第 121 页
6.3 二氧化碳和一氧化碳
“人类只有一个地球!”
防止温室效应进一步增强
根本对策是全球参与控制二氧化碳的排放量
世界各国签订国际公约 《联合国气候变化框架公约》 《京都议定书》 《哥本哈根协议》
课本精讲
课本第
页
6.3 二氧化碳和一氧化碳
一氧化碳极易与血液中的血红 蛋白结合,从而使血红蛋白不 能再与氧气结合,造成生物体 内缺氧,严重时会危及生命。
鲜红的动脉血变为暗红。
课本精讲
课本第
页
一氧化碳有毒!
6.3 二氧化碳和一氧化碳
冬天用煤火取暖时,一定要装 烟囱,并且注意室内通风,防 止一氧化碳中毒。
《二氧化碳和一氧化碳》PPT课件(公开课)2022年人教版 (4)

6.我能把水变成蓝色
常见的盐:
氯化钠:调味品,融雪剂,医药等食;盐 NaCl 碳酸钙:建筑材料,补钙剂大理石,石灰石 CaCO3
碳酸钠:工业原料 侯德榜 纯碱,苏打 Na2CO3
碳酸氢钠:发酵粉,治疗胃酸过多 小苏打 NaHCO3 亚硝酸钠: NaNO2多次引起中毒事件 硫酸铜:水溶液呈蓝色;
【实验】 取四朵用石蕊溶液染成紫色的干燥的小花。第一朵小
花喷上稀醋酸,第二朵小花喷上水,第三朵小花直接放入 盛满二氧化碳的集气瓶中,第四朵小花喷上水后,再放入 盛满二氧化碳的集气瓶中,观察四朵花的颜色变化。然后 将第一朵小花和第四朵小花取出小心加热,观察现象。
[讲解]CO2与H2O能发生化学反应生 成碳酸,碳酸能使紫色的石蕊试液变成 红色。CO2+H2O H3CO3
《盐的复习》
一、教材与课标
《盐》是九年级化学下册课本第十一单元课题1的内容, 主要介绍常见的盐的组成、用途,分离提纯物质,碳酸盐 的性质及检验方法,复分解反应及其发生的条件,溶解性 表等内容。除此之外,第六、八、十、十一单元都有涉及
盐的知识,所以归纳盐的性质也是本节课的重点内容。
食盐是日常生活中最常见、最熟悉的一种盐,但把盐 等同于食盐是较常见的误解。本课题一开始通过食盐中毒 事件就提醒学生注意二者的区别,让学生体会到学习化学 知识对提高国民素质的重要性;通过对盐的用途的学习可 以进一步让学生感受到化学来源于生活,生活离不开化学。
使学生自主地获取知识。 ②探究学习:学生通过有关盐的化学反应探究盐的
性质,培养学生的分析、归纳能力。 ③合作学习:利用学生分组实验和小组讨论,使学 生在沟通中创新,在交流中发展,在合作中获得新知。
二氧化碳和一氧化碳PPT课件42(3份) 人教版1
确的是( C ) ①分别通入澄清石灰水中;②分别通过灼热的.①②③ B. ②③④ C. ①② D.②④
【课堂反馈】
【课堂反馈】
3.符合下图装置设计意图的有( C ) ①说明CO具有氧化性 ②既说明CO具有可燃性,又充分地利用了能源 ③说明CO得氧后的产物是CO2 ④有效地防止了剧毒的CO对空气的污染 A.①② B.②④ C.②③④ D.①②③④
【课堂反馈】
4.(15年襄阳)在一定条件下,一氧化碳、木炭 都能与氧化铜发生反应,下列叙述正确的B是 ()
①装置A中,盛放浓硫酸的仪器名称是 分液漏斗 ;
②收集一氧化碳时,打开a、b,关闭c,装置B的作用是
吸收CO2
。由于一氧化碳有毒,多余的气
体应 点燃或用气球收集
(填写具体处理办法);
③关闭 b 、打开 c ,释放出二氧化碳,并通过
装置 C、D 可收集到干燥的二氧化碳气体。
如图所示装置可以验证某混合气体(无色无味)是否含 有CO2和CO.
请回答下列问题:
(1)A装置中的试剂是(写名称,下同) 澄清石灰水 ,
B装置中的试剂是 氢氧化钠溶液;
A中澄清石
(2)证明原混合气体中CO2存在的实验现象是 灰水变浑浊;
证明原混合气体中CO存在的实验现象是:
C中黑色粉末变红,D中澄清石灰水变浑浊 ;
写出CO与CuO反应的方程式:
△
CO+CuO ==Cu+CO2
在一般情况下,既不 能燃烧也不能支持燃 烧
氧化性
CO2+H2O====H2CO3
《二氧化碳和一氧化碳》(共26张)PPT课件

它是什么?
一、二氧化碳的性质
1.二氧化碳的性质 物理性质:无色无味的气体,可 溶于水,密度大于空气
探究实验1 倾倒二氧化碳的实验
探索问题 1.烧杯内的蜡烛为什么会熄灭? 说明二氧化碳有什么性质? 2.为什么下层蜡烛先熄灭,上层 后熄灭? 3.据此实验说明二氧化碳有什么 性质?
知识点二、一氧化碳的性质 【典例2】下列叙述中不符合实验 设计意图的是( B ) A.说明一氧化碳具有还原性 B.说明生成物二氧化碳的密度比空气大 C.说明一氧化碳和氧化铜的反应需要加热 D.可以防止有毒的一氧化碳气体对空气的污染
2.还原性(一氧化碳还原氧化铜) 仔细观察如图实验,你观察到什么现象?
1.可燃性
注意:点燃CO和空气的混合气也能发生 爆炸!要注意安全!在点燃CO之前也要 先检验CO的纯度。也是用爆鸣法检验。
点燃
2CO+O高2温= 2CO2 C+CO2 = 2CO
点燃
C+O2 = CO2
3.一氧化碳的毒性
一氧化碳有剧毒。这是因为一氧化碳吸进 肺里很容易跟血液里的血红蛋白结合,使血红 蛋白不能很好地跟氧气结合,造成生物体缺氧。 如果吸入较多的一氧化碳,会因缺少氧气而死 亡。
阳光的能量不易散失,从而使全球变
暖,这种现象叫“温室效应”。
③防治措施
②危害 a、两极冰川融化,海平面上升。 b、气候反常,海洋风暴增多 。 c、土地干旱,沙漠化面积增大。
a、尽量减少使用化石燃料
b、利用太阳能、风能等清洁燃料
c、大力植树造林,严禁乱砍滥伐
2022人教版(五四)化学初二《二氧化碳和一氧化碳》课件.pptx

观察并填表:
现象:小花由紫变红 结论: 醋酸能使紫色石蕊变红
现象:小花没变红
结论: 水不能使
紫色石蕊 变红
现象:小花没变红 结论: CO2不能使
紫色石蕊 变红
现象: 小花由紫变红 结论: CO2与H2O反应生成碳酸,
碳酸使紫色石蕊变红
反应方程式: CO2+H2O = H CO
略加热
现象:小花由红变紫 结论: 碳酸不稳定,易分解 化学方程式:H2CO3 H2O +CO2
空气中CO2的含量/%
症状
2.5
经数小时无任何症状
3.0
无意识地呼吸次数增加
4.0
出现局部刺激症状
6.0
呼吸量增加
8.0
呼吸困难
10.0
意识不清,不久导致死亡
20.0
数秒后瘫痪,心脏停止跳动
灯火实验
山洞
在意大利那不勒斯的深山峡谷中,有一个著 名的屠狗洞,洞里有个屠狗妖,当人牵着狗进入 洞时,人安然无恙,狗却昏倒,甚至死亡。有人 说这是专门吃狗的魔鬼在作怪。
织金六中 李从菊
一、二氧化碳
1、物理性质
实验探究1:探究二氧化碳的密度比空气的大还
是比空气的小?(实验6-4)
看一看: 方案及步骤 向图示的烧杯里倾倒CO2。
实验让学生最下观层察的一蜡瓶烛已先熄经灭收,集然好后的是上CO层2,的
现象
蜡烛后熄灭
然后说出二氧CO化2碳的不颜支色持、燃状烧态也不以能及燃气烧味,
温 室 危害
效
1人、为使地因球素温使度C升O高2含,两量极升冰高川
融化,海平面升高,淹没部分沿 海城市。 2、使土地沙漠化,农业减产。
应
1、减少使用含碳燃料,更多地利
《二氧化碳和一氧化碳》PPT课件(公开课)2022年人教版 (11)

化作用下完全分解后,小明同学想回收剩余
固体中的氯化钾(可溶于水),他可以采用
溶解,过滤,蒸发
的方法;如果
他要回收二氧化锰,可以用什么方法呢?
2,我知道:
水银不是银,是汞;
干冰不是冰,是二氧化碳固体;
还有 纯碱不是碱,是盐
等。
3:夏天,汗液留在衣服上,干了后常出现 白色固体,该固体是 NaCl (填化学式)
在实际教学中,一节课要完成相应的内容。本节课内容多, 稍不注意就成了面面俱到、不能突出重点。因此,我设计了如下 教学过程:
1、图片导入新课。(展示课件)以盐田的图片引出《盐》、 食盐,通过“它们能直接食用吗?”引出粗盐提纯的步骤,让学 生思考得出此步骤是分离混合物的一种方法,并由此评价学生应 用知识解决实际问题的能力。一图多用,激发学生的学习积极性。
2、设疑过渡:盐仅仅指食盐吗?从而导入广义的盐。
这些盐可以直接食用吗? 怎样使它成为精盐? (简要步骤)
溶解,过滤,蒸发
请注意:
可溶性物质与
不溶性物质的 混合物
“溶解,过滤,蒸发”不仅能提纯 粗盐,还是分离类似混合物的方法!
思 考:
氯酸钾在二氧化锰(不溶于水)的催化作用下完全分解后,小明同学
想回收剩余固体中的氯化钾(可溶于水),他可以采用
讨论:为了使用石灰浆[Ca(OH)2]抹的墙壁快点干燥, 为什么常常需在室内生炭火盆?为什么开始放炭火 盆时,墙壁反而潮湿?
用途
灭火器
光合作用
你能说出这些用途与哪些性质相关吗?
汽水
温室效应
温室有两个特点:温度较室外高, 不散热。 生活中我们可以见到的玻璃 育花房和蔬菜大棚就是典型的温室。 使用玻璃或透明塑料薄膜来做温室, 是让太阳光能够直接照射进温室,加 热室内空气,而玻璃或透明塑料薄膜 又可以不让室内的热空气向外散发, 使室内的温度保持高于外界的状态, 以提供有利于植物快速生长的条件。
《二氧化碳和一氧化碳》PPT课件(公开课)2022年人教版 (3)

二、二氧化碳对生活和环境的影响 1.对生活的影响 (1)做灭火剂 (2)做制冷剂、人工降雨 (3)可制汽水等碳酸饮料 (4)温室肥料 2.环境的影响:温室效应
二氧化碳是学生比较熟悉的物质,它的化学性质并不难掌握。 本节课充分体现了新课标“从生活走进化学,从化学走向社会” 的教学宗旨,教学中运用了实验探究的方法,通过探究二氧化 碳的性质,从探究中发现问题、分析问题,从而提高了学生解 决问题的能力。
第2课时 一氧化碳
知识与技能 1.认识一氧化碳,了解其物理性质和化学性质以及主要用途。 2.知道一氧化碳还原氧化铜的原理以及一氧化碳使人中毒的原 因。 过程与方法 在解决问题的过程中。让学生逐步养成良好的学习习惯和学习方 法。
重点 一氧化碳的物理性质和化学性质。 难点 一氧化碳的的还原性。
二氧化碳、一氧化碳、澄清石灰水、新鲜鸡血、抗凝血 剂、氧化铜等
盐的知识,所以归纳盐的性质也是本节课的重点内容。
食盐是日常生活中最常见、最熟悉的一种盐,但把盐 等同于食盐是较常见的误解。本课题一开始通过食盐中毒 事件就提醒学生注意二者的区别,让学生体会到学习化学 知识对提高国民素质的重要性;通过对盐的用途的学习可 以进一步让学生感受到化学来源于生活,生活离不开化学。
(2)一氧化碳有剧毒 师:用煤火取暖容易发生煤气中毒,你知道中毒的原理吗? 演示实验:在试管中加入新鲜鸡血(加入抗凝血剂),然后通入 一氧化碳气体,观察血液颜色的变化。 生:通入一氧化碳后,血液由深红色变成鲜红色。 师:一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋 白不能很好地与氧气结合,造成生物体内缺氧,所以会出现上 述现象,严重时会危及生命。
CO2+C=高==温==2CO
第 2 课时 一氧化碳 一、氧化碳的性质 1.物理性质 无色无味气体 2.化学性质 (1)一氧化碳的可燃性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题3 二氧化碳和一氧化碳第一课时教学目标:认知性目标:1、了解二氧化碳的性质。
2、了解二氧化碳的用途。
技能性目标:1、熟练书写相关的化学方程式。
2、初步学会二氧化碳的制备。
体验性目标:1、通过实验探究二氧化碳的性质,学会观察、分析实验现象及实验探究的科学方法。
2、通过认识自然界中二氧化碳的循环及重要性,增强环保意识及人与自然的和谐统一意识。
3、了解并关注温室效应。
教学重点:二氧化碳的化学性质。
教学难点:实验探究二氧化碳的性质。
教学方法:分析法、讨论法、探究法、实验法。
教学用具:多媒体,二氧化碳的制取装置、相关性质所需仪器。
教师总结归纳学生的分析,用多媒体展示结论:二氧化碳和水反响生成碳酸,碳酸能使紫色石蕊试液变红色,碳酸不稳定,容易分解生成水和二氧化碳。
[来源:学_科_网]学生书写相关化学方程式:CO2+H2O=H2CO3H2CO3= H2O+ CO2↑熟练写出相应化学方程式。
提问:长期盛放石灰水的试剂瓶壁上为什么会有一层薄膜?可能是怎么来的?学生讨论:1、与二氧化碳反响。
2、与氧气反响。
3、与水反响。
并用实验探究得出与二氧化碳反响的结论。
让学生学会科学探究的实验方法并熟练写出:CO2+Ca(OH)2=CaCO3↓+H2O知道二氧化碳的鉴定方法。
多媒体展示干冰及用途,并提问:同学们根据日常生活中的经验知识和已有的化学知识,能否说出二氧化碳有哪些应用?学生思考、讨论得出:1、二氧化碳可以制汽水。
2、干冰升华吸热,可用于人工降雨。
3、二氧化碳是温室肥料。
4、二氧化碳可用来灭火等用途。
让学生了解性质决定用途的观点。
多媒体展示二氧化碳对生活和环境的影响。
学生相互交流讨论二氧化碳的功与过〔课前布置学生调查与研究〕。
培养学生关注社会和环境,关注温室效应。
学完本课题,同学们知道了什么?学生讨论归纳:二氧化碳的物理性质和化学性质及其相关用途。
反思与交流。
板书设计一、二氧化碳的性质1、物理性质颜色、状态、气味、密度、溶解性无气体无比空气大能溶于水2、化学性质〔1〕二氧化碳和水反响生成碳酸,碳酸能使紫色石蕊试液变红色CO2+H2O=H2CO3H2CO3= H2O+ CO2↑〔2〕二氧化碳和石灰水反响CO2+Ca(OH)2=CaCO3↓+H2O〔3〕在一般情况下二氧化碳不能燃烧,也不支持燃烧,不供应呼吸。
[来源:学科网]3、二氧化碳的用途〔1〕二氧化碳可以制汽水。
〔2〕干冰升华吸热,可用于人工降雨。
〔3〕二氧化碳是温室肥料。
〔4〕、二氧化碳可用来灭火等用途附:课堂练习一[来源:学|科|网Z|X|X|K]1、国外试行用“汽水〞〔碳酸饮料〕浇灌植物,它的作用是〔〕A、对植物的呼吸作用有利B、加速光合作用的进行C、在植物上形成温室D、改进土壤2、以下行为中,不属于自然界吸收二氧化碳的途径是〔〕A、江、河、湖、海溶解二氧化碳B、大森林火灾C、原始森林的光合作用D、矿物燃料的燃烧3、意大利有一“死狗洞〞,游客牵着小狗进入洞内,小狗会晕倒在地,而人却能平安出入,后来科学家波曼发现洞内湿漉漉的泥土中冒着气泡〔CO2〕,据此说明二氧化碳的性质:。
4、用实验证明二氧化碳具有以下性质:〔1〕CO2的密度比空气大。
〔2〕CO2能溶于水。
随堂检测1、判断正误,并将错误的说法加以改正。
〔1〕干冰不是冰,而是固体二氧化碳。
〔2〕盛石灰水的试剂瓶用久了瓶壁上有白色沉积物,是因为石灰水长期放置,水分蒸发干,最后氢氧化钙沉积在瓶壁上。
〔3〕物质燃烧后,都有二氧化碳生成。
〔4〕氢气与二氧化碳一样,可以从一个容器向另一个容器里倾倒。
〔5〕通常情况下,加压可以使二氧化碳在水里溶解得更多些。
2、为什么有时人走进久未开启的菜窖会突然晕倒?进入菜窖前应该怎样检验,才能防止发生这种事故?3、如何证明人呼出的气体中会有较多的二氧化碳?你对现今空气中二氧化碳的含量呈现上升趋势的客观事实,有什么看法?4、在下左图所示的密闭暗箱里,放一盆生机盎然的绿色植物,烧杯中盛有蒸留水,并悬浮着一个塑料小球,数天后,发现塑料小球漂浮在液面上,根据上述现象答复:〔1〕烧杯中发生反响的化学方程式为。
〔2〕塑料小球漂浮的原因是。
〔3〕要证明〔1〕中发生的变化,可在烧杯中滴入试剂,可观察到的现象是。
作业:1、书P120页3,6,7,8题。
2、课后完成书P119页调查与研究。
教学反思:二氧化碳使空气中的一种常见的气体,它能促进植物的光合作用,但向空气中排放过量的二氧化碳气体,导致“温室效应〞,影响生态平衡。
从而教育学生为了防止“温室效应〞的产生,你作为一名中学生应该怎样做,增强环保意识。
第二课时教学目标:认知性目标:1、了解一氧化碳的性质。
2、认识一氧化碳在冶金工业的重要用途,知道生活中一氧化碳的产生途径,致人中毒的机理及对环境的污染。
技能性目标:1、熟练书写有关化学方程式。
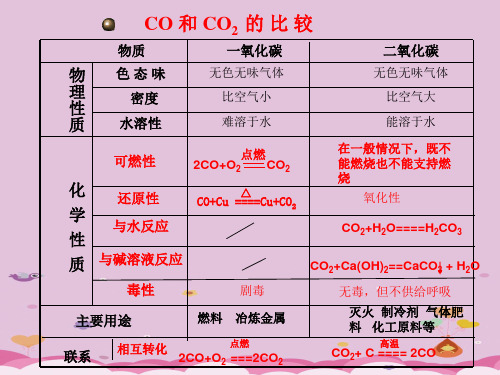
2、通过一氧化碳与二氧化碳性质比照,学习比照的学习方法。
体验性目标:1、通过全面认识一氧化碳的性质,体会任何事物的两面性。
2、通过对一氧化碳的毒性的了解及其对环境的污染,增强环境保护和自我保护意识。
教学重点:一氧化碳的化学性质。
教学难点:一氧化碳的化学性质。
教学方法:实验法、讨论法、探究法、比照学习法。
教学用具:多媒体展示台、有关实验仪器〔一氧化碳性质实验〕。
教师活动学生活动教学意图指导学生观察一氧化碳的物理性质,并要求学生学会和二氧化碳进行比照。
学生首先回忆二氧化碳的物理性质,并在教师指导下,观察一氧化碳的物理性质,比照得表格如下:CO2CO[来源:Z|xx|]颜色气味状态溶让学生了解一氧化碳的物理性质,初步学会比照学习的方法。
解性密度教师演示一氧化碳的可燃性实验即[实验6-7] 学生观察实验现象,并作出答复:能够燃烧,放出大量热,火焰呈蓝色。
化学方程式为:2CO+O2===2CO2学生学会观察实验现象,并由现象得出结论。
多媒体展示煤炉里,煤层上方、中方、下方各发生的化学反响。
学生书写各层反响的化学方程式:上方:2CO+O2===2CO2中方:C+CO2===2CO下方:C+O2===CO2熟练书写化学方程式教师演示一氧化碳的毒性实验即[实验6-8] 观察现象并归纳结论:正常血液CO 血液〔深红色〕〔鲜红色〕原因:一氧化碳及易与血液中的血红蛋白结合,从而使血红蛋白不能很好的与氧气结合,造成生物体内缺氧,一氧化碳有毒。
了解一氧化碳的中毒的事例过程。
提出讨论问题:1、在什么条件下容易发生煤气中毒?2、用煤火取暖时,应该怎样防止煤气中毒?3、煤气厂为什么常在家用煤气中掺入很少量具有难闻气味的气体?4、如发生煤气泄漏,应该怎么办?学生围绕问题,讨论、交流、汇报:1、炭在氧气不充足的条件下燃烧会产生一氧化碳,因此,在缺氧,不通风等条件易发生煤气中毒,因此,取暖时应保持通风。
2、一氧化碳无色无味,中毒不易觉察,参加有气味的气体,有利于及时发现煤气泄漏。
如发生煤气泄漏事件,应及时关闭泄漏源,保持通风等。
通过对一氧化碳的毒性了解,增强环保意识和自我保护意识。
[来源:学科网]教师演示一氧化碳的复原性实验即[实验6-9] 学生通过观察得出现象,并根据现象作出分析,填写下表现象分析[来了解一氧化碳的复原性,学会根据现象分析结论。
高温点燃点燃点燃源:Z,xx,] 化学方程式提问:由于一氧化碳气体有毒,在设计此实验时,书中用了尾气回收装置,你有何新的改进方案?学生讨论、交流、汇报:1、气球收集。
2、重新用作能源,来复原氧化铜。
学会探究新方法,新途径的能力。
根据一氧化碳的性质,你能说出一氧化碳的用途吗?其中哪些有利于人类,哪些不利于人类?学生讨论、交流、汇报:1、有利的一面: 如作为能源、冶炼金属等。
2、不利的一面: 如果使用不当会使人中毒等。
通过全面认识一氧化碳的性质,体会任何事物的两面性。
通过对本节课的学习,同学们知道了什么?学生讨论、交流、回忆、汇报:一氧化碳的物理性质、化学性质及相关用途。
反思与交流。
板书设计二、一氧化碳的性质1、物理性质颜色、状态、气味、密度、溶解性无气体无比空气略小难能溶于水2、化学性质〔1〕一氧化碳的毒性一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能很好的与氧气结合,造成生物体内缺氧而中毒。
〔2〕一氧化碳的可燃性点燃2CO+O2===2CO2〔3〕一氧化碳的复原性△CO+CuO===Cu+CO23、一氧化碳的用途有利的一面:如作为能源、冶炼金属等。
不利的一面: 如果使用不当会使人中毒等。
附:课堂练习一1、不可能产生一氧化碳的途径是〔〕A、燃着的香烟B、煤炉烤火C、紧闭门窗的空调房间D、浴室中使用着的燃气热水器2、不适合用排空气法收集的气体是〔〕A、氢气B、氧气C、一氧化碳D、二氧化碳3、一氧化碳有毒是因为〔〕A、它具有复原性B、它具有可燃性C、它能与血液里的氧气结合生成二氧化碳D、它能与血红蛋白结合,使血红蛋白不能很好的跟氧气结合4、用哪些方法可以鉴别一氧化碳和二氧化碳?随堂检测:1、以下有关一氧化碳的说法中,错误的选项是〔〕A、一氧化碳能跟血液里的血红蛋白结合而使人体缺氧B、在炉火上放一盆水,可以防止一氧化碳中毒C、一氧化碳燃烧时有蓝色火焰D、一氧化碳可以用排水法收集2、以下物质中,既有可燃性,又有复原性,而且是化合物的是〔〕A、氢气B、碳C、一氧化碳D、二氧化碳3、有A、B、C、D四种气体,A和B、B和D 按一定比例混合后点燃都会爆炸;A和B化合生成C,C不能燃烧,也不支持燃烧;B和D化合生成E;C 溶解在E里生成F,F能使紫色石蕊试液变红色。
写出它们的化学式:A ,B ,C ,D ,E ,F 。
4、符合以以下图装置设计意图的有①说明CO具有复原性②既说明CO具有可燃性,又充分地利用了能源③说明CO得氧后的产物是CO2④有效地防止了剧毒的CO对空气的污染A、①②B、②④C、②③④D、①②③④作业:书P119-120页1,2,5, 题教学反思:通过全面认识一氧化碳的性质,体会任何事物的两面性。
了解一氧化碳对环境的污染,增强环境保护意识。
注意家庭中使用一氧化碳时要注意平安,学会自己检查泄漏的方法,以增强自我保护意识。
课题1 常见的酸和碱学习目标:1、了解常见碱的物理性质及用途。
2、掌握碱的化学性质并能灵活运用。
3、了解酸碱具有相似化学性质的原因。
知识回忆:1、浓盐酸具有___________性,假设敞口放置其质量会________,其溶质的质量分数会_______2、浓硫酸可以作枯燥剂,是因为其具有________,存放时必须_____ __。
3、氢氧化钠溶于水,能够_________ 〔放出或吸收〕热量4、二氧化碳的检验:〔化方〕_________________________ _课堂探究一、认识常见的碱:1、根据氢氧化钠、氢氧化钙、氢氧化钾、氨水,的化学式判断碱的组成,结构2、碱属于物二、氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠氢氧化钙颜色、状态________色体,______溶于水〔溶解放热〕易吸水而。
