脂肪烃类
脂肪烃讲解

脂肪烃【本节学习目标】学习目标1、了解烷烃、烯烃、炔烃物理性质的变化与分子中碳原子数目的关系;2、了解、掌握烷烃、烯烃、炔烃的结构特点和主要化学性质以及乙炔的实验室制法;3、根据有机化合物组成和结构的特点,认识加成、取代反应。
学习重点:烷烃和烯烃的结构特点和主要化学性质学习难点:烯烃的顺反异构【知识要点梳理】知识点一、前言:1、烃的衍生物:烃分子中的氢原子被其他原子或原子团取代的产物称为烃的衍生物;如烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。
2、有机反应的特点:①反应缓慢。
有机分子中的原子一般以共价键结合,有机反应是分子之间的反应;②反应产物复杂。
有机物往往具有多个反应部位,在生成主要产物的同时,往往伴有其他副产物生成;③反应常在有机溶剂中进行。
有机物一般在水中的溶解度较小,而在有机溶剂中的溶解度较大。
知识点二、烷烃:(又叫饱和链烃,分子中的原子全部以单键相连,易发生取代反应)1、基本概念:烷烃:仅含C—C键和C—H键的饱和链烃。
(若C—C连成环状,称为环烷烃。
)通式:C n H2n+2 (n≥1)2、物理性质递变规律:烷烃的物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高(碳原子数相同时,支链越多,沸点越低);相对密度逐渐增大;常温下的存在状态,也由气态(n≤4)逐渐过渡到液态、固态。
还有,烷烃的密度比水小,不溶于水,易溶于有机溶剂。
说明:沸点的高低与分子间作用--范德华力(包括静电引力、诱导力和色散力)有关。
烃的碳原子数目越多,分子间作用力就越大,因而沸点升高。
支链增多时,使分子间的距离增大,分子间作用力减弱,因而沸点降低。
3、化学性质的相似性:(同系物结构相似,决定了其他烷烃与甲烷性质相似)①取代反应(烷烃的特征反应)如:CH3CH3 + Cl2 CH3CH2Cl + HCl说明:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。
如烃的卤代反应。
高二化学苏教版选修5专题3第一单元脂肪烃学案含解析

互动课堂疏导引导一、烃的基本知识 1。
烃的分类烃分为脂肪烃和芳香烃,其中脂肪烃的分子中一定不含有苯环,芳香烃的分子中一定含有苯环。
根据脂肪烃的结构,人们把脂肪烃分为饱和烃和不饱和烃。
饱和烃:碳原子之间的共价键全部为碳碳单键,其中的碳原子皆为饱和碳原子.如:烷烃.不饱和烃:分子中含有双键和叁键等不饱和键的脂肪烃,其中的碳原子有不饱和碳原子。
如:烯烃、炔烃. 2。
常见的脂肪烃⎪⎩⎪⎨⎧⎩⎨⎧炔烃烯烃简称不饱和烃不饱和脂肪烃乙烷甲烷烷烃简称饱和烃饱和脂肪烃脂肪烃)(),(:)( 二、脂肪烃的性质 1。
烷烃的性质 (1)物理性质随着碳原子数的增多,烷烃同系物的物理性质呈现周期性变化,即熔沸点逐渐升高,密度逐渐增大。
注:①所有烷烃均难溶于水,密度均小于1。
②常温下烷烃的状态:C 1—C 4 气态 C 5—C 16 液态 C 17—固态 (2)化学性质①与卤素单质的反应 CH 3CH 3+Cl 2CH 3CH 2Cl+HCl可逐步取代,所得有机产物有:C 2H 5Cl 、C 2H 4Cl 2、C 2H 3Cl 3、C 2H 2Cl 4,C 2HCl 5、C 2Cl 6,其中氯乙烷为其一氯代物,以上物质均称为氯代物。
取代反应:像烷烃的卤代反应那样,有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
②与氧气的反应CH 4+2O 2−−→−点燃CO 2+2H 2OC n H 2n +2+213+n O 2−−→−点燃nCO 2+(n+1)H 2O知识总结不同的烃,碳元素所占的质量分数有所不同。
分子中碳原子数相同而碳元素的质量分数越低的烃,完全燃烧时放出的热量越多。
在所有烃中,烷烃(特别是甲烷)的碳元素的质量分数比相应的其他烃都低。
因此人们倾向于选用烷烃,尤其是相对分子质量小的烃作燃料。
2.烯烃、炔烃的性质 (1)物理性质①烯烃:随着分子里碳原子数的增加:a 状态:g→l→s;b 沸点:逐渐升高;c 密度:逐渐变大(但小于1 g·cm -3). 常温常压下,n≤4的烯烃为气态。
第一章 脂肪烃类习题

第一章脂肪烃类习题1、命名,有立体问题请注明2、写出下列化合物的结构式:(1)3,5-二甲基-1-庚烯(2)2,4-二甲基-5-异丙基壬烷(3)1-甲基-1,3-环戊二烯(4)1,3,3-三甲基二环[2.2.1]庚烷(5)1,5-己二烯-3-炔(6)反-1,2-二甲基环己烷(7)(Z)-1,3-己二烯(8)顺-3-溴-1-叔丁基环己烷优势构象(9)丙二烯(10)4-乙烯基-1-庚烯-5-炔(11)2-甲基螺[3.4]辛烷(12)7-甲基双环[2.2.1]-2-庚烯3、排序(1)构象稳定性(2)烯烃稳定性(3)碳正离子稳定性(4)自由基稳定性(5)CH3CH=CHCH(CH3)CH2CH3在高温下与氯反应,生成产物多少的顺序(6)沸点(7)熔点A 1-丁烯B 顺-2-丁烯C 反-2-丁烯(8)密度A 2-丁烯B 2-丁炔C 丁烷D 戊烷(9)酸性A 水B 氨C 乙炔D 乙烯(10)亲电加成反应活性A 1,3-丁二烯B 1-丁烯C 2-甲基丙烯D 三氟甲基乙烯4、选择题(1)燃烧热最小的是5、写出下列反应的主要产物6、给出下列反应的试剂或者必要反应条件7、写出异丁烯与下列试剂反应所得产物的结构式(1) H2,Ni(2)Cl2 (3)HBr(ROOR) (4)KMnO4(冷OH-) (5)H2SO4(6)H2O,H+ (7)Br2,H2O (8)Br2,NaCl水溶液(9)①O3②Zn,H2O (10)KMnO4,H+8、鉴别下列各组化合物9、合成题(1)由1-丁烯合成1-溴丁烷(2)由1-丁烯合成1-丁醇(3)由1-丁炔合成丁酮(4)由3-甲基-1-丁炔合成4-甲基-2-戊炔(5)由1,3-丁二烯和丙烯合成4-溴甲基-1,2-环己二醇10、推倒结构(1)化合物A和B都含碳88.8%,氢11.1%,分子量为54,且都能使Br2/CCl4溶液退色。
A与硝酸银氨溶液作用生成沉淀;A经氧化最终得到CO2和CH3CH2COOH。
脂肪烃

4.可以用来鉴别甲烷和乙烯,又可以用来除去甲烷
中混有的少量乙烯的操作方法是( B )
A. 混合气体通过盛酸性高锰酸钾溶液的洗气瓶 B. 混合气体通过盛足量溴水的洗气瓶 C. 混合气体通过盛水的洗气瓶 D. 混合气体跟氯化氢混合
PPT模板下载:/moban/
CH3CH2OH
二、烷烃
1、通式:CnH2n+2 2、化学性质:
(1)氧化反应(燃烧)
CnH2n+2 +
3n+1 2
O2 n CO2 +
(n+1) H2O
(2)取代反应(卤代)
特点:
(3)对酸、碱、氧化剂很稳(1定)反应条件:光照 (4C)4高H1温0 分高温解(C裂2H化4、+C裂2H解6((故23)))产卤各物素个是要饱混求和合:C—物不H能都使可用以溶被液取代
液体燃料 甲醇
1、聚氯乙烯是一种合成树脂,可用于制备塑料和合成 纤维等。聚氯乙烯可由H2、Cl2和乙炔为原料制取。请 写出有关的反应方程式。
H2+Cl2 点燃 2HCl
CH≡CH+HCl
催化剂 △
CH2=CHCl(氯乙烯)
小 聚氯乙烯在使用的过程中,易发生老化,会变硬、发脆、
知 识
开裂等,并释放出对人体有害的氯化氢,故不宜使用聚氯
巩固练习:
1.下列烷烃的沸点是:
物质 甲烷 乙烷 丁烷 戊烷
沸点 -162ºC -89ºC -1ºC +36ºC
根据以上数据推断丙烷的沸点可能是( A )
A.约- 40ºC
B.低于-162ºC
C.低于-89ºC
D.高于+36ºC
2. 制取氯乙烷的最好方法是( C ) A.乙烷和氯气反应 B.乙烯和氯气反应 C.乙烯和氯化氢反应 D.乙炔和氯化氢反应
专题3 第1单元 脂肪烃

?
②被氧化剂氧化:将乙
炔气体通往酸性高锰酸 钾溶液中,可使酸性高 锰酸钾褪色
2)、加成反应
应用:用于 鉴别乙炔和 乙烯气体!
将乙炔气体通入溴水溶液中,可以 见到溴的红棕色褪去,说明乙炔与溴发 生反应。(比乙烯与溴的反应慢)
CH2≡CH2 + 2Br2 → CHBr2CHBr2
加成反应过程分析
1, 2—二溴乙烯
④加热时应由试管口向后逐渐移动。如先加热试管底部, 产生的甲烷气可能会把前面的细粉末冲散,引起导管口 堵塞。加热温度不可过高,以免发生副反应,而使产生 的甲烷中混入丙酮等气体。 ⑤在导管口点燃甲烷前,应先检验纯度。
知识迁移
写出苯甲酸钠与碱石灰加热的反应方程式
回顾:2.乙烯的实验室制法
⒈实验原理:
低温
H2C=CH-CH=CH2+Br2→ H2C-CH-CH=CH2 | | 低温:1,2加成 Br Br H2C=CH-CH=CH2+Br2→
高温
H2C-CH=CH-CH2 | | 高温:1,4加成 Br Br
3)加聚反应:
由相对分子质量小的化合物分子互相结合 成相对分子质量大的高分子的反应叫做聚合反 应。 由不饱和的相对分子质量小的化合物分子 结合成相对分子质量大的化合物分子,这样的 聚合反应同时也是加成反应,所以这样聚合反 应又叫做加成聚合反应,简称加聚反应。 nCH2==CH2
⒉实验仪器及装置: ⒊收集方法: ⒋实验注意事项:
3、乙炔的实验室制法:
(1)、反应原理:
CaC2+2H—OH
C2H2↑+Ca(OH)2 +127KJ
《教材》P21:通常,
单键都是σ(西格玛)键; 双键中一个σ键一个π键;
脂肪烃及芳香烃

烯烃
定义
烯烃是含有碳-碳双键的链状烃。
结构特征
烯烃的通式为CnH2n,其中n表示碳 原子数。
命名
烯烃的命名通常采用系统命名法,根 据碳链的长短和双键的位置来命名。
化学性质
烯烃具有不饱和性,容易发生加成、 氧化、聚合等反应。
炔烃
定义
炔烃是含有碳-碳三键的链状烃 。
性质
脂肪烃的物理性质如熔点、沸点和密 度通常取决于其碳原子数,芳香烃具 有特殊的芳香气味和较高的化学稳定 性。
02
脂肪烃
烷烃
定义
烷烃是只含有碳-碳单键的链状烃。
命名
烷烃的命名通常采用系统命名法,根据碳链 的长短和支链的位置来命名。
结构特征
烷烃的通式为CnH2n+2,其中n表示碳原子 数。
物理性质
命名
环烷烃的命名通常采用系统命名法,根据环的大小和位置来命名。
物理性质
环烷烃通常是低沸点的无色液体,具有特殊的气味。
03
芳香烃
苯及其同系物
苯(Benzene)
01
一种无色透明的液体,具有强烈的芳香气味。苯是重要的化工
原料,可用于合成苯胺、苯酚等化合物。
甲苯(Methylbenzene)
02
无色透明的液体,有类似苯的芳香气味。甲苯是重要的化工原
高分子材料
合成纤维
如尼龙、涤纶等,由脂肪 烃或芳香烃通过聚合反应 制成,具有优良的力学性 能和耐久性。
合成胶粘剂
利用脂肪烃和芳香烃合成 的胶粘剂,具有粘附力强、 耐久性好等特点。
涂料与油漆
脂肪烃和芳香烃也是涂料 和油漆的主要成分之一, 赋予涂层良好的附着力和 耐久性。
常见有机溶剂极性表
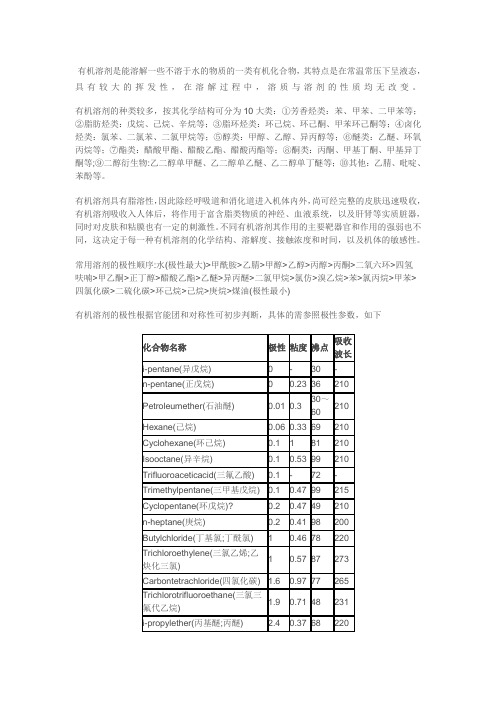
有机溶剂是能溶解一些不溶于水的物质的一类有机化合物,其特点是在常温常压下呈液态,具有较大的挥发性,在溶解过程中,溶质与溶剂的性质均无改变。
有机溶剂的种类较多,按其化学结构可分为10大类:①芳香烃类:苯、甲苯、二甲苯等;②脂肪烃类:戊烷、己烷、辛烷等;③脂环烃类:环己烷、环己酮、甲苯环己酮等;④卤化烃类:氯苯、二氯苯、二氯甲烷等;⑤醇类:甲醇、乙醇、异丙醇等;⑥醚类:乙醚、环氧丙烷等;⑦酯类:醋酸甲酯、醋酸乙酯、醋酸丙酯等;⑧酮类:丙酮、甲基丁酮、甲基异丁酮等;⑨二醇衍生物:乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;⑩其他:乙腈、吡啶、苯酚等。
有机溶剂具有脂溶性,因此除经呼吸道和消化道进入机体内外,尚可经完整的皮肤迅速吸收,有机溶剂吸收入人体后,将作用于富含脂类物质的神经、血液系统,以及肝肾等实质脏器,同时对皮肤和粘膜也有一定的刺激性。
不同有机溶剂其作用的主要靶器官和作用的强弱也不同,这决定于每一种有机溶剂的化学结构、溶解度、接触浓度和时间,以及机体的敏感性。
常用溶剂的极性顺序:水(极性最大)>甲酰胺>乙腈>甲醇>乙醇>丙醇>丙酮>二氧六环>四氢呋喃>甲乙酮>正丁醇>醋酸乙酯>乙醚>异丙醚>二氯甲烷>氯仿>溴乙烷>苯>氯丙烷>甲苯>四氯化碳>二硫化碳>环己烷>己烷>庚烷>煤油(极性最小)有机溶剂的极性根据官能团和对称性可初步判断,具体的需参照极性参数,如下表示有机溶剂的极性,关系到其物理化学性质、如介电常数、偶极矩或折射率。
这种表示方法把所有的溶剂看作是连续作用的介质,而不是看作由各个分子组成的非连续统一体,并且未考虑到溶剂和溶质之间的特殊的相互作用。
烃的分类脂肪烃

烃的分类脂肪烃
脂肪烃是指分子中只含有单键的饱和烃。
根据碳原子数量的不同,脂肪烃可分为以下几类:
1. 甲烷(CH4)
甲烷是最简单的脂肪烃,是无色无味的气体。
它是重要的化工原料和燃料。
2. 烷烃(CnH2n+2)
烷烃是一类同分异构体最多的脂肪烃,包括乙烷(C2H6)、丙烷(C3H8)、正丁烷(C4H10)等。
烷烃是重要的燃料和化工原料。
3. 环烷烃
环烷烃是环状结构的饱和烃,如环丙烷(C3H6)、环己烷(C6H12)等。
环烷烃是重要的化工原料。
4. 石蜡
石蜡是固体烷烃的混合物,主要由高级烷烃(C20-C40)组成。
石蜡广泛用于制造蜡烛、防水材料等。
5. 凝析油
凝析油是液体烷烃的混合物,主要由C5-C20的烷烃组成。
凝析油是重要的燃料和溶剂。
脂肪烃作为化工原料和燃料在工业和日常生活中有着广泛的应用。
它们的化学性质相对较为稳定,但可通过裂解、加氢等方式进行化学反应获得其他有机化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脂肪烃(aliphatic hydrocarbons)
具有脂肪族化合物基本属性的碳氢化合物叫做脂肪烃。
分子中碳原子间连结成链状的碳架,两端张开而不成环的烃,叫做开链烃,简称链烃。
因为脂肪具有这种结构,所以也叫做脂链烃。
有些环烃在性质上不同于芳香烃,而十分类似脂链烃,这类环烃叫脂环烃。
这样,脂肪烃便成为除芳香烃以外的所有烃的总称。
脂链烃和它的衍生物总称为脂肪族化合物,脂环烃及它的衍生物总称脂环族化合物[1]。
自然界中的脂肪烃较少,但其衍生物则广泛存在,而且与生命有极密切的关系。
如:樟脑常用驱虫剂、麝香常用中草药和冰片。
根据碳原子间键的种类——单键、双键、叁键,可分为烷烃或石蜡烃、烯烃、二烯烃、炔烃。
含有双键或三键的叫作不饱和烃。
碳链是直的叫作直链烃,有侧链的叫作侧链烃。
烷烃的分子通式为C n H2n+2、烯烃为C n H2n、炔烃和二烯烃为C n H2n-2。
脂肪烃的物理性质,例如沸点、熔点、相对密度等,随分子中碳原子数的递增而呈现出有规律的变化,常温下的状态则由气态逐渐变成液态、固态。
主要化学性质为碳原子上的氢原子被其他活泼原子的置换反应、高温下断链、脱氢生成较低碳数的烷烃,烯烃的裂解反应。
C6~C8直链烷烃可经脱氢环化生成苯系芳烃的反应。
烯烃、二烯烃、炔烃的化学性质活泼,可以进行加成、置换、齐聚、共聚、聚合、氧化等多种反应,工业上最有用的是加成反应及聚合反应。
脂肪烃一般都是石油和天然气的重要成分。
C1~C5低碳脂肪烃是石油化工的基本原料,尤其是乙烯、丙烯和C4、C5共轭烯烃,在石油化工中应用最多、最广。
分类方法。
①饱和脂肪烃分子中无不饱和的键,碳原子间以碳碳单键相连,通式C n H2n+2。
②不饱和脂肪烃分子中有不饱和键存在。
按不饱和键的不同又分为:
烯烃含有碳碳双键通式:有x个碳碳双键,C n H2n+2-2x
炔烃含有碳碳叁键通式:有x个碳碳三键,CnH2n+2-4x
200#溶剂油(松香水、矿油精、白节水)⑴物化性能:
外观:无色透明
闪点/℃ 33
相对密度(20℃)0.78
沸点范围/℃ 154~194
芳烃含量/% ≤ 15
贝壳松脂·丁醇(KB值) 36
苯胺点/℃: 65.6
相对挥发速率(乙酸正丁酯=1):0.19
粘度(20℃)/mPa·s 0.9
馏程初馏点/℃ 140
98%馏出温度/℃ 200
机械杂质和水分无
组成:C7~C11脂肪烃。
典型组成为烷烃C7,52;环烷烃C7,27;芳烃C8,1;三甲苯10
对树脂的溶解性:①可溶:酚醛、醇酸、长油醇酸、甘油松香酯、达玛树脂、天然和合成沥青。
②不溶:短油醇酸树脂、中油醇酸树脂需和芳烃合用才能溶解。
200#溶剂油用作油漆工业溶剂和稀释剂。
产品特点:溶剂主要用作化工溶剂,它有良好的溶解性能,该产品不含四乙基铝,硫含量少,本产品易挥发,易燃,易爆。
对油、脂溶解力强,安定性好,产品为无色,透明液体,长期贮存不变。
⑵安全和毒性
①安全性能
闪点(闭杯)/℃ 39
自然点/℃ 230
(下)0.9
爆炸极限/(mL/mL)%
(上)8
②毒性
溶剂汽油车间内最高允许浓度为350mg/m3。
吸入汽油蒸汽能引起头痛、眩晕、恶心和心动过速等症状。
吸入大量蒸气时,会引起严重的中枢神经障碍,空气中浓度为0.02%(V)时,对敏感的人有轻度的症状。
但普通的人会在0.025%~0.05%(V)范围内,呼吸数小时也无明显症状。
工业用汽油长时间与皮肤接触会产生脱脂作用。
误饮汽油会引起呕吐,消化道粘膜受刺激等症状,严重时将导致抽搐不安、心力衰竭和呼吸困难。
