β不饱和羧酸的反应
南昌大学有机化学16 不饱和羧酸和取代羧酸

戴延凤博士 yfdai@
1
16.1 不饱和羧酸
一、不饱和羧酸的制法 芳醛的缩合反应
PhCHO + CH2(COOH)2
吡吡, 六六吡吡 回回
phCH
CHCO2H
PhCHO + (CH3CO)2O
PhCHO + CH3COOEt
CH3CO2Na 180 C
16.9 碳酸衍生物
20
练习: 练习: CH2COOH 1. 以丙二酸二乙酯为原料,合成 以丙二酸二乙酯为原料,
CH2COOH
T.M
(1) EtONa EtOH CH(CO Et) (1) NaOH 分 2 2 CH2(CO2Et)2 (2) ClCH2COOC2H5 CH COOC H (2) H O + 析 3
O CH2CH2OC2H5OC C COOC2H5 CH CH O2 2
C2H5ONa
CH2(CO2Et)2 O
EtONa 0.5 C
o
o
phCH
CHCO2H
5h
phCH
2h
CHCO2Et
2
二、α,β-不饱和羧酸的反应 不饱和羧酸的反应 1,4-加成(共轭体系) 加成(共轭体系) 加成
CH2 CHCOOH
狄尔斯-阿德尔反应(亲双烯体系) 狄尔斯 阿德尔反应(亲双烯体系) 阿德尔反应
三、α,β-不饱和羧酸的用途 不饱和羧酸的用途 甲基丙烯酸甲酯: 甲基丙烯酸甲酯:有机玻璃的原料 丙烯腈 丙烯腈:合成纤维原料
2 2 5
2.以丙二酸二乙酯为原料,合成 CH2CH2COOH 以丙二酸二乙酯为原料, 以丙二酸二乙酯为原料
CH2CH2COOH
有机化学反应机理+范例+原理

1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
缩合反应

6 缩合反应缩合反应一般指两个或多个有机化合物分子形成较大的分子的反应,此外缩合反应也可以发生在分子内。
缩合过程常伴有小分子消除。
通过缩合反应可以形成碳碳键、碳杂键,进而达到增碳、引入官能团以及成环等目的,在药物合成中占有重要地位。
本章内容主要为含活泼氢化合物(醛、酮和酯)之间的缩合反应。
6.1alpha-羟烷化、alpha-卤烷化和alpha-氨(胺)烷化反应指在底物分子的某位置引入alpha-羟烷基、alpha-卤烷基和alpha-氨烷基的反应。
alpha是指羟基(卤素和氨(胺)基)直接与引入的烷基的碳相连。
6.1.1alpha-羟烷化(1)羰基alpha碳的alpha-羟烷化(羟醛缩合)具活泼氢的醛(酮)在碱(或酸)的催化下,自身或交叉缩合,生成beta-羟基醛或酮的反应。
最初是因为烯醇负离子对一个醛(aldehyde)加成得到醇(alcohol)而得名(aldol)。
反应机理为烯醇(负离子)对羰基的亲核加成。
①具活泼氢的醛或酮的自身缩合反应可以是碱催化的。
根据反应条件的不同,生成的beta-羟基醛或酮可以发生消除而生成烯,如丁醛的羟醛缩合反应。
也可以用酸催化,比如硫酸、盐酸以及离子交换树脂等。
碱能催化的原因在于碱可以夺取底物的质子,使其形成烯醇负离子;酸能催化的原因在于酸既能质子化羰基,使之更容易被亲核试剂进攻,也能帮助烯醇式的形成,又能催化脱水。
对称酮缩合产物单一。
对于不对称酮,不论碱催化或酸催化,反应主要发生在含氢较多的alpha碳原子上,得到beta羟基酮或其脱水物。
②芳醛与具活泼氢的醛或酮的缩合芳醛与具活泼氢的醛或酮的缩合可生成b羟基芳丙醛(酮),并进一步消除生成更稳定的芳丙烯醛(酮),即Claisen-Schmidt反应。
消除产物以反式构型为主,如苯甲醛与苯乙酮的缩合。
这与过渡态的稳定性有关(反式共平面消除)。
芳醛与两个alpha位都含活泼氢的酮反应时,酸催化倾向于在含氢较少的位置缩合,碱催化与此相反。
不饱和羧酸和取代羧酸

CH 3
• 2.芳醛的缩合反应(普尔金和脑文格反应)
• 三. a,β-不饱和羧酸的反应 • a,β-不饱和羧酸及其衍生物分子中含有共轭双键体系,与 a,β-不饱和醛酮相似,容易起1,4-加成反应。例如:
OHCCOOH
乙醛酸能形成稳定的水合物 (HO) 2CHCOOH
• 丙酮酸由相应的腈水解得到,能还原土伦试剂,用硝 酸氧化则生成草酸,与稀硫酸加热脱酸生成乙醛,与 浓硫酸加热则生成乙酸,这是a-酮酸的特性反应.
O O O
CH 3CCl
O
NaCN
CH 3CCN
H3O+
CH 3CCOOH
Ag(NH3)2+
O H3C C O H CH2 CH3COH + CO2 O H3C O H O CH3CCH3 + CO2 O O
有的多环β –酮酸加热时不脱羧,可能是由于脱羧生成的烯 醇含有张力很大的桥头双键,不容易生成。 β –酮酸酯是稳 定的。
• 三. γ-酮酸 • 4-戊酮酸是最简单的γ-酮酸,加热容易脱水:
2-羟基丙酸 羟基丙酸 乳酸
COOH OH
2-羟基苯甲酸 邻羟基苯甲酸 水杨酸
COOH HO OH OH
3,4,5-三羟基苯甲酸 没食子酸
COOH CHOH CHOH COOH
2,3-¶¶¶¶¶¶ ¶ ù á , '¶¶¶¶¶¶ ¶ ù á ¶¶á ¶
COOH CHOH CH2 COOH
2-¶¶¶¶¶ ¶ù á ¶¶¶¶¶ ¶ù á ¶¶¶ á
CH2COOH HO-C-COOH CH2COOH
不饱和羧酸和取代羧酸
3).瑞佛尔马斯基(Reformatsky)反应
指α-卤代酸酯与醛或酮在惰性溶剂中和锌粉反应,产物水解得β-羟基酸酯的反应。
注:①制备β-羟基酸酯时,金属只能用Zn不能用Mg。α-卤代酸酯通常用α-溴代酸酯。
②醛酮结构不受限制。
③可制备β-羟基酸酯,β-羟基酸,α,β-不饱和羧酸。
比较新的制备羟基酸的方法:
5).诺文葛耳(Knoevenagel)反应
指具有活泼亚甲基的化合物,在碱性试剂存在下和醛发生的加成-消去反应。
含有活泼亚甲基的化合物:
醛:脂肪醛,芳香醛,甚至酮也可以。
3α,β-不饱和羧酸的反应
1).共轭加成
2).D-A反应
1 , 3-丁二烯
丙烯酸甲酯
3-环己烯甲酸甲酯
练习:以环戊二烯和4C以下有机物为原料合成:
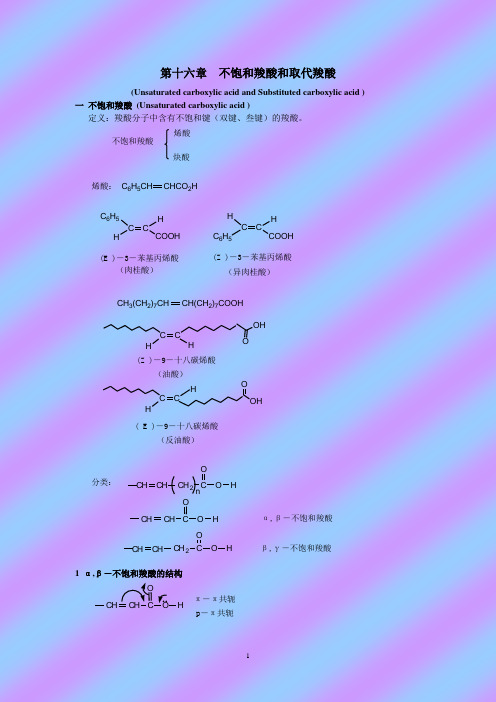
第十六章
不饱和羧酸和取代羧酸
(Unsaturated carboxylic acid and Substituted carboxylic acid )
一
一.不饱和羧酸(Unsaturated carboxylic acid )
定义:羧酸分子中含有不饱和键(双键、叁键)的羧酸。
1α,β-不饱和羧酸的结构
385.6±2.6387.7±3.8390.2±2.9394.8±2.9394.4±3.8
单位:kJ•mol-1
2α,β-不饱和羧酸的制备
1).腈的水解
2).格利雅试剂法
3).α-羟基酸脱水
4).佩金(Perkin)反应
指芳香醛和酸酐在相应羧酸钠(或钾)盐存在下发生的类似于羟醛缩合的反应,最终得到α,β-不饱和羧酸。
Pka=2.96
反应:
乙酰水杨酸
β不饱和羧酸的反应

RCOH
RCOCR
O RCNH2
O RCOR'
O RCOR"
RCN
一、 不饱和羧酸
1 不饱和羧酸的结构
不饱和羧酸——分子中含有烯键和炔键。 1) 根据羧基与重键的相对位置可分为:
α,β —或β,γ—不饱和羧酸
2) 不饱和羧酸酯结构与生成热
不饱和羧酸反式比顺式异构体熔点高:
2 不饱和羧酸的制法
β —酮酸酯中活性亚甲基上的氢有酸性,存在着酮— 烯醇平衡。在酸碱催化下,则迅速进行.
O CH3CCH2COOC2H5 92.5% O CH3 C H 7.5% O CH3 O C H O C OC2H5
CH C OC2H5
CH
O
O
OH
O
CH3CH2OCCH2COCH2CH3 99.9%
CH3CH2OC CHCOCH2CH3 0.1%
1) OH 2) H+
-
Br(CH2)4Br
COOC2H5 COOC2H5
COOH
2 CH2(COOC2H5)2
C2H5ONa
_ BrCH2CH2Br 2 CH(COOC2H5)2
CH2CH2COOH -CO2 CH2CH2COOH
CH2CH(COOC2H5)2 1) OHCH2CH(COOC2H5)2 2) H+
+ -
CH3CH2C H
OZnBr CH3CH2CHCH2COOC2H5
H2O
OH CH3CH2CHCH2COOC2H5
CHO + BrCHCOOC2H5 + Zn CH3
1) 苯 2) H2O
OH CHCHCOOC2H5 CH3
讨论
化学竞赛PPT-第十五章 羧酸衍生物-第15章取代2

四、 醇酸
1、β-醇酸加热时容易脱水生成α, β-不饱和酸,往往还生成 β, γ-不饱和酸:
O
O
RCHCH2COH
RCH CHCOH + H2O
OH
2、γ-醇酸极易脱水而转变为内酯:
五元环内 酯相对稳
定
3、δ-醇酸生成内酯较难,生成的δ-内酯也容易开环。
4、α-醇酸的降解
与浓硫酸一起加热时,分解为醛酮,CO和水; 如与稀硫酸一起加热,分解为醛酮和甲酸:
2、在酸碱催化剂下,则迅速进行。
化合物
OO
OEt OO
OEt CH3 OO
OEt C2H5 OO
OEt CH(CH3)2 OO
OEt CF3
pKa 10.65 12.25 12.50 13.50
烯醇含量/%
8(液态) 0.39(水溶液)
5 (液态) 0.29(水溶液)
1(液态) 0.17(水溶液)
OH CO2H
苯酚钠
水杨酸钠
水杨酸
科尔伯将无水苯酚钠与CO2在180~200℃下加热, 除了水杨酸二钠外,还生成苯酚:
OH CO2Na C6H5ONa
ONa
OH
CO2Na +
施密特发现在较低温度下,苯酚钠吸收二氧化碳,生成碳
酸苯酯的钠盐,后者在120~145℃下加热即转变为水杨酸钠,
产率接近100%。
CO2CH3
+
CO2CH3
1,3-丁二烯 丙烯酸甲酯
3-环己烯基甲酸甲酯
三、卤代酸
1、α-卤代酸及其衍生物中卤原子在羰基的影响 下,活性增强,容易与各种亲核试剂起SN2反应,生 成α-取代羧酸。
2、β-卤代酸容易消去卤化氢得到α,β-不饱和羧酸。 3、γ-,δ- 和ε-卤代酸在碱的作用下,容易生成内酯:
常见人名反应及机理

1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
d β —醇酸易脱水成不饱和酸。
2)与醛反应
a α -和β -醇酸与醛一起加热都生成环状化合物
3) α -和β -醇酸的降解
由羧酸经过α —溴代酸可合成高级醛
4) 醇酸酯的反应
a Reformatsky反应
β —醇酸酯容易脱水而转变为α ,β —不饱和酸酯
O + BrCH2COOC2H5 + Zn
多环β —酮酸加热时不脱羧,
β —酮酸的酯稳定,合成上有重要用途
3 γ —酮酸
六 β —酮酸酯
β —酮酸酯可以在活性亚甲基上起烃化和酰化反应,
从而转变为多种类型的化合物,在合成上有重途。
1 β —酮酸酯合成
1)克莱森缩合 ——是制备β —酮酸酯的重要方法。
2 RCH2COOR'
1) C2H5ONa 2) H+
CH3ONa
ph CH3OOC
COOCH3 O
环化方向 含两种不同-H时, 酸性较大的-H优先被碱夺去。
COOC2H5 O CH3
CH2CH2CH2COOC2H5 CH2CHCOOC2H5 CH3
:B-
CH2CH2CHCOOC2H5 CH2CHCOOC2H5 CH3
3) 酮与酯的缩合 有α —氢的酮在强碱作用下,可以与无α —氢的酯缩合, 则产物为β —酮酸酯或β —二酮:
科尔伯—施密特(Kolbe-Schmidt)反应
水杨酸在加热时脱羧
溴化时,羧基被溴原子取代:
2
对羟基苯甲酸
3
棓 酸 棓酸即 3 , 4 , 5—三羧基苯甲酸,熔点: 202℃。加
热时容易脱羧:
五
羰基酸——醛酸和酮酸
1 乙醛酸和丙酮酸
丙酮酸能还原土伦试剂
α—酮酸的特性反应
2 β —酮酸是不稳定的化合物,易脱羧变为酮
1 性质: 酸性随着羟基与羧基远近由弱变 强; α — 醇酸酸性最强(pKa值约降低0.45)
2 反应
1) 脱水反应
a α —醇酸易脱水成酯
b 加热脱水,分解为甲酸和醛
c α —位被—OR或—OCOR取代 时,加热更易分解,并 得到高产率的醛
α —羟基与叔碳原子相连,在加热时生成 α 、 β —不饱和酸 和酮的混合物:
不饱和羧酸反式比顺式异构体熔点高:
2 不饱和羧酸的制法
1)
佩金(Perkin)反应
2)醇钠催化得到肉桂酸酯
3 α ,β —不饱和羧酸的反应 —— 容易起 1,4—加成反应。
α ,β —不饱和酸与共轭二烯烃1,4 加成(Diels—Alder)
4 α,β—不饱和羧酸的用途(自学)
甲基丙烯酸甲酯
CH C OC2H5
CH
O
O
OH
O
CH3CH2OCCH2COCH2CH3 99.9%
CH3CH2OC CHCOCH2CH3 0.1%
酮式-烯醇式互变异构体
Organic Chemistry
延安大学化工学院 有机化学教研室
第 十六 章
不饱和羧酸和取代羧酸
一. 不饱和羧酸 三. 醇酸 五. 羰基酸 二. 卤代酸 四. 酚酸
六. β-酮酸酯
七.三乙和丙二酸酯合成法 八.迈克尔反应 九.碳酸衍生物
2
O
SOCl2 or PX3 or PX5 H2O
RCCl
HO CH2COOC2H5
苯
BrZnO
CH2COOC2H5
H2O
O BrCH2COOC2H5 + Zn BrZnCH2COOC2H5
+ -
CH3CH2C H
OZnBr CH3CH2CHCH2COOC2H5
H2O
OH CH3CH2CHCH2COOC2H5
CHO + BrCHCOOC2H5 + Zn CH3
为无色液体,沸点:100~101℃。
丙酮与
氢氰酸合成——有机玻璃的原料(工业化)
二
卤
代
酸
习惯名称常用希腊字母表示卤素的位置
卤素在碳链的末端的,称为ω —卤代酸
1 卤代酸的制法
2 卤代酸的反应
易起SN 2反应
γ—,δ—和ε—卤代酸在碱作用下,易成内酯
三 、卤代酸的用途(自学)
三
醇酸
常按来源命名
COOCH3 + CH3CH2CH2COOEt N
NaH N
COCHCOOEt CH2CH3
2) 分子内酯缩合——迪克曼缩合( Dieckmann) 合成五、六元环
COOEt CH2COOEt CH2COOEt CH3CH2ONa O
ph C CH3OOC
CH2CH2COOCH3 CH2CH2COOCH3
A
B
C
b 二异丙氨基锂与酯反应(LDA)
生成的烯醇盐除与醛酮缩合外,还可以与卤代烷反应,在 α —位导入烷基
3 醇酸的用途(自学)掌握 乳酸 、苹果酸、酒石酸 、柠檬酸、
扁桃酸、内酯的结构、用途。
四
酚 酸 羟基在芳环上的羧酸称为酚酸: 1 水杨酸
180一200℃下加热,除了水杨酸二钠外,还生成苯酚
O RCH2CCHCOOR' R
位阻很大的格利雅试剂不能与羰基加成,但可以夺取活 性氢,也可以用来使羧酸酯变成烯醇盐:
交叉酯缩合(两种不同的酯,其中一个不含-H)。
COOCH2CH3 COOCH2CH3
1) C2H5ONa 2) H
+
+ C6H5CH2COOC2H5
COOCH2CH3 COCHCOOC2H5 C6H5
有α —氢的酮、酯相互缩合时,酮的-H比酯的-H活泼。
O CH3CCH3 + CH3(CH2)4COOC2H5
1) NaH 2) H
+
O
O
CH3(CH2)4CCH2CCH3
2 β —酮酸酯——酮—烯醇平衡
β —酮酸酯中活性亚甲基上的氢有酸性,存在着酮— 烯醇平衡。在酸碱催化下,则迅速进行.
O CH3CCH2COOC2H5 92.5% O CH3 C H 7.5% O CH3 O C H O C OC2H5
1) 苯 2) H2O
OH CHCHCOOC2H5 CH3
讨论
O CH3CH2CCH3 + BrCH2COOC2H5 + Zn O LiAlH4 CH3CCH3
1) 苯 2) H2O
A
B
OH
C
CH3 CH3CH2 O O CH3 CH3
OH CH3CH2CCH2COOC2H5 CH3
CH3CH2CCH2CH2OH CH3
NH3 (R)
羧酸衍生物相互转换图
O
RCOOH or RCOONa R'OH
O O
RCOH
RCOCR
O RCNH2
O RCOR'
O RCOR"
RCN
一、 不饱和羧酸
1 不饱和羧ቤተ መጻሕፍቲ ባይዱ的结构
不饱和羧酸——分子中含有烯键和炔键。 1) 根据羧基与重键的相对位置可分为:
α,β —或β,γ—不饱和羧酸
2) 不饱和羧酸酯结构与生成热
