浅议胶体的性质及其应用
10.24胶体的性质

如何检 测?
分散系 溶液 分散质粒子 <10-9m 的直径 分散质粒子 单个小分子
或离子
浊液 >10-7m
巨大数目分子 集合体
胶体 10-9~10-7m
许多分子集合 体或高分子
豆浆, 泥水, 豆浆,牛奶 实例 酒精, 酒精,氯化钠溶液 泥水,油水 均一, 均一,透明 均一, 均一, 不均一,不透明 均一,透明 外观 稳定 较稳定 稳定性 不稳定 能否透过滤 能 能 不能 纸 能否透过半 能 不能 不能 透膜 鉴别 静置分层 丁达尔效应 无丁达尔效应
观察与思考
3:胶体微粒带电,那么整个胶体分散 胶体微粒带电, 系显电性吗? 系显电性吗?
胶粒带电, 胶粒带电, 但整个胶体分散 系是呈电中性的. 系是呈电中性的.
胶体的应用与危害
应用:由于胶体的介稳性, 应用:由于胶体的介稳性,使得它们在工农业生 产和日常生活中有广泛应用. 墨水,墨汁, 产和日常生活中有广泛应用.如,墨水,墨汁, 明矾净水,土壤保肥中均应用胶体原理. 明矾净水,土壤保肥中均应用胶体原理.
胶体的性质 ,按分散质粒子的大小将分散系分为: 分散剂是液体时 分散质粒子的大小将分散系分为: 分散系分为
分散系
分散质 < 1nm 粒子直径
溶液
胶体 浊液
1nm ~ 100nm >100nm
分散质粒子的直径在1nm 分散质粒子的直径在1nm ~ 100nm 之间的分散系叫做胶体 之间的分散系叫做胶体
使胶体聚沉的方法:
(1).加热 加热 ——思路:加速胶粒碰撞,使得胶粒在 思路:加速胶粒碰撞, 思路 更强烈的碰撞时容易结合成大颗粒, 更强烈的碰撞时容易结合成大颗粒,形 成沉淀. 成沉淀. 应用实例: 应用实例: 1,淀粉溶液加热后凝聚成了浆糊凝胶. ,淀粉溶液加热后凝聚成了浆糊凝胶. 2,蛋清加热后凝聚成了白色胶状物. ,蛋清加热后凝聚成了白色胶状物.
胶体的性质及其应用

(胶体)
原因:胶粒直径大小与光的波长相近,胶粒对 光有散射作用;而溶液分散质的粒子太 小,不发生散射。 应用:鉴别溶胶和溶液。 练习:不能发生丁达尔现象的分散系是(A B ) A、碘酒 B、无水酒精 C、蛋白质溶液 D、钴玻璃
2、 布朗运动(动力学性质)
在超显微镜下观察胶体溶液可以看到胶体颗粒 不断地作无规则的运动。
实例:
①浑浊的井水中加入少量石灰能使水变澄清; ②豆浆里加盐卤(MgCl2· 6H2O)或石膏 (CaSO4· 2H2O)溶液使之凝聚成豆腐; ③水泥里加石膏能调节水泥浆的硬化速率; ④在江河与海的交汇处形成的沙洲。
(2)加入胶粒带相反电荷的胶体
带不同电荷的胶体微粒相互吸引发生电性中和, 从而在胶粒碰撞时发生凝聚,形成沉淀或凝胶。 实验:将Fe(OH)3胶体溶液与硅酸胶体溶液 现象:形成大量的沉淀. 结论:Fe(OH)3胶粒与H2SiO3胶粒带相反电荷.
△
Fe(OH)3(胶体)+3HCl
红褐色
注意:不能过度加热,以免出现Fe(OH)3胶体凝聚。 FeCl3溶液中存在微弱的水解,生成极少量的Fe(OH)3 , 加热, 加大水解程度, 使Fe(OH)3聚集成较大颗粒 ——胶体
条件:饱和FeCl3溶液、沸水
②复分解法
AgNO3+KI=AgI(胶体)+KNO3 浅黄色
许多分子 集合体
浊液 >100 nm
大量分子 集合体
< 1nm
单个分子或离子
能 能 稳定
能 不能 较稳定
不能 不能 不稳定
三、胶体的性质
1、丁达尔现象(光学性质) 实验:光束分别通过AgI胶体和CuSO4溶液,观察现象。 现象:一束光通过胶体时,从侧面可观察到胶体里 产生一条光亮的“通路”。
胶体材料的性质与应用综述

胶体材料的性质与应用综述胶体材料是一类在溶液中形成的微粒子,由于其具有特殊的物理化学性质,被广泛应用于各种领域。
本文将从胶体材料的基本性质、制备方法和应用领域三个方面进行综述。
一、基本性质1. 大小、形态和结构胶体颗粒大小一般在1~100纳米之间,可形成球形、棒形、星形等各种形态。
其结构也非常复杂,由核心、表面修饰层和带电层三部分组成。
2. 稳定性胶体颗粒受到浓度、温度、PH值等多种因素的影响,极易聚集和沉淀。
为了保证稳定性,可以通过表面修饰、电磁相互作用、范德华力等方式进行表面修饰。
3. 光学性质胶体颗粒所呈现出的光学性质主要包括吸收、散射和发光。
其中,金属纳米颗粒可呈现出表面等离子体共振现象,形成色散光谱;荧光胶体颗粒可以通过激发荧光染料产生特定的发光波长。
二、制备方法1. 化学方法化学方法是最常见的胶体制备方法之一,该方法利用化学反应过程来控制胶体颗粒的形态和大小。
常见的化学合成方法包括还原法、溶剂热法、热分解法等。
2. 物理方法物理方法是将物理学的基本原理应用于胶体制备中。
常见的物理制备方法包括溶胶-凝胶法、微流控技术、膜分离法等。
3. 生物方法生物方法是利用生物体系中的分子和生化反应来制备胶体材料。
常见的例子包括蛋白质纳米颗粒、磁性纳米颗粒等。
三、应用领域1. 生命科学领域生命科学领域是胶体材料最广泛应用的领域之一。
胶体颗粒可以作为生物分子的载体和探针,在基因治疗、癌症诊断、蛋白质分离等方面发挥着重要作用。
2. 环境科学领域在环境领域,胶体材料主要应用于污染物的吸附和去除。
通过改变胶体颗粒的表面性质和孔隙结构,可使其对各种有机和无机污染物具有较好的吸附和去除能力。
3. 光电领域由于胶体颗粒具有独特的光学性质,因此被广泛应用于光电器件的制备中。
如利用金属纳米颗粒的表面等离子体共振现象来制备SPR传感器。
4. 能源领域胶体材料在太阳能电池、燃料电池、储能材料等能源领域也具有较好的应用前景。
胶体的性质及应用

胶体的性质及应用
3.电泳
胶体的性质及应用
3.电泳
电泳—— 在电场的作用下,胶粒在分散剂里作定向移动 •原因:Fe(OH)3胶粒带正电荷(选择性吸附)→向阴极移动→
阴极区颜色逐渐变深
•警示:是胶体粒子带电,整个胶体是不带电的
胶体的性质及应用
3.电泳
胶体粒子带电的一般规律:
胶体的性质及应用
5.渗析
应用:胶体的提纯等
渗析——利用 半透膜 的选择透过性 (能透过小分 子和离子,但不能透过胶体粒子),从胶体中除掉 作为杂质的小分子和离子的过程。
浊液 胶体 溶液
滤纸
半透膜
胶体的性质及应用
滤纸
半透膜
浊液 胶体 溶液
5.渗析
例: 半透膜
实验室中制取的Fe(OH)3胶体中常常含有杂质Cl, 可用的方法除去Fe(OH)3胶体中混有的杂质Cl 。
金属氢氧化物、金属氧化物的胶体粒子——带正电荷 非金属氧化物、金属硫化物和硅酸胶体粒子——
向胶体中加入少量电解质溶液 时,由于加入的阳离子(或阴离子) 中和胶体粒子所带电荷,使胶体粒 子聚集成较大的颗粒,从而形成沉 淀从分散剂中析出的过程。
胶体的性质及应用
4.聚沉
胶体的性质及应用
美丽的长江三角洲
胶体的性质及应用
1.丁达尔效应
丁达尔效应—— 一束光通过胶体有一 条光亮的“通路”。 应用: 区分胶体与溶液
丁达尔效应的原因:
溶液
粒子小,透射
胶体
粒子较大,散射
浊液
粒子很大,全反射
胶体的性质及应用
2.介稳定性(阅读P28科学视野)
原因一 :胶体粒子可以通过吸附同性离子而 带同种电荷,而同种电荷会相互排斥,阻碍 胶粒变大。(主要)
胶体的性质及应用
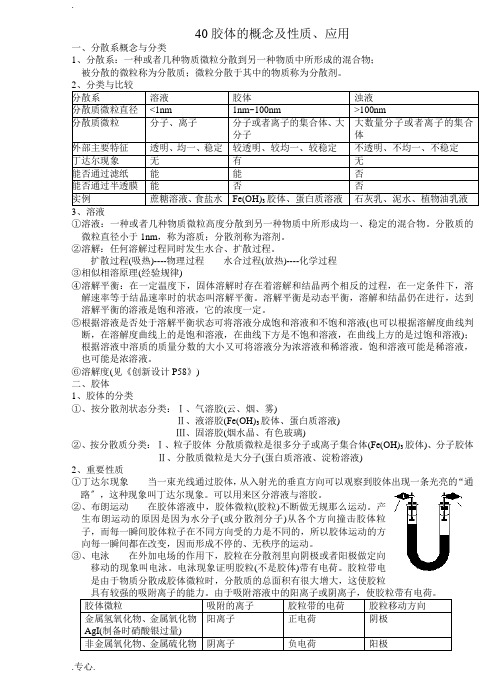
40胶体的概念及性质、应用一、分散系概念与分类1、分散系:一种或者几种物质微粒分散到另一种物质中所形成的混合物;被分散的微粒称为分散质;微粒分散于其中的物质称为分散剂。
2、分类与比较分散系溶液胶体浊液分散质微粒直径<1nm 1nm~100nm >100nm分散质微粒分子、离子分子或者离子的集合体、大分子大数量分子或者离子的集合体外部主要特征透明、均一、稳定较透明、较均一、较稳定不透明、不均一、不稳定丁达尔现象无有无能否通过滤纸能能否能否通过半透膜能否否实例蔗糖溶液、食盐水Fe(OH)3胶体、蛋白质溶液石灰乳、泥水、植物油乳液3、溶液①溶液:一种或者几种物质微粒高度分散到另一种物质中所形成均一、稳定的混合物。
分散质的微粒直径小于1nm,称为溶质;分散剂称为溶剂。
②溶解:任何溶解过程同时发生水合、扩散过程。
扩散过程(吸热)----物理过程水合过程(放热)----化学过程③相似相溶原理(经验规律)④溶解平衡:在一定温度下,固体溶解时存在着溶解和结晶两个相反的过程,在一定条件下,溶解速率等于结晶速率时的状态叫溶解平衡。
溶解平衡是动态平衡,溶解和结晶仍在进行,达到溶解平衡的溶液是饱和溶液,它的浓度一定。
⑤根据溶液是否处于溶解平衡状态可将溶液分成饱和溶液和不饱和溶液(也可以根据溶解度曲线判断,在溶解度曲线上的是饱和溶液,在曲线下方是不饱和溶液,在曲线上方的是过饱和溶液);根据溶液中溶质的质量分数的大小又可将溶液分为浓溶液和稀溶液。
饱和溶液可能是稀溶液,也可能是浓溶液。
⑥溶解度(见《创新设计P58》)二、胶体1、胶体的分类①、按分散剂状态分类:Ⅰ、气溶胶(云、烟、雾)Ⅱ、液溶胶(Fe(OH)3胶体、蛋白质溶液)Ⅲ、固溶胶(烟水晶、有色玻璃)②、按分散质分类:Ⅰ、粒子胶体分散质微粒是很多分子或离子集合体(Fe(OH)3胶体)、分子胶体Ⅱ、分散质微粒是大分子(蛋白质溶液、淀粉溶液)2、重要性质①丁达尔现象当一束光线通过胶体,从入射光的垂直方向可以观察到胶体出现一条光亮的“通路〞,这种现象叫丁达尔现象。
胶体的性质及其应用

胶体具有介稳性的原因
主要是因为胶体粒子表面积大,可以通 过吸附而带电荷。同种胶体粒子的电性相 同,在通常情况下,它们之间的相互排斥 阻碍了胶体粒子变大,使它们不容易聚集。 胶体粒子所作的布朗运动也使得它们不容 易聚集成质量较大的颗粒而沉降下来。
3、胶体的电泳:在外加电场的作用下,胶 粒定向地向阴极或阳极运动。 原因:胶粒吸附离子而带同种电荷。 带正电:金属氧化物、金属氢氧化物胶体 如Fe2O3 、 Al(OH)3胶体等 带负电:非金属氧化物、金属硫化物胶体 如H2SiO3(SiO2) 、 Sb2S3胶体等 应用:⑴ 静电除尘 ⑵ 精制粘土 ⑶ 血清电泳用于诊断疾病
3、已知土壤胶体粒子带负电,在土壤里施用含 氮量相等的下列肥料,肥效较差的是 ( C ) A.(NH4)2SO4 B.NH4HCO3 C.NH4NO3 D.NH4Cl 4、下列事实与胶体知识有关的是 ( D) ①用卤水点豆腐 ②工厂烟窗用电极除尘 ③河 海交接处易沉积形成沙洲 ④向25ml沸腾的蒸馏 水中加入5-6滴饱和FeCl3溶液所得液体. A.①②③ B.②③④ C.①③④ D.全部都是
凝胶的形成: 胶体在聚沉的过程中由于某种原因使分散 剂一起聚沉成的一种不流动的胶冻状物质。 如:豆腐脑、果冻等
三、胶体的制备方法 1、分散法:大→小 ⑴ 、研磨法:把固体磨成直径大小为1nm~ 100nm之间的微粒,再分散到适当 的分散剂中, 并加入稳定剂。
如:工业制石墨胶体、有色玻璃、碳素墨水、 涂料、颜料、炸药、塑料、橡胶等。 ⑵ 、胶溶法 2 、凝聚法:小→大 AgNO3 + KI = AgI(胶体) + KNO3 注意:⑴溶液浓度足够稀(0.001mol/L)。 ⑵有一种反应物必须过量。 四、胶体的精制—渗析
如何学好胶体的性质及应用

如何学好胶体的性质及应用胶体知识与我们身边的生活、生产、自然和科学技术密切联系,如由豆浆制豆腐、江河入海口形成三角洲等就与胶体的聚沉有关,还如新技术纳米材料(几nm至几十nm)与胶粒的大小相近,可应用胶体的制备方法来制备纳米材料。
一、用理论联系实际的方法学习胶体的制备、性质及应用1、胶体的制备(1)物理分散法:使难溶于水的物质颗粒分散成1nm~100nm之间的胶粒溶于水,如研磨。
(2)化学凝聚法:如制备Fe(OH3)胶体:将1~2mL FeCl3饱和溶液滴入20mL沸水中至溶液显红褐色。
FeCl3+3H2OFe(OH)3(胶体) +3HCl易错点提示:①所用FeCl3溶液要饱和且没有浑浊;②烧杯里蒸馏水煮沸后,滴加FeCl3溶液时要不断振荡;③溶液呈红褐色后,停止加热,以免生成沉淀,④化学方程式不用“”和“↓”等符号。
2、胶体的重要性质光束通过胶体时,形成一条光亮的通路(垂直于光的方向观察),这是由于胶体粒子对光线的散射而形成的现象。
应用此性质可以区分胶体和溶液。
易错点提示:浊液和胶体都有丁达尔现象,且浊液的丁达尔现象还更明显。
二、用比较的方法加深对分散系、胶体等概念的理解1、分散系、分散质、分散剂有关概念分散系:一种物质(或几种物质)分散到另一种物质里形成的混合物。
分散质:分散成微粒的物质叫分散质。
分散剂:微粒分布在其中的物质叫分散剂。
2、列表比较区别溶液、胶体和浊液。
提醒:①胶体与其他分散系的本质区别:胶体粒子的直径在 1 nm~100nm 之间是胶体的本质特征,也是胶体区别于其他分散系的依据,同时也决定了胶体的性质。
②分离方法:渗析法(将胶体与溶液的混合液装入半透膜袋,浸入流动的蒸馏水中,逐渐可分离去混在胶体里的溶质)。
③鉴别方法:根据丁达尔现象。
三、适当进行知识拓展,加深对知识的全面理解1、胶体的丁达尔现象是由于胶体微粒使光线散射而产生的,溶液中的溶质微粒太小,没有这种现象。
散射是怎么一回事?当光通过不均匀媒质悬浮的颗粒或分子时,部分光束将偏离原来方向而分散到各个不同方向去,称之为光的散射。
胶体材料的性质及应用

胶体材料的性质及应用胶体材料是指由两个或多个物质组成的混合系统,其中一种物质以微粒或分子簇的形式分散在另一种物质中。
通常情况下,其中一种物质为固体,被称为分散相;另一种物质为液体或气体,被称为连续相。
胶体材料具有特殊的性质和应用,下面就胶体材料的性质及应用进行详细介绍。
首先,胶体材料具有较小的粒径。
根据国际纯粹与应用化学联合会(IUPAC)的定义,胶体材料的粒径范围为1纳米到1000纳米。
这种小尺寸使得胶体材料具有较大的表面积和高度的分散性,有利于传质和反应等表面相关过程。
其次,胶体材料具有可逆性。
胶体材料的分散相可以在连续相中快速扩散,同时也可以很容易地从连续相中析出,这种可逆性使得胶体材料在构建纳米结构和调控溶液性质等方面具有重要作用。
再次,胶体材料呈现出特殊的光学性质。
由于胶体材料中微粒的尺寸与可见光的波长相当,当光线通过胶体材料时,会发生散射现象,称为光散射。
这种光散射使得胶体材料呈现出特殊的光学效应,如Tyndall散射和胶体的色散。
此外,胶体材料还具有流变性质。
胶体材料中微粒的存在可以改变连续相的粘度和流动性质。
同时,胶体材料还具有较高的稳定性,能够长时间保持分散相的分布状态,不易发生沉淀和凝聚。
胶体材料具有广泛的应用领域。
以下是胶体材料常见的应用之一:1. 药物传递:由于胶体材料的微粒尺寸小且具有较大的表面积,因此可用于药物的负载和传递。
将药物包裹在胶体微粒中,可实现药物的延缓释放和靶向输送,提高药物的生物利用度和疗效。
2. 分离技术:胶体材料可用于固液分离、液液分离和气固分离等领域。
例如,胶体过滤膜可用于分离悬浮固体颗粒,胶体凝胶可用于分离混合溶液中的组分。
3. 光学材料:胶体材料可用于制备光学玻璃、光子晶体和光学涂层等材料。
通过控制胶体微粒的形状和大小,可调控材料的光学性质,实现光学功能的设计和应用。
4. 纳米材料:胶体材料可用于制备纳米材料和纳米复合材料。
通过胶体方法,可以精确控制材料的尺寸、形状和结构,实现对材料性质的调控和功能的设计。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浅议胶体的性质及其应用
摘要:高中化学对物质分类的分散系的基础上在分类得出胶体的概念,从而区
分胶体材料与胶体和进一步完善胶体概念。
由胶体本质和实验得出胶体的性质:丁达尔效应、介稳性、吸附性、渗析、电泳、聚沉。
胶体日常生活中的应用,鉴别
胶体、制豆腐、明矾净水、长江三角洲的形成、墨水、医学透析和输液原理。
关键词: 分散系分类原理
高中化学必修一第二章对物质进行分类,分为纯净物和混合物两大类。
而分
散系是指一种或几种物质以粒子形式分散到另一种物质的混合物。
分散系分分散
质和分散剂;分散质是被分散的物质;分散剂是起容纳分散质的作用的物质。
当
分散剂是水或其他液体时,按分散质粒子直径的大小来分类,可分为溶液、胶体
和浊液。
分散质粒子直径在1~100nm(即10-9m~10-7m)之间的分散系是胶体。
这样就容易区分纳米材料不一定是胶体。
因纳米是长度单位,纳米材料不一定是
分散系,而胶体必须是分散系。
胶体不一定都是胶状物,也不一定是液体。
如:
氢氧化铁胶体、云、雾等。
实际上胶体的分散剂也不一定就是水或其他液体,也
可以是固态或气态。
一、胶体分类
1.照分散剂状态不同分为:气溶胶——以气体作为分散剂的分散体系。
其分
散质可以是液态或固态(如烟、雾等);液溶胶——以液体作为分散剂的分散体系。
其分散质可以是气态、液态或固态(如Fe(OH)3胶体);固溶胶——以固体
作为分散剂的分散体系。
其分散质可以是气态、液态或固态。
2.按分散质的不同可分为:粒子胶体、分子胶体。
如:烟、云、雾是气溶胶;烟水晶、有色玻璃、水晶是固溶胶;蛋白溶液、淀粉溶液是液溶胶;淀粉胶体、
蛋白质胶体是分子胶体;土壤是粒子胶体。
3.常见胶体:Fe(OH)3胶体、Al(OH)3胶体、硅酸胶体、淀粉胶体、蛋白质胶体、豆浆、雾、墨水、涂料、AgI胶体、Ag2S胶体、As2S3胶体、有色玻璃、果冻、鸡蛋清、血液等。
比如面条就是一种常见的淀粉胶体,因为溶解度吸水膨胀。
二、胶体具有的性质
1.丁达尔效应。
丁达尔效应因英国物理学家丁达尔(J.Tyndall,1820-1893)于
1869年发现而得名。
当阳光从窗隙射入暗室,或者光线透过树叶间的缝隙射入密林中时,可以观察到一条光亮的“通路”,这是由于胶体粒子对光线散射(光波偏
离原来方向而分散传播)形成的,这种现象叫做丁达尔效应。
放电影时,放映室
射到银幕上的光柱的形成也属于丁达尔效应。
利用丁达尔效应是区分胶体与溶液
的一种常用物理方法。
作用:常用于区分胶体与溶液和鉴别胶体。
2.介稳性。
胶体具有介稳性的两个原因:一是胶体粒子可以通过吸附而带有
电荷,同种胶粒带同种电荷,而同种电荷会相互排斥(要使胶体聚沉,就要克服
排斥力,消除胶粒所带电荷);二是胶体粒子在不停地做布朗运动,与重力作用
相同时便形成沉降平衡的状态。
介稳性的作用: 农业生产中土壤的保肥作用.土壤
里许多物质如粘土腐殖质等常以胶体形式存在。
3.吸附性。
胶体表面具有吸收物质的性能叫吸附性。
是因为胶体具有很高的
比表面积,而分子结构是多孔型,被吸附物扩散到分子孔道中,附着在内壁上。
吸附性是物理性质。
应用: 明矾的净水。
明矾是十二水硫酸铝钾溶于水电离出铝
离子:
KAl(SO4)2=k++Al3++2SO42-
铝离子水解得到氢氧化铝胶体
Al3++ 3H2O=Al(OH)3(胶体)+3H+
氢氧化铝胶体吸附水中的有色杂质。
不同与氯气和高铁盐的净水原理,不能消毒杀菌。
4.渗析。
渗析,有称透析。
是一种以浓度差为推动力的膜分离操作,利用膜对分散质的选择性透过,实现不同性质分散质的分离。
溶液粒子直径最小,所以既能通过滤纸又能通过半透膜;浊液粒子直径大,既不能通过滤纸又不能通过半透膜;胶体粒子直径剧中,所以能通过滤纸但不能通过半透膜。
渗析的应用:胶体的提纯。
用一玻璃棒横放在一盛有蒸馏水的烧杯口上,把制备的Fe(OH)3胶体盛入鸡蛋皮悬挂在玻璃棒上侵入蒸馏水中。
FeCl3溶液通过鸡蛋皮进入蒸馏水中,达到提纯Fe(OH)3胶体的目的。
5.电泳。
电泳是由于胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里作定向移动的这种现象。
胶粒具有很大的比表面积(比表面积=表面积/颗粒体积),因而有很强的吸附能力,使胶粒表面吸附溶液中的离子。
这样胶粒就带有电荷。
不同的胶粒吸附不同电荷的离子。
一般说,金属氢氧化物、金属氧化物的胶粒吸附阳离子,胶粒带正电。
非金属氧化物、金属硫化物的胶粒吸引阴离子,胶粒带负电。
另外胶体粒子虽然可以带电荷,但整个胶体呈电中性。
胶粒带有相同的电荷,互相排斥,所以胶粒不容易聚集,这是胶体保持稳定的重要原因。
6.聚沉。
向胶体中加入少量的电解质溶液时,由于加入的阳离子或阴离子中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的这个过程叫做聚沉。
另外,带有相反电荷的胶体粒子相混合时,也会发生聚沉。
蓝墨墨水和碳素墨水不能混合使用,因两种墨水胶体带有不同电荷要发生聚沉;医学上输血,血液是胶体,不同血液带有不同电荷,O型血液不带电荷,所以血型匹配才能输血,因同种电荷相互排斥不会聚沉,O型血液不带电荷,也不能发生聚沉;A型与B型血不能混输,说明带有不同电荷,混输后发生聚沉危害生命。
