肌红蛋白(MYO)测定试剂盒(荧光免疫层析法)产品技术要求华科泰
肌红蛋白肌酸激酶心肌肌钙蛋白I三项联合检测试剂盒(胶体金免疫层析法)医疗器械产品注册技术要求

医疗器械产品技术要求编号:肌红蛋白/肌酸激酶/心肌肌钙蛋白I三项联合检测试剂盒(胶体金免疫层析法)1.产品型号/规格及划分说明1.1型号/规格:检测卡1人份/袋。
1.2主要组成成分:每人份含:1.检测试剂:肌红蛋白:由胶体金垫(胶体金标记羊抗鼠MYO单克隆抗体)、硝酸纤维素膜(C线包被羊抗鼠多克隆抗体,T线包被羊抗鼠MYO单克隆抗体)、纤维膜、吸水纸、PVC板;肌酸激酶:由胶体金垫(胶体金标记羊抗鼠CK-MB单克隆抗体)、硝酸纤维素膜(C线包被羊抗鼠多克隆抗体,T线包被羊抗鼠CK-MB单克隆抗体)、纤维膜、吸水纸、PVC板;心肌肌钙蛋白I:由胶体金垫(胶体金标记羊抗鼠cTnI单克隆抗体)、硝酸纤维素膜(C线包被羊抗鼠多克隆抗体,T线包被羊抗鼠cTnI单克隆抗体)、纤维膜、吸水纸、PVC板;2.干燥剂1个;3.滴管1支;4铝箔袋1个。
1.3适用范围适用于体外定性检测人血清、血浆中的肌红蛋白、肌酸激酶、心肌肌钙蛋白I。
1.4产品储存条件及有效期(体外诊断试剂适用)18℃~25℃,密封避光保存,效期为24个月。
2.性能指标2.1物理性状2.1.1外观:检测试纸整洁完整、无毛刺、无破损、无污染。
2.1.2宽度:检测试纸宽度≥2.5mm。
2.1.3移行速度:液体移行速度应不低于10mm/min。
2.2最低检出限 2.2.1肌红蛋白(MYO):最低检出量不高于80ng/ml。
2.2.2肌酸激酶(CK-MB):最低检出量不高于5.0ng/ml。
2.2.3心肌肌钙蛋白I(cTnI):最低检出量不高于1.0ng/ml。
2.3阴性参考品符合率2.3.1肌红蛋白(MYO):检测15ng/ml心肌肌钙蛋白I和50ng/ml肌酸激酶参考品,结果为阴性;检测血红蛋白10mg/ml、胆红素6mg/ml、胆固醇5mg/ml、甘油三酯15mg/ml,均为阴性。
2.3.2肌酸激酶(CK-MB):检测15ng/ml心肌肌钙蛋白I和250ng/ml肌红蛋白参考品,结果为阴性;检测肌酸激酶同工酶CK-MM1000ng/ml、肌酸激酶同工酶CK-BB100ng/ml、胆红素6mg/ml、胆固醇5mg/ml、甘油三酯15mg/ml,均为阴性。
肌红蛋白(MYO)测定试剂盒(免疫比浊法)产品技术要求利德曼

肌红蛋白(MYO)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人体血清或血浆中肌红蛋白的含量。
1.1包装规格试剂1(R1):4×60mL、试剂2(R2):3×60mL;试剂1(R1):1×60mL、试剂2(R2):1×45mL;试剂1(R1):1×45mL、试剂2(R2):1×15mL;试剂1(R1):2×45mL、试剂2(R2):2×15mL;试剂1(R1):1×15mL、试剂2(R2):1×5mL;试剂1(R1):2×75mL、试剂2(R2):2×25mL;试剂1(R1):1×75mL、试剂2(R2):1×25mL;试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):1×60mL、试剂2(R2):1×20mL;试剂1(R1):2×61mL、试剂2(R2):2×21mL;试剂1(R1):1×46mL、试剂2(R2):1×16mL;840测试/盒:【试剂1(R1):2×61mL、试剂2(R2):2×20mL】;校准品(选配):4×1mL;质控品(选配):高、低值两个水平1×3mL、1×1mL。
1.2主要组成成分1.2.1试剂组成试剂1(R1):氨基乙酸缓冲液试剂2(R2):MYO胶乳试剂:被抗人肌红蛋白抗体包裹的聚苯乙烯橡胶等大小颗粒0.12%悬浊液。
1.2.2 校准品的组成四个水平的液体校准品,在50mmol/L pH=7.0 的Capso(3-(环己烷)-1-丙磺酸)缓冲液中添加肌红蛋白纯品,定值范围:(50~150)ng/mL、(150~250)ng/mL、(350~450)ng/mL、(700~900)ng/mL。
肌红蛋白(Myo)测定试剂(荧光免疫层析法)产品技术要求万孚

肌红蛋白(Myo)测定试剂(荧光免疫层析法)
性能指标
1 外观检查
外观应平整,材料附着应牢固,各组份应齐全,卡固定紧密。
2 物理检查
膜条宽应不小于2.0mm;液体移行速度应不低于10mm/min。
3 线性范围
取同一批号的试剂分别对五个浓度的肌红蛋白参考品进行检测,其检测范围为2.0ng/mL~400.0ng/mL,每份参考品重复检测3次,计算相关系数r,其中r值应≥0.9900。
4 精密度
4.1 批内精密度
随机抽取同一批号的试剂10份,分别对同一浓度的肌红蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
4.2 批间精密度
随机抽取连续三个批号的试剂,每个批号取3份分别对同一浓度的肌红蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
5 准确度
用同一批号试剂分别测定三个水平浓度的肌红蛋白参考品,计算样本测定结果均值和相对偏差,其中相对偏差(Bias%)应在±15%内。
6 最低检出限
取同一批号的试剂10份,对配制参考品基质进行检测,计算样本测定结果均值X和标准偏差SD,其中(X+2SD)≤2.0ng/mL。
7 分析特异性
选择同一浓度的肌红蛋白参考品分别加入胆固醇、甘油三酯、胆红素,使干扰物最终浓度胆固醇60mg/mL、甘油三酯40mg/mL、胆红素2mg/mL,各干扰样本重复检测3次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)应在±15%内。
心肌肌钙蛋白I 肌酸激酶同工酶 肌红蛋白检测试剂盒(胶体金免疫层析法)产品技术要求

心肌肌钙蛋白I/肌酸激酶同工酶/肌红蛋白检测试剂盒(胶体金免疫层析法)适用范围:用于体外定性检测人全血,血清或血浆中的心肌肌钙蛋白I、肌酸激酶同工酶CK-MB、肌红蛋白的1.1 产品包装规格1人份/袋、25人份/盒、50人份/盒。
1.2主要组成成分试剂条内含硝酸纤维素膜(NC膜)的检测区(三条T线)分别固有抗人心肌肌钙蛋白I(cTnI)、肌酸激酶同工酶CK-MB和肌红蛋白MYO的抗体,质控区(C)固有以非标记羊抗鼠IgG。
每人份内含1条试剂条、干燥剂一袋、采样滴管一个、密封袋一袋。
2.1 外观2.1.1 外观:试剂盒表面清洁、密封完整、检测条无破损、无污染。
2.1.2 宽度:膜条宽4.0mm,允差±0.2 mm。
2.1.3 爬速:液体移行速度应不低于8mm/min。
2.2检出限心肌肌钙蛋白I最低检出限1.0 ng /ml,CK-MB最低检出限5ng/ml,肌红蛋白最低检出限70ng/ml。
2.3分析特异性2.3.1阴性特异性:将质控品浓度为50μmol/L胆红素、49g/L白蛋白、5mmol/L胆固醇,分别加入到肌钙蛋白I、肌红蛋白、肌酸激酶同工酶的质控品液中对试剂盒进行检测,其浓度相当于0 ng /ml 肌钙蛋白I、0ng/ml肌酸激酶同工酶和0ng/ml肌红蛋白,测试结果应为阴性。
点样15分钟内仅在观察窗上端出现一条红色C对照线。
阴性特异性肌钙蛋白I为100%、肌红蛋白为100%、肌酸激酶同工酶为100%;2.3.2阳性特异性:将质控品浓度为50μmol/L胆红素,49g/L白蛋白,5mmol/L胆固醇分别加入到质控品肌钙蛋白I、肌酸激酶同工酶和肌红蛋白的质控品液中进行测试,其浓度相当于1.0 ng /ml 肌钙蛋白I、5ng/ml肌酸激酶同工酶和70ng/ml肌红蛋白,测试结果应为阳性。
点样15分钟内在观察窗上出现四条红色对照线(一条红色C对照线、一条红色Myo对照线、一条红色CKMB对照线、一条红色TNI对照线)。
体外诊断试剂产品技术要求肌酸激酶同工酶(CKMB)肌红蛋白(Myo)肌钙蛋白I(cTnI)测定试剂盒
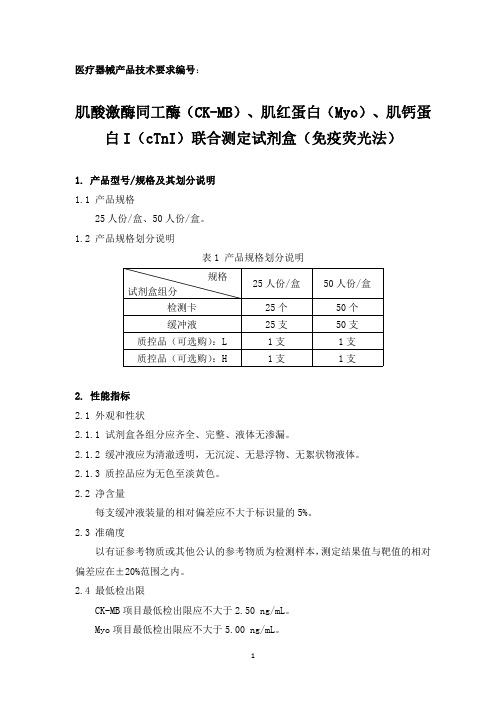
医疗器械产品技术要求编号:肌酸激酶同工酶(CK-MB)、肌红蛋白(Myo)、肌钙蛋白I(cTnI)联合测定试剂盒(免疫荧光法)1.产品型号/规格及其划分说明1.1产品规格25人份/盒、50人份/盒。
1.2产品规格划分说明表1产品规格划分说明规格25人份/盒50人份/盒试剂盒组分检测卡25个50个缓冲液25支50支质控品(可选购):L1支1支质控品(可选购):H1支1支2.性能指标2.1外观和性状2.1.1试剂盒各组分应齐全、完整、液体无渗漏。
2.1.2缓冲液应为清澈透明,无沉淀、无悬浮物、无絮状物液体。
2.1.3质控品应为无色至淡黄色。
2.2净含量每支缓冲液装量的相对偏差应不大于标识量的5%。
2.3准确度以有证参考物质或其他公认的参考物质为检测样本,测定结果值与靶值的相对偏差应在±20%范围之内。
2.4最低检出限CK-MB项目最低检出限应不大于2.50ng/mL。
Myo项目最低检出限应不大于5.00ng/mL。
cTnI 项目最低检出限应不大于0.50ng/mL。
2.5线性范围2.5.1试剂盒检测CK-MB 的线性范围为2.50ng/mL~200.00ng/mL,回归系数r ≥0.990;[2.50,10.00]ng/mL 区间内,测量结果的绝对偏差不大于±3.00ng/mL;[10.01,200.00]ng/mL 区间内,测量结果的相对偏差不大于±15%。
2.5.2试剂盒检测Myo 的线性范围为5.00ng/mL~400.00ng/mL,回归系数r≥0.990;[5.00,20.00]ng/mL 区间内,测量结果的绝对偏差不大于±3.00ng/mL;[20.01,400.00]ng/mL 区间内,测量结果的相对偏差不大于±15%。
2.5.3试剂盒检测cTnI 的线性范围为0.50ng/mL~50.00ng/mL,回归系数r≥0.990;[0.50,2.00]ng/mL 区间内,测量结果的绝对偏差不大于±0.30ng/mL;[2.01,50.00]ng/mL 区间内,测量结果的相对偏差不大于±15%。
肌红蛋白(MYO)测定试剂盒(荧光免疫层析法)产品技术要求华科泰

肌红蛋白(MYO)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中肌红蛋白的含量。
1.1 包装规格10人份/盒、20人份/盒、50人份/盒。
1.2 主要组成成分每盒含10/20/50人份检测卡(每人份包装中含1袋干燥剂)、1个校准信息卡。
主要组成成分见表1:表12.1物理性能2.1.1 外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2 膜条宽度膜条的宽度≥3mm。
2.1.3 移行速度液体移行速度应不低于10 mm/min。
2.2 空白检测限空白检测限应不高于10 ng/mL。
2.3 准确度回收率应在85%~115%之间。
2.4 线性在企业线性范围内[10,500]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性用浓度为(25±2.5) ng/mL、(50±5) ng/mL和(450±45)ng/mL的样本重复检测15次,其变异系数(CV%)应不高于15.0%。
2.6 批间差用3个不同批号的检测卡分别检测浓度为(25±2.5)ng/mL、(150±15)ng/mL 的样本,则批间相对极差(R%)应不高于15.0%。
2.7 特异性表22.8 溯源性根据GB/T 21415-2008的有关规定,校准信息卡溯源至企业工作校准品,并与已上市产品比对赋值。
2.9 稳定性10℃~30℃保存,有效期12个月,效期后2个月内分别检测2.1~2.5、2.7项,其结果应符合各项要求。
肌红蛋白(MYO)测定试剂盒(磁微粒化学发光法)产品技术要求lideman

肌红蛋白(MYO)测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人体血清或血浆中的肌红蛋白(MYO)含量。
1.1规格100测试/盒。
1.2组成试剂盒由校准品、试剂1号、试剂2号、磁分离试剂和质控品组成。
试剂1号(5mL/瓶×2瓶):内容物含荧光素标记肌红蛋白单克隆抗体试剂2号(5mL/瓶×2瓶):内容物含碱性磷酸酶标记肌红蛋白单克隆抗体。
缓冲液:含1%羊血清蛋白、2%马血清蛋白、1%牛血清蛋白等的缓冲溶液。
磁分离试剂(2.5mL/瓶×2瓶):含有0.1%磁性微粒(共价包被抗荧光素抗体)和1%牛血清白蛋白的0.1mol/L Tris缓冲液,含0.2%w/v的NaN。
3校准品(0.5mL/瓶×6瓶):校准品分别含有0、25、100、300、500和1000ng/mL 的肌红蛋白,以含有的0.1mol/L Tris和0.2%w/v NaN的缓冲液配制而成。
3质控品(1.0mL/瓶×2瓶):2个水平,含一定量的肌红蛋白,以含有0.1mol/L Tris 的缓冲液配制而成。
质控范围详见质控单。
和0.2%w/v NaN32.1 试验条件以下所有试验,均要求环境温度为:18℃~25℃。
2.2 外观2.2.1试剂盒各组分应齐全、完整、液体无渗漏;2.2.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.2.3液体组分应澄清,无沉淀或絮状物;2.2.4包装标签应清晰,易识别。
2.3 特异性(交叉反应)试剂盒与表1中有关潜在交叉反应物应无显著的交叉反应表1 交叉反应2.4 准确度回收试验:应在85-115%范围内。
2.5 最低检测限应不大于2ng/mL。
2.6 线性在[2,1000]ng/mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.7 重复性用(60±12)ng/mL和(300±60)ng/mL 的样本各重复检测10次,其变异系数(CV)应不大于10%。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)产品技术要求tongxin

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中肌红蛋白(MYO)的含量。
1.1 包装规格
96人份/盒
1.2 主要组成成分
表1主要组成成分
注:校准品采用贝克曼MYO检测试剂盒(磁颗粒化学发光法)比对赋值,校准品(A~F)目标浓度为0、20、200、1000、2000、3000ng/ml。
2.1 外观
组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量
液体装量应不少于标示值。
2.3 准确度
在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在
85~115%范围内。
2.4 线性
在线性范围 [10,3000]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限
应不大于10ng/ml。
2.6 重复性
变异系数(CV)应不大于10.0%。
2.7 批间差
批间变异系数(CV)应不大于15.0%。
2.8 分析特异性
测定浓度为5mg/ml血红蛋白,交叉反应率小于0.002%。
2.9 稳定性
产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语
4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析
4.2 MYO:Myoglobin肌红蛋白
4.3 RLU:Relative Light Unit相对光单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肌红蛋白(MYO)测定试剂盒(荧光免疫层析法)
适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中肌红蛋白的含量。
1.1 包装规格
10人份/盒、20人份/盒、50人份/盒。
1.2 主要组成成分
每盒含10/20/50人份检测卡(每人份包装中含1袋干燥剂)、1个校准信息卡。
主要组成成分见表1:
表1
2.1物理性能
2.1.1 外观
检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2 膜条宽度
膜条的宽度≥3mm。
2.1.3 移行速度
液体移行速度应不低于10 mm/min。
2.2 空白检测限
空白检测限应不高于10 ng/mL。
2.3 准确度
回收率应在85%~115%之间。
2.4 线性
在企业线性范围内[10,500]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性
用浓度为(25±2.5) ng/mL、(50±5) ng/mL和(450±45)ng/mL的样本重复检测15次,其变异系数(CV%)应不高于15.0%。
2.6 批间差
用3个不同批号的检测卡分别检测浓度为(25±2.5)ng/mL、(150±15)ng/mL 的样本,则批间相对极差(R%)应不高于15.0%。
2.7 特异性
表2
2.8 溯源性
根据GB/T 21415-2008的有关规定,校准信息卡溯源至企业工作校准品,并与已上市产品比对赋值。
2.9 稳定性
10℃~30℃保存,有效期12个月,效期后2个月内分别检测2.1~2.5、2.7项,其结果应符合各项要求。
