(完整版)离子反应与氧化还原反应专题训练(含答案),推荐文档
【押题】离子反应与氧化还原反应--2024年新高考化学(解析版)

专题三离子反应与氧化还原反应【高考押题】1(2024·河北·校联考模拟预测)下列离子方程式与所给事实不相符的是()A.用K3[Fe(CN)6]检验FeSO4中的Fe2+离子:Fe2++K++Fe(CN)63-=KFe Fe(CN)6↓B.一元弱酸次磷酸(H3PO2)与足量的KOH溶液反应:H3PO2+OH-=H2PO-2+H2OC.向ZnS白色悬浊液中滴入CuSO4溶液生成黑色CuS沉淀:ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq)D.向明矾[KAl(SO4)2]溶液中滴加Ba(OH)2溶液,恰好使SO2-4沉淀完全:2Al3++3SO2-4+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓【答案】D【解析】A.用铁氰化钾检验溶液中亚铁离子的反应为溶液中亚铁离子与铁氰酸根离子、钾离子反应生成KFe[Fe(CN)6]蓝色沉淀,反应的离子方程式为Fe2++K++Fe(CN)63-=KFe Fe(CN)6↓,故A正确;B.一元弱酸次磷酸溶液足量的氢氧化钾溶液反应生成次磷酸钾和水,反应的离子方程式为H3PO2+OH-=H2PO-2+H2O,故B正确;C.向硫化锌白色悬浊液中滴入硫酸铜溶液生成黑色硫化铜沉淀发生的反应为硫化锌与硫酸铜溶液反应生成硫酸锌和硫化铜,反应的离子方程式为ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq),故C正确;D.向明矾溶液中加入滴加氢氧化钡溶液恰好使硫酸根离子完全沉淀发生的反应为硫酸铝钾溶液与氢氧化钡溶液反应生成偏铝酸钾、硫酸钡沉淀和水,反应的离子方程式为Al3++2SO2-4+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓+2H2O,故D错误;故选D。
2(2023·河北保定·校联考三模)化学在日常生活工农业生产中的应用非常广泛。
下列化学原理或应用的离子方程式书写正确的是()A.少量SO2通入Ca(ClO)2溶液中:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+B.钢铁浸泡在NaCl溶液中被腐蚀的正极反应:2H2O+2e-=H2↑+2OH-C.向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑D.用石墨电极电解MgCl2溶液:2H2O+2Cl-电解Cl2↑+H2↑+2OH-【答案】C【解析】A.由于SO2少量,ClO-剩余与产生的H+结合为HClO,离子方程式为Ca2++2ClO-+SO2+H2O =CaSO4↓+Cl-+HClO+H+,故A错误;B.钢铁浸泡在NaCl溶液中发生吸氧腐蚀,其正极反应:O2+4e-+2H2O=4OH-,故B错误;C.向硫酸铜溶液中加入过量的NaHS溶液,发生复分解反应,生成CuS沉淀和H2S气体,离子方程式为:Cu2++2HS-=CuS↓+H2S↑,故C正确;D.用石墨电极电解MgCl2溶液时:溶液中的Mg2+会与阴极产生的OH-生成Mg(OH)2,总反应式为:2H2O+2Cl-+Mg2+通电Cl2↑+H2↑+Mg OH2↓,故D错误;故选C。
高中化学《离子反应、氧化还原反应》测试题及答案

高中化学《离子反应、氧化还原反应》测试题及答案I 卷(非选择题)一、选择题(本题包括17小题,每小题只有一个选项符合题意,将正确选项填 入答题表中,每小题3分,共51分)1.根据下列反应:(1)2FeCl 3+2HI=2FeCl 2+I 2+2HCl(2)2KMnO 4+16HCl=2MnCl 2+5Cl 2↑+2KCl+8H 2O (3)2FeCl 2+Cl 2=2FeCl 3若要从含有Fe 2+、I -、Cl -的混合溶液中,只除去I -,而Fe 2+和Cl -不被氧化,应向混合溶液中加入A .KMnO 4B .Cl 2C .FeCl 3D .HCl2.下列氧化还原反应中,水作为氧化剂的是A .CO +H 2O=====高温CO 2+H 2B .3NO 2+H 2O===2HNO 3+NOC .2Na 2O 2+2H 2O===4NaOH +O 2↑D .2F 2+2H 2O===4HF +O 2 3.下列化学反应的离子方程式正确的是:A .在稀氨水中通入过量CO 2: NH 3·H 2O + CO 2 = NH 4++ HCO 3--B .少量SO 2通入Ca(ClO)2溶液中:SO 2 + H 2O + Ca2+ + 2ClO --= CaSO3↓+2HClOC .用稀HNO 3溶解FeS 固体:FeS + 2H +-= Fe 2++ H 2S ↑D .氢氧化钙溶液与等物质的量的稀硫酸混合:Ca 2++ OH --+ H ++ SO 42-=CaSO 4↓+H 2O4.下列说法正确的是( )A .难溶于水的电解质一定是弱电解质B .强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强C .某物质若不是电解质,就一定是非电解质D .溶于水的强电解质,在水溶液中全部电离成离子5.(2010·东城区模拟)三氟化氮(NF 3)是微电子工业中优良的等离子刻蚀气体,它在潮湿 的环境中能发生反应:3NF 3+5H 2O===2NO +HNO 3+9HF.下列有关说法正确的是A .NF 3是氧化剂,H 2O 是还原剂B .还原剂与氧化剂的物质的量之比为2∶1C .若生成0.2 mol HNO 3,则转移0.2 mol 电子D .NF 3在潮湿的空气中泄漏会产生红棕色气体6.阿波罗宇宙飞船以N 2H 4(联氨)和N 2O 4为推力源,反应温度达2700℃,反应式为 2N 2H 4+N 2O 4=3N 2+4H 2O 。
高一化学氧化还原反应、离子反应综合练习(附答案)
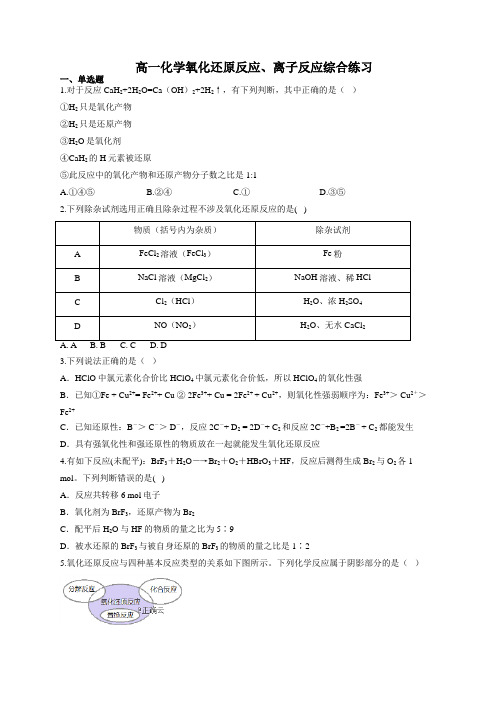
高一化学氧化还原反应、离子反应综合练习一、单选题1.对于反应CaH2+2H2O=Ca(OH)2+2H2↑,有下列判断,其中正确的是()①H2只是氧化产物②H2只是还原产物③H2O是氧化剂④CaH2的H元素被还原⑤此反应中的氧化产物和还原产物分子数之比是1:1A.①④⑤B.②④C.①D.③⑤2.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )物质(括号内为杂质)除杂试剂A FeCl2溶液(FeCl3)Fe粉B NaCl溶液(MgCl2)NaOH溶液、稀HClC Cl2(HCl)H2O、浓H2SO4D NO(NO2)H2O、无水CaCl23.下列说法正确的是()A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强B.已知①Fe + Cu2+= Fe2++ Cu ② 2Fe3++ Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为:Fe3+> Cu2+>Fe2+C.已知还原性:B-> C-> D-,反应2C-+ D2 = 2D-+ C2和反应2C-+B2 =2B-+ C2 都能发生D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应4.有如下反应(未配平):BrF3+H2O―→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。
下列判断错误的是( )A.反应共转移6 mol电子B.氧化剂为BrF3,还原产物为Br2C.配平后H2O与HF的物质的量之比为5∶9D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶25.氧化还原反应与四种基本反应类型的关系如下图所示。
下列化学反应属于阴影部分的是()A. 324NH +5O 24NO+6H OB. ()2224Fe OH +O +2H O ()34Fe OHC. 32NaHCO 2322Na CO +H O+CO ↑D. 2Cl +2NaBr22NaCl+Br6.SO 2气体与足量Fe 2(SO 4)3溶液完全反应后,再加入K 2Cr 2O 7溶液,发生如下两个化学反应: ①SO 2+2Fe 3++2H 2O 24SO -+2Fe 2++4H +;②227Cr O -+6Fe 2++14H +2Cr 3++6Fe 3++7H 2O 。
离子反应与氧化还原反应专题训练(含答案)

离子反应和氧化还原反应专题训练1、下列离子方程式正确的是( )A、澄清石灰水与稀盐酸反应 Ca(OH)2 + 2H+=Ca2+ + 2H20B、碳酸钠溶液与盐酸反应 Na2CO3 + 2H+ =2Na+ + H2O + CO2↑C、稀硫酸与氢氧化钡溶液反应 H+ + OH- +Ba2+ +SO42-=H2O+ BaSO4↓D、氢氧化铜与稀硫酸反应 Cu(OH)2 + 2H+= Cu2+ +2H2O2、下列离子方程式中正确的是()A、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑B、向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+= BaSO4↓C、向稀硫酸溶液中加铁:2Fe + 6 H+ =2Fe3+ +3H2↑D、向硝酸银溶液中加盐酸:Ag+ + Cl- = AgCl↓3、下列离子方程式中错误的是()A、铁与稀硫酸反应 2Fe + 6 H+ =2Fe3+ +3H2↑B、碳酸镁与H2SO4反应 MgCO3 + 2H+ = Mg2+ + H2O + CO2↑C、向澄清石灰水中通入过量的CO2气体 CO2+ 2OH- = HCO3-D、澄清石灰水与盐酸的反应 H+ + OH-= H2O4、在水溶液中,下列各组离子能大量共存的是()A、Na+、SO42- 、Cl-B、Ba2+、SO42- 、OH-C、Ca2+、CO32-、Cl-D、OH- 、H+、Cl-5、在强酸无色透明溶液中,下列各组离子能大量共存的是()A、Fe3+、K+、Cl-、NO3-B、Ag+、Na+、NO3-、Cl-C、Zn2+、Al3+、SO42-、Cl-D、Ba2+、NH4+、Cl-、HCO3-6、室温下,强酸性和强碱性中都不能大量共存的离子组是()A、NH4+、Cu2+、Cl-、NO3-B、K+、Na+、SO32-、S2-C、K+、Na+、SO42-、AlO2-D、Ba2+、Fe2+、NO3-、Br-7、向0.1mol/L的NaOH溶液中通入过量的CO2后,溶液中存在的主要离子有()A、Na+ 、CO32-B、Na+、HCO3-C、HCO3-、CO32-D、Na+、OH-8、下列各组离子,在指定环境中能大量共存的是()A、常温下,在PH>7的溶液中, Na+、 S2-、 K+、AlO2-B、常温下,在PH>1的溶液中, SO32-、S2-、 K+ 、 NH4+C、常温下,在PH<7的溶液中, Fe3+、 Cu2+、 Cl-、 NO3-D、常温下,在PH=1的溶液中, Fe2+、HCO3-、 Na+、SO42-9、在给定的四种溶液中加入以下各种离子,能在原溶液中较大量共存的是()A、PH=1的溶液:Cu2+、Na+、Mg2+、NO3-B、滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、NO3-C、所含溶质为NaOH的溶液中:K+、SO42-、NO3-、 OH-D、在碱性溶液中:K+、HCO3-、Br-、Ba2+10.某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。
高三化学氧化还原反应、离子反应练习含答案

氧化还原、离子反应一.选择题1.下列反应中,CO 2做氧化剂的是A .CO 2被过氧化钠固体吸收,有氧气生成B .镁条在CO 2中燃烧,有黑色固体生成C .将足量CO 2通入氨水中,有碳酸氢铵生成D .将CO 2通入苯酚钠溶液中,有白色浑浊物生成 2.某工业生产中存在如下转化关系:下列说法错误的是A .转化关系中涉及的反应均是氧化还原反应B .转化关系中PdCl 2既作氧化剂又是氧化产物C .转化关系中Pd 、PdCl 2、CuCl 、CuCl 2作催化剂D .整个生产过程可表示为2CH 2CH 2+O 22CH 3CHO3.水热法制备Fe 3O 4纳米颗粒的反应是3Fe 2++2S 2O 2-3+O 2+x OH-Fe 3O 4+S 4O 2-6+2H 2O ,下列说法正确的是( )A .x =2B .参加反应的Fe 2+全部作还原剂C .每生成1 mol Fe 3O 4,被S 2O 2-3还原的O 2为0.5 molD .1 mol Fe 2+被氧化时,被Fe 2+还原的O 2的物质的量为1/3 mol 4.根据表中信息判断,下列选项正确的是 ( )A .第①组反应的其余产物为H 20B .第②组反应中Cl 2与FeBr 2的物质的量之比小于或等于1:2C .第③组反应中生成1 mol Cl 2,转移电子5 molD .氧化性由强到弱顺序为Mn04-->Cl 2 >Fe 3+>Br 25.向含有Fe 2+、I −、Br −的溶液中通入适量Cl 2,溶液中各离子的物质的量变化如图所示。
下列有关说法正确的是A .线段BC 代表Cl −数目的变化情况B .原混合溶液中c (FeBr 2)=6 mol·L −1C .当通入 2 mol Cl 2时,溶液中已发生的离子反应可表示为2Fe 2++2I −+2Cl22Fe 3++I 2+4Cl −D .原溶液中n (Fe 2+)∶n (I −)∶n (Br −)=2∶2∶3 6.下列解释实验事实的离子方程式正确的是A .将Na 2O 2固体投入H 182O 中:2Na 2O 2+2H 182O===4Na ++4OH -+18O 2↑ B .明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al 3++2SO 2-4+2Ba 2++3OH -===Al(OH)3↓+2BaSO 4↓C .误将洁厕灵与消毒液混合:2H ++Cl -+ClO -===Cl 2↑+H 2OD .明矾溶液中滴入Ba(OH)2溶液使SO 42-恰好完全沉淀:2Ba 2++3OH -+Al 3++2SO 42-2BaSO 4↓+Al(OH)3↓7.水溶液中可能存在Na +、Al 3+、Fe 2+、NH +4、NO -3、CO 2-3、SO 2-4中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验:下列判断正确的是( )A .气体A 一定是CO 2,气体B 一定是NH 3 B .白色沉淀一定是Al(OH)3C .溶液中一定存在Al 3+、Fe 2+、NO -3、NH +4D .溶液中一定不存在大量Na +8.溶液中可能含有H +、NH +4、Mg 2+、Al 3+、Fe 3+、CO 2-3、SO 2-4、NO -3中的几种。
离子反应、氧化还原反应练习(总练习)

离子反应练习一、选择题1.以下物质的水溶液能导电,但其本身属于非电解质的是〔〕A.液氯B.干冰C.酒精D.硫酸钡2.以下属于强电解质的是〔〕①NaOH ②NH3·H2O ③AgCl ④醋酸⑤NaHCO3A.①②⑤B.①③④C.②③④D.①③⑤3.以下反应中是离子反应,但不是氧化复原反应的是〔〕A.氯化钠溶液中滴入硝酸银溶液B.金属钠在氯气中燃烧C.铁片置于硫酸铜溶液中D.金属钠放入水中生成氢氧化钠和氢气4.以下四种物质的溶液,其中一种与其它三种能发生离子反应,这种物质是〔〕A.H2SO4B.KOH C.BaCl2D.Na2CO35.BaCO3与稀硝酸反应,正确的离子方程式是〔〕A.Ba2++ CO32-+2H+=Ba(NO3)2+ H2O+CO2↑B.BaCO3+2H++2NO3-= Ba(NO3)2+ H2O+CO2↑C.BaCO3+2H+= Ba2++ H2O+CO2↑D.CO32-+2H+= H2O+CO2↑6.已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是〔〕A.SO42-B.Cl-C.OH-D.CO32-7.能用H++OH-=H2O表示的化学方程式有〔〕A.氢氧化钠溶液与醋酸反应B.氢氧化铁与硫酸反应C.氢氧化钡与硫酸反应D.硫酸氢钠与氢氧化钠溶液反应8.有四位同学分别对四种溶液中所含的离子进行检测,所得结果如下,其中所得结果错误的选项是〔〕A.K+、Na+、Cl-、NO3-B.OH-、CO32-、Cl-、K+C.Ba2+、Na+、OH-、NO3-D.Cu2+、NO3-、OH-、Cl-9.以下离子方程式书写正确的选项是〔〕A.饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2OB.稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑C.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2OD.小苏打溶于醋酸溶液:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑10.以下各组的两种物质在溶液中的反应,可用同一离子方程式表示的是〔〕A.Cu(OH)2与盐酸,Cu(OH)2与醋酸B.BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液C.NaHCO3溶液与盐酸,Na2CO3溶液与盐酸D.石灰石与硝酸反应,石灰石与盐酸11.〔双选〕以下各组溶液,不用其他试剂,就可以将它们区别开来的是〔〕A.盐酸,氢氧化钠,碳酸钠,硫酸钠B.盐酸,氢氧化钠,酚酞,硫酸铜C.氢氧化钠,硫酸镁,碳酸钠,硫酸氢钠D.氯化钡,硫酸钠,氯化钙,硝酸钙二、填空题12.现有以下物质:①NaCl晶体②液态SO3③液态的醋酸④汞⑤BaSO4固体⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化KNO3 ⑨纯水。
(完整版)离子反应与氧化还原反应专题训练(含答案),推荐文档

高三化学离子反应与氧化还原反应专题训练1.在pH=1的某无色溶液中能大量共存的离子组是( )A.NH4+、Mg2+、SO42-、Cl-B.Ba2+、K+、OH-、NO3-C.Al3+、Cu2+ 、SO42-、Cl-D.Na+、Ca2+、AlO2-、Cl-2下列反应中,Na2O2既不是氧化剂又不是还原剂的是 ()A.2Na2O2+2H2O=4NaOH+O2↑ B.2Na2O2+2CO2=2Na2CO3+O2↑C.2Na2O2+H2SO4=Na2SO4+H2O2D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O3.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是()A.2NaBr+Cl2=2NaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)↓+3NaCl3C.3S+6KOH=2K2S+K2SO3+3H2O D.NH4Cl+NaNO2=NaCl+N2↑+2H2O4.在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是() A.Na+、Fe2+、Br-、Cl-B.Al3+、K+、NH4+、Na+C.K+、Na+、NO3-、H+D.K+、S2-、SO42-、OH-5.下列离子方程式书写正确的是() A.向碳酸氢钠溶液中滴入氢氧化钠HCO3-+OH-=CO32-+H2OB.向碳酸氢钾溶液中滴入过量澄清石灰水2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓C.次氯酸钠溶液中通入过量的二氧化硫ClO-+SO2+H2O=HSO3-+HClOD.硫酸铜和氢氧化钡溶液混合Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓6.下列离子方程式中正确的是()A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH—+H++SO42—BaSO4↓+H2O电解B.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑C.三氯化铝溶液跟过量氨水反应:Al3++3NH3·H2O Al (OH)3↓+3NH4+D.铜片投入稀HNO3溶液:Cu + NO3-+ 4H+ = Cu2+ + 2H2O + NO↑7.下列各种溶液中,一定不能大量共存的离子组是() A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-B.由水电离的c(H+)=10-14mol·L-1的溶液中:Na+、AlO2-、S2-、SO42-C .含有大量Fe 3+的溶液中:Mg 2+、Al 3+、Cu 2+、SO 42-D .使紫色石蕊试液变红色的溶液中:K +、Na +、Ca 2+、HCO 3-8.K 35ClO 3晶体与H 37Cl 溶液反应生成氯气、氯化钾和水,此反应生成的氯气的相对分子质量为 ( )A .73.3B .73C .74D .70.69.较活泼的金属锌与不同浓度的硝酸反应时,可得到不同价态的还原产物。
【高三化学专题测试】离子反应与氧化还原反应(解析版)

专题测试【满分:100分时间:90分钟】一、选择题(本题共包括15小题,每小题4分,共60分)1.人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。
下列叙述不正确的是()A.亚硝酸盐被还原B.维生素C是还原剂C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐与一氧化碳使人中毒的原理相同【解析】亚硝酸盐将Fe2+氧化为Fe3+,所以亚硝酸盐应被还原,故A正确;服用维生素C可解毒,则维生素C可将Fe3+还原为Fe2+,维生素C作还原剂,故B、C均正确;一氧化碳的毒性主要体现在能与血红蛋白结合,从而使血红蛋白失去运输氧气的能力,与亚硝酸盐使人中毒原理不同,故D错误。
【答案】D2.某离子反应涉及H+、Bi3+、MnO-4、BiO-3、Mn2+、H2O六种微粒。
其中c(MnO-4)随反应进行逐渐增大。
下列判断错误的是()A.该反应的还原产物为Bi3+B.氧化剂与还原剂的物质的量之比为5∶2C.反应后溶液的酸性明显增强D.若有1 mol还原剂参加反应,转移电子的物质的量为5 mol【解析】根据题意c(MnO-4)随反应进行逐渐增大,这说明MnO-4是生成物,则Mn2+是反应物,即锰元素的化合价从+2价升高到+7价,Mn2+作还原剂,则BiO-3是氧化剂,铋元素化合价从+5价降低到+3价,则该反应的还原产物为Bi3+,A项正确;根据得失电子守恒可知氧化剂与还原剂的物质的量之比为5∶2,B项正确;根据以上分析可知该反应的离子方程式为14H++5BiO-3+2Mn2+===5Bi3++2MnO-4+7H2O,因此反应后溶液的酸性明显减弱,C项错误;根据以上分析可知若有1 mol还原剂参加反应,转移电子的物质的量为5 mol,D项正确。
【答案】C3.向暗红色CrO3固体表面喷洒酒精会剧烈反应,生成绿色固体Cr2O3,同时有具有刺激性气味的乙醛生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学
离子反应与氧化还原反应专题训练
1.在pH=1的某无色溶液中能大量共存的离子组是( )A.NH4+、Mg2+、SO42-、Cl-B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+ 、SO42-、Cl-D.Na+、Ca2+、AlO2-、Cl-
2下列反应中,Na2O2既不是氧化剂又不是还原剂的是 ()A.2Na2O2+2H2O=4NaOH+O2↑ B.2Na2O2+2CO2=2Na2CO3+O2↑
C.2Na2O2+H2SO4=Na2SO4+H2O2D.3Na2O2(熔融)
+Fe2O3=2Na2FeO4+Na2O
3.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是()
A.2NaBr+Cl2=2NaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)
↓+3NaCl
3
C.3S+6KOH=2K2S+K2SO3+3H2O D.NH4Cl+NaNO2=NaCl+N2↑+2H2O
4.在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是() A.Na+、Fe2+、Br-、Cl-B.Al3+、K+、NH4+、Na+
C.K+、Na+、NO3-、H+D.K+、S2-、SO42-、OH-
5.下列离子方程式书写正确的是() A.向碳酸氢钠溶液中滴入氢氧化钠HCO3-+OH-=CO32-+H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水
2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓
C.次氯酸钠溶液中通入过量的二氧化硫ClO-+SO2+H2O=HSO3-+HClO
D.硫酸铜和氢氧化钡溶液混合Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
6.下列离子方程式中正确的是()A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
Ba2++OH—+H++SO42—BaSO4↓+H2O
电解
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
C.三氯化铝溶液跟过量氨水反应:Al3++3NH3·H2O Al (OH)3↓+3NH4+
D.铜片投入稀HNO3溶液:Cu + NO3-+ 4H+ = Cu2+ + 2H2O + NO↑
7.下列各种溶液中,一定不能大量共存的离子组是() A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离的c(H+)=10-14mol·L-1的溶液中:Na+、AlO2-、S2-、SO42-
C .含有大量Fe 3+的溶液中:Mg 2+、Al 3+、Cu 2+、SO 42-
D .使紫色石蕊试液变红色的溶液中:K +、Na +、Ca 2+、HCO 3-
8.K 35ClO 3晶体与H 37Cl 溶液反应生成氯气、氯化钾和水,此反应生成的氯气的相对分子
质量为 ( )
A .73.3
B .73
C .74
D .70.6
9.较活泼的金属锌与不同浓度的硝酸反应时,可得到不同价态的还原产物。
如果已反应的锌与被还原的硝酸的物质的量之比为4:1,则硝酸的还原产物可能为 ( ) A .NO 2 B .NO
C .N 2O
D .NH 4NO 3 .
10.向含0.78mol 的FeCl 2溶液中通人0.09molCl 2,再加入含0.1mol X 2O 72-的酸性溶液,
使溶液中Fe 2+全部恰好氧化,而X 2O 72-变成X n +,则下列说法不正确的是 ( )
A .FeCl 2是还原剂
B .X n +是还原产物
C .n 的值是3
D .Fe 3+是还原产
物
11.某稀溶液中含有Fe(NO 3)3、Cu(NO 3)3、HNO 3,向其中逐渐加入铁粉,
溶液中Fe 2+的浓度(纵坐标/mol·L -1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。
则溶液中Fe(NO 3)3、Cu(NO 3)3、HNO 3物质的量浓度之比为
(
)
A .1∶1∶1
B .1∶3∶1
C .3∶3∶8
D .1∶1∶4
12.G 、Q 、X 、Y 、Z 均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平): ① G → Q + NaCl
② Q + H 2
O
X + H 2
③ Y + NaOH → G+ Q+H 2O ④ Z + NaOH → Q + X + H 2O
这五种化合物中,氯的化合价由低到高的顺序为
( )
A .GYZQX
B .GYQZX
C .QGZYX
D .ZXGYQ
13.配平下列离子方程式,并回答问题:
(1) Fe(OH)3+ +ClO -+ OH -= FeO 4n -+ Cl -+ H 2O (2)若有3.21gFe(OH)3参加反应,共转移了5.418×1022个电子,则n = ,FeO 4n -
中铁的化合价为 。
(3)试推测FeO 4n -能与下列哪些物质反应(填序号) 。
A .Cl 2
B .SO 2
C .H 2S
D .O 2
14.某主族元素R 形成的离子R 3+最外层有两个电子,在碱性条件下,R 3+可被Cl 2氧化成带一个单位负电荷的含氧酸根阴离子,该阴离子在酸性条件下能将Mn 2+氧化成
MnO 4-,同时本身又被还原为R 3+。
试写出其中两个反应的离子方程式(不必确定R 为何种元素):
电解
(1)_______________________________________________________________________;
(2)
_______________________________________________________________________。
15.在含有1 mol FeBr2的溶液中,通入Cl2的物质的量为x mol。
当x为不同值时,有不同
的反应和不同的产物。
试根据要求填写下表的空格:
x的取值离子反应方程式产物的化学式
2 Fe2+ + Cl2 2 Fe3+ + 2 Cl-
FeCl3Br2 x = 1 mol
16.已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe +
b NO3-+
c H+ =
d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O化学计量数a-k均为正
整数)。
回答下列问题:
⑴根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个
代数式表示。
下同)
⑵根据反应中离子的电荷守恒,可得b、c、d、f的关系式是
⑶根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
⑷若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是;c的取值范
围是。
17.某无色溶液,其中可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-。
取该溶液进行有关实验,实验结果如下图所示。
请回答下列问题:
(1)沉淀甲的化学式为;
(2)由溶液甲生成沉淀乙的离子方程式为_______________;
(3)沉淀丙中一定含有(填化学式,下同),可能含有;
(4)综合上述信息,该溶液中肯定存在的离子有___________________。
高三化学
离子反应与氧化还原反应专题训练
参考答案
1.A 2.C 3.D 4.D 5.AD 6.BC
7.AD 8.A 9.CD 10.D 11.D 12.B
13.(1)2 5-n2n 2 5-n n+3
(2) 2 +6
(3) B C
14.(1) R3+ + Cl2 + 6OH-RO3-+ 2 Cl-+ 3H2O
(2) 2Mn2+ + 5RO3-+ 14H+2MnO4-+ 5R3+ + 7H2O
15 .
x的取值(n的表达式)离子反应方程式产物的化学式x ≤ 0.5 mol 2 Fe2+ + Cl2=2 Fe3+ + 2 Cl-FeCl3FeBr3 x≥ 1.5 mol 2 Fe2+ + 4 Br-+ 3 Cl2=2 Fe3+ + 2Br2 + 6 Cl-FeCl3Br2 x = 1 mol 2 Fe2+ + 2 Br-+ 2 Cl2=2 Fe3+ + Br2 + 4 Cl-FeCl3 FeBr3 Br2
16.(1) c = 4 g + 10 h
(2) c-b =2 d + 3 f
(3) 2 d + 3 f = 3 g +8h
(4) 6~12 30~48
17.⑴S
⑵Al3++3HCO3-Al(OH)3↓+3CO2↑
⑶BaCO3、BaSO4
⑷S2-、SO3+、AlO2-、Na+。
