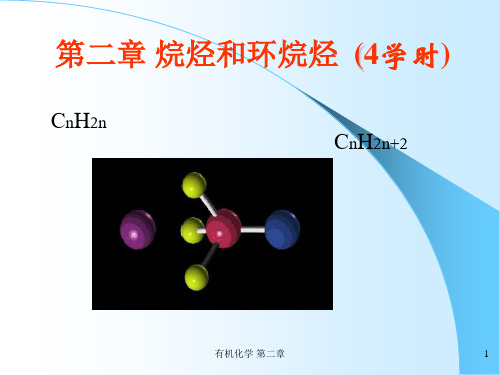
有机化学c2 饱和烃
合集下载
大学有机化学第二章饱和烃

绿色化学与可持 续发展
随着环保意识的提高,绿色 化学和可持续发展已成为有 机化学的重要发展方向。研 究和发展环境友好、资源节 约的合成方法与技术,对于 实现可持续发展具有重要意 义。
计算机辅助ห้องสมุดไป่ตู้机 合成设计
随着计算机科学的发展,利 用计算机辅助设计工具进行 有机合成已成为可能。这种 方法有助于提高合成效率和 降低成本,为有机化学的发 展开辟了新的途径。
环烷烃的化学性质
01
02
03
加成反应
环烷烃中的碳碳单键可以 被氢气、卤素等试剂加成, 生成相应的烷基卤化物或 醇类。
开环反应
在酸或碱催化下,环烷烃 可以发生开环反应,生成 链状烷烃。
氧化反应
环烷烃在常温下容易被氧 化剂氧化,生成酮、醛等 化合物。
05 不饱和烃
烯烃和炔烃的结构
烯烃结构
烯烃是含有碳碳双键的烃类,双 键连接的两个碳原子为sp2杂化, 双键中的一根键为π键,另一根
命名法
系统命名法
根据国际纯粹与应用化学联合会 (IUPAC)的规定,采用系统命名法 对饱和烃进行命名。主要依据碳链的 长度和取代基的种类、位置来确定烃 的名称。
习惯命名法
对于一些简单的饱和烃,可以采用习 惯命名法,如甲烷、乙烷、丙烷等。
03 烷烃
烷烃的结构
烷烃由碳原子和氢原子组成, 碳原子之间通过单键连接,形 成链状或环状结构。
重要性及应用
01
基础理论
烷烃是学习有机化学的基础,对 于理解其他烃类和有机化合物的 性质至关重要。
工业应用
02
03
科学研究
烷烃是石油工业的主要组成部分, 用于生产燃料、润滑油、溶剂等。
烷烃是合成其他有机化合物的重 要原料,在药物合成、材料科学 等领域有广泛应用。
有机化学02第二章饱和烃烷烃

H
H
H H
H
HH
H
H
H
2H之间的距离: 0.250nm 2H原子的范德华半径之和:
H
H
0.229nm
0.24nm
交叉式: 0.250nm > 0.24nm 无范氏张力
重迭式:
0.229nm<0.24nm 有范氏张力
24
乙烷分子的构象稳定性和内能变化
➢扭转能:使构象之间转化所需要的能量。
构象的稳定性与内能有关. 内能低,稳定;内能高,不稳 定。内能最低的稳定构象称优势构象。
➢书写规则:
1)相同取代基合并,数目用汉文数字二、三 ...表示; 2)取代基位号用阿拉伯数字表示; 3)阿拉伯数字与汉字之间必须用短横线分开; 4)阿拉伯数字之间必须用逗号分开。 5) 中文名称按基团次序规则,较小的基团列在前
CH3 C5H3__C4 H___C3 H __2C__C1 H3
CH3 CH2
☺杂化过程:
2p1x 2p1y 2pz 2s2
激发
1s2
2s1 2p1x 2p1y 2p1z
杂化
1s2
2s轨道的能量与 2p较接近,2s上 的1个电子可以 激发到2pz空轨 道上。
激发态的碳原子 有4个单电子,但 轨道能量不等。
2s1 2p1x 2p1y 2p1z
1s2
杂化形成4个能量相 等的新轨道sp3轨道
杂化
19
3 烷烃分子的形成
+
sp3 s
sp3-s
+
sp3
sp3
sp3-sp3
+
+6
20
σ- 键: 形成:由原子轨道头碰头重迭而形成. 特征:电子云沿键轴呈圆柱状对称分布,成键两原子可 围绕键轴自由旋转不会影响电子云密度的分布。
有机化学-第五章

第五章 饱和烃
5.1 饱和烃的结构和分类 5.2 链烷烃的物理性质 5.3 烷烃的化学性质
卤代反应的机理 烷烃的其他取代反应 烷烃的氧化反应 裂解及异构反应
5.4 环烷烃的化学性质
烃:分子中只含碳、氢两种元素的化合物 统称为碳氢化合物,简称为烃。烃是有机化合 物最基本的化合物,也是有机化学工业的基础 原料。
硝化反应产物复杂,除取代反应外,还有烃分子断链的 反应。 硝化反应属自由基型反应机理:
开始的· NO2来自硝酸中,· NO2是个含奇数电子的中性物种, 是一个自由基。 硝化产物作为工业溶剂,如用硝基戊烷作为纤维素酯和 合成树脂的溶剂;硝基甲烷是有机合反应的重要原料。
二. 氯磺酰化反应
烃分子中的氢被氯磺酰基(-SO2Cl)取代的反应称为 氯磺酰化反应。 常用的氯磺酰化试剂有:硫酰氯(SO2Cl2)或氯和二 氧化硫。
5469.2
2,2-二甲基己 烷
5462.1
2,2,3,3-四 甲基丁烷
5455.4
烃氧化反应的产物都是 CO2 和 H2O ,燃烧焓 -Δ Hθ 值反映了反应物的焓 Hθ反应物,即反映了异构体的 稳定性: 正构CnH2n+2 比 异构CnH2n+2 能量高,不稳定 在CnH2n+2中:支键数增多,HØ值小,稳定 每一摩尔 -CH2- 的 -ΔHθ ≈ 660 kJ· mol-1 烷烃的最大用途就是作为燃料,是目前人类的主要能 源。 合理利用现有能源,开发新的能量是人类生存面临的 主要问题之一。
可用反应--能量图表示这一反应过程:
在这一反应过程中,C 原子的杂化状态是由 Csp3 向 Csp2 的转变过程,中间体· CH3的 C 的构型是 sp2 杂化, 即平面构型。 生成的· CH3中间体的能量很高,极活泼, 很快与Cl2反应:
5.1 饱和烃的结构和分类 5.2 链烷烃的物理性质 5.3 烷烃的化学性质
卤代反应的机理 烷烃的其他取代反应 烷烃的氧化反应 裂解及异构反应
5.4 环烷烃的化学性质
烃:分子中只含碳、氢两种元素的化合物 统称为碳氢化合物,简称为烃。烃是有机化合 物最基本的化合物,也是有机化学工业的基础 原料。
硝化反应产物复杂,除取代反应外,还有烃分子断链的 反应。 硝化反应属自由基型反应机理:
开始的· NO2来自硝酸中,· NO2是个含奇数电子的中性物种, 是一个自由基。 硝化产物作为工业溶剂,如用硝基戊烷作为纤维素酯和 合成树脂的溶剂;硝基甲烷是有机合反应的重要原料。
二. 氯磺酰化反应
烃分子中的氢被氯磺酰基(-SO2Cl)取代的反应称为 氯磺酰化反应。 常用的氯磺酰化试剂有:硫酰氯(SO2Cl2)或氯和二 氧化硫。
5469.2
2,2-二甲基己 烷
5462.1
2,2,3,3-四 甲基丁烷
5455.4
烃氧化反应的产物都是 CO2 和 H2O ,燃烧焓 -Δ Hθ 值反映了反应物的焓 Hθ反应物,即反映了异构体的 稳定性: 正构CnH2n+2 比 异构CnH2n+2 能量高,不稳定 在CnH2n+2中:支键数增多,HØ值小,稳定 每一摩尔 -CH2- 的 -ΔHθ ≈ 660 kJ· mol-1 烷烃的最大用途就是作为燃料,是目前人类的主要能 源。 合理利用现有能源,开发新的能量是人类生存面临的 主要问题之一。
可用反应--能量图表示这一反应过程:
在这一反应过程中,C 原子的杂化状态是由 Csp3 向 Csp2 的转变过程,中间体· CH3的 C 的构型是 sp2 杂化, 即平面构型。 生成的· CH3中间体的能量很高,极活泼, 很快与Cl2反应:
有机化学第2章饱和烃

CH3 CH3CH2CH2CH2CH3 CH3 CH CH2CH3 CH3 CH3 C CH3 CH3
沸点℃
36
28
9.5
2. 熔点
烷烃熔点(mp)的变化基本上与沸点相似,直链烷烃的熔点变化 也是随着相对分子质量的增减而相应增减。但因在晶体中,分子间 的作用力不仅取决于分子的大小,而且与晶体中晶格排列的对称性 有关,对称性大的烷烃晶格排列比较紧密,熔点相对要高些。
沸点是与分子间的作用力——van der Waals力有关的,烷烃是非极 性分子,van der Waals力主要产生于色散力。
直链烷烃的沸点与分子中所含碳原子数的关系图 一般在常温常压下,四个碳以下的直链烷烃是气体,由戊烷开始 是液体,大于十七个碳的烷烃是固体。
在碳原子数相同的烷烃异构体中,含支链越多的烷烃,相应 沸点越低。
为了使成键电子之间的排斥力最小、最稳定,四个sp3杂化轨 道在空间的排布,是以碳原子为中心,四个轨道分别指向正四面体 的四个顶点,使sp3 杂化轨道具有方向性。同时两个轨道对称轴之 间的夹角 (键角)为109.5°。
1/4s + 3/4p
2. σ键的形成及其特性
原子轨道沿核间联线(键轴)相互交盖,形成对键轴呈圆柱形对称 的轨道,称为σ轨道。σ轨道上的电子称为σ电子。 σ轨道构成的共价 键称为σ键。
当含有不止一个相等的最长碳链可供选择时,一般选取包含支链最多 的最长碳链作为主链。根据主链所含碳原子数称为“某烷”。
“庚烷”
②将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号;
当主链编号有几种可能时,应选定支链具有“最低系号相同时,给小的取代基较小的编号:
异丁烷
为了形象地表示分子的立体形状,常采用立体模型表示。常用 的模型有两种:球棒模型(Kekule模型)和比例模型(Stuart模型,它与
沸点℃
36
28
9.5
2. 熔点
烷烃熔点(mp)的变化基本上与沸点相似,直链烷烃的熔点变化 也是随着相对分子质量的增减而相应增减。但因在晶体中,分子间 的作用力不仅取决于分子的大小,而且与晶体中晶格排列的对称性 有关,对称性大的烷烃晶格排列比较紧密,熔点相对要高些。
沸点是与分子间的作用力——van der Waals力有关的,烷烃是非极 性分子,van der Waals力主要产生于色散力。
直链烷烃的沸点与分子中所含碳原子数的关系图 一般在常温常压下,四个碳以下的直链烷烃是气体,由戊烷开始 是液体,大于十七个碳的烷烃是固体。
在碳原子数相同的烷烃异构体中,含支链越多的烷烃,相应 沸点越低。
为了使成键电子之间的排斥力最小、最稳定,四个sp3杂化轨 道在空间的排布,是以碳原子为中心,四个轨道分别指向正四面体 的四个顶点,使sp3 杂化轨道具有方向性。同时两个轨道对称轴之 间的夹角 (键角)为109.5°。
1/4s + 3/4p
2. σ键的形成及其特性
原子轨道沿核间联线(键轴)相互交盖,形成对键轴呈圆柱形对称 的轨道,称为σ轨道。σ轨道上的电子称为σ电子。 σ轨道构成的共价 键称为σ键。
当含有不止一个相等的最长碳链可供选择时,一般选取包含支链最多 的最长碳链作为主链。根据主链所含碳原子数称为“某烷”。
“庚烷”
②将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号;
当主链编号有几种可能时,应选定支链具有“最低系号相同时,给小的取代基较小的编号:
异丁烷
为了形象地表示分子的立体形状,常采用立体模型表示。常用 的模型有两种:球棒模型(Kekule模型)和比例模型(Stuart模型,它与
有机化学烷烃知识

CH4
+
2 O2
CO2
+ 2 H2O
低级的烷烃与一定比例空气的混合物,遇到火花时会
发生爆炸,这就是矿井瓦斯爆炸的原因
3.热裂反应
C1,C2断 裂 1 2 3 4 C2,C3断 裂 C3,C4断 裂
CH3
CH3CH2CH2CH2CH2CH3
·+ CH CH CH CH CH · CH CH · + CH CH CH CH · 2 CH CH CH ·
正丁烷各种构象的能差不大,室温下可迅速转化,正丁烷实际上是 各种构象异构体的混合物,但对位交叉式 (Anti)为优势构象,约占 70%,邻位交叉式(Gauche)约占30%,其他构象所占比例极小。
当正烷烃碳原子数增加时,尽管构象也随之更复 杂,但仍然主要以对位交叉式构象状态存在。所以直 链烷烃绝大多数是锯齿形的。如正戊烷主要以第 1 种构象形式存在,第 3 种为全重叠构象,最不稳定。
纽曼 (Newman)投影式
构象的能量分析
非键合的两原子或基团接近到相当于范氏半径之和时, 二者间以弱的引力相互作用,体系能量较低;如果接近到这 一距离以内,斥力就会急剧增大,体系能量升高。
一些原子或基团的范德华半径(pm) H C N O Cl CH3 120 150 150 140 180 200
CH3-CH
CH-CH3
CH3 CH3
2,5-甲基-3,4二乙基己烷
2,5-2甲基 3,4-2乙基己烷
2 4 5 6 1 例3 CH3-CH-CH2—CH—CH—CH3 2,5-二甲基-3-异丙基己烷 6 5 3 2 1 CH3 CH CH3 2,5-二甲基-4-异丙基己烷 CH3 CH3
CH3
有机化学-第二章-烷烃和环烷烃(二)
英文简写 Me Et n-Pr i-Pr n-Bu s-Bu i-Bu t-Bu
neo-Pentyl
有机化学 第二章
13
烷烃的命名
有机化学 第二章
14
普通命名法
有机化学 第二章
15
普通命名法
局限:复杂 的烷烃无法 命名。
有机化学 第二章
16
衍生命名法
以甲烷为母体,把其它的烷烃都看作是甲 烷的烷基衍生物。
有机化学 第二章
65
CH3
1
H 2H
H
CH3 H 1 2 CH2
H
CH2
H
H
1
2 HCH3 H
H
H 1 2 CH2
CH3
CH2
H
取代基处在e 键上稳定。
有机化学 第二章
66
有机化学 第二章
12
一些烷基(alkyl)结构及名称
烷基 CH3 CH3CH2 CH3CH2CH2 CH3CHCH3 CH3CH2CH2CH2 CH3CH2CHCH3
(CH3)2CHCH2 (CH3)3C (CH3)3CCH2
烷基名称 甲基 乙基 正丙基 异丙基 正丁基 仲丁基 异丁基 叔丁基 新戊基
有机化学 第二章
62
环己烷可以由一种椅型构象翻转成另一 种椅型构象,原来的a键变为e键,原来的e键 变为a键:
翻转
一种椅型构象经半椅型、纽船型、船型翻转 成另一种椅型构象。在能量上:
椅型构象 < 纽船型构象 < 船型构象 < 半椅型构象
有机化学 第二章
63
环己烷的有构机化象学 第翻二章转
64
2.4.4 取代环己烷的构象
稳定性:
1 饱和烃

化合物名称:3-甲基-4-乙基己烷
为了表达化合物的立体化学关系,须决定有关原子或基
团的排列顺序,其方法称为基团的优先“次序规则”,主要
内容如下:
1、将各种取代基与主链直接相连的原子,按原 子序数由大到小排列,原子序数大的基团为“优先” 基团。若为同位素,则质量数高的为“优先”基团。
I > Br > Cl > S > P > F > O > N > C > D > H
熔点(m.p.)
直链烷烃的熔点随分子质量的增加而增加,一般含偶数碳原子烷烃 的熔点通常比含奇数碳原子烷烃的熔点升高较多。
相对密度
烷烃相对密度小于1,随分子量的增加逐渐增大。
溶解度
烷烃不溶于水,易溶于有机溶剂。
名称
甲烷 乙烷 丙烷 丁烷 戊烷 己烷
分子式或结构式
CH4 CH3CH3 CH3CH2CH3 CH3(CH2)2CH3 CH3(CH2)3CH C H H C H H H
H C C H H C H H H
H
1
2
3
4
3、当基团含有双键或叁键时,可以看做连有两个或三个相 同的原子(即重键可以看成多个单键)。
(C,C、C、H,H) (C,O、O、H) (C,O、O、O,H) (C,C、C、C) (C,N、N、N)
根据次序规则,常见的取代基的优先次序排列如下: -I>-Br>-Cl>-SO3H>-F>-OCOR>-OR>- OH>-NO2>-NR2>-NHR>-COOH>-CONH2>-
到的位次最小者定为最低系列)。例如:
1 2
CH3
6
CH
5
3
4
CH3 C
烃基饱和和不饱和

烃基饱和和不饱和
烃基饱和和不饱和是有机化学中的两个常见概念。
烃是指仅由碳氢元素构成的化合物,其中碳氢键是主要的键类型。
烃可以分为两类:饱和烃和不饱和烃。
饱和烃,也称为脂肪烃,是指分子中所有碳原子都与最大数量的氢原子相连。
这意味着它们没有任何双键或环状结构。
最常见的饱和烃是烷烃,其中所有碳原子都是以单键链接的。
例如,甲烷(CH4)、乙烷(C2H6)和丙烷(C3H8)都是饱和烃。
饱和烃通常是液体或固体,在常温下很少存在气态。
不饱和烃是指分子中存在一个或多个碳-碳双键或环状结构。
不饱和烃分为两类:烯烃和炔烃。
烯烃是指分子中至少有一个碳-碳双键,而炔烃则是指分子中至少有一个碳-碳三键。
例如,乙烯(C2H4)和丙烯(C3H6)是烯烃,而乙炔(C2H2)是炔烃。
不饱和烃通常是气态,在常温下很少存在液态或固态。
在化学反应中,烃基的饱和或不饱和性质会对反应的类型和速率产生影响。
例如,饱和烃更难被氧化,因此烷烃的燃烧反应需要更高的温度和氧气浓度。
另一方面,不饱和烃的双键或三键更容易参与化学反应,如加成反应和聚合反应。
总之,烃基的饱和和不饱和性质对于有机化学的研究和实际应用都具有重要意义。
了解这些概念可以帮助我们更好地理解烃化合物的性质和反应行为。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
16 C 结晶像冰
HO O C C O O H 草酸
。
冰醋酸
CH4
—— 甲烷,
沼气
凡士林(C18-C22的烷烃混合物) 石油醚(C5-C9的烷烃混合物) 液体石蜡(C9-C17的烷烃混合物)
3. 烷烃的结构
一、碳原子的sp3杂化: 1个s轨道和3个p轨道杂化后,形成4个完全相等的轨道,这种轨道 称为sp3杂化轨道。
从C-C单键的延线上观察:
3、构象的表示方法: 纽曼式(Newman) 楔形式 锯架式
球棒模型
4、构象的稳定性 [分析乙烷两个极端构象]
H H C H
229
H C H H
H H C H
250
C
H H H
排斥力最大 内能高
排斥力最小 内能低
非键连相互作用力:不直接相连的原子间的作用力。 构象的稳定性与内能有关。内能低,稳定;内能高,不稳定。
带有支链的烷烃则按以下命名规则命名
1、基团 (-yl) 的概念:烷烃分子中除去一个氢原子后余下 的部分,以R-表示
(1)某基:甲基(methyl) CH3- ;乙基(ethyl) CH3CH2- ; 丙基 CH3CH2CH2(2)异某基:异丙基 (CH3)2CH- ; 异丁基 (CH3)2CHCH2(3)仲某基:仲丁基 CH3CH2CH(CH3)(4)叔某基:叔丁基 (CH3)3C-
一、乙烷的构象:
构象:围绕单键旋转所产生分子中的原子或基团在空间的不同排列。 1、透视式:
H H
H H H
H
H
H HH
H H
交叉式
2、纽曼投影式:
H H H H
重叠式
H H
H H
HH
H H
纽曼投影式规则(重点)
①画一个圆圈表示离眼睛较远的碳原子,圆圈上三 等份圆周的短线表示这个碳原子上的三根σ键; ②圆心表示离眼睛较近的碳原子,由圆心到圆周三 等份的延长线表示这个碳上的 三根σ键。
(3).汉字二、三、四等不能用阿拉伯数字2,3,4等替换
选择含取代基多的最长碳链
7 6 5 4 3 2 1 CH3CH2CH CH CH CHCH3 CH3 CH2 CH3 CH3 CH2CH3
2,3,5-三甲基-4-丙基庚烷
最低系列原则
2,2,3,5 – ( 2,4,5,5 – (
CH3 1 2 3 4 5 6 顺次逐项比较, CH3C CH CH2 CHCH3 4 3 2 1 最先遇到位次最小者。 6 5 CH3 CH3 CH3
CH3-CH2-CH2-CH2-CH3
正戊烷
CH3
CH3 CH CH3
异戊烷
CH2 CH3
CH3
C CH3
CH3
新戊烷
二、系统命名法(IUPAC)(International Union of Pure and Applied Chemistry)国际纯粹和应用化学联合会
直链烷烃系统命名与普通命名法相同,只是把“正”字取 消
同分异构体:具有相同分子式的不同化合物。 构造异构体:具有相同分子式,分子中原子或基团因连接顺 序不同而产生的异构体。
碳架异构:由碳架不同引起的异构,称碳架异构。(属构造 异构)
开链烷烃的构造异构只有碳架异构
CH 3-CH2-CH2-CH2-CH3 CH 3 CH CH 2-CH3 CH 3 CH 3 CH 3 C CH 3 CH 3
四.其它烷烃的构型 1) 碳原子都是以SP3杂化轨道与其他原子形成σ 键,碳 原子都为四面体结构。 2) C-C键长均为0.154nm, C-H键长为0.109nm,,键角都接 近于109.5°。 3) 碳链一般是曲折地排布在空间,在晶体时碳链排列整 齐,呈锯齿状,在气、液态时呈多种曲折排列形式(因σ 键能自由旋转所致)。
) )
2,2,3,5-四甲基己烷
次序规则的主要内容
• 原子序数大的次序大,原子序数小的次序 小,同位素中质量高的次序大 。次序大的 为“较优”基团后命名。 I >Br >Cl >S >P >F >O >N >C >D >H • 如果原子团的第一个原子相同,则比较与 它相连的其它原子(第二个原子)的原子 序数大小 ,其它依次类推 。 • 含有双键或叁键的原子团,可以认为连有 二个或三个相同的原子 。
7 CH3
4-甲基-3-乙基庚烷 3-乙基-4-甲基庚烷(×) ( )
三、衍生物命名法
该法是按照化合物由简到繁的原则,规定每类化合 物以最简单的一个化合物为母体,而将其余部分作为取 代基来命名的。
C H3
C H3
烷烃:
C H3
C C H3
C H3
C H3C H
C
C H2C H2C H3
C H3 C H3
2、命名规则:(重点) “三步曲” (1)选主链:最长碳链。等长时, 取代基最多。
(2)编号:a:从离支链最近的一端开始编号;
b: ―位置和最小”(以前) _____―最低系列”规则(现在) (3)写出名称:a:支链烷基名称和位置写在前; b: 小基团在前,大基团在后(次序规则); c:相同基团合并,以汉字二、三、四等标明数目。 注意: (1).数字与汉字间用“—‖隔开,数字间用“,”分开; (2). ―某基”和“某烷”之间不能用“—‖隔开;
CH3 CH3 H H
CH3 60O H H
丁烷的构象 CH
CH3 H H 60O H H
3
60O CH3 H
HH 1 全重叠式 CH3
H 2 邻位交叉式 CH3 H
3 部分重叠式 CH3 60
O
H H CH3 4
H H
60
O
CH3 H H 6
H H
CH3 H 5
HH
对位交叉式
部分重叠式
邻位交叉式
1° C 例如: H 3 C H 3 4° 2 ° C CH 2 C H 3 3° CH C H 3 1° CH 3
与伯、仲、叔碳原子相连的 氢原子,分别称为伯、仲、叔氢 原子。 不同类型的氢原子的反应性能有 一定的差别。
碳原子和氢原子的分类(重点)
CH3 H 3C C CH CH2 CH3
CH3 CH3
内能最低的构象称优势构象。
其它构象的内能介于这两者之间。
乙烷不同构象的能量曲线图
E
重叠式构象 HH H H H H H H H H HH
优势构象
交叉式构象 H H H H H H H H
HH HH
扭张力
扭转能
12.1 kJ / mol 60 120 180 240
旋转角度
能量最低的构象最稳定,最稳定的构象称为优势构象。
分子式
甲烷 CH4 C 2H 6
构造式
构造简式
CH4
H H C H H
H H H C C H H H
H H H H C C C H H H H
乙烷
CH3CH3
丙烷
C 3H 8
CH3CH2CH3 CH3CH2CH2CH3
丁烷
C4H10
H H H H H C C C C H H H H H
二、 烷烃的同分异构现象
a
杂化轨道有更强的方向性; 四个键尽可能远离;
1s
6
b
四个SP3杂化轨道完全等值;
c
d
2s
每两个杂化轨道之间的夹角都是10928’
2s 2px 2py 2pz
sp3
C
2s 2px 2py 2pz
激发
2px 2py 2pz
杂化
基态
激发态
二、甲烷的正四面体结构 键长:0.110nm 键角:10928’ C的四个sp3轨道 sp3 轨道和甲烷分子的形成
第二章 饱和烃(烷烃)
Alkanes
【学习要求】 1. 能正确书写烷烃的构造异构体,掌握烷烃的命名原则。 2. 能用原子轨道杂化理论解释烷烃中碳原子的构型。 3. 掌握σ键的形成、结构特点及特性 。 4. 掌握构象式(纽曼式和透视式)的写法。 5. 掌握烷烃的物理性质(沸点,熔点,溶解度,比重等) 存在的规律性的变化。 6. 掌握烷烃的氧化,裂化,取代反应。 7. 掌握烷烃的卤代反应、自由基反应的条件、历程及自 由基的稳定性。
四甲基甲烷
C H3 C H3 C C H3
二甲基(正)丙基异丙基甲烷
C H3 C H2 C C H3 C H3
二叔丁基甲烷
四、有机化合物的俗名和简称:
所谓俗名(trivial name)就是化学工作者根据化合 物的来源、制法、性质或采用人名等加以命名的。仅举 几例:
HC O O H 蚁酸 C H3O H 木醇 C H3C O O H
斯陶特模型
4. 烷烃的构象(Conformation) (重点)
• 构象:构造一定的分子,通过单键的旋转而引起
的分子中各原子在空间的不同排布称为构象。
• 构象异构体(Conformers):由单键旋转而产生的
异构体。属于立体异构。
• 单键旋转会产生无数个构象,它们互为构象异构
体。室温下,异构体不能分离。
碳原子都是SP3杂化, 烷烃分子中: C-C 键为SP3- SP3 σ 键
C-H 键为SP3- S
σ键
乙 烷 分 子 中 原 子 轨 道 重 叠 示 意 图
碳-碳单键的键长是0.154nm,键能为345.6kJ/mol。
C-H -键
C-C -键
可绕键轴自由 旋转
这是C原子能形成碳链和碳环的化学键的基础。
R
R
2 1
2
H
C H
1
2
H H
C C
2
H H
2
H
2
H
所以乙基和甲ห้องสมุดไป่ตู้相比,乙基为“较优”基团,因此 乙基应排在甲基之后命名, “>”表示优先于。 H H H H C CH3 C H C H C H CH3 CH2CH3 H CH3
HO O C C O O H 草酸
。
冰醋酸
CH4
—— 甲烷,
沼气
凡士林(C18-C22的烷烃混合物) 石油醚(C5-C9的烷烃混合物) 液体石蜡(C9-C17的烷烃混合物)
3. 烷烃的结构
一、碳原子的sp3杂化: 1个s轨道和3个p轨道杂化后,形成4个完全相等的轨道,这种轨道 称为sp3杂化轨道。
从C-C单键的延线上观察:
3、构象的表示方法: 纽曼式(Newman) 楔形式 锯架式
球棒模型
4、构象的稳定性 [分析乙烷两个极端构象]
H H C H
229
H C H H
H H C H
250
C
H H H
排斥力最大 内能高
排斥力最小 内能低
非键连相互作用力:不直接相连的原子间的作用力。 构象的稳定性与内能有关。内能低,稳定;内能高,不稳定。
带有支链的烷烃则按以下命名规则命名
1、基团 (-yl) 的概念:烷烃分子中除去一个氢原子后余下 的部分,以R-表示
(1)某基:甲基(methyl) CH3- ;乙基(ethyl) CH3CH2- ; 丙基 CH3CH2CH2(2)异某基:异丙基 (CH3)2CH- ; 异丁基 (CH3)2CHCH2(3)仲某基:仲丁基 CH3CH2CH(CH3)(4)叔某基:叔丁基 (CH3)3C-
一、乙烷的构象:
构象:围绕单键旋转所产生分子中的原子或基团在空间的不同排列。 1、透视式:
H H
H H H
H
H
H HH
H H
交叉式
2、纽曼投影式:
H H H H
重叠式
H H
H H
HH
H H
纽曼投影式规则(重点)
①画一个圆圈表示离眼睛较远的碳原子,圆圈上三 等份圆周的短线表示这个碳原子上的三根σ键; ②圆心表示离眼睛较近的碳原子,由圆心到圆周三 等份的延长线表示这个碳上的 三根σ键。
(3).汉字二、三、四等不能用阿拉伯数字2,3,4等替换
选择含取代基多的最长碳链
7 6 5 4 3 2 1 CH3CH2CH CH CH CHCH3 CH3 CH2 CH3 CH3 CH2CH3
2,3,5-三甲基-4-丙基庚烷
最低系列原则
2,2,3,5 – ( 2,4,5,5 – (
CH3 1 2 3 4 5 6 顺次逐项比较, CH3C CH CH2 CHCH3 4 3 2 1 最先遇到位次最小者。 6 5 CH3 CH3 CH3
CH3-CH2-CH2-CH2-CH3
正戊烷
CH3
CH3 CH CH3
异戊烷
CH2 CH3
CH3
C CH3
CH3
新戊烷
二、系统命名法(IUPAC)(International Union of Pure and Applied Chemistry)国际纯粹和应用化学联合会
直链烷烃系统命名与普通命名法相同,只是把“正”字取 消
同分异构体:具有相同分子式的不同化合物。 构造异构体:具有相同分子式,分子中原子或基团因连接顺 序不同而产生的异构体。
碳架异构:由碳架不同引起的异构,称碳架异构。(属构造 异构)
开链烷烃的构造异构只有碳架异构
CH 3-CH2-CH2-CH2-CH3 CH 3 CH CH 2-CH3 CH 3 CH 3 CH 3 C CH 3 CH 3
四.其它烷烃的构型 1) 碳原子都是以SP3杂化轨道与其他原子形成σ 键,碳 原子都为四面体结构。 2) C-C键长均为0.154nm, C-H键长为0.109nm,,键角都接 近于109.5°。 3) 碳链一般是曲折地排布在空间,在晶体时碳链排列整 齐,呈锯齿状,在气、液态时呈多种曲折排列形式(因σ 键能自由旋转所致)。
) )
2,2,3,5-四甲基己烷
次序规则的主要内容
• 原子序数大的次序大,原子序数小的次序 小,同位素中质量高的次序大 。次序大的 为“较优”基团后命名。 I >Br >Cl >S >P >F >O >N >C >D >H • 如果原子团的第一个原子相同,则比较与 它相连的其它原子(第二个原子)的原子 序数大小 ,其它依次类推 。 • 含有双键或叁键的原子团,可以认为连有 二个或三个相同的原子 。
7 CH3
4-甲基-3-乙基庚烷 3-乙基-4-甲基庚烷(×) ( )
三、衍生物命名法
该法是按照化合物由简到繁的原则,规定每类化合 物以最简单的一个化合物为母体,而将其余部分作为取 代基来命名的。
C H3
C H3
烷烃:
C H3
C C H3
C H3
C H3C H
C
C H2C H2C H3
C H3 C H3
2、命名规则:(重点) “三步曲” (1)选主链:最长碳链。等长时, 取代基最多。
(2)编号:a:从离支链最近的一端开始编号;
b: ―位置和最小”(以前) _____―最低系列”规则(现在) (3)写出名称:a:支链烷基名称和位置写在前; b: 小基团在前,大基团在后(次序规则); c:相同基团合并,以汉字二、三、四等标明数目。 注意: (1).数字与汉字间用“—‖隔开,数字间用“,”分开; (2). ―某基”和“某烷”之间不能用“—‖隔开;
CH3 CH3 H H
CH3 60O H H
丁烷的构象 CH
CH3 H H 60O H H
3
60O CH3 H
HH 1 全重叠式 CH3
H 2 邻位交叉式 CH3 H
3 部分重叠式 CH3 60
O
H H CH3 4
H H
60
O
CH3 H H 6
H H
CH3 H 5
HH
对位交叉式
部分重叠式
邻位交叉式
1° C 例如: H 3 C H 3 4° 2 ° C CH 2 C H 3 3° CH C H 3 1° CH 3
与伯、仲、叔碳原子相连的 氢原子,分别称为伯、仲、叔氢 原子。 不同类型的氢原子的反应性能有 一定的差别。
碳原子和氢原子的分类(重点)
CH3 H 3C C CH CH2 CH3
CH3 CH3
内能最低的构象称优势构象。
其它构象的内能介于这两者之间。
乙烷不同构象的能量曲线图
E
重叠式构象 HH H H H H H H H H HH
优势构象
交叉式构象 H H H H H H H H
HH HH
扭张力
扭转能
12.1 kJ / mol 60 120 180 240
旋转角度
能量最低的构象最稳定,最稳定的构象称为优势构象。
分子式
甲烷 CH4 C 2H 6
构造式
构造简式
CH4
H H C H H
H H H C C H H H
H H H H C C C H H H H
乙烷
CH3CH3
丙烷
C 3H 8
CH3CH2CH3 CH3CH2CH2CH3
丁烷
C4H10
H H H H H C C C C H H H H H
二、 烷烃的同分异构现象
a
杂化轨道有更强的方向性; 四个键尽可能远离;
1s
6
b
四个SP3杂化轨道完全等值;
c
d
2s
每两个杂化轨道之间的夹角都是10928’
2s 2px 2py 2pz
sp3
C
2s 2px 2py 2pz
激发
2px 2py 2pz
杂化
基态
激发态
二、甲烷的正四面体结构 键长:0.110nm 键角:10928’ C的四个sp3轨道 sp3 轨道和甲烷分子的形成
第二章 饱和烃(烷烃)
Alkanes
【学习要求】 1. 能正确书写烷烃的构造异构体,掌握烷烃的命名原则。 2. 能用原子轨道杂化理论解释烷烃中碳原子的构型。 3. 掌握σ键的形成、结构特点及特性 。 4. 掌握构象式(纽曼式和透视式)的写法。 5. 掌握烷烃的物理性质(沸点,熔点,溶解度,比重等) 存在的规律性的变化。 6. 掌握烷烃的氧化,裂化,取代反应。 7. 掌握烷烃的卤代反应、自由基反应的条件、历程及自 由基的稳定性。
四甲基甲烷
C H3 C H3 C C H3
二甲基(正)丙基异丙基甲烷
C H3 C H2 C C H3 C H3
二叔丁基甲烷
四、有机化合物的俗名和简称:
所谓俗名(trivial name)就是化学工作者根据化合 物的来源、制法、性质或采用人名等加以命名的。仅举 几例:
HC O O H 蚁酸 C H3O H 木醇 C H3C O O H
斯陶特模型
4. 烷烃的构象(Conformation) (重点)
• 构象:构造一定的分子,通过单键的旋转而引起
的分子中各原子在空间的不同排布称为构象。
• 构象异构体(Conformers):由单键旋转而产生的
异构体。属于立体异构。
• 单键旋转会产生无数个构象,它们互为构象异构
体。室温下,异构体不能分离。
碳原子都是SP3杂化, 烷烃分子中: C-C 键为SP3- SP3 σ 键
C-H 键为SP3- S
σ键
乙 烷 分 子 中 原 子 轨 道 重 叠 示 意 图
碳-碳单键的键长是0.154nm,键能为345.6kJ/mol。
C-H -键
C-C -键
可绕键轴自由 旋转
这是C原子能形成碳链和碳环的化学键的基础。
R
R
2 1
2
H
C H
1
2
H H
C C
2
H H
2
H
2
H
所以乙基和甲ห้องสมุดไป่ตู้相比,乙基为“较优”基团,因此 乙基应排在甲基之后命名, “>”表示优先于。 H H H H C CH3 C H C H C H CH3 CH2CH3 H CH3
