《第二节_离子反应》离子方程式的写法PPT课件
合集下载
化学1必修2.2《离子反应》教学+(1)-PPT课件

【讨论与思考】
物质溶解于水时产生自由移动的 离子过程可用什么方程式来表示?
2. 电离及电离方程式
填空: ⑴能发生电离的物质类别: ⑵电离的条件(与通电有无关系):
⑶电离的结果: ⑷电离的定义: ⑸电离的表示方法:
酸碱盐在水溶液中的电离
电离方程式
用分子式和离子符号表示电解质电离 的方程式叫做电离方程式
【注意事项】
……不用湿手板开关、换灯泡,插、拔插头 不站在潮湿的桌椅上接触火线……
——引自初三物理“用电安全”
酸碱盐在水溶液中的电离
化学问题:NaCl溶液导电性研究
1.水的导电性 2.NaCl晶体的导电性 3.NaCl溶液的导电性
纯水
NaCl晶体 不导电
溶解
?
NaCl溶液 导电
酸碱盐在水溶液中的电离
Cu2+ + 2OH- == Cu(OH)2↓
离子方程式
2.正确书写离子方程式的步骤
(1)写出化学方程式:
例:2AgNO3+CuCl2== 2AgCl↓+Cu(NO3)2 (2)把易溶于水、易电离(强酸\强碱\可
溶性盐)的物质拆写成离子形式。
难溶或难电离的物质以及气体等仍用化学 式表示。 2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2.向盛2 mL NaOH 溶液的试 管中滴加酚酞溶液,再慢慢 加入稀盐酸,直到无色
红色慢慢变浅,最后无色 H++OH- = H2O
3.向盛2 mL Na2CO3 溶液的 有无色无味气体产生
试管中加入2 mL 稀HCl
2H++CO32-=CO2↑+H2O
物质溶解于水时产生自由移动的 离子过程可用什么方程式来表示?
2. 电离及电离方程式
填空: ⑴能发生电离的物质类别: ⑵电离的条件(与通电有无关系):
⑶电离的结果: ⑷电离的定义: ⑸电离的表示方法:
酸碱盐在水溶液中的电离
电离方程式
用分子式和离子符号表示电解质电离 的方程式叫做电离方程式
【注意事项】
……不用湿手板开关、换灯泡,插、拔插头 不站在潮湿的桌椅上接触火线……
——引自初三物理“用电安全”
酸碱盐在水溶液中的电离
化学问题:NaCl溶液导电性研究
1.水的导电性 2.NaCl晶体的导电性 3.NaCl溶液的导电性
纯水
NaCl晶体 不导电
溶解
?
NaCl溶液 导电
酸碱盐在水溶液中的电离
Cu2+ + 2OH- == Cu(OH)2↓
离子方程式
2.正确书写离子方程式的步骤
(1)写出化学方程式:
例:2AgNO3+CuCl2== 2AgCl↓+Cu(NO3)2 (2)把易溶于水、易电离(强酸\强碱\可
溶性盐)的物质拆写成离子形式。
难溶或难电离的物质以及气体等仍用化学 式表示。 2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2.向盛2 mL NaOH 溶液的试 管中滴加酚酞溶液,再慢慢 加入稀盐酸,直到无色
红色慢慢变浅,最后无色 H++OH- = H2O
3.向盛2 mL Na2CO3 溶液的 有无色无味气体产生
试管中加入2 mL 稀HCl
2H++CO32-=CO2↑+H2O
离子反应ppt课件

教学目标
Overview of job performance
教学目标
1
本质与实质 发生条件
2
离子方程式
3
兴趣与素养
教学重难点
Work plan for next year
教学重难点
教学重点
离子反应的实质 探究离子反应发生的条件
教学难点
理解离子反应式的原理与实质
电解
离子
电离
质
反应
…
原理
…
教学过程
教材分析
Overview Of Annual Work
选自人教版高中化学 必修一第一章第二节
1
重要的化学用语
离子反应
2
基本概念 基础知识
3
贯穿始终 难点和重点
学情分析
Overview of job performance
已掌握:
学情分析
将学习:
电解质的概念 电离方程式书写
分析离子之间的反应, 引导学生形成科学的思 维方法。
Work plan for next year
引入Leabharlann 实验教学过程微观
分析
总结
板书
教学过程
引入
实验
微观
分析
总结
板书
菠菜豆腐汤到底能不能喝?
教学过程
引入
实验
微观
分析
总结
板书
硫酸钠分别与氯化钡、氯化钾反应 写出反应方程式
教学过程
引入
实验
微观
分析
总结
利用所学电解质与电离方程分析问题: “变与不变”
“不变”引出离子反应的实质:电解质在 水溶液中的反应,是离子之间的反应
离子反应及离子方程式ppt课件

(2)NaOH、KOH、Ba(OH)2 NaOH == Na+ + OH-
HNO3 == H+ + NO3-
Ca(OH)2 == Ca2+ + 2OH-
H2SO4 == 2H+ + SO42-
Ba(OH)2 == Ba2+ + 2OH-
(3)Na2SO4、 Fe2(SO4)3、 NH4C1
Na2SO4 == 2Na+ + SO42- ▲酸:电离时生成的阳离子全部是H+的化合物 Fe2(SO4)3 == 2Fe3+ + 3SO42- ▲碱:电离时生成的阴离子全部是OH-的化合物
Na
Na
+
+
Na NO3-
+
HNO3 NaOH NaNO3
+ H+ NO3Na++ OH+ Na+ NO3-
+ H+ OH- H2O
H+
SO42-
H+
H+
SO42-
H+
O- OH-
Na
+ Na +
+
OH-
Na+
Na
+
Na
+
Na
+
Na
+
SO42-
H2SO4 NaOH Na2SO4
+ 2H+ SO42Na++ OH+ 2Na+ SO42-
NH4C1 == NH4+ + C1-
▲盐:电离时能生成金属离子和酸根阴离子的化合物。
包括铵根离子
1.下列电离方程式中,正确的是( )
D
第二节《离子反应(第二课时)》PPT课件

13
2、附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有色离子。
有色离子: MnO4- (紫红色)、Fe3+ (黄色)、 Fe2+ (浅绿色)、 Cu2+(蓝色)
⑵强碱性溶液中肯定不存在与OH-反应的离子。
隐含:PH 〉7,能使酚酞试液变红、能使石蕊变蓝
大量OH-
⑶强酸性溶液中肯定不存在与H+反应的离子。 隐含:PH 〈 7 ,能使石蕊变红,存在大量H+
C、铝和硝酸铜溶液反应
Al+Cu2+=Al3++Cu
D、碳酸钠和稀硫酸反应
CO32-+2H+=CO2↑+H2O
11
三、离子共存问题:
原则:同一溶液中若离子间符合下列任意一个条件就 会发生离子反应,离子之间便不能在溶液中大量共存。
1、不能大量共存的情况
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等
⑵生成气体或挥发性物质:
如:H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3NH4+与OH-
12
⑶生成难电离(弱电解质)物质:
如:H+与Ac-、CO32-、S2-、SO32-、SiO32-ClO3等生成弱酸;
OH-与NH4+生成的弱碱; H+与OH-生成水
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等) 与还原性离子(如S2-、I-、Fe2+、SO32-等) 不能大量共存。
· (3)生成难电离的物质(弱电解质) :如水、NH3 H2O等。 2
2、附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有色离子。
有色离子: MnO4- (紫红色)、Fe3+ (黄色)、 Fe2+ (浅绿色)、 Cu2+(蓝色)
⑵强碱性溶液中肯定不存在与OH-反应的离子。
隐含:PH 〉7,能使酚酞试液变红、能使石蕊变蓝
大量OH-
⑶强酸性溶液中肯定不存在与H+反应的离子。 隐含:PH 〈 7 ,能使石蕊变红,存在大量H+
C、铝和硝酸铜溶液反应
Al+Cu2+=Al3++Cu
D、碳酸钠和稀硫酸反应
CO32-+2H+=CO2↑+H2O
11
三、离子共存问题:
原则:同一溶液中若离子间符合下列任意一个条件就 会发生离子反应,离子之间便不能在溶液中大量共存。
1、不能大量共存的情况
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等
⑵生成气体或挥发性物质:
如:H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3NH4+与OH-
12
⑶生成难电离(弱电解质)物质:
如:H+与Ac-、CO32-、S2-、SO32-、SiO32-ClO3等生成弱酸;
OH-与NH4+生成的弱碱; H+与OH-生成水
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等) 与还原性离子(如S2-、I-、Fe2+、SO32-等) 不能大量共存。
· (3)生成难电离的物质(弱电解质) :如水、NH3 H2O等。 2
第二节离子反应要的离子方程式的写法PPT课件
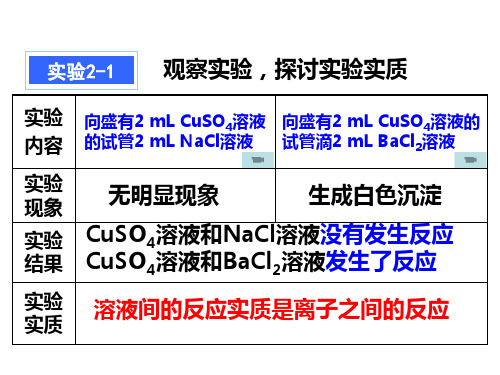
实验2-1 观察实验,探讨实验实质
实验 向盛有2 mL CuSO4溶液 向盛有2 mL CuSO4溶液的 内容 的试管2 mL NaCl溶液 试管滴2 mL BaCl2溶液
实验 现象
无明显现象
生成白色沉淀
实验 CuSO4溶液和NaCl溶液没有发生反应 结果 CuSO4溶液和BaCl2溶液发生了反应
实验 实质
随堂练习
1、写出下列化学方程式和离子方程式
①Na2CO3+HCl ②CuCl2+NaOH
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
深入挖掘:课本34页9
二、离子反应及其发生的条件
1、离子反应的定义 2、离子方程式的书写步骤 3、离子反应发生的条件 4、离子反应的实质
1、课本P34页习题第9题(离子方程式 暂不写)
2、预习课本P31-P32离子方程式及其 书写
复习部分酸、碱、盐的溶解性表及常见的强弱电解质
① HCl + NaOH = NaCl +H2O ② CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaC ③ CuSO4 + Fe = FeSO4 + Cu ④ 2HCl+ CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
溶液间的反应实质是离子之间的反应
实验 向盛有2 mL CuSO4溶液 向盛有2 mL CuSO4溶液的 内容 的试管2 mL NaCl溶液 试管滴2 mL BaCl2溶液
实验 现象
无明显现象
生成白色沉淀
实验 CuSO4溶液和NaCl溶液没有发生反应 结果 CuSO4溶液和BaCl2溶液发生了反应
实验 实质
随堂练习
1、写出下列化学方程式和离子方程式
①Na2CO3+HCl ②CuCl2+NaOH
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
深入挖掘:课本34页9
二、离子反应及其发生的条件
1、离子反应的定义 2、离子方程式的书写步骤 3、离子反应发生的条件 4、离子反应的实质
1、课本P34页习题第9题(离子方程式 暂不写)
2、预习课本P31-P32离子方程式及其 书写
复习部分酸、碱、盐的溶解性表及常见的强弱电解质
① HCl + NaOH = NaCl +H2O ② CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaC ③ CuSO4 + Fe = FeSO4 + Cu ④ 2HCl+ CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
溶液间的反应实质是离子之间的反应
人教版高中化学必修一第二章第二节离子反应 课件(共34张PPT)

不可能一蹴而就,将进一步完善,
基本技能课
• 常见教学内容:
–从教学特征看,主要包括计算技能、化学用语书写 技能、有机物命名技能、实验基本操作技能等内容为 主的课属于这一课型。
–还有一些由于考试而衍生出来的一些专项技能的训 练也可属这一课型,如溶液中离子浓度大小的比较、
NA问题等
–某些新授课和复习课中都可能包含技能课课型特征
如何缩短思考的时间能够实现微观——符号的转 换。书写规则能否也程序化并且像“四步法” 一样容易实操?
调查研究法
• 1.三步法不适合学困生的原因分析 • 对于中等及偏下学生来讲书写程序过于笼统,
操作性不强。
2.以生为本,通过问卷、测验、口语报告等方式及时了 解学生子技能的掌握情况,课前存在哪些相异概念。 如重点是子技能——物质的存在形式,常见的难溶物, 弱酸,弱碱的识记。
• 高级技能课(问题离解子反决应)的书写涉及到
• 复习课
几个步骤(程序性知 识),属于化学用语书
写技能课
人教版教材的表述“由于电解质
溶于水后电离成为离子,所以,
概念课 电解质在溶液中的反应实质上是
离子之间的反应,这样的反应叫
• 显性教学任务:
做离子反应。”
– 知道概念是什么(名称、定鲁义科、版属教性材和的表例述证“分像析上)述 – 运用概念去办事(分类、属反性应的这运样用,有)离子参加的化 – 辨明新概念与有关概念的关系学,反形应成称概为离念子系反统应”
由于学生接受程度原因, 容量不宜太大,离子反 应,离子方程式的定义, 将其放到课后填写思考。 在下一节课对课本的表 述进行简要的阐述。
在课后练习中强化物质的存在 形式,书写的程序性,建构微 粒观。至于弱酸,多离子反应, 离子方程式判断,离子共存拓 展题等考虑到本校学生实际接 受情况将其放到课后作业,在 下一课时拓展。
基本技能课
• 常见教学内容:
–从教学特征看,主要包括计算技能、化学用语书写 技能、有机物命名技能、实验基本操作技能等内容为 主的课属于这一课型。
–还有一些由于考试而衍生出来的一些专项技能的训 练也可属这一课型,如溶液中离子浓度大小的比较、
NA问题等
–某些新授课和复习课中都可能包含技能课课型特征
如何缩短思考的时间能够实现微观——符号的转 换。书写规则能否也程序化并且像“四步法” 一样容易实操?
调查研究法
• 1.三步法不适合学困生的原因分析 • 对于中等及偏下学生来讲书写程序过于笼统,
操作性不强。
2.以生为本,通过问卷、测验、口语报告等方式及时了 解学生子技能的掌握情况,课前存在哪些相异概念。 如重点是子技能——物质的存在形式,常见的难溶物, 弱酸,弱碱的识记。
• 高级技能课(问题离解子反决应)的书写涉及到
• 复习课
几个步骤(程序性知 识),属于化学用语书
写技能课
人教版教材的表述“由于电解质
溶于水后电离成为离子,所以,
概念课 电解质在溶液中的反应实质上是
离子之间的反应,这样的反应叫
• 显性教学任务:
做离子反应。”
– 知道概念是什么(名称、定鲁义科、版属教性材和的表例述证“分像析上)述 – 运用概念去办事(分类、属反性应的这运样用,有)离子参加的化 – 辨明新概念与有关概念的关系学,反形应成称概为离念子系反统应”
由于学生接受程度原因, 容量不宜太大,离子反 应,离子方程式的定义, 将其放到课后填写思考。 在下一节课对课本的表 述进行简要的阐述。
在课后练习中强化物质的存在 形式,书写的程序性,建构微 粒观。至于弱酸,多离子反应, 离子方程式判断,离子共存拓 展题等考虑到本校学生实际接 受情况将其放到课后作业,在 下一课时拓展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.消除水中污染物。
如明矾净水
除杂注意:所加试剂最好和杂质离子生 成沉淀、气体或水,不得引入新杂质 8.除去括号中杂质,写出所加试剂与反应的离子方 程式。 (1)SO42- (CO32-),所加试剂: H2SO4 , 离子方程式 2H+ + CO32- = H2O + CO2↑ ; BaCl2 (2)Cl- (SO42-),所加试剂: , 离子方程式 ; Ba2+ +SO42- = BaSO4↓ (3)Fe2+ (Cu2+),所加试剂: , Fe 离子方程式 ; Fe +Cu2+ = Fe2+ +Cu (4)BaCl2 (HCl ),所加试剂: Ba(OH)2 , H++ OH- = H2O 离子方程式 。
随堂练习
变式训练
9.某河道两旁有甲、乙两厂,它们排放的工 业废水中,共含有K+、Ag+、Fe3+、 NO3- 、 Cl-、OH-六种离子。 甲厂的废水明显呈碱性,故甲厂废水中所含 的三种离子是:( K+、Cl-、OH) 乙厂的废水中含有另外三种离子。如果加一 定量( 铁粉 )(填“活性炭”、“硫酸亚 铁”或“铁粉”),可以回收其中的金属是 Ag ( )
观察实验,探讨实验实质
向盛有2 mL CuSO4溶液的 向盛有2 mL CuSO4溶液的试 试管2 mL NaCl溶液 管滴2 mL BaCl2溶液
实验 现象
实验 结果
无明显现象
生成白色沉淀
CuSO4溶液和NaCl溶液没有发生反应 CuSO4溶液和BaCl2溶液发生了反应
实验 电解质在溶液间的反应实质是离子之间的反应 实质
1、写,写出化学方程式
2、改,把易溶于水且易电离的物质(易溶于水的强
电解质)写成离子形式,难溶的物质(沉淀)、
气体、难电离物质(弱电解质)、单质、氧化物
等仍用化学式表示。 3、删,删去两边没反应的离子。 4、查,检查方程式两边各元素的原子个数和电荷总 数是否相等。
随堂练习
1、写出下列化学方程式和离子方程式
Have a try
1、下列各组中的离子,能在溶液中大量共 存的是( ) A.Mg2+、H+、C1-、OH- B.Na+、Ba2+、CO32-、NO3C. Na+、H+、Cl-、 CO32D.K+、Cu2+、 NO3-、SO42-、
及时巩固
2.下列各组离子不能同时大量共存的是(
A. K+、Mg2+、OH-、SO42-
随堂练习
2、根据溶解性表,判断下列物质是否溶于 水:CaCO3、BaCO3、CuSO4、Mg(NO3)2、 Al(OH)3、BaCl2、AgCl、BaSO4、Na2CO3、 Ba(OH)2
不溶于水的物质:
CaCO3、BaCO3、Al(OH)3、AgCl、BaSO4
3、下列离子方程式正确的是 ( B )
③ Ca2++CO32-=CaCO3 ↓ ④ Fe+ Cu2+= Cu + Fe2+
⑤ CuO+ 2H+= Cu2++H2O ⑥ NH3·2O+H+=NH4++H2O H
⑦ 2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
易溶于水且易电离的物质(易溶于水强电解质)
①、强酸:HCl、H2SO4、HNO3等; ②、强碱:KOH、NaOH、Ba(OH)2等。 Ca(OH)2是微溶物,作反应物时(澄清稀溶液),写离 子形式,(若是固体或浊液),写分子式,作生成物 时,写分子式。 ③、可溶性盐:(请观察溶解性表110页,找出规律)
)。
B. Cu2+、Fe3+、Cl-、NO3C. Ca2+、Na+、CO32-、NO3-
D. K+、Na+、HCO3-、Cl-
深入探讨
3.欲配制含有大量下列各离子的溶液,能
够实现的是( )
A.
B.
Na+、CO32-、OH-、H+
Cu2+、K+、SO42+ 、NO3-
C.
D.
Cu2+、K+、OH-、NO3Mg2+ 、Na+、CO32- 、Cl-
知识回顾
• 在下列物质中:①CH3COOH ②盐酸 ③NaOH ④Cu(OH)2 ⑤AgCl ⑥ Na2CO3⑦C2H5OH ⑧H2O ⑨SO2 ⑩Fe 属于电解质的是:①③④⑤⑥⑧ 属于非电解质的是:⑦⑨ ②③⑥ 溶液中以离子形式存在的是:
第二课时:离子反应和离子方程式的书写
实验2-1 实验 内容
隐含条件的应用
①溶液为无色透明时,则不存在Cu2+(蓝色)、
Fe3+(黄色)、Fe2+(浅绿色)、MnO4-(紫色) 等; ②强碱性溶液或pH>7时,则溶液中存在大量 OH-,肯定不存在与OH- 反应的离子。 ③强酸性溶液或pH<7时,则溶液中存在大量 H+,肯定不存在与H+反应的离子。
随堂练习
课本34页5、6
复分解型离子反应发生的条件
实验2-3
CuSO4和NaOH NaOH加酚酞再加HCl HCl和Na2CO3
观察实验,探讨反应条件
现象及离子方程式 有蓝色沉淀产生Ba2+ + SO42- =BaSO4 ↓ 溶液先变红后无色 H+ + OH- = H2O 有气泡产生CO32- + 2H+ =H2O+CO2↑
①Na2CO3+HCl 3.固体+固体、浓硫酸与固体反应能不能 ②CuCl2+NaOH 写离子方程式??
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑ ②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
① ② ③ ④
HCl + CuCl2 CuSO4 2HCl+
NaOH = NaCl +H2O + 2NaOH = Cu(OH)2↓+ 2NaCl + Fe = FeSO4 + Cu CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
盐的溶解性基本规律如下:
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
溶解性表:
易溶物质能改,难溶物质不能改 钾钠铵盐硝酸盐,都能溶在水中间; 碳酸磷酸两种盐,溶者只有钾钠铵; 盐酸难溶银亚汞, 硫酸难溶是钡铅; 碱溶钾钠铵和钡,注意钙盐常是微。
)
B、AgNO3溶液Байду номын сангаас NaCl溶液混合
C、Na2CO3溶液与Ca(OH)2溶液混合
D、NaCl溶液与 Ca(NO3)2溶液混合
离子共存问题
共存原则:离子间不发生反应则能共存 同一溶液中若离子间符合下列任意一个 条件就会发生离子反应,离子之间便不 能在溶液中大量共存。 ⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等 ⑵生成气体 如:H+与Ac-、CO32-、S2-、SO32-等生 成弱酸;OH-与NH4+生成的弱碱; H+与OH-生成水 ⑶生成难电离的物质(弱电解质):弱酸、弱碱
4.在无色透明溶液中,能大量共存的离子组
是( )。 A、K+、Cu2+、NO3-、SO42B、K+、Na+、Cl-、CO32C、Mg2+、OH-、NO3-、ClD、K+、Na+、MnO4-、SO42-
随堂练习
5.在pH=1的无色透明溶液中能大量共存的离 子组是( )。 A. K+、Ag+、NO3-、ClB. Cu2+、Na+、NO3-、SO42C. K+、Na+、S2-、ClD. Mg2+、Na+、NO3-、SO42-
一.离子反应
1.定义:有离子参加或生成的反应叫做离子反应。(在水 溶液中) 2.离子方程式:用实际参加反应的离子符号来表示反应 的式子叫做离子反应方程式。(只有在水溶液中才能写 离子方程式)
BaCl2 + CuSO4 =
BaSO4 ↓ + CuCl2
SO42- +Ba2+ = BaSO4 ↓
二.离子反应方程式的书写步骤
自我检测
3、写出下列反应的离子方程式
① BaCl2+AgNO3 ②大理石和盐酸反应 ③在氢氧化钙溶液中滴加碳酸钠溶液 ④铁屑放入硫酸铜溶液 ⑤氧化铜粉末加入稀硫酸 ⑥向氨水中通入氯化氢 ⑦硫酸和 Ba(OH)2溶液反应 ⑧ 向澄清的石灰水中通入少量的二氧化碳 ① Ag++Cl-=AgCl↓ ② CaCO3+2H+=Ca2++H2O+CO2↑
A.Cu(OH)2与稀HNO3混合
OH- + H+ == H2O B.CaCl2与Na2CO3反应
Ca2+ + CO32- == CaCO3 ↓
C. MgO与 HCl反应 O2- + H+ == H2O
