徐州工程学院有机化学期末复习提纲
大学有机化学第三版上复习提纲

CH2Br-CHBr-CH=CH2 CH2Br-CH=CH-CH2Br
CH2=CH-CH=CH2
nCH2=CH-CH=CH2
HCl
聚合 (jùhé)
1,2-加成
CH3-CHCl-CH=CH2
1,4-加成
CH3-CH=CH-CH2Cl [CH2-CH=CH-CH2]n
CH2=CH-CH= CH2 电环合,h
1. 脱卤化氢
消除反应——这种从分子中失去一个(yī ɡè)简 单分子生成不饱和键的反应,称为消除反应, 用E表示。该反应在有机合成上常作为在分子中 引入碳碳双键和碳碳三键的方法。
卤烷脱卤化氢的难易与烃基结构有关:
叔卤烷最易,仲卤烷次之,伯卤烷最难
精品资料
•叔卤烷和仲卤烷在脱卤化氢时可能得到(dé dào)两种不同的消除产物。
1o RX
2o RX
3o RX
R-Br + I-
RI + Br -
R: CH3 CH3CH2 (CH3)2 CH
V相对 150
1
0.01
(CH3)3 C
0.001
考虑位阻效应 碳上取代基增加也影响SN2的反应
精品资料
烷基结构对SN1的影响
V > V > V > V 3o RX
2o RX
1o RX
CH3X
HNO3, HOAc
O2N
CH(CH3)2 OCH3
(CH3)2C=CH2, H2SO4
COOH Cl
COOH C(CH3)3
CH(CH3)2 NO2
OCH3 C(CH3)3
CH3 H3C CH2
OH CH3
Br2, CHCl3
大学化学复习提纲

理想气体状体公式PV=nRT注意气体常量的单位:R=8.314 J⋅mol−1⋅K−1化学反应中的能量转化1.概念:状态函数P15(特点),热和功(注意规定符号)p162.化学计量数(1.1)反应进度(1.3)[指的是书中最右边的公式顺序]p173.∆U = Q + W (1.4)热力学第一定律P18。
4.两种反应热的定义,Q V=∆U - W =∆U(1.6),Q p=H2-H1=∆H(1.7)p205.Δr H m=Δr U m+∑νBg RT (1.8)6.标准状态p226. Δr H mΘ的定义,Δr H mΘ=∑νBΔf H mΘ(B)(1.9)化学反应的基本原理1.熵(S)——混乱度的量度,热力学第三定律即S0KΘ= 0p34,标准摩尔熵S mΘ的比较,Δr S mΘ=∑νB S mΘ(B)(2.5)注意:单质S mΘ不为零(对于指定单质在298.15K的标准熵值不是零),而Δr H mΘ,Δr G mΘ及(H+,aq)的人为规定值为零2.ΔG<0, 自发过程,反应向正方向进行(2.7)3. Δr G mΘ=∑νBBΔf G mΘ(B),是T的函数(2.8)p37不在298.15K时,Δr G mΘ=Δr H mΘ−TΔr S mΘ,计算时注意S的单位。
(2.10) 根据Δr H mΘ,Δr S mΘ的正负、温度的影响可分四种情况。
T转折=Δr H mΘΔr S mΘ4. 化学平衡具有的特征p395会写出任意反应的标准平衡常数p40(书写规则),平衡常数之间的关系6.能熟练应用范特霍夫等温式:P42(2.19)A 判断化学反应自发进行的方向;B 计算非标准状态下的吉不斯自由能变。
7. 掌握标准平衡常数K θ的有关计算p428化学平衡的移动Δr G m =RTln Q Kθ (2.22).掌握浓度、压力、温度对平衡常数及化学平衡移动的影响p43增加反应物浓度或减少生成物浓度,平衡向正反应方向移动;增加总压力,平衡向气体分子数减少的方向移动。
有机化学实验考核复习提纲.docx

有机化学实验考核复习提纲(-)实验装置的安装1.安装蒸憎乙醴的装置。
2.安装熔点测定装置。
3.安装水蒸汽蒸懾装置。
4.安装加热回流的装置。
5.安装利用共沸去水的反应装置。
6.安装趁热过滤装置和样品抽滤装置。
7.选出重结晶所用的全部仪器。
8.安装环己烯制备以及捉纯的装置。
9.安装制备正澳丁烷和将粗品分离出来的装置。
10.安装合成2■甲基・2■己醇以及蒸侧纯品的装置。
11.安装连续合成乙酸乙酯的装置。
12.安装合成乙酸异戊酯的回流装置。
13.安装合成乙酸丁酯的装置。
14.制备到一个有机物,其沸点是16()。
经多步洗涤、干燥后,谙安装一个合适的装置将其蒸懈出来。
15.安装带有分水器的回流反应装置。
16.有一个混合物:A沸点是83°C, B沸点是100°C, C沸点是90。
(3,请安装一个能分离它们的装置。
17.混合物中含冇大屋树脂状杂质或不挥发性杂质,采用蒸懈、萃取等方法却难以分离,此物不溶于水,与水共沸不发生化学反甌在1()()弋左右时有20.1 mmHg的蒸汽压,请安装一个能分离此混合物的装置。
(-)实验操作的掌握1.演示分液漏斗的操作。
2.搭建一个内消旋酒石酸的分了模型。
3.搭建一个1 ■甲基-2-氯环己烷的优势构象分子模型,并说出它是顺式还是反式。
4.熔点测定时,操作毛细管的封口、样品的研磨、装样。
5.搭建一个(1S,2S)亠甲基2氯环己烷的椅式构象分子模型。
6.搭建一个(Z) -3-氯-2-戊烯的分子模型。
7.某学生在制备己二酸实验中做到用水璽结晶,加入活性碳脱色,滤去不溶性物后,滤液析出大量结晶,请你将此实验继续做至用红外灯烘T•这一步。
8.某学卞做阿斯匹林制备,除去高聚物后,滤液酸化,析出大量结晶,请你将实验继续做到产品干燥前这步。
(三)知识点的掌握1.什么叫蒸锚?利用蒸懈能将沸点相差至少多大的液态混介物分开?如果液体具冇恒定的沸点,能否认为它是单纯物质。
2.常压蒸谓中,圆底烧瓶为什么要加入沸石?如果加热后才发觉未加入,应该怎样处理才安全?怎样才能保证冷凝管套管小充满水?3.测定熔点时,温度计的水银球应放在什么位置?常压蒸憎时,温度计的水银球应放在什么位置?且实验结束时,停止加热和停止通水谁先谁后?在制备乙酸乙酯时,温度计的水银球又放在什么位置?4.什么叫熔程?纯物质的熔点和不纯物质的熔点有何区别?两利|熔点相同的物质等量混合后,混合物的熔点有什么变化?冇机物中含杂质时,熔点特征是什么?测定熔点时,判断始熔的现象是:(),判断全熔的现象是:()A、样品塌落并出现液滴B、样品发毛C、样品收缩D、样品全变透明5.重结晶的作用是什么?重结晶要经过哪些步骤?何种操作可检测经重结晶产品的纯度? 重结晶趁热过滤时,应选用:()A、金属漏斗B、玻璃漏斗C、金属漏斗加短颈玻璃漏斗D、金属漏斗加长颈玻璃漏斗重结晶实验时,抽气过滤中布氏漏斗屮的晶体应使用下列哪种物质进行洗涤?()A、母液B、新鲜的冷溶剂C、冷水D、热水6.水蒸汽蒸饰的原理是什么?水蒸气蒸係装置包括哪四个部分?装置屮T型管的作用是什么?直立的长玻璃管起什么作用?蒸汽导入管的末端为什么要插入到接近容器底部?7.分懈的原理是什么?分蚀柱为什么要保温?木学期哪个冇机实验用到了分馆柱?请写出该实验的原理。
有机物概述复习提纲

有机物概述复习提纲《有机化学基础》——有机物概述复习提纲⼀.有机物的概念及性质1.有机物的概念:含有碳元素的化合物叫做有机化合物,简称有机物【注意】少数含碳元素的化合物,如CO、CO2、碳酸盐、碳酸氢盐、NaCN、KSCN等虽含有碳元素,但具有⽆机化合物的特点,因此把它们看做⽆机化合物【思考】下列物质CO2、CaCO3、CH4、CH3CH2OH、CO(NH2)2中属于有机物的是2.有机物的性质(1)溶解性:⼤多数有机物难溶于⽔,易溶于有机溶剂①常见难溶于⽔且密度⽐⽔⼩的有机物有:烃类、酯类、⼀氯代烃②常见难溶于⽔且密度⽐⽔⼤的有机物有:⼆(或三、四)氯代烃、溴代烃、碘代烃、硝基苯③常见易溶于⽔的有机物:碳原⼦数较少的醇、醛、酮、羧酸,这些物质溶解性的递变规律是:当官能团的个数相等时,随着碳原⼦数的增加溶解度逐渐降低当碳原⼦数相等时,随着官能团数⽬的增加溶解度逐渐增⼤2.耐热性:多数不耐热,熔点较低,⼀般在400℃以下3.可燃性:多数可以燃烧4.电离性:多数是⾮电解质5.化学反应:⼀般⽐较复杂,副反应多,反应速率较慢⼆.有机物的分类和通式(⼀)分类及通式(⼆)概念的辨析1.链烃(⼜称脂肪烃):分⼦中碳原⼦间结合成链状的烃。
(1)烷烃:分⼦中的碳原⼦间都以单键相连的链烃。
(2)烯烃:分⼦中的碳原⼦间有碳碳双键的链烃。
(3)炔烃:分⼦中的碳原⼦间有碳碳叁键的链烃。
2.环烃:分⼦中有碳环的烃。
(1)脂环烃:包括环烷烃、环烯烃、环炔烃。
①环烷烃:碳环中碳与碳原⼦之间是单键相连的,属于饱和烃,②环烯烃与环炔烃含有碳碳双键或碳碳叁键,属于不饱和烃。
(2)芳⾹族化合物:分⼦中含有苯环的化合物①芳⾹烃:分⼦中含有苯环的烃。
②苯的同系物:分⼦⾥都只含有⼀个苯环且苯环上的侧链全为烷烃基。
3.饱和碳原⼦:该碳原⼦成的键均为单键。
如:烷烃和环烷烃中的碳原⼦全都是饱和碳原⼦不饱和碳原⼦:与碳原⼦成键的原⼦数⽬⼩于4的碳原⼦。
有机化学期末复习总结
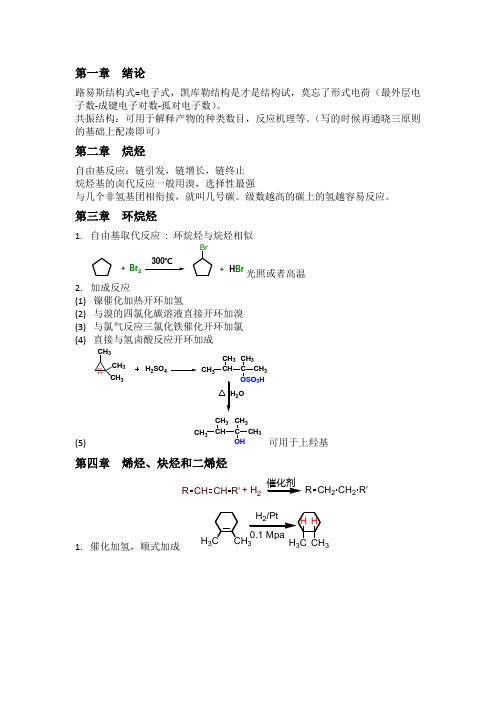
第一章 绪论路易斯结构式=电子式,凯库勒结构是才是结构试,莫忘了形式电荷(最外层电子数-成键电子对数-孤对电子数)。
共振结构:可用于解释产物的种类数目,反应机理等。
(写的时候再通晓三原则的基础上配凑即可)第二章 烷烃自由基反应:链引发,链增长,链终止 烷烃基的卤代反应一般用溴,选择性最强与几个非氢基团相衔接,就叫几号碳。
级数越高的碳上的氢越容易反应。
第三章 环烷烃1. 自由基取代反应 : 环烷烃与烷烃相似光照或者高温2. 加成反应(1) 镍催化加热开环加氢(2) 与溴的四氯化碳溶液直接开环加溴 (3) 与氯气反应三氯化铁催化开环加氯 (4) 直接与氢卤酸反应开环加成(5)可用于上羟基第四章 烯烃、炔烃和二烯烃1. 催化加氢,顺式加成Br 2H Br++BrH 2SO 4CH C CH 3CH 3CH 3CH 32OCH C CH 3CH 3CH 3CH 3CH 3CH 3CH 3OSO 3H OHRCHCHR'+ H 2R CH 2CH 2R'H 3CCH 3332. 亲电加成,遵从马氏规则,反式加成3. 马氏规则:正电荷首先去进攻带负电的部位,因此马氏规则中正电荷具体进攻哪个位置由该位置的负电性决定。
纵然是反马氏规则的反映也是要遵循此5. 氧化反应● 用碱性或中性的KMnO4冷溶液,才能双键变二醇,条件很苛刻● 用酸性KMnO4溶液,双键变二羰基,氢变羟基(实则醛变羧酸),其余不变 ●臭氧氧化同上,有还原剂才可出现醛基6.反马氏加成与过氧化物效应,注意:只有HBr 有过氧化物效应,HCl 和HI 没有过氧化物效应7.酸性及金属炔化物的生成8. 炔的三种催化加氢方式:●氢加金属催化剂一步到位到饱和● 氢加lindlar 催化剂(Pd/BaSO 4)顺式到稀● 氢加Na 液氨催化剂,反式到稀9.炔去一个氢是非常好的亲核反应试剂第五章芳香烃1. 虽然质量不咋地,但是也能发生亲核反应。
高二化学选修《有机化学》复习提纲
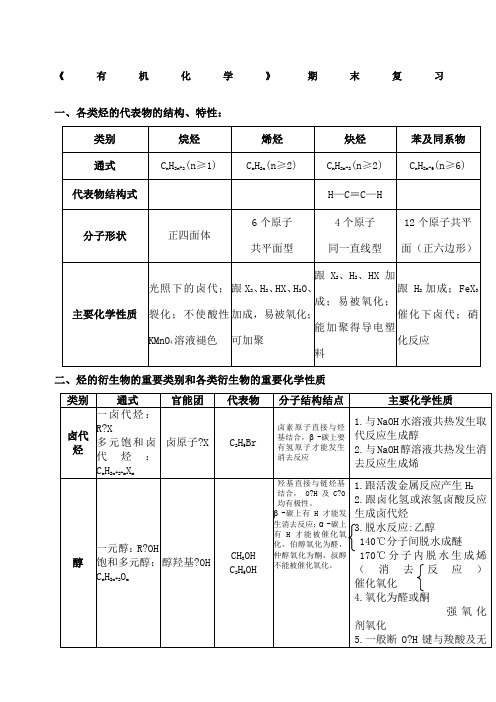
《有机化学》期末复习一、各类烃的代表物的结构、特性:二、烃的衍生物的重要类别和各类衍生物的重要化学性质羰基酯基可能有碳碳双键三、重要的有机反应及类型1.取代反应(1) 酯化反应(2) 水解反应C2H5Cl+H2O C2H5OH+HCl CH3COOC2H5+H2O CH3COOH+C2H5OH (3)(4)(5)2.加成反应(烯烃与X2、H2O、HX、H2)NaOH?H+3.消去反应C 2H 5OH CH 2═CH 2↑+H 2O CH 3?CH 2?CH 2Br+KOH CH 3?CH═CH 2+KBr+H 2O 4.氧化反应(1)燃烧反应: 2C 2H 2+5O 2 4CO 2+2H 2O (2)醇、醛的催化氧化: 2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O2CH 3CHO+O 2 (3)被弱氧化剂氧化: CH 3CHO + 2Ag(NH 3)2OH+ 2Ag↓+3NH 3 + H 2OCH 3CHO + 2Cu(OH)2 + NaOH CH 3COONa + Cu 2O↓+ 3H 2O(4)被强氧化剂氧化:烯、炔、醇、醛、酚、苯的同系物等被酸性高锰酸钾氧化 5.还原反应(1)能与H 2加成的反应:(烯、炔、苯环、醛基、酮) 6. 聚合反应 7.中和反应 四、重要的反应1. 能使溴水(Br 2/H 2O )褪色的物质① 通过加成反应使之褪色:含有 、?C≡C?的不饱和化合物② 通过取代反应使之褪色:酚类(注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀[三溴苯酚]。
)点燃Ag550℃Cu?浓H 2SO 4 170℃乙醇③ 通过氧化反应使之褪色:含有-CHO (醛基)的有机物(有水参加反应) (注意:纯净的只含有—CHO (醛基)的有机物不能使溴的四氯化碳溶液褪色) 2. 能使酸性高锰酸钾溶液KMnO 4/H +褪色的物质含有 、-C≡C -、-OH (较慢)、-CHO 的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应) 3.与Na 反应的有机物: -OH 、-COOH与NaOH 反应的有机物:酚羟基、?COOH ,加热时能与卤代烃、酯反应(取代反应) 与Na 2CO 3反应的有机物:酚羟基反应生成酚钠和NaHCO 3; -COOH 反应放出CO 2气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、命名(10分)10题
1、烯烃(Z、E标记法),带有三键的烯烃也要会命名
2、螺环烃(带有不饱和双键的螺环烃也要会命名)
3、桥环烃
4、芳香族化合物的命名(注:哪些为取代基,哪些作为母体)
5、醇的命名
6、R、S标记法
7、醚的命名
8、硫醚的命名
二、写出结构式(10分、10题)
1、烯烃(Z、E标记)
2、环己烷的稳定式或稳定构象
3、芳香族化合物
4、课上讲的一些俗名(如:NBS、肉桂醇等)
三、选择题(基础理论知识的考察)(20分、10题)
1、溶解度的判断
2、沸点的判断
3、芳香性判断
4、氢化热与稳定性的关系
5、亲核加成反应的活性比较
6、亲电取代反应的活性比较
7、苯环的定位规律
8、碳正离子的稳定性比较
9、SN1和SN2
10、对映异构、手性的判断
四、完成反应方程式(20分,每空一分)
1、烯烃的性质(亲电加成反应,与次卤酸的加成,硼氢化氧化、臭氧化,KMNO4氧化等)
(注意重排,马式规则)
2、炔烃的性质(同上)(炔烃如H停留在烯烃阶段)
3、双烯合成反应
4、醇的性质(脱水反应、氧化反应等)
5、芳烃的性质(苯环的亲电取代反应,定位规律等)
6、环氧乙烷的开环反应
7、萘的氧化
五、鉴别(15分,3题)
1、格式规范,按照鉴别题格式书写,观察简要描述,如:沉淀,气体
2、烷烃,烯烃,环烷烃,苯及其同系物,醇(不同级别的醇、卤代烃等的鉴别)
六、合成题(15分,3题)
1、利用苯环的定位规律合成相类化合物
2、格式试剂法制备不同级别的醇
3、灵活运用所学知识,如烯烃的性质,双烯合成反应等解决相关合成问题
七、推断题(10分,1题)
综合烯烃,卤代烃,炔烃,醇等内容,重视课后推断题
