硫酸铈滴定
硫酸铈标准容液的配置

1工作程序
1.1配制称取40g硫酸铈[Ce(SO4)2•4H2O]加30ml水及28ml硫酸,再加300ml水,加
热溶解,再加650ml水,摇匀。
1.2标定:称取0.25克于105-110℃烘至恒重的工作基准试剂草酸钠,溶于75毫升水
中,加4毫升硫酸溶液(20%)及10ml的1+1盐酸,加热至65-70℃,用配制好的硫酸
铈溶液滴定至溶液呈浅黄色,待冷却至室温时,加入10滴邻菲罗林指示液使溶液变为
橘红色,继续滴定至溶液呈浅蓝色,同时做空白试验。
硫酸铈标准滴定液的浓度(C)数值以摩尔每升(mol/L)
2计算公式:
m1×1000
C =
(V1-V2)×m
式中: V1 —样品耗硫酸铈体积ml
V2 —空白耗硫酸铈体积ml
m1—草酸钠的摩尔质量单位为克每摩尔[m(1/2Na2C2O4)]=66.999 m —草酸钠质量g
邻菲罗林指示液:取硫酸亚铁0.5g,加水100ml使溶解,加硫酸2滴与邻菲罗林1.5g 摇匀即得,本液应临用新制。
硫酸铈容量标准溶液检测方法

硫酸铈容量标准溶液检测方法说实话硫酸铈容量标准溶液检测方法这事,我一开始也是瞎摸索。
我就想知道怎么能准确地检测这个溶液呢,最开始我以为就跟检测普通溶液似的,直接拿个仪器测测浓度就得了。
我试了用那种简易的浓度测量仪,结果那数字跳来跳去的,根本不准,这可把我给坑苦了。
后来我才知道,硫酸铈容量标准溶液可不能这么简单粗暴地检测。
然后我就去看书,书上说要用氧化还原滴定法。
这就好比一场接力赛,这个滴定过程里面的试剂就像接力选手一样,一个把“接力棒”递给另一个。
比如说硫酸铈作为氧化剂,它就像是那个刚开始拿接力棒跑得选手。
我们得把要检测的试样当成另一个选手,让他们在合适的条件下比赛,谁强谁弱就看消耗了多少硫酸铈,这就类似于在比赛里跑了多少距离。
我开始做具体的操作准备。
我不确定我取的硫酸铈容量标准溶液量是否合适,第一次取的时候取多了,结果在滴定的时候,那滴定液都加了好多还没反应完,差点把整瓶滴定液都加进去了,这肯定是错的。
后来我就小心多了,按照非常精确的数值去取溶液。
我还发现加热这个环节特别重要。
就像是给这场接力赛当裁判的,控制好局面。
不加热或者加热过度都不行。
如果不加热,反应就慢悠悠的,像个蜗牛在爬;要是加热过度呢,可能就乱套了,各种反应不受控制地进行,那最后测量出来的数据肯定也是错的。
再有就是指示剂量的控制也是个学问。
我老是掌握不好这个度,放多了它颜色变得太明显太快,放少了又怕错过那个准确的终点。
这就像做菜放盐一样,放多了太咸,放少了没味道。
我折腾了好久才摸清楚了一点规律。
这些就是我目前在硫酸铈容量标准溶液检测方法上的一些真实经历啦,希望对你们也有点帮助,这过程真的是得小心翼翼,处处都是细节,稍微不注意就错了。
0.1硫酸铈滴定液

R–A410–02
滴定液名称
硫酸铈滴定液(0.1mol/L)
配制数量
1000ml
基准试剂名称
三氧化二砷
配制日期
年月日
指示剂名称
邻二氮菲指示液
使用期限
三个月
标化温度
20℃
标化日期
年月日
复标温度
20℃
复标日期
年月日
配制方法:
取硫酸铈g(42g)(或硫酸铈铵70g),加含有硫酸28ml的水500ml,加热溶解后,放冷,加水适量使成1000ml,摇匀。
V4=ml V5=ml V6=ml
计算:
F=
W基×1000
V消×4.946
F4=
W基4×1000
=
×1000
=
V消4×4.946
×4.946
F5=WΒιβλιοθήκη 5×1000=×1000
=
V消5×4.946
×4.946
F6=
W基6×1000
=
×1000
=
V消6×4.946
×4.946
相对偏差:
F复=
F4+F5+F6
注:W5:为第三次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W6:为第四次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W7:为第五次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W8:为第六次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
加氢氧化钠滴定液(1mol/L)10ml,微热使溶解,加水50ml、盐酸25ml、一氯化碘试液5ml与邻二氮菲指示液2滴,用本液滴定至近终点时,加热至50℃,继续滴定至溶液由浅红色转变为淡绿色。每1ml硫酸铈滴定液(0.1mol/L)相当于4.946mg的三氧化二砷。根据本液的消耗量与三氧化二砷的取用量,算出本液的浓度,即得。
硫酸铈滴定法测定铁矿中铁

文章编号:1000 - 7571 (2003) 03 - 0057 - 02硫酸铈滴定法测定铁矿中铁董亦斌3 ,束嘉秀,王素萍(昆明理工大学生化学院,云南昆明650224)摘要:提出在H Cl 介质中,以抗坏血酸还原铁∆,残余的抗坏血酸以次甲基蓝为指示剂,硫酸铈氧化,然后在硫2磷混酸介质中,以二苯胺磺酸钠为指示剂,硫酸铈标准溶液滴定铁Χ。
大多数常见离子不干扰铁的测定,氟的干扰可用硼酸消除。
本方法简便、快速,用于铁矿中铁的测定,结果满意。
关键词:铁;硫酸铈;抗坏血酸中图分类号:O655123 文献标识码:B重铬酸钾滴定法测定铁[ 1 ,2 ] ,虽准确度高,但因汞Χ和铬Γ的有害性,致使其应用受到很大限制。
近年来,关于无汞无铬Γ法测定铁已有一些研究[ 3 ,4 ] ,但效果不很理想。
本文提出在HCl 介质中用抗坏血酸还原铁∆,残余的抗坏血酸以次甲基蓝为指示剂,硫酸铈氧化。
然后在硫- 磷混酸介质中,以二苯胺磺酸钠为指示剂,硫酸铈标准溶液滴定铁Χ。
所拟方法简便、快速,用于铁矿中铁的测定,结果满意。
1 实验部分111 主要试剂硫酸铈标准溶液: 0105mol/ L , 取1616g C e ( SO4) 2 ,用H2 SO4 ( 8 + 92 ) 溶解并以此稀至1000mL ,放置36h 后用纯铁标定;铁标准溶液: 1g/ L ,取015000g 纯铁(质量分数为99199 %) ,加入20mL HCl (1 + 1) ,溶解(必要时可加热) 后,以水稀至500mL ,摇匀;抗坏血酸(VC) 溶液:100g/ L ,现配现用;硫2磷混酸: 150mL H2 SO4 (ρ约1184g/ mL ) 缓缓加入至700mL 水中, 冷后加入150mL H3 PO4 (ρ约1169g/ mL) ,混匀;二苯胺磺酸钠溶液:2g/ L ;次甲基蓝溶液:015g/ L 。
所用试剂除注明外均为分析纯,水为蒸馏水。
112 实验方法取20mL 铁标液或试液于锥形瓶中, 加入HCl (1 + 1) 至2mol/ L ,滴加VC 至浅黄色,加入5 滴次甲基蓝,继续滴加VC 至蓝色褪去并过量1mL ,放置3min ,用硫酸铈标准溶液滴定至蓝色刚出现,加入20mL 水, 15mL 硫2磷混酸, 5 滴二苯胺磺酸钠,继续用硫酸铈标准溶液滴定至紫红色即为终点。
硫酸铈滴定法测定高锑铅中锑含量

43化学化工C hemical Engineering硫酸铈滴定法测定高锑铅中锑含量谢丽芳郴州市产商品质量监督检验所,湖南 郴州 423000摘 要:准确测定高锑铅中锑的含量,对其生产、交易具有重要意义。
采用硝酸、酒石酸混合酸溶解,加入硫酸碳化酒石酸,滴加硝酸除碳。
以硫酸联胺为还原剂,在80℃~90℃下,以甲基橙做指示剂,用硫酸铈标准溶液滴定,建立了硫酸铈滴定法测定高锑铅中锑含量的方法。
考察了溶样酸、硫酸用量、还原剂的选择及其破坏等条件对实验过程的影响。
在优化的实验条件下,对4个高锑铅实际样品进行了测定,其结果的相对标准偏差(n=7)为0.43%~1.5%,加标回收率在99.8%~106.1%。
样品前处理后经硫酸铈滴定和电感耦合等离子体原子发射光谱法测定锑,两种方法检测结果基本一致,并经其他实验室验证,结果满意。
该方法准确、可靠,适用于高锑铅中5%~50%锑含量的测定。
关键词:高锑铅;锑含量;硫酸铈滴定法中图分类号:O655.2 文献标志码:A 文章编号:1002-5065(2024)01-0043-3Determination of antimony in Lead with High antimony by cerium sulfate titrationXIE Li-fangChenzhou Commodity Quality Supervision and Inspection Institute, Chenzhou 423000, ChinaAbstract: The accurate determination of antimony content in high antimony lead is of great significance to its production and trading. Use nitric acid, tartaric acid mixed acid to dissolve, add sulfuric acid carbonized tartaric acid, drop add nitric acid to remove carbon. A method for the determination of antimony content in high antimony lead by ceric sulfate titration was established with diethylamine sulfate as reducing agent, methyl orange as indicator and ceric sulfate standard solution at 80℃~90℃. The influence of the amount of dissolved acid, sulfuric acid, the selection of reducing agent and the amount of reducing agent on the experimental process was investigated. The relative standard deviations (n=7) of 4 samples were 0.43%~1.5%, and the recoveries were 99.8%~106.1%. This method is compared with inductively coupled plasma atomic emission spectrometry. The results of the two methods are basically the same, and the results are verified by other laboratories. The method is accurate, reliable and suitable for the determination of 5%~50% antimony in high antimony lead.Keywords: high antimony lead; Antimony content; Cerium sulfate titration method收稿日期:2023-11作者简介:谢丽芳,女,生于1985年,硕士,工程师,研究方向:化学分析检测。
《铅及铅合金化学分析方法硫酸铈滴定法测定锑量》

《铅及铅合金化学分析方法硫酸铈滴定法测定锑量》引言:铅及其合金是一种常见的金属材料,在工业中有着广泛的应用。
然而,铅及其合金中可能会含有其他的杂质元素,如锑。
锑在铅中的含量对于铅及其合金的质量和性能有着重要影响。
因此,准确测定铅及其合金中锑的含量是非常重要的。
本文将介绍一种常用的化学分析方法,硫酸铈滴定法来测定铅及其合金中锑的含量。
实验方法:1.样品的预处理:-将待测的铅及其合金样品完全溶解于稀硝酸中;-加入过滤纸,将其中的固体杂质过滤掉;-将过滤后的溶液中残留的铅沉淀过滤掉,得到纯净的铅溶液。
2.确定滴定条件:-将纯净的铅溶液转移至滴定瓶中;-加入硫酸溶液,并与溶液中铅的量保持较多的过饱和;-加入高氯酸溶液,使溶液酸性增强,同时避免溶液的过氧化;-加入二氧化碳气体,使溶液酸性中和,以获得较稳定的铅的氧化态。
3.滴定锑的过程:-向溶液中加入硫酸亚铁标准溶液;-摇动滴定瓶,使反应充分进行;-当滴加的硫酸亚铁溶液中催化了锑的还原反应,并将锑还原为Sb(III)离子时,溶液的颜色会发生变化;-当溶液由浅紫色变为无色时,完成滴定。
4.结果计算:-记录滴定所使用的硫酸亚铁溶液体积;-根据硫酸亚铁和锑的化学方程式,计算锑的摩尔浓度;-根据锑在铅中的摩尔比例,计算得到铅样品中的锑含量。
结果分析与讨论:通过硫酸铈滴定法,我们可以准确测定铅及其合金中锑的含量。
在实验过程中,由于硫酸铈滴定法对于溶液的酸性和过饱和度等条件有较高的要求,因此需要注意控制这些实验条件,以获得准确的化学分析结果。
此外,在滴定过程中,摇动滴定瓶是非常重要的,可以加快反应速度,确保反应充分进行。
通过这种方法,我们可以方便地测定铅及其合金中锑的含量,为质量控制和工艺改进提供依据。
结论:硫酸铈滴定法可以有效地测定铅及其合金中锑的含量。
该方法操作简便,结果准确可靠,适用于工业中对于铅及其合金质量控制的分析需求。
在实际应用中,我们可以根据硫酸铈滴定法的结果对铅及其合金的锑含量进行监测和调整,以保证产品质量和性能的稳定性。
2020版《中国药典》硫酸铈滴定液配制与标定操作规程
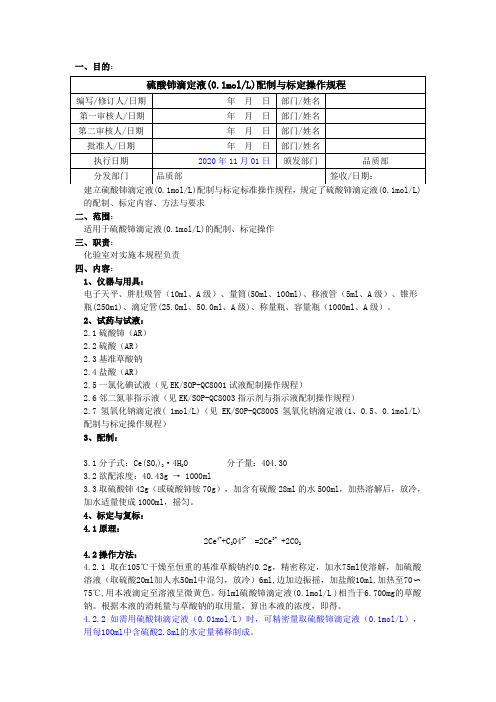
的配制、标定内容、方法与要求二、范围:适用于硫酸铈滴定液(0.1mol/L)的配制、标定操作三、职责:化验室对实施本规程负责四、内容:1、仪器与用具:电子天平、胖肚吸管(10ml、A级)、量筒(50ml、100ml)、移液管(5ml、A级)、锥形瓶(250m1)、滴定管(25.0ml、50.0ml、A级)、称量瓶、容量瓶(1000ml、A级)。
2、试药与试液:2.1硫酸铈(AR)2.2硫酸(AR)2.3基准草酸钠2.4盐酸(AR)2.5一氯化碘试液(见EK/SOP-QC8001试液配制操作规程)2.6邻二氮菲指示液(见EK/SOP-QC8003指示剂与指示液配制操作规程)2.7氢氧化钠滴定液( 1mol/L)(见EK/SOP-QC8005氢氧化钠滴定液(1、0.5、0.1mol/L)配制与标定操作规程)3、配制:3.1分子式:Ce(SO4)2·4H2O 分子量:404.303.2欲配浓度:40.43g → 1000ml3.3取硫酸铈42g(或硫酸铈铵70g),加含有硫酸28ml的水500ml,加热溶解后,放冷,加水适量使成1000ml,摇匀。
4、标定与复标:4.1原理:2Ce4++C2O42- =2Ce3+ +2CO24.2操作方法:4.2.1 取在105℃干燥至恒重的基准草酸钠约0.2g,精密称定,加水75ml使溶解,加硫酸溶液(取硫酸20ml加人水50ml中混匀,放冷)6ml,边加边振摇,加盐酸10ml,加热至70〜75℃,用本液滴定至溶液呈微黄色。
每lml硫酸铈滴定液(0.lmol/L )相当于6.700mg的草酸钠。
根据本液的消耗量与草酸钠的取用量,算出本液的浓度,即得。
4.2.2 如需用硫酸铈滴定液(0.01mol/L)时,可精密量取硫酸铈滴定液(0.1mol/L),用每100ml中含硫酸2.8ml的水定量稀释制成。
硫酸铈滴定液的浓度C(mol/L)按下式计算:00.67V m mol/L C ⨯=)( 式中:m 为草酸钠称取量,mg ;V 为本滴定液的消耗量,ml ;67.00为1m 与l 硫酸铈滴定液(1.000mol/L )相当的以毫克表示的草酸钠的质量。
硫酸铈滴定

硫酸铈滴定引言:硫酸铈滴定是一种常用的分析化学方法,用于测定溶液中的氧化还原物质的含量。
本文将介绍硫酸铈滴定的原理、实验步骤以及影响滴定结果的因素。
一、硫酸铈滴定的原理硫酸铈滴定是一种氧化还原反应,其原理基于铈的两种不同氧化态之间的氧化还原反应。
在滴定中,溶液中的氧化还原物质与硫酸铈溶液中的二价铈离子发生反应,使其氧化为三价铈离子。
反应的终点可以通过添加指示剂来判断,常用的指示剂有硫代硫酸钠和铁(II)铵硫酸。
二、硫酸铈滴定的实验步骤1. 首先,准备好所需的试剂和仪器,包括硫酸铈溶液、指示剂、滴定管、容量瓶等。
2. 将待测溶液加入容量瓶中,并用适量的蒸馏水稀释至一定体积。
3. 取一定体积的稀释后的溶液,加入滴定管中。
4. 加入适量的指示剂,使溶液颜色发生变化。
5. 开始滴定,将硫酸铈溶液缓慢滴入滴定管中,同时轻轻摇晃容器。
6. 当溶液颜色发生明显变化,并持续一段时间后,停止滴定。
记录滴定所需的硫酸铈溶液体积。
7. 重复以上步骤,进行至少三次滴定,并计算平均值。
三、影响滴定结果的因素1. 溶液的酸度:溶液酸度过高或过低都会影响滴定反应的进行,因此需要调节溶液的pH值。
2. 指示剂的选择:不同的氧化还原物质需要使用不同的指示剂,选择合适的指示剂能够提高滴定结果的准确性。
3. 滴定剂的浓度:硫酸铈溶液的浓度对滴定结果有直接影响,需要根据待测溶液的浓度选择合适的滴定剂浓度。
4. 滴定速度:滴定时需要缓慢滴加硫酸铈溶液,过快或过慢都会影响滴定结果。
5. 温度:温度的变化会影响滴定反应的速率,需要保持恒定的温度条件。
结论:硫酸铈滴定是一种常用的分析化学方法,通过氧化还原反应来测定溶液中氧化还原物质的含量。
在进行硫酸铈滴定实验时,需要注意溶液的酸度、指示剂的选择、滴定剂的浓度、滴定速度以及温度等因素的影响。
只有在严格控制这些因素的前提下,才能得到准确可靠的滴定结果。
硫酸铈滴定方法的简便性和准确性使其在化学分析实验中得到广泛应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸铈滴定
硫酸铈滴定是一种常用的分析化学方法,用于测定溶液中氧化还原反应的滴定过程。
本文将介绍硫酸铈滴定的原理、操作步骤以及注意事项。
一、硫酸铈滴定的原理
硫酸铈滴定是基于硫酸铈(Ce(IV))和还原剂之间的氧化还原反应。
在滴定过程中,硫酸铈充当氧化剂,而还原剂则是溶液中待测物质。
硫酸铈溶液呈淡黄色,滴定过程中由淡黄色变为无色,这是由于Ce(IV)被还原成Ce(III)。
1. 准备滴定溶液:称取一定量的硫酸铈溶液,通常浓度为0.1mol/L。
2. 预处理样品:将待测溶液按照实验要求进行预处理,如稀释、酸化等。
3. 滴定:将预处理后的样品溶液滴入滴定瓶中,加入适量的硫酸铈溶液作为滴定剂。
滴定过程中,溶液颜色由淡黄色逐渐变为无色。
4. 终点判断:滴定至溶液颜色变为无色时,滴定结束。
可以通过加入淀粉指示剂,溶液变蓝后再滴定,出现无色终点时即可停止滴定。
5. 计算结果:根据滴定溶液的浓度和滴定的体积,可以计算出待测溶液中还原剂的浓度。
三、硫酸铈滴定的注意事项
1. 滴定前应对硫酸铈溶液进行标定,确定其浓度。
2. 滴定过程中要注意滴定速度,避免过快或过慢。
3. 滴定过程中应搅拌溶液,以保证反应充分。
4. 避免阳光直射,以免影响溶液颜色判断。
5. 滴定前要保证玻璃仪器干净无杂质,以免影响滴定结果。
硫酸铈滴定是一种常用且灵敏的分析方法,被广泛应用于化学、环境等领域。
通过硫酸铈滴定,我们可以测定出溶液中还原剂的浓度。
在实际应用中,我们可以根据滴定结果进行定性分析和定量分析,以满足实验和分析的需求。
硫酸铈滴定是一种重要的分析方法,通过滴定溶液中的还原剂,可以准确测定其浓度。
在进行硫酸铈滴定时,需要注意实验操作的细节,以保证滴定结果的准确性和可靠性。
通过合理使用硫酸铈滴定法,我们可以获得丰富的化学信息,并为实验和分析提供有效的数据支持。
