游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求中航赛维
游离三碘甲腺原氨酸(FT3)测定试剂盒(化学发光法)产品技术要求科美

游离三碘甲腺原氨酸(FT3)测定试剂盒(化学发光法)
适用范围:本试剂盒用于定量测定人血清中游离三碘甲腺原氨酸(FT3)的含量。
规格:
2.1外观
FT3试剂盒组分齐全、完整;溶液无混浊,无沉淀或絮状物;微孔板包装袋无破损、漏气现象。
2.2 准确性
用Siemens公司FT3试剂和本公司的FT3试剂,同时测定新鲜血样,检测结果的相关系数r>0.975。
2.3 剂量反应曲线的线性
在(1.8~50.0 pg/mL)范围内,用Log-Logit或其他适当的数学模型拟合,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4 空白检测限
应不大于0.80pg/mL。
2.5精密度
2.5.1分析内精密度
测定QC血清,变异系数(CV)应小于15.0%。
2.5.2分析间精密度
测定QC血清,变异系数(CV)应小于20.0%。
2.6批间差
用三个批号的试剂盒,分别测量同一质控血清,FT3试剂盒变异系数(CV)应小于20.0%。
2.7 质控血清测定值
用FT3试剂盒测定质控血清,结果应在允许的质控范围内。
2.8 特异性
2.8.1与甲状腺素(T4)的交叉反应
检测浓度为1000ng/mL的T4,交叉反应率应不大于0.01%。
2.8.2与反三碘甲腺原氨酸(rT3)的交叉反应
检测浓度为1000ng/mL的rT3,交叉反应率应不大于0.02%。
2.9 稳定性
FT3试剂盒在2~8℃避光保存,有效期12个月。
在FT3试剂盒有效期满后2个月内,分别检测2.1、2.2、2.3、2.4、2.5.1、2.7项,结果应符合各项目的要求。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk

游离三碘甲状腺原氨酸(FT3)测定试剂盒(电化学发光免疫分析法)组成:适用范围:本试剂盒用于体外定量测定人体血清样本中游离三碘甲状腺原氨酸(FT3)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.4pmol/L。
2.3 准确度用FT3企业参考品进行检测,其测量结果的相对偏差应在±15%范围内。
2.4 线性在[1.0,50.0]pmol/L范围内,线性相关系数的绝对值(|r|)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(5.0±1.0pmol/L)和(30.0±6.0pmol/L)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0pmol/L)和(30.0±6.0pmol/L)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与甲状腺素(T4)浓度不低于200ng/mL的T4样品,在本试剂盒测定结果应不大于0.4pmol/L;2.6.2 与3、3’、5’-三碘甲腺原氨酸(rT3)浓度不低于200ng/mL的rT3样品,在本试剂盒测定结果应不大于0.4pmol/L。
2.6.3 与3、3’-二碘甲腺原氨酸浓度不低于200ng/mL的T2样品,在本试剂盒测定结果应不大于0.4pmol/L。
2.7 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至罗氏诊断生产的FT3定标液。
游离甲状腺素测定试剂盒(化学发光免疫分析法)产品技术要求
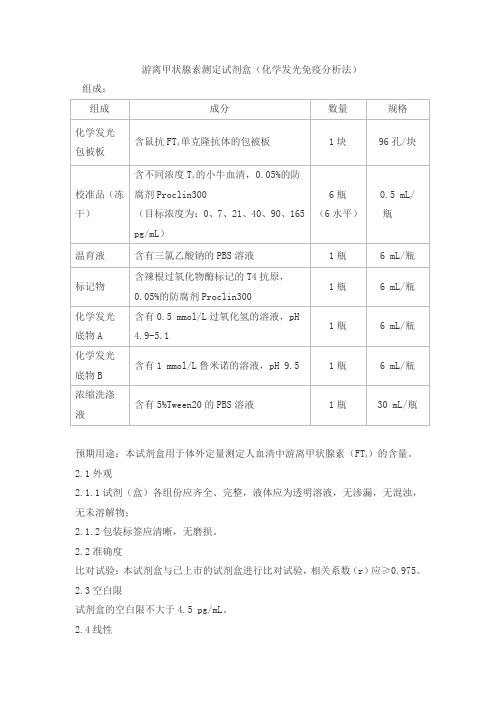
游离甲状腺素测定试剂盒(化学发光免疫分析法)
组成:
)的含量。
预期用途:本试剂盒用于体外定量测定人血清中游离甲状腺素(FT
4
2.1外观
2.1.1试剂(盒)各组份应齐全、完整,液体应为透明溶液,无渗漏,无混浊,无未溶解物;
2.1.2包装标签应清晰,无磨损。
2.2准确度
比对试验:本试剂盒与已上市的试剂盒进行比对试验,相关系数(r)应≥0.975。
2.3空白限
试剂盒的空白限不大于4.5 pg/mL。
2.4线性
在[7,165] pg/mL线性范围内,试剂盒的线性相关系数r应不低于0.990。
2.5重复性
测高、低浓度样本,批内变异系数(CV)应不大于15.0%。
2.6批间差
用三个批次产品测样本,批间变异系数(CV)应不大于20.0%。
2.7稳定性
2℃~8℃保存,有效期12个月,取失效期的试剂盒检测其准确度、空白限、线性和重复性,应符合2.2~2.5的要求。
2.8 校准品溯源性
应根据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定,提供所用企业产品校准品来源、赋值过程以及测量不确定度等内容,校准品溯源至企业工作校准品,工作校准品与已上市产品比对赋值。
游离三碘甲腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)产品技术要求yuande

游离三碘甲腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清中的FT3的含量。
1.1 产品规格试剂盒规格为48人份/盒、96人份/盒。
1.2 主要组成成分表1 游离甲状腺素(FT3)测定试剂盒(化学发光免疫分析法)主要组成成分a) 酶结合物以含牛血清白蛋白的缓冲液配制的联接HRP的T3,其中含ProClin300做为防腐剂。
b) 反应抗体:以含牛血清白蛋白的缓冲液配制的T3单克隆抗体,其中含ProClin300做为防腐剂。
c) 校准品校准品主要是牛血清白蛋白的缓冲液,其中含ProClin300做为防腐剂。
校准品A~F目标浓度分别为0、1 pmol/L、3 pmol/L 、6.5 pmol/L、12 pmol/L、40pmol/L。
校准品具体浓度详见标签及试剂盒参数IC卡。
d) 发光液发光液A主要成份为鲁米诺,发光液B主要成份为过氧化脲,两者均以pH8.6的Tris-HCl缓冲液配制。
e) 包被微孔板包被有羊抗鼠白色聚苯乙烯微孔板,用铝箔袋真空包装。
f) 质控品(备选)以正常人血清为基质制备的冻干品,其中含ProClin300做为防腐剂,其靶值浓度范围QCⅠ为2.00 pmol/L~8.00 pmol/L,QCⅡ为9.00 pmol/L~24.00 pmol/L。
质控品具体浓度详见质控品参数表。
不同批号试剂盒中的相同组分不能互换。
2.1 外观a)液体组分应澄清,无沉淀或絮状物,实际装量应不小于标示装量;b)冻干组分呈白色或淡黄色疏松体,加水后应在3分钟内完全溶解;c)所有组分均无包装破损,标示清楚。
2.2 准确度使用试剂盒校准品校准后测定企业工作参考品,企业工作参考品的实测浓度与标示浓度的偏差在±15%之间。
2.3 线性用Logit-Ln数学模型拟合,在[1,40] pmol/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4 精密度2.4.1分析内精密度:CV≤10%2.4.2分析间精密度:CV≤15%2.4.3批间精密度:CV≤15%2.5空白限试剂盒空白限应不高于1.0 pmol/L。
游离三碘甲状腺原氨酸(FT3)质控品产品技术要求华科泰

游离三碘甲状腺原氨酸(FT3)质控品
组成:
游离三碘甲状腺原氨酸(FT3)质控品为冻干粉,由高、低两水平质控品组成,基质液为含添加0.1%生物防腐剂的牛血清。
适用范围:游离三碘甲状腺原氨酸(FT3)质控品与本公司生产的游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光法)配套使用,用于游离三碘甲状腺原氨酸(FT3)测定项目的室内质量控制。
2.1 外观
质控品包装标签应清晰,无磨损;冻干粉呈疏松体,加入纯化水复溶,溶解后的液体澄清透明,无沉淀或絮状物。
2.2 预期结果
测定高值、低值浓度质控品,其结果均应在质控范围内。
2.3 均匀性
2.3.1 瓶内均匀性
取同批号的一定数量(n≥10)最小包装单元的高、低值质控品,分别重复检测3次,变异系数(CV)应不高于10%。
2.3.2 瓶间均匀性
变异系数(CV)应不高于15%。
2.4 稳定性
2.4.1 复溶稳定性
质控品复溶后,-20℃以下储存,有效期15天,稳定期末质控品与新复溶质控品检测结果的差异不显著。
2.4.2 效期稳定性
质控品原包装2℃~8℃储存,有效期12个月,效期后两个月内检测2.2项,其结果应符合要求。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求北京北方生物技术

游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光免疫分析法) 适用范围:本产品用于体外定量测定人血清中的游离三碘甲状腺原氨酸(FT3)的含量。
1.1包装规格100测试/盒,200测试/盒1.2主要组成成分注:1. 不同批号试剂盒中各组分不可以互换使用。
2. 校准品和质控品具有批特异性,具体浓度见瓶签。
2.1外观试剂盒各组分应齐全、完整、液体无渗漏;磁微粒试剂摇匀后为棕色含固体微粒的均匀悬浊液,无明显凝集;其他液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
2.2 装量各组分装量应不得低于标示体积。
2.3溯源性根据GB/T21415-2008及有关规定,提供试剂盒内校准品的来源、赋值过程以及测量不确定度等内容,溯源至企业一级校准品,一级校准品与已上市产品比对赋值。
2.4线性在[1.0,50.0] pmol/L范围内,相关系数r应不低于0.9900。
2.5空白限应不高于0.4 pmol/L。
2.6准确度回收率应在85.0%~115.0%范围内。
2.7重复性变异系数(CV)应不大于8.0%。
2.8质控品的测定值质控品的测定结果均应在规定的质控范围内。
2.9特异性2.9.1 与甲状腺激素(TT)4在本试剂盒上的测定结果应不高于6.8 pmol/L。
浓度为500 ng/mL的TT42.9.2 与3,3’,5’-反三碘甲状腺原氨酸浓度为50 ng/mL的3,3’,5’-反三碘甲状腺原氨酸在本试剂盒上的测定结果应不高于6.8 pmol/L。
2.10批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.0%。
2.11稳定性试剂盒在2~8℃保存,有效期为12个月,在有效期结束的前后两个月内,检测试剂盒的线性、空白限、准确度、重复性、质控品的测定值,应符合相应的规定。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)产品技术要求tgkx
游离三碘甲状腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒主要用于体外定量测定人血清中的游离三碘甲状腺原氨酸(FT3)含量。
1.1 规格48人份/盒,96人份/盒。
1.2 主要组成成分2.1 外观液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量装量不少于标示值。
2.3 准确性回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数在[2.9,28]pmol/L范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度2.5.1 重复性(C.V%)应不高于15.0%;2.5.2 批间差(C.V%)应不高于20.0%。
2.6 最低检出量应不高于2.00pmol/L。
2.7 质控血清测定值应在允许的范围之内。
2.8 特异性与浓度为320nmol/L 的T4反应,测定结果应小于2.00 pmol/L;与浓度为10nmol/L 的rT3反应,测定结果应小于2.00 pmol/L。
2.9 稳定性2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与进口试剂盒(Siemens Healthcare Diagnostics Inc.)比对赋值。
游离甲状腺素测定试剂盒(磁微粒化学发光法)产品技术要求中生北控
游离甲状腺素测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人血清中游离甲状腺素的浓度。
1.1包装规格100人份/盒,50人份/盒。
1.2 主要组成成分2.1 外观2.1.1 试剂盒中的液体组分应澄清,无沉淀和絮状物,外包装完整无破损。
2.1.2 磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 准确度)检测试剂盒作为比对系统,以中生试以西门子公司已注册游离甲状腺素(FT4剂盒作为待测系统,分别测定40个在测定范围内的样本,计算两组数据的相关系数r,要求r≥0.975;2.4空白检测限应不大于1.0 pg/mL。
2.5 线性范围在[1.0,60]pg/mL测量范围内,线性相关系数r应≥0.9750。
2.6 重复性重复测试高、低浓度样本,变异系数(CV)应≤10%。
2.7 批间差测试同一样本,批间变异系数(CV)应≤15%。
2.8 特异性2.8.1 与三碘甲状腺原氨酸(T)3在本试剂盒上的测定结果应不高于5pg/mL。
浓度为10ng/mL的T3)2.8.2 与反三碘甲状腺原氨酸(rT3浓度为10ng/mL的rT在本试剂盒上的测定结果应不高于5pg/mL。
32.9稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6的要求。
2.10校准品溯源性校准品溯源性应符合GB/T 21415《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,并提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至工作校准品,工作校准品采用西门子公司同类产品比对定值。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求大成
游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中游离三碘甲状腺原氨酸的含量。
1.1包装规格规格W:W1:25人份/盒;W2:50人份/盒;W3:2×50人份/盒;W4:4×50人份/盒。
规格L:L1:25人份/盒;L2:50人份/盒;L3:100人份/盒;L4:2×100人份/盒。
1.2 产品主要组成成分校准品和质控品浓度具有批特异性,具体浓度见标签。
2.1 外观试剂盒中的组分应澄清,应无沉淀和絮状物。
磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集。
校准品和质控品均为澄清无沉淀液体。
2.2空白限应不大于0.6pg/mL。
2.3准确度回收率应在(85%-115%)范围内。
2.4 线性在[0.6,25]pg/mL测量范围内,相关系数R≥0.9900。
2.5 重复性用高低两个浓度的样本,各重复检测10次,变异系数CV应不大于10%。
2.6 批间差用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间变异系数CV应不大于15%。
2.7 特异性2.7.1含浓度不低于10ng/mL 二碘甲腺原氨酸的零浓度FT3样本,测值应不高于0.6pg/mL。
2.7.2含浓度不低于10ng/mL反三碘甲腺原氨酸的零浓度FT3样本,测值应不高于0.6pg/mL。
2.8 稳定性试剂盒在2℃~8℃的贮存条件下保存至有效期(12个月)后,结果应符合2.1-2.5项的要求。
2.9 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品可溯源至本企业指定纯品抗原,该纯品抗原通过北京利德曼生化股份有限公司试剂盒比对赋值。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)产品技术要求爱康试剂
游离三碘甲状腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)性能指标1试剂条性能指标1.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰、准确、牢固;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.2检出限应不大于0.600pmol/L。
1.3准确度-相对偏差使用企业参考品进行测定,实测值与标示值的相对偏差应在±15.0%内。
1.4线性区间试剂盒在0.600pmol/L~50.0pmol/L区间内,其线性相关系数(r)应不小于0.9900。
1.5重复性用同一批次的试剂盒测定两份不同浓度的内控品,重复检测10次,其变异系数(CV)应不大于10.0%。
1.6批间差用3个批号试剂盒测定两份不同浓度的内控品,重复检测10次,测定结果的变异系数(CV)应不大于15.0%。
1.7分析特异性a)对浓度为200ng/mL的甲状腺激素进行测定,测定结果应不高于0.600pmol/L;b)对浓度为100ng/mL的3,3’,5’-三碘甲腺原氨酸进行测定,测定结果应不高于15.0pmol/L;c)对浓度为100ng/mL的3,3’-二碘甲腺原氨酸进行测定,测定结果应不高于20.0pmol/L。
2校准品性能指标2.1外观校准品应为无色透明或淡黄色液体,无悬浮物、无沉淀、无絮状物。
2.2装量校准品装量偏差应在±10.0%之内。
2.3准确度游离三碘甲状腺原氨酸(FT3)校准品,测试结果偏差应在±10.0%之内。
2.4均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10.0%,批内瓶间差CV应≤10.0%。
3质控品性能指标3.1外观质控品应为无色透明或淡黄色液体,无悬浮物、无沉淀、无絮状物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光免疫分析法)
适用范围:该产品用于体外定量测定人血清中的游离三碘甲状腺原氨酸(FT3)含量
1.1 产品规格
100测试/盒
1.2 划分说明
1.2.1 FT3校准品(FT3-STD)(选配),0.5mL/瓶×6瓶,含一定浓度FT3抗原和去激素人血清(pH=7.4)。
目标浓度分别为0、1.5、3.5、7、15和30pg/mL。
1.2.2 FT3试剂1号(FT3-R1),5mL/瓶×1瓶,含有FT3单克隆抗体(0.1μg/mL)、牛血清白蛋白(0.5%)的Tris缓冲液(浓度0.1mol/L,pH=8.0)。
1.2.3 FT3试剂2号(FT3-R2),5mL/瓶×1瓶,含有ALP标记的FT3抗原(0.1μg/mL)、牛血清白蛋白(0.5%)的Tris缓冲液(浓度0.1mol/L,pH=8.0)。
1.2.4 FT3磁分离试剂(FT3-M),5mL/瓶×1瓶,含有标记羊抗鼠IgG抗体的磁性微粒(0.5mg/mL)、牛血清白蛋白(0.5%)的Tris缓冲液(浓度0.1mol/L,pH=8.0)。
1.2.5 FT3质控品(FT3-QC),(选配),1mL/瓶×2瓶,2个水平的液体质控品,含一定量FT3抗原和去激素人血清(pH=7.4)。
质控范围分别为:(3.5±
0.7)pg/mL和(15±3)pg/mL。
由于每批质控品的浓度范围有所不同,具体浓度范围详见每批的质控单。
本试剂盒校准品可溯源至国家标准物质(编号150550)
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3 液体组分应澄清,无沉淀或絮状物;
2.1.4 包装标签应清晰,易识别;
2.1.5 各组分装量不得低于标示体积。
2.2 特异性(交叉反应)
试剂盒与表1中有关潜在交叉反应物应无显著的交叉反应。
表1 交叉反应
2.3 准确度
用国家标准物质(编号150550)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 空白限
应不大于1.0pg/mL。
2.5 线性
在[1.5,30]pg /mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.6 重复性
变异系数(CV)应不大于10%。
2.7 质控品的赋值有效性
质控品的测量值应在质控范围内。
2.8 批间差
变异系数(CV)应不大于15%。
2.9 效期稳定性
该试剂盒在2-8℃贮存,有效期为12个月,在有效期满后一个月内检测试剂盒的准确度、空白限、线性、重复性和质控品的赋值有效性,应符合2.3、2.4、2.5、2.6和2.7的要求。
