氨氧化古菌——环境微生物生态学研究的一个前沿热点
【国家自然科学基金】_氨氧化古菌(aoa)_基金支持热词逐年推荐_【万方软件创新助手】_20140802
推荐指数 3 3 3 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19源自20 21 22 23 24 25
2013年 科研热词 推荐指数 氨氧化古菌 3 群落结构 2 氨氧化细菌 2 氨氧化古菌(aoa) 2 氨氧化 2 丰度 2 纯培养物 1 研究进展 1 环境工程学 1 环境因子 1 溶氧 1 沉积物 1 氨氧化菌 1 氨氧化细菌i氨氧化古菌 1 氨氧化细菌(aob) 1 氨氧化作用 1 岸边带沉积物 1 富集 1 多样性 1 外源氨氮 1 堆肥 1 反硝化作用 1 厌氧氨氧化细菌 1 pcr-dgge 1 amoa基因 1
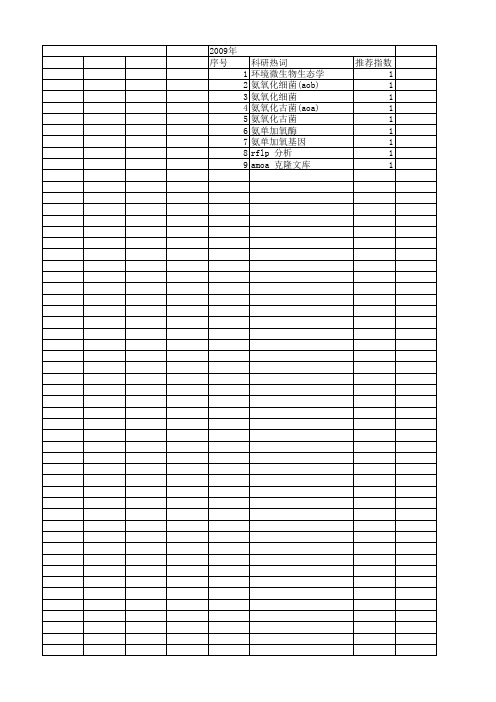
2009年 序号 1 2 3 4 5 6 7 8 9
科研热词 环境微生物生态学 氨氧化细菌(aob) 氨氧化细菌 氨氧化古菌(aoa) 氨氧化古菌 氨单加氧酶 氨单 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19
2014年 序号 1 2 3 4 5 6 7 8 9 10
科研热词 群落结构 氨氮去除 氨氧化细菌 氨氧化古菌aoa 氨氧化古菌 森林类型 土壤 低温 人工湿地 丰度
推荐指数 1 1 1 1 1 1 1 1 1 1
推荐指数 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29
氨氧化古细菌(AOA)的研究进展

氨氧化古细菌(AOA)的研究进展摘要一直以来,氨氧化细菌(AOB)是硝化反应中负责将NH4+ 转化成为NO2- 的一类无机自养微生物。
近几年来国外一些学者于海洋中发现氨氧化古细菌(AOA)存在,它们同样广泛存在于土壤、自然水体、污水处理厂、垃圾渗滤液等产生硝化反应的环境中,负责将氨转化为亚硝酸盐。
甚至在某些生态环境中,AOA 占主导地位。
概述了国外对不同环境下氨氧化古细菌种群多样性的差异,以及各类环境中共有的氨氧化古细菌种类。
最后,对今后氨氧化菌深入研究的方向及其功能作了进一步的展望。
[关键字]:氨氧化古细菌系统发育生态分布Advances on Ecological Research of AmmoniaoxidizingAbstract:For long times, ammonia oxidation by ammonia-oxidizing bacteria (AOB)is the key process in thenitration reaction. These ammonia-oxidizing bacteria are a kind of inorganic autotrophic microorganism who have theresponsibility of transferring NH4+ to NO2-. But in these several years, some foreign researchers found ammonia-oxidizingarchaea (AOA)who exist in the marine. They are generally in the environment which contains nitration reaction,such as soils, fresh water, wastewater treatment systems. soils and even wastewater treatment. AOA have thesame function as AOB, and in some certain habit, the AOA are the predominant oxidizer. We also summarize thediversity difference between the AOA in various environments. Here we describe our perspectives for the future researchof AOA in applied ecology and environmental protection.Keywords:Ammonia-oxidizing archaea; Phylogeny; Ecological distribution1 氨氧化古细菌在生态环境中的分布1.1 AOA 的发现氨氧化细菌(AOB)在泥土、淡水、海水层、河口以及沉积物等各种生态环境中已经得到了广泛关注,并在海洋的上层和深海层中的生物地球化学循环中起到了关键作用。
氨氧化古菌及其在氮循环中的重要作用

氨氧化古菌及其在氮循环中的重要作用3刘晶静1 吴伟祥1,233 丁 颖1,2 石德智1 陈英旭1,2(1浙江大学环境保护研究所,杭州310029;2浙江省水体污染控制与环境安全技术重点实验室,杭州310029)摘 要 氨氧化作用作为硝化过程的第一步,是氮素生物地球化学循环的关键步骤.长期以来,变形菌纲β和γ亚群中的氨氧化细菌一直被认为是氨氧化作用的主要承担者.然而,近年来研究发现氨氧化古菌广泛存在于各种生态系统中,并且在数量上占明显优势,在氮素生物地球化学循环中起着非常重要的作用.本文概述了氨氧化古菌的形态、生理生态特性及其系统发育特征,对比分析了氨氧化古菌和氨氧化细菌的氨单加氧酶及其编码基因的异同,综述了氨氧化古菌在水生和陆地等生态系统氮素循环中的作用,同时就氨氧化古菌在应用生态和环境保护领域今后的研究重点进行了展望.关键词 氨氧化古菌 氨单加氧酶 氮循环文章编号 1001-9332(2010)08-2154-07 中图分类号 X172 文献标识码 A Amm on i a 2ox i d i z i n g archaea and the i r i m port an t roles i n n itrogen b i ogeoche m i ca l cycli n g:Arev i ew .L I U J ing 2jing 1,WU W ei 2xiang 1,2,D I N G Ying 1,2,SH I De 2zhi 1,CHE N Ying 2xu 1,2(1Institu te of Environm ental S cience and Technology,Zhejiang U niversity,Hangzhou 310029,Chi 2na;2Zhejiang P rovince Key L aboratory forW ater Pollution Control and Environm en tal Safety,Hang 2zhou 310029,China ).2Chin .J.A ppl .Ecol .,2010,21(8):2154-2160.Abstract:A s the first step of nitrificati on,a mmonia oxidati on is the key p r ocess in gl obal nitr ogen bi ogeoche m ical cycling .So far,the aut otr ophic ammonia 2oxidizing bacteria (AOB )in the β2and γ2subgr oup s of p r oteobacteria have been considered as the most i m portant contribut ors t o a mmonia oxidati on,but the recent researches indicated that a mmonia 2oxidizing archaea (AOA )are widely distributed in vari ous kinds of ecosyste m s and quantitatively p redom inant,p laying i m portant r oles in the gl obal nitr ogen bi ogeoche m ical cycling .This paper revie wed the mor phol ogical,physi ol ogical,and ecol ogical characteristics and the molecular phyl ogenies of AOA,and compared and analyzed the differences and si m ilarities of the a mmonia monooxygenase (AMO )and its encoding genes be 2t w een AOA and AOB.I n additi on,the potential significant r oles of AOA in nitr ogen bi ogeoche m ical cycling in aquatic and terrestrial ecosyste m s were summarized,and the future research directi ons of AOA in app lied ecol ogy and envir onmental p r otecti on were put f or ward .Key words:a mmonia 2oxidizing archaea;a mmonia monooxygenase;nitr ogen cycling .3国家“863”计划项目(2006AA06Z327)和浙江省科技计划项目(2006C13066)资助.33通讯作者.E 2mail:weixiang@zju .edu .cn 2009212231收稿,2010206201接受. 氨氧化作用是好氧微生物将铵态氮转化为亚硝酸盐氮的过程[1-2].作为硝化作用的限速步骤,氨氧化作用微生物学研究在氮素生物地球化学循环过程中一直倍受关注.长期以来,研究者普遍认为变形菌纲的氨氧化细菌(a mmonia 2oxidizing bacteria,AOB )是地球氮素循环过程中最主要的承担者[3].然而,近年来随着环境微生物分子生态学技术的发展和研究的深入[4],研究者发现另一类具有氨氧化能力的微生物———氨氧化古菌(a mmonia 2oxidizing archaea,AOA ).它们是一类以重碳酸盐为碳源、利用铵态氮氧化产生细胞能量进行化能无机自养生长的独立于AOB 进化分枝外的进化类群,属于泉古菌门(Cren 2archaeota ).AOA 广泛分布于海洋[5-7]、土壤[8]、温泉[9-10]和湿地[11]等各种类型的生态系统中,在地球生态系统的氮素循环过程中可能起着相当重要的作用.本文介绍了AOA 的形态、生理生态特性及其系统发育特征,对比分析了AOA 和AOB 的氨单加氧酶及其编码基因的异同,并从水生生态系统、陆地生态系统和其他生态系统等方面综述了AOA 的生应用生态学报 2010年8月 第21卷 第8期 Chinese Journal of App lied Ecol ogy,Aug .2010,21(8):2154-2160态分布、丰度、活性及其在氮循环中的重要作用.1 氨氧化古菌的形态、生理生态特性及其系统发育2004年,Venter 等[12]在Sargass o Sea 海水微生物宏基因组测序分析中发现泉古菌编码氨单加氧酶(AMO )各亚基的基因,首次提出了海洋泉古菌可能具有氨氧化能力.2005年,Treusch 等[13]在对土壤泉古菌基因组分析时也发现泉古菌氨单加氧酶编码基因.同年,K nneke 等[14]成功分离并获得具有氨氧化能力的中温泉古菌N itrosopum ilus m ariti m us 纯培养物,Francis 等[15]将具有氨氧化能力的泉古菌命名为氨氧化古菌(a mmonia 2oxidizing archaea,AOA ).自此,古菌的氨氧化引起了全世界氮循环研究者的广泛关注.AOA 定二氧化碳,进行化能无机自养生长,受缺氧环境,域等缺氧环境中氨氧化的优势微生物类群[生存环境温度划分,低于45℃环境中的中温泉古菌(mes ophilic Crenarchaeota ),高于环境中的AOA 属于嗜热泉古菌(ther mophilic archaeota )[17-18].研究者推测氨氧化能力起源于嗜热泉古菌[10,18-19].地球早期高温环境产生的铵态氮可以为化能无机自养的嗜热泉古菌提供能量来源,这与地球早期的氮循环由化学驱动相一致.中温AOA 则可能是嗜热AOA 随着环境温度的变化采用独立的次级响应机制进化而来[18].随着地球环境的变化,氨氧化泉古菌可能随地壳运动而分布到各种生态系统中[10,19].生物进化使得泉古菌营养类型丰富,严格自养和兼养型的泉古菌都能够进行铵态氮氧化而获得细胞能量[14,20].氨氧化能力起源的问题涉及到能量起源和生物进化,尚需大量假设和模型进一步论证.迄今为止,研究者仅从环境中纯培养了1株中温AOA N.m a riti m us [14].该菌是以西雅图水族馆热带水域沙砾层为接种物富集、分离培养获得;细胞直杆状,长015~019μm ,切面直径0117~0122μm;有机碳源的加入会对其生长产生抑制作用.嗜热AOA N itrososphaera gargensis [18]和N itrosocaldus yel 2lo w ston ii [19]以及中温AOA Cenarchaeum sym bio 2sum [20]均为富集培养产物.富集培养的AOA 为杆状或球状,世代周期约为20h,与废水处理厂中AOB的生长速度相似[21].N.gargensis 对铵态氮浓度变化较为敏感,铵态氮浓度>3108mmol ・L -1时会抑制其活性,这远低于文献报道AOB 对铵态氮200mmol ・L -1以上的耐受能力[22-23].C.sym biosum 不仅能够通过32羟基丙酸循环将二氧化碳转化为有机碳进行化能无机自养生长,还能够通过三羧酸循环以有机化合物为碳源产生细胞能量进行混合营养型生长[24].C.sym biosum 基因组中不仅具有氨单加氧酶的am o A 、am o B 和am o C 基因,还具有氨通透性酶、脲酶、尿素转运系统、亚硝酸盐还原酶以及一氧化氮还原酶,但是没有检测到AOB 铵态氮代谢途径中涉及到的羟胺氧化还原酶和电子传递体细胞色素c 554及c m 552. 在系统发育与进化方面,AOA 形成了一类完全独立于AOB 的进化分支.16S r RNA 系统发育揭示了AOA 的亲缘关系(图1).海洋、大多数水体以及征以及细胞生物化学和分子生物学的研究尚处于图1 泉古菌系统发育树及分支结构[25]F i g .1 Phyl ogenetic tree of maj or crenarchaeota and branch structure .A:海洋水体及沉积物来源Marine water and sedi m ents (Gr oup 1.1a );B:土壤和其他环境来源Ubiquit ous in most s oil and other envir on 2ments (Gr oup1.1b );C:牧草地和针叶林土壤来源Grassland and co 2nifer ous f orest s oils;D:沉积物来源Sedi m ents;E:淹水土壤、沉积物、淡水及其他环境来源Fl ooded s oils,sedi m ents,freshwater and other envir onments;F:深海分支B Marine benthic gr oup B;G:深海分支C Marine benthic gr oup C;H:地下植物根系来源Subsurface p lant r oots;I :陆地温泉和热液喷口中可培养嗜热泉古菌分支Terrestrial hot s p rings and hydr other mal vents .55128期 刘晶静等:氨氧化古菌及其在氮循环中的重要作用 起步阶段,AOA碳氮代谢机制也需要进一步探明. 2 氨氧化古菌的氨单加氧酶及其编码基因氨单加氧酶(a mmonia monooxygenase,AMO)是由AmoA、AmoB和AmoC3个亚基组成的三聚体膜结合蛋白[26],是好氧氨氧化微生物所特有的一种胞内酶.尽管3个亚基的编码基因am o A、am o B和am o C在AOA与AOB之间存在一定的差异,但是AOA和AOB的AMO氨基酸序列在金属离子结合位点具有较强的保守性,大约25%的序列相同, 40%的序列相似[25],跨膜结构也很相似[24].AOA和AOB的AmoA亚基氨基酸序列相似性虽然也较低,却非常重要,都具有氨单加氧酶家族特有的10个氨基酸序列[13].因此,可以推测AOA和AOB的AMO 具有相同的进化史,同属于单加氧酶蛋白家族.AmoA是AMO活性多肽位点[27-28],以其编码纲AOB只有1个拷贝;自然环境中的AOA有2~3个拷贝,富集培养的AOA只有1个拷贝[5,30].现阶段只能采用am o A基因拷贝数研究环境样品中AOA 与AOB的相对丰度.am o的系统发育分析表明,AOA和AOB的am o 基因同源性较小,在进化树上两者属于不同的分支[25],而且am o A、am o B和am o C在AOA与AOB中的排列顺序也存在明显差异(图2).AOB的am o基因簇排列较保守,am o A和am o B位于同一操纵子, am o B位于am o A下游,am o C位于am o A上游[30]. AOA的am o基因簇排列多变[25],与细菌存在明显差异.N.m ariti m us和马尾藻海AOA的am o基因簇中,am o B位于am o C下游,am o A位于am o C上游, am o C和am o A基因之间有未知功能基因插入.土壤来源的AOA缺少am o C基因,am o B与am o A基因中也有与海洋AOA相同的未知功能基因插入[13].嗜热AOA的am o基因簇中也缺少am o C基因,且am o A位于am o B的下游[18-19].N.yello w ston ii的Amo B亚基氨基酸序列与土壤和海洋来源AOA的Amo B一致性<50%,并有30个氨基酸插入序列,图2 AOA和AOB中不同种am o基因排列示意图[19]F i g.2 Sche matic rep resentati on of am o genes in different s pe2 cies of AOA and AOBN itroso m onas europaea:欧洲亚硝化单胞菌;Sargass o Sea scaffold CH004643:马尾藻海泉古菌AMO基因片段;Soil Crenarchaeota fos2土壤泉古菌AMO基因片段;Cenarchaeum sym biosum,N i2Candidatus“N itr os ocaldus yell owst onii”:富集培obtained by enrichment culture;D:保守假设Con2E:连接Connecti on.在高温环境生长及其蛋白表达,AOA能够将无机的氮源和碳源转化为细胞能量和细胞生物有机体,在地球生物化学循环中起着至关重要的作用.虽然目前的研究还不足以确定AOA对全球氮素循环的具体贡献,但是泉古菌在脂质分析、荧光原位杂交分析、16S r RNA基因聚类分析以及am o A基因定量分析中特有的结果均可证实AOA在自然界中分布广泛,并在生态系统氮素循环中起着极其重要的作用. 311 氨氧化古菌在水生生态系统氮素循环中的作用中温AOA大量分布于水生生态系统中的各个区域,包括海洋透光层[5-6,31]和深海缺氧层[7,32-33]、深海沉积物[32,34]、珊瑚和暗礁[35]、江河口[36-37]、地下暗河[38]、淡水沉积物[37],甚至在南北两极的海水中也检测到泉古菌am o A基因存在[39].相反,部分海域AOB的am o A基因含量较低甚至难以检测[5-6].虽然最近有文献报道高盐度水域AOB的am o A基因数量高于AOA,例如弗罗里达州河口[37]、地下河入海口[38]以及圣弗朗西斯科海湾[40]的高盐度水体和沉积物中,AOB的am o A基因拷贝数均略高于AOA.但是总体而言,在大多数的水生6512 应 用 生 态 学 报 21卷生态系统中,AOA的am o A基因在水体中拷贝数为10~105copy・m l-1,在沉积物中拷贝数高达107~108copy・g-1,比AOB的am o A基因数量高1~3个数量级.AOA与AOB的am o A基因数量比值在北极圈海水中更是高达11071[5-6,34,39].在水生生态系统中,AOA数量上占优势,而且am o A基因拷贝数与氨氧化速率存在很好的相关性,因而可以推测AOA对硝化作用的贡献可能大于AOB.研究者发现,在阿拉伯海[41]、圣芭芭拉海峡[42]、加利福尼亚海湾[31]和荷兰西斯海尔德河口[43]等水体中,亚硝酸盐浓度和氨氧化速率均与泉古菌am o A基因数量呈显著正相关.弗罗里达州9个不同河口底层水体和沉积物中,硝化速率与泉古菌am o A基因数量也呈正相关,但与AOB的am o A 数量没有显著的相关性[37].W uchter等[5]对北海沿岸海水进行连续12个月的监测发现,泉古菌am o A 基因数量与海水中铵态氮浓度呈显著负相关.最近, La m等[7]研究发现AOA为黑海中厌氧氨氧化过程提供了大约一半的亚硝酸盐.在太平洋上中层海域中,绝大多数泉古菌都具有铵态氮氧化的代谢机制,这些AOA是海洋氮素循环非常活跃的贡献者[44].AOA在贫营养水体的氮素循环中也可能起着主导作用.AOA的半饱和速率常数Km与海洋原位氨氧化作用的Km非常接近[16].当铵态氮浓度低至10~20n mol・L-1时,AOA仍可进行氨氧化作用,这一浓度比富集培养的AOB最低生长浓度(>1μmol ・L-1)还要小100倍以上[45].N.m a riti m us对底物铵态氮的亲和力是已报道生物底物亲和力中最高的,达68700g-1・h-1,比AOB高出200多倍,比贫营养区硅藻属高30多倍.因此,在氨氮浓度极低的贫营养海域尤其是深海,AOA不仅丰度远高于AOB,而且在与AOB、异养微生物和浮游藻类竞争底物铵态氮的过程中占有绝对优势,可以推测AOA 在贫营养海域的氮素循环和能量转换中扮演着极为重要的角色.312 氨氧化古菌在陆地生态系统氮素循环中的作用AOA在陆地生态系统中的分布也非常广泛.迄今为止,研究者已在碱性沙地[46]、农业土壤[8]、半干旱森林土壤[47]、牧草土壤[48-49]、盐沼湿地[50]、稻田土壤[51-52]、淡水大型植物L ittorella uniflora根系土壤[11]以及高山永久冻结带[53]等陆地生态系统中检测到AOA的存在.Zhang等[53]发现珠穆拉玛峰北坡高海拔(>5700masl)土壤中,AOB的am o A基因拷贝数比AOA略高1~2个数量级.但是总体而言,陆地生态系统AOA的am o A基因数量在104~108 copy・g-1,比AOB的am o A基因数量高出约2~3个数量级.铵态氮浓度、pH和温度的变化都会影响土壤生态系统中AOA的群落结构和活性.高钙草原土壤中铵态氮浓度的升高会显著促进AOA am o A基因表达量的增加[13];稻田土壤中氮肥的施用也会显著促进AOA的生长和表达活性[52].酸性土壤硝化作用可能主要由AOA承担.N icol等[54]发现在土壤pH 值为419~715时,AOA am o A基因的拷贝数及表达活性均随土壤pH值的降低而升高;当pH最低时, AOA与AOB的am o A转录活性比值达到最大;而碱性土壤中,pH值(813~817)对AOA丰度和群落结构没有明显影响[46].培养温度(10℃~30℃)变化对AOA群落结构和转录活性都有明显影响[55].高丰度和高效基因表达说明AOA对土壤生态系统的氮循环可能起着非常重要的作用.Tourna 等[55]研究发现,土壤中AOA的am o A基因不仅数量远高于AOB,其转录活性和转录产物数量也高于AOB.Offre等[56]利用乙炔对氨单加氧酶活性的抑制研究了土壤硝化过程中AOA与AOB的生长,结果表明土壤硝化过程中只有AOA在生长,AOA对土壤硝化作用起主要作用.Chen等[52]发现,AOA对淹水稻田土壤氨氧化过程也起着主导性作用,其am o A基因数量以及转录水平均显著高于AOB.但是也有研究指出,在铵态氮浓度较高的生态系统中, AOB可能对硝化作用贡献更大.长期施用氮肥的碱性沙质土壤中,铵态氮浓度升高对AOA的am o A基因拷贝数影响不大,而AOB的am o A基因拷贝数与硝化速率有明显的正相关关系[48].在高氮草原土壤中,AOA的丰度和活性并没有随氮肥的施入而增大,而AOB的数量和活性不仅与土壤硝化活性呈正相关,而且随土壤铵态氮浓度的升高而增大[49].这表明过高的铵态氮浓度可能会抑制AOA活性;与AOB相比,AOA更适合于低浓度铵态氮的环境条件,并且在低浓度铵态氮硝化作用中起主导作用. 313 氨氧化古菌在其他生态系统氮素循环中的作用AOA不仅对海洋、陆地等自然生态系统的氮素循环做出了重要的贡献,在人工污水处理系统中也发挥着重要作用.在水族馆生物膜系统[57]、地下水处理生物滤器[58]和污水处理厂活性污泥反应器[59-60]中均发现了泉古菌am o A基因的存在.虽然75128期 刘晶静等:氨氧化古菌及其在氮循环中的重要作用 目前对这些系统中AOA的具体贡献尚不明确,但是可以确定AOA是这些系统中微生物群落结构的重要组成部分.AOA对地热环境中的氮素循环也起着至关重要的作用.嗜热AOA对温度和pH的变化具有很高的耐受能力,它们能够活跃在38℃~97℃和pH 215~910的温泉、地矿等受地热影响的环境中[9-10,61-62].氨氧化能力在嗜热泉古菌中的发现不仅拓展了硝化作用上限温度,而且AOB在地热环境中鲜有发现也证明了高温环境中的氨氧化作用可能主要由AOA承担.4 结论与展望AOA是地球生态系统中非常丰富的氨氧化微生物,广泛存在于海洋、淡水流域、土壤、温泉等生态系统.AOA不仅丰度显著高于AOB,而且在部分生境中其转录和表达活性也高于AOB,尤其在低浓度铵态氮生态系统和贫营养海域,AOA对硝化作用的贡献远大于AOB.嗜热AOA更是高温环境氨氧化作用的主要承担者.因此,AOA在自然界氮素生物地球化学循环中可能起着非常重要的作用.但是,目前对AOA的研究主要集中在对比各种类型生态系统中AOA和AOB对硝化作用的贡献,许多领域的研究工作尚不完善,急需深入研究,主要包括以下几个方面:1)分离、筛选不同生态环境条件下的AOA 菌种,研究其生理生态和细胞生物化学特征,并结合现代微生物分子生物学和生态学技术揭示AOA铵态氮氧化以及二氧化碳固定机制;2)克隆AOA氨氧化过程中相关酶的基因,研究酶学性质,尤其是其氨单加氧酶的作用机理;3)开展各种类型生态系统中AOA的分子生态学研究,阐明生态结构和环境因素对AOA群落结构和硝化活性的影响以及氮素循环中AOA与AOB及其它微生物之间的相互作用机制;4)研究污水处理系统硝化过程中AOA的群落生态结构,开发以AOA为主的脱氮工艺技术,利用AOA处理低浓度铵态氮的养殖废水,对减缓我国日趋严重的流域水环境氮素污染具有非常重要的意义.参考文献[1] Kowalchuk G A,Stephen JR.Ammonia2oxidizing bacte2ria:A model f or molecular m icr obial ecol ogy.A nnualR evie w of M icrobiology,2001,55:485-529[2] Dong L2H(董莲华),Yang J2S(杨金水),Yuan H2L(袁红莉).Research advances in molecular ecol ogy ofa mmonia oxidizing bacteria.Chinese Journal of A ppliedEcology(应用生态学报),2008,19(6):1381-1388(in Chinese)[3] Purkhold U,Pommerening2R ser A,Juretschko S,etal.Phyl ogeny of all recognized s pecies of a mmonia oxi2dizers based on comparative16S r RNA and am o A se2quence analysis:I m p licati ons f or molecular diversitysurveys.A pplied and Environm ental M icrobiology,2000,66:5368-5382[4] Zhong M(钟 鸣),Zhou Q2X(周启星).Molecularecol ogical technol ogy of m icr oorganis m and its app lica2ti on t o research on envir on mental polluti on.ChineseJournal of A pplied Ecology(应用生态学报),2002,13(2):247-251(in Chinese)[5] W uchter C,Abbas B,Coolen MJL,et al.A rchaeal ni2trificati on in the ocean.Proceedings of the N ationalA cade m y of Sciences of the U nited S tates of Am erica,2006,103:12317-12322[6] M incer T J,Church MJ,Tayl or LT,et al.Quantitativedistributi on of p resu mp tive archaeal and bacterial nitrifi2ers in Monterey Bay and the North Pacific Subtr op icalGyre.Environm ental M icrobiology,2007,9:1162-1175[7] La m P,Jensen MM,Lavik G,et al.L inking crenar2chaeal and bacterial nitrificati on t o ana mmox in theB lack Sea.Proceedings of the N ational A cade m y of Sci2ences of the U nited S tates of Am erica,2007,104:7104-7109[8] Leininger S,U rich T,Schl oter M,et al.A rchaea p re2dom inate a mong a mmonia2oxidizing p r okaryotes in s oils.N ature,2006,442:806-809[9] Reigstad LJ,R ichter A,Dai m s H,et al.N itrificati on interrestrial hot s p rings of I celand and Ka mchatka.FE M SM icrobiology Ecology,2008,64:167-174[10] W eidler G W,Gerbl F W,Stan2Lotter H.Crenarchaeotaand their r ole in the nitr ogen cycle in a subsurface radi o2active ther mal s p ring in the Austrian central A l p s.A p2plied and Environm ental M icrobiology,2008,74:5934-5942[11] Herr mann M,Saunders AM,Schra mm A.A rchaeadom inate the ammonia2oxidizing community in the rhizo2s phere of the fresh water macr ophyte L ittorella uniflora.A pplied and Environm entalM icrobiology,2008,74:259-270[12] Venter JC,Re m ingt on K,Heidelberg JF,et al.Envi2r on mental genome shotgun sequencing of the Sargass oSea.Science,2004,304:66-74[13] Treusch AH,Leininger S,Kletzin A,et al.Novel genesfor nitrite reductase and Amo2related p r oteins indicate ar ole of uncultivated M esophilic crenarchaeota in nitr ogencycling.Environm ental M icrobiology,2005,7:1985-1995[14] K nneke M,Bernhard AE,de la Torre JR,et al.Is ola2ti on of an aut otr ophic a mmonia2oxidizing marine archae2on.N ature,2005,437:543-546[15] Francis C A,Roberts KJ,Robert KJ,et al.Ubiquityand diversity of a mmonia2oxidizing archaea in water col28512 应 用 生 态 学 报 21卷u mns and sedi m ents of the ocean.Proceedings of the N a2tional A cade m y of Sciences of the U nited S tates of Am eri2ca,2005,102:14683-14688[16] Martens2Habbena W,Berube P M,U raka wa H,et al.Ammonia oxidati on kinetics deter m ine niche separati onof nitrifying archaea and bacteria.N ature,2009,461:976-979[17] Reysenbach AL,Shock E.M erging genomes with geo2che m istry in hydr other mal ecosyste m s.Science,2002,296:1077-1082[18] Hatzenp ichler R,Lebedeva E V,Sp ieck E,et al.Amoderately ther mophilic ammonia2oxidizing crenarchae2ote fr om a hot s p ring.Proceedings of the N ational A cade2m y of Sciences of the U nited S tates of Am erica,2008,105:2134-2139[19] de la T orre JR,W alker C B,I ngalls AE,et al.Cultiva2ti on of a ther mophilic a mmonia oxidizing archaeon syn2thesizing crenarchaeol.Environm ental M icrobiology,2008,10:810-818[20] Halla m SJ,Konstantinidis KT,Putna m N,et al.Ge2nom ic analysis of the uncultivated marine crenarchaeoteCenarchaeum sym biosum.Proceedings of the N ationalA cade m y of Sciences of the U nited S tates of Am erica,2006,103:18296-18301[21] Grady CP L,Daigger GT,L i m HC.B i ol ogicalW aste water Treat m ent.2nd Ed.Ne w York:M arcelDekker,1999[22] Sat o C,Schnoor LA,Hommes NG,et al.Ammonia2oxi2dizing bacteria with different sensitivities t o(NH4)2S O4in activated sludge.W ater Research,1994,28:1523-1532[23] Su wa Y,Su m ino T,Not o K.Phyl ogenetic relati onshi p sof activated sludge is olates of a mmonia oxidizers withdifferent sensitivities t o a mmoniu m sulfate.Journal ofGeneral and A pplied M icrobiology,1997,43:373-379 [24] Halla m SJ,M incer TJ,Schleper C,et al.Path ways ofcarbon assi m ilati on and ammonia oxidati on suggested byenvir on mental genom ic analyses of marine crenarchae2ota.PL oS B iology,2006,4:520-536[25] N icol G W,Schleper C.Ammonia2oxidizing crenarchae2ota:I m portant p layers in the nitr ogen cycle?Trends inM icrobiology,2006,14:207-212[26] A r p DJ,Sayavedra2Sot o LA,Hommes NG.Molecularbi ol ogy and bi oche m istry of ammonia oxidati on by N itro2so m onas europaea.A rchives M icrobiology,2002,178:250-255[27] Hommes NG,Sayavedra2S ot o LA,A r p DJ.Mutagenesisand exp ressi on of am o,which codes for a mmonia monoo2xygenase in N itroso m onas europaea.Journal of B acteriol2ogy,1998,180:3353-3359[28] Stephen JR,Chang YJ,Macnaught on SJ,et al.Effectof t oxic metals on indigenous s oil beta2subgr oup p r o2teobacteriu m a mmonia oxidizer community structure andp r otecti on against t oxicity by inoculated metal2resistantbacteria.A pplied and Environm ental M icrobiology,1999,65:95-101[29] McTavish H,Fuchs JA,Hooper AB.Sequence of thegene coding f or a mmonia monooxygenase in N itroso m onaseuropaea.Journal of B acteriology,1993,175:2436-2444[30] Nort on J M,A lzerreca JJ,Su wa Y,et al.D iversity ofa mmonia monooxygenase oper on in aut otr ophic a mmonia2oxidizing bacteria.A rchives of M icrobiology,2002,177:139-149[31] Be man J M,Popp BN,Francis CA.Molecular and bi o2geoche m ical evidence f or ammonia oxidati on by marinecrenarchaeota in the Gulf of Calif ornia.The ISM E Jour2nal,2008,2:429-441[32] Nakaga wa T,Mori K,Kat o C,et al.D istributi on ofcold2adap ted a mmonia2oxidizing m icr oorganis m s in thedeep2ocean of the northeastern Japan Sea.M icrobes andEnvironm ents,2007,22:365-372[33] Coolen MJL,Abbas B,B leijs wijk J,et al.Putative a m2monia2oxidizing crenarchaeota in suboxic waters of theB lack Sea:A basin2wide ecol ogical study using16S ri2bos omal and functi onal genes and me mbrane li p ids.Environm ental M icrobiology,2007,9:1001-1016 [34] Park S J,Park BJ,Rhee parative analysis of ar2chaeal16S r RNA and am o A genes t o esti m ate the abun2dance and diversity of a mmonia2oxidizing archaea in ma2rine sedi m ents.Extre m ophiles,2008,12:605-615 [35] Be man J M,Roberts KJ,W egley L,et al.D istributi onand diversity of archaeal ammonia monooxygenase genesass ociated with corals.A pplied and Environm ental M i2crobiology,2007,73:5642-5647[36] Be man J M,Francis C A.D iversity of a mmonia2oxidizingarchaea and bacteria in the sedi m ents of a hy pernutrifiedsubtr op ical estuary:Bahía del Tóbari,Mexico.Appliedand Environm ental M icrobiology,2006,72:7767-7777 [37] Caffrey J M,Bano N,Kalanetra K,et al.Ammonia oxi2dati on and a mmonia2oxidizing bacteria and archaea fr omestuaries with differing hist ories of hypoxia.The ISM EJournal,2007,1:660-662[38] Sant or o AE,Francis CA,de Sieyes NR,et al.Shifts inthe relative abundance of a mmonia2oxidizing bacteriaand archaea acr oss physicoche m ical gradients in a sub2terranean estuary.Environm ental M icrobiology,2008,10:1068-1079[39] Kalanetra K M,Bano N,Hollibaugh JT.Ammonia2oxi2dizing archaea in the A rctic Ocean and Antarctic coastalwaters.Environm ental M icrobiology,2009,11:2434-2445[40] Mosier AC and Francis CA.Relative abundance and di2versity of ammonia2oxidizing archaea and bacteria in theSan Francisco Bay estuary.Environm entalM icrobiology,2008,10:3002-3016[41] Sinninghe Da m stéJS,R ij p stra W.I C,Hopmans EC,etal.D istributi on of me mbrane li p ids of p lankt onic crenar2chaeota in the A rabian Sea.A pplied and Environm entalM icrobiology,2002,68:2997-3002[42] Murray AE,B lakis A,Massana R,et al.A ti m e seriesassess ment of p lankt onic archaeal variability in the SantaBarbara Channel.A quaticM icrobial Ecology,1999,20:129-14595128期 刘晶静等:氨氧化古菌及其在氮循环中的重要作用 [43] Sahan E,M uyzer G.D iversity and s pati o2te mporal dis2tributi on of a mmonia2oxidizing archaea and bacteria insedi m ents of the W esterschelde estuary.FE M S M icrobi2ology Ecology,2008,64:175-186[44] Church MJ,W ei B renner,Karl DM,et al.Abundancesof crenarchaeal am o A genes and transcri p ts in the Pacif2ic Ocean.Environm ental M icrobiology,2010,12:679-688[45] Boll m ann A,B r2Gilissen,MJ,Laanbr oek,HJ.Gr owth at l ow ammoniu m concentrati ons and starvati onres ponse as potential fact ors involved in niche differenti2ati on a mong a mmonia2oxidizing bacteria.A pplied andEnvironm ental M icrobiology,2002,68:4751-4757 [46] Shen JP,Zhang LM,Zhu YG,et al.Abundance andcompositi on of a mmonia2oxidizing bacteria and a mmonia2oxidizing archaea communities of an alkaline sandyl oa m.Environm ental M icrobiology,2008,10:1601-1611[47] Adair K L,Sch wartz E.Evidence that ammonia2oxidizingarchaea are more abundant than a mmonia2oxidizing bac2teria in sem iarid s oils of northern A rizona,US A.M icro2bial Ecology,2008,56:420-426[48] D i HJ,Ca mer on KC,Shen JP,et al.A lysi m eter studyof nitrate leaching fr om grazed grassland as affected by anitrificati on inhibit or,dicyandia m ide,and relati onshi p swith ammonia oxidizing bacteria and archaea.Soil U seand M anage m ent,2009,25:454-461[49] D i HJ,Ca mer on KC,Shen JP,et al.N itrificati on driv2en by bacteria and not archaea in nitr ogen2rich grasslands oils.N ature Geoscience,2009,2:621-624[50] Moin NS,Nels on K A,Bush A,et al.D istributi on anddiversity of and bacterial a mmonia oxidizers insalt marsh sedi m ents.A pplied and Environm entalM icro2biology,2009,75:7461-7468[51] W ang Y N,Ke XB,W u LQ,et munity composi2ti on of a mmonia2oxidizing bacteria and archaea in ricefield s oil as affected by nitr ogen fertilizati on.Syste m aticand A pplied M icrobiology,2009,32:29-36[52] Chen XP,Zhu YG,Xia Y,et al.Ammonia oxidizingarchaea:I m portant p layers in paddy rhizos phere s oil?Environm ental M icrobiology,2008,10:1978-1987 [53] Zhang LM,W angM,Pr osser J I,et al.A ltitude a mmo2nia2oxidizing bacteria and archaea in s oils of Mount Ev2erest.FE M S M icrobiology Ecology,70:52-61 [54] N icol G W,Leininger S,Schleper C,et al.The influ2ence of s oil pH on the diversity,abundance and tran2scri p ti onal activity of a mmonia oxidizing archaea andbacteria.Environm ental M icrobiology,2008,10:2966-2978[55] Tourna M,Freitag TE,N icol G W,et al.Gr owth,activ2ity and te mperature res ponses of a mmonia2oxidizing ar2chaea and bacteria in s oil m icr ocos m s.Environm entalM icrobiology,2008,10:1357-1364[56] Offer P,Pr osser J I,N icol G W.Gr owth of a mmonia2oxi2dizing archaea in s oil m icr ocos m s is inhibited by acety2lene.FE M S M icrobiology Ecology,2009,70:99-108 [57] U raka wa H,Taji m a Y,Nu mata Y,et al.Low tempera2ture decreases the phyl ogenetic diversity of a mmonia2oxi2dizing archaea and bacteria in aquariu m bi ofiltrati on sys2te m s.A pplied and Environm ental M icrobiology,2008,74:894-900[58] de VetWWJ M,D inkla I JT,M uyzer G,et al.Molecularcharacterizati on of m icr obial populati ons in gr ound waters ources and sand filters f or drinking water p r oducti on.W ater R esearch,2009,43:182-194[59] Park HD,W ells GF,Bae H,et al.Occurrence of a m2monia2oxidizing archaea in waste water treat m ent p lantbi oreact ors.A pplied and Environm ental M icrobiology,2006,72:5643-5647[60] Zhang T,J in T,Shao M,et al.Occurrence of a mmo2nia2oxidizing archaea in activated sludges of a laborat oryscale react or and t w o waste water treat m ent p lants.Jour2nal of A pplied M icrobiology,2009,107:970-977 [61] Zhang CL,Ye Q,Huang ZY,et al.Gl obal occurrenceof archaeal am o A genes in terrestrial hot s p rings.A p2plied and Environm ental M icrobiology,2008,74:6417-6426[62] Spear JR,Bart on HA,Roberts on CE.M icr obial com2munity bi ofabrics in a geother mal m ine adit.A pplied andEnvironm ental M icrobiology,2007,73:6172-6180作者简介 刘晶静,女,1985年生,博士研究生.主要从事环境微生物分子生态学研究.E2mail:ljj851113@ 责任编辑 肖 红0612 应 用 生 态 学 报 21卷。
氨氧化细菌及其在环境中的应用

氨氧化细菌及其在环境中的应用氨氧化细菌是一种在自然界中广泛存在的细菌,它们能将氨转化为亚硝酸,是氮素循环的重要环节之一。
在土壤和水体中,氨氧化细菌的存在对生物进化和生态环境的保护都有着重要的意义。
同时,氨氧化细菌的应用也逐渐受到人们的关注和重视,被广泛应用于废水处理、环境修复等方面。
氨氧化细菌的基本特征氨氧化细菌主要分为两类:硝化细菌和亚硝化细菌。
硝化细菌能将氨通过氧化反应转化成亚硝酸,进一步氧化为硝酸,亚硝化细菌则能将亚硝酸氧化成为氮气。
这两类细菌的协同作用使得氮素循环得以顺畅进行,维持了生态系统中的氮素平衡。
氨氧化细菌的生态意义氨氧化细菌在土壤和水体中的存在对生态系统有着重要的意义。
一方面,氨氧化细菌能够将氨转化为亚硝酸,使得土壤和水体中的氨含量得到控制,避免了过量氨的排放对生态环境的污染。
另一方面,氨氧化细菌的代谢也为生物提供了必需的氮源,促进了生态系统中生物的生存和繁衍。
此外,氨氧化细菌的存在还能够影响土壤和水体的物理、化学特性,有助于调节环境。
氨氧化细菌在废水处理中的应用氨氧化细菌在废水处理中的应用受到了广泛的关注。
以废水中含氨量较高的养殖废水为例,如果直接排入环境中,将会造成氮素的过度积累,对水体生态造成破坏。
而使用氨氧化细菌进行废水处理,则能够将氨转化为亚硝酸,进一步转化为硝酸,从而达到减少氨排放的目的。
此外,在处理城市污水时也可以使用氨氧化细菌,加速污水中氨的转化和去除。
氨氧化细菌在环境修复中的应用氨氧化细菌在环境修复中也有着广泛的应用。
例如,在土壤污染修复中,氨氧化细菌能够将土壤中的氨转化为亚硝酸,进而促进氮素的循环和土壤生物的恢复和发展。
此外,氨氧化细菌在土壤重金属污染修复中也具有一定的应用价值,能够促进重金属的转化和去除,从而减轻土壤的污染程度。
总体来说,氨氧化细菌在环境领域中的应用前景广阔,有望实现环境污染的有效控制和生态平衡的保护。
然而,目前氨氧化细菌的应用还面临一些困难和挑战,例如对氨氧化细菌的研究和应用还存在一定的技术壁垒,需要加强人才培养和科学研究,同时也需要加强对氨氧化细菌的生态安全性评估和检测,确保其在应用过程中不会对环境造成不良影响。
氨氧化菌种群的多样性和功能研究

氨氧化菌种群的多样性和功能研究氨氧化菌是一类重要的细菌,它们在土壤和水体中发挥着非常重要的作用。
这些菌能够将氨氮转化为硝酸盐,这个过程被称为氨氧化。
在自然界中,氨氧化对于保持水体和土壤的健康至关重要。
同时,氨氧化也为研究人员提供了一个重要的研究课题,因为氨氧化菌的多样性和功能都十分丰富。
氨氧化菌在土壤和水体中分布广泛,它们属于不同的系统分类单元,包括古菌、放线菌、革兰氏阳性菌和革兰氏阴性菌。
这些菌的多样性非常丰富,在各自的环境中,它们能够发挥出不同的功能。
对于氨氧化菌种群的研究,重要的一个方面是分离和鉴定细菌。
通过分离细菌,我们可以确定这些生物在不同的环境中的数量和分布情况。
鉴定细菌可以帮助我们确定其所属的分类单元、特性和种群构成。
另一个重要的方面是了解氨氧化菌的生态功能。
氨氧化菌在氮素循环中是非常重要的。
在土壤中,氨氧化细菌能够将氨氮转化为硝酸盐,同时硝酸盐也可以被还原为氨氮。
这个循环过程对于土壤和水体的健康非常重要,因为氮素是植物生长和生态系统维持的关键元素之一。
对于氨氧化菌的生态功能研究,我们可以通过测量不同环境中的氨氮和硝酸盐含量来了解细菌的作用。
此外,我们还可以通过分子生物学技术来研究氨氧化菌的功能和种群构成。
例如,通过分析氨氧化菌的基因组,我们可以了解它们在不同环境中的适应性和多样性。
近年来,对于氨氧化菌的研究也在不断发展,研究人员通过各种手段不断深入探究氨氧化菌的多样性和功能。
例如,一些研究人员利用高通量测序技术分析了不同环境中氨氧化菌的群落结构和物种多样性。
另外,还有人利用基因组学和功能基因组学的方法来了解氨氧化菌的适应性和功能。
总之,氨氧化菌作为一类非常重要的细菌,其多样性和生态功能的研究对于理解生态系统和氮素循环非常重要。
通过不断深入的研究,我们可以更好地了解氨氧化菌的多样性和功能,为保护生态系统和人类健康提供更加全面的支持。
氨氧化菌的研究及其在废水处理中的应用

氨氧化菌的研究及其在废水处理中的应用废水处理作为环境保护的一项重要工作,关系到人们的生产生活环境。
传统的废水处理方式主要是利用物理和化学方法处理,但这些方法处理完后,仍然会有一定量的氨氮残留在水中,给环境造成严重污染。
因此,一些新型的废水处理技术逐渐得到关注,其中氨氧化菌在废水处理中的应用引起了广泛的关注。
氨氧化菌是一类在自然界中常见的细菌,其主要功能是将含氮物质转化为亚硝酸盐。
氨氧化菌的研究是比较早的一个领域,早在19世纪50年代,科学家们就已经发现了氨氧化菌的存在和作用。
随着人们对环保的高度重视和废水处理技术的不断改进,氨氧化菌在废水处理中的应用逐渐被广泛认可。
氨氧化菌的应用原理基于其对含氨废水中氨氮的转化作用。
对于含氨的废水,通过预处理采用硝化/反硝化过程将氨氮转化为亚硝酸盐,再将亚硝酸盐氧化为硝酸盐,最后利用硝酸盐还原反应降解污染物。
氨氧化菌的参与,能够将废水中高浓度的氨氮转化为亚硝酸盐,降低废水中的氨氮浓度,减轻氨氮对环境的污染。
除了在废水处理方面的应用,氨氧化菌还有其他的应用价值。
例如,氨氧化菌在农业生产中也有应用,可用于改良土壤、提高农作物生产效率和保护生态环境等方面。
然而,氨氧化菌在废水处理中的应用也存在一些问题。
由于氨氮浓度较高,氨氧化反应速率较慢,废水处理效果可能不理想;另外,氨氧化菌的灵敏度较高,容易受到恶劣环境的影响,导致处理效力下降。
针对这些问题,科学家们不断进行研究,试图提高氨氧化菌在废水处理中的应用效果和稳定性。
总的来说,氨氧化菌在废水处理中的应用是一项值得开发和推广的新技术。
其有望在保障水资源安全、改善生态环境等方面发挥积极的作用。
科学家们需要进一步进行深入研究和开发创新,通过科技手段不断推动废水处理技术的创新和提升。
氨氧化细菌生理特性论文素材
氨氧化细菌生理特性论文素材1. 引言氨氧化细菌是一类重要的微生物,能够将氨氮氧化为亚硝酸盐,这在环境和工业领域具有广泛的应用价值。
本文旨在探讨氨氧化细菌的生理特性,为相关研究和应用提供素材和理论基础。
2. 氨氧化细菌的分类和系统学特点氨氧化细菌属于古菌域中的变形菌门,其系统学特点包括形态、代谢机制、细胞功能等方面的研究。
目前,已发现了多种氨氧化细菌,如亚硝化细菌(Nitrosomonas)和亚硝酸盐氧化细菌(Nitrobacter)等。
3. 氨氧化细菌的生理特性3.1 氨氧化细菌的生活环境氨氧化细菌主要生活在含氨氮较高的环境中,如土壤、水体和污水处理系统等。
它们对于硝化作用的进行起到了重要的作用。
3.2 氨氧化细菌的代谢途径氨氧化细菌主要通过氨氮氧化和亚硝酸盐产生能量。
在氨氧化过程中,氨氧化酶(Ammonia monooxygenase)发挥重要作用。
亚硝酸盐氧化细菌通过氧化还原酶(Nitrite oxidoreductase)将亚硝酸盐氧化为硝酸盐。
3.3 氨氧化细菌的生长条件氨氧化细菌生长的条件包括温度、pH值、氧气浓度等。
它们一般喜欢中性或略碱性的环境,适宜的温度范围为20-40摄氏度。
3.4 氨氧化细菌的生理特征氨氧化细菌具有一系列生理特征,如产生胞内或胞外多聚物、耐受低氧环境、对抗氨毒性等。
这些特性使得氨氧化细菌在环境修复和工业处理中具有广泛的应用前景。
4. 氨氧化细菌的应用展望氨氧化细菌的研究不仅仅是为了理解其生理特性,更是为了在环境修复、废水处理、植物生长和农业领域等方面的应用。
目前,已经有一些相关的研究进展,但仍需要进一步的深入研究和开发。
5. 结论氨氧化细菌是一类重要的微生物,具有丰富的生理特性。
深入了解这些特性,对于推动环境科学和工业技术的发展具有重要意义。
希望本文提供的素材和理论基础能够为相关研究和应用提供帮助。
以上就是根据题目提供的氨氧化细菌生理特性的素材,希望能对您的论文写作提供一些参考和思路。
2024年微生物总结资料
2024年微生物总结资料2024年,微生物领域迎来了许多重要的突破和进展。
在这篇文章中,我将为您总结一些2024年微生物的关键资料。
一、新发现的微生物物种2024年,科学家们鉴定和发现了许多新的微生物物种。
这些微生物物种的发现不仅扩大了我们对微生物世界的认识,还为生物技术和医学领域提供了新的研究对象和潜在应用。
1.1 多种多样的细菌2024年,科学家们鉴定和描述了大量的新细菌物种。
例如,研究人员从深海中分离出了一种名为深海厌氧氨氧化菌的细菌。
这种细菌能够在缺氧的环境中将氨氧化成亚硝酸盐,从而在深海生态系统中发挥着重要的生物地球化学功能。
1.2 神秘的古菌在2024年,科学家们还发现了一些新的古菌物种。
古菌是一类与细菌和真核生物有着不同特征的微生物,其在极端环境中生存能力强大。
例如,一种新的古菌物种被发现在冰川中生存,这表明古菌在寒冷环境中的适应能力可能具有重要的生物技术应用潜力。
1.3 多样性的真菌此外,在2024年,也有许多新的真菌物种被鉴定和描述。
真菌是一类重要的微生物,既可以作为致病菌造成疾病,也可以作为产生有用化合物和酶的工具。
例如,科学家们发现一种新的真菌物种,能够分解难降解的有机废物,这为环境污染的治理提供了新的思路。
二、微生物与环境2024年,微生物研究的一个重要方向是微生物与环境之间的相互作用。
微生物存在于各种环境中,包括土壤、水体和空气中,以及各种生物体内。
了解微生物在不同环境中的功能和相互作用对于生态学和环境保护具有重要意义。
2.1 土壤微生物多样性土壤是一个复杂的生态系统,其中微生物起着关键作用。
2024年的研究表明,土壤中存在着丰富的微生物多样性,这些微生物种类繁多且功能多样。
例如,某些土壤微生物能够通过固定氮气来提供植物所需的氮素,这对于农业生产和可持续发展具有重要意义。
2.2 水体微生物群落此外,2024年的研究还表明,水体中的微生物群落对水环境的质量和稳定性起着重要作用。
氨氧化微生物生态学与氮循环研究进展
氨氧化微生物生态学与氮循环研究进展一、本文概述随着全球氮素循环和环境问题日益凸显,氨氧化微生物在氮循环中的作用受到了广泛关注。
氨氧化微生物作为氮循环中的关键参与者,负责将氨氧化为亚硝酸盐,为后续的硝酸盐还原和氮的去除提供必要条件。
近年来,氨氧化微生物的生态学特征、功能基因多样性及其在氮循环中的作用机制等方面取得了显著进展。
本文旨在综述氨氧化微生物生态学与氮循环研究的最新进展,以期为深入理解氮循环过程、优化氮素管理和缓解环境问题提供理论依据和实践指导。
二、氨氧化微生物生态学氨氧化微生物在氮循环中发挥着至关重要的作用,它们负责将氨(NH₃)或铵(NH₄⁺)氧化为硝酸盐(NO₃⁻),这是氮素从生物可利用形式向更稳定、不易被生物利用的形式转化的关键步骤。
近年来,随着分子生物学技术的发展,我们对氨氧化微生物生态学有了更深入的理解。
氨氧化微生物主要包括氨氧化细菌(AOB)和氨氧化古菌(AOA)。
这两种微生物在生理生态特征上有所不同,但都能执行氨氧化这一核心功能。
AOB通常生活在富含氧气的环境中,而AOA则更适应于低氧或缺氧条件。
在土壤、水体和沉积物等自然环境中,AOB和AOA常常共存,并可能通过竞争或合作的方式共同影响氮循环的速率和方向。
在生态学上,氨氧化微生物的分布和活性受到多种环境因素的影响,包括温度、pH值、氧气浓度、底物浓度以及其它微生物的竞争和相互作用等。
氨氧化微生物的群落结构和多样性也会随着环境的变化而变化,这种变化可能会影响到氮循环的效率和稳定性。
为了更深入地理解氨氧化微生物生态学,研究者们采用了一系列分子生物学手段,如高通量测序、宏基因组学、稳定同位素示踪等,来揭示氨氧化微生物的种群结构、基因表达、代谢途径和生态功能。
这些研究不仅增进了我们对氨氧化微生物生态学的认识,也为调控和管理氮循环提供了理论基础和技术支持。
氨氧化微生物生态学是氮循环研究中的重要领域,它不仅关乎氮素的生物地球化学循环,也直接影响到农业、环境保护和气候变化等多个领域。
氨氧化微生物生态学与氮循环研究进展
氨氧化微生物生态学与氮循环研究进展贺纪正;张丽梅【摘要】氮的生物地球化学循环主要由微生物驱动,除固氮作用、硝化作用、反硝化作用和氨化作用外,近年还发现厌氧氨氧化是微生物参与氮循环的一个重要过程.同时,随着宏基因组学等分子生物技术的快速发展和应用,参与氮循环的新的微生物类群--氨氧化古菌也逐渐被发现.这两个重要的发现大大改变了过去人们对氮循环的认识,就近年有关厌氧氨氧化细菌、氨氧化古菌和氨氧化细菌的生态学研究进展作一简要综述.【期刊名称】《生态学报》【年(卷),期】2009(029)001【总页数】10页(P406-415)【关键词】氮循环;氨氧化作用;厌氧氨氧化作用;中温泉古菌;氨氧化细菌【作者】贺纪正;张丽梅【作者单位】城市与区域生态国家重点实验室,中国科学院生态环境研究中心,北京,100085;城市与区域生态国家重点实验室,中国科学院生态环境研究中心,北京,100085【正文语种】中文【中图分类】Q142;Q938氮(N)是所有生物必需的营养元素。
作为蛋白质的主要成份,氮也是维持生物体结构组成和执行所有生物化学过程的基础。
氮循环的4个主要过程,即固氮作用、硝化作用、反硝化作用和氨化作用,均由微生物所驱动(图1)。
图1 微生物参与的氮循环过程[1] Fig. 1 Schematic processes of global nitrogen cycle driven by micro-organisms[1] amo代表氨单加氧酶;hao代表细菌羟胺氧化还原酶;nir代表亚硝酸盐还原酶;nor代表氧化氮还原酶 amo, ammonia mono-oxygenase; hao, bacterial hydroxylamine oxidoreductase; nir, nitrite reductase; nor, nitric oxide reductase在这些过程中,固氮作用由多种细菌参与,它们利用固氮酶,结合其它的酶和辅酶,消耗能量,打开氮气分子的三键,生成氨[2]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自显科予越展第19卷第4期2009年4月明,AOA在这些自然环境中普遍存在¨0。
.随后,AOA在低氧废水处理器L3引、低溶氧高硫化氢特征的黑海“分层带”L35’如J、河El沉积物Ⅲ]、深海沉积物【‘2]、土壤¨2’43]、海洋动物组织[“’45]、陆地热泉口[Z7,28,46“71以及矿区L48“们等环境中踪迹也一一被发现.作者最近对厦门东山岛海水养殖区水体中的古菌群落结构调查也发现了AOA(图3).这些调查极大地拓展了我们对AOA生态分布的了解.近日,又有两株嗜热类型A()AN.gargensis[27]和N.yellowstonii【283(表1)被富集培养,不仅从细胞水平上提供了嗜热AOA的证据,更为进一步研究氨氧化古菌的进化历史提供了重要材料.圈3东山岛海水养殖区表层水样的古菌amoA基因扩增产物1,DI。
一2000DNA标志;1和2,不同养殖池古菌amoA基因PCR结果;3,阴性对照AOA不仅在自然环境中分布广泛,并且数量上也超过了AOB.Wuchter等[3¨和Mincer等心列的研究结果表明,在海洋中,古菌amoA基因的拷贝数要高出细菌amoA基因1至3个数量级.而在土壤环境中,古菌arnoA基因数量最高可达AOB的3000倍凹引,并且在tuRNA水平上也远远超过了AOBLl仉3z].虽然AOB可能在某些特定环境中会处于优势【35山州,总体上AOA才是地球上的最丰富的氨氧化生物L11’29’3h3“42’51。
.此外,一些学者还发现,古菌amoA基因与常温型泉古菌的16SrRNA基因、细胞数量以及脂类标志物之间具有较好的正相关关系.这说明绝大部分的常温型泉古菌可能都是AOALz乳3k61.如果这个推测正确,那么自然界中总共有2.3X1028个常温型泉古菌¨lJ可以进行氨氧化.据Ingalls等的估算,仅在海洋生态系统中,海洋泉古菌可以每年生成1.2Gt/a的NOz,与全球海洋的新生产力相当哪!.如果根据Redfield比率换算,AOA氧化海洋中的NH3获能固定的CO:则可达到0.275Gt·C/a,远远超过了每年沉降到海洋沉积物中的碳量(O.15Gt·C/a)‘31’521.2.2.2AOA与环境因子之间的联系总体上,AOB可分为4个生态类群;(1)淡水沉积物类群,(2)污水类群,(3)土壤类群,(4)海洋类群【l“211.这4大类群具有各自独特的环境适应机制嵋¨.AOA与AOB的生态功能相似,那么AOA是否也同样有类似的生态类群和环境适应机制呢?从古菌amoA基因系统发育树(图4)可以发现,AOA总体上分为了水体/沉积物(watercolumnsedimentgroup)和土壤(soilgroup)两大进化分支.说明AOA可能通过环境调控和自然选择进化形成了不同的生态类群¨0。
.在某些“特殊”环境下,如低氧废水处理器和海绵组织,AOA系统发育比较单一L3钆45],是AOA适应“特殊”生境的最好例证.然而,我们对影响AOA分布的具体环境因素还知之甚少.近期研究发现,在海洋生态系统中,营养盐、浮游植物的生物量和群落结构是调控AoA的环境因子【3引.这与Murray等153。
幻早年的调查结果一致.而盐度则是控制河口AOA群落结构的重要环境因子[5且与硫化物一起控制着河口沉积物中的氨氧化速率[55‘.在土壤生境中,pH是影响古菌amoA基因拷贝数的环境因子[43。
.土壤AOB以其独特的尿素代谢功能来适应pH的影响心¨,AOA是否也同样具有类似的生态适应机制?这还有待于进一步的研究.学者们还发现,温度也是一项重要的环境指标,可能会影响A()A遗传多样性和种群结构【5引.以上的研究实例不仅揭示了环境因素对AOA的生态分布、数量、遗传多样性的调控作用,而且为进一步理解AOA的环境适应机制提供了重要线索.AOA作为生态系统中一个环节,必然与其他生物之间存在着相互作用.对AOB的研究表明,AOB与NOB通过NOz的介导,可以互利“共生”u2“3’2¨.近期,Mincer等心¨发现AOA与NOB同样存在着类似的“共生”关系.同样由于NO。
的介导,AOA与anamrnox细菌之间也存在着耦联[35J叫.Lain等L35]发现AOA和7一AOB分别占据了黑海的低氧水层(10weroxiczone)和缺氧水层方数据氨氧化古菌——环境微生物生态学研究的一个前沿热点作者:胡安谊, 焦念志作者单位:厦门大学,近海海洋环境科学国家重点实验室,厦门,361005刊名:自然科学进展英文刊名:PROGRESS IN NATURAL SCIENCE年,卷(期):2009,19(4)被引用次数:2次1.Woese CR;Fox GE Phylogenetic structure of the prokaryotic domain:The primary kingdoms[外文期刊] 1977(11)2.Barns SM;Delwiche CF;Palmer JD Perspectives on archaeal diversity,thermophily and monophyly from environmental rRNA sequences[外文期刊] 1996(17)3.Woese CR;Magrum LJ;Fox GE Archaebacteria 1978(03)4.Delong EF Archaea in coastal marine environment 1992(12)5.Fuhrman JA;McCallum K;Davis AA Novel major archaebacterial group from marine planton 1992(6365)6.Karner MB;DeLong EF;Karl DM Archaeal dominance in the mesopelagic zone of the Pacific Ocean[外文期刊] 2001(6819)7.Chaban B;Ng SYM;Jarrell KF Archaeal habitats-from the extreme to the ordinary[外文期刊] 2006(02)8.Venter JC;Remington K;Heidelberg JF Environmental genome shotgun sequencing of the Sargasso Sea[外文期刊] 2004(5667)9.Konneke M;Bernhard AE;de la Torre JR Isolation of an autotrophic ammonia-oxidizing marine archaeon [外文期刊] 2005(7058)10.Treusch AH;Leininger S;Kletzin A Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[外文期刊] 2005(12)11.Nicol GW;Schleper C Ammonia-oxidising Crenarchaeota:Important players in the nitrogen cycle?[外文期刊] 2006(05)12.Werner D;Newton WE Nitrogen Fixation in Agriculture,Forestry,Ecology,and the Environment 200513.Kowalchuk GA;Stephen JR Ammonia-oxidizing bacteria:A model for molecular microbial ecology 200114.Mulder A;van de Graaf AA;Robertson LA Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor 1995(03)15.Hayatsu M;Tago K;Saito M Various players in the nitrogen cycle:Diversity and functions of the microorganisms involved in nitrification and denitrification[外文期刊] 2008(01)16.Klotz MG;Stein LY Nitrifier genomies and cvolution of the nitrogen cycle[外文期刊] 2008(02)17.Rotthauwe JH;Witzel KP;Liesack W The ammonia monooxygenase structural gene amoA as a functional marker:Molecular fine-scale analysis of natural ammonia-oxidizing populations[外文期刊] 1997(12) 18.Bothe H;Jost G;Schloter M Molecular analysis of ammonia oxidation and denitrification in natural environments[外文期刊] 2000(05)19.Purkhold U;Pommerening-Roser A;Juretschko S Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amoA sequence analysis:Implications for moleculardiversity surveys[外文期刊] 2000(12)20.Klotz MG;Arp DJ;Chain PSG Complete gcnome sequence of the marine,chemolithoautotrophic,ammonia-oxidizing bacterium Nitrosocoecus oceani ATCC 19707[外文期刊] 2006(9)21.Arp DJ;Chain PSG;Klotz MG The impact of genome analyses on our understanding of ammonia-oxidizing bacteria[外文期刊] 2007(0)22.Holmes A J;Costello A;Lidstrom ME Evidence that particulate methane monooxygenase and ammonia monooxygenase may he evolutionarily related 1995(03)23.Schleper C;Jurgcns G;Jonuscheit M Genomic studies of uncultivated archaea[外文期刊] 2005(06)24.Hallam SJ;Knnstantinidis KT;Putnam N Genomic analysis of the uncultivated marine crenarchaeote Cenarchaeum symbiosum[外文期刊] 2006(48)25.Hallam SJ;Mincer TJ;Schleper C Pathways of carbon assimilation and ammonia oxidation suggested by environmental genomic analyses of marine Crcnarchaeota 2006(e95)26.Norton JM;AIzerreca JJ;Suwa Y Diversity of ammonia monooxygenase operon in autotrophic ammonia-oxidizing bacteria[外文期刊] 2002(02)27.Hatzenpichler R;Lebedeva EV;Spieck E A moderately thermophilic ammonia-oxidizing crenarchaeota from a hot spring 2008(06)28.de la Torte JR;Walker CB;Ingalls AE Cultivation of a thermophilic ammonia oxidizing archaeon synthesizing crenarchaeol[外文期刊] 2008(03)29.Mincer TJ;Church MJ;Taylor LT Quantitative distribution of presumptive archaeal and bacterial nitrifiers in Monterey Bay and the North Pacific Subtropical Gyre[外文期刊] 2007(05)30.Francis CA;Roberts KJ;Beman JM Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[外文期刊] 2005(41)31.Wuchter C;Abhas B;Coolen MJL Archaeal nitrification in the ocean[外文期刊] 2006(33)32.Leininger S;Urich T;Schloter M Archaea predominate among ammonia-oxidizing prokaryotes in soils [外文期刊] 2006(7104)33.Smolina I;Lee C;Frank-Kamenetskii M Detection of low-copynumber genomie DNA sequences in individual bacterial cells by using peptide nucleic acid-assisted rolling-circle amplification and fluorescence in situ hybridization[外文期刊] 2007(07)34.Ward BB;Eveillard D;Kirshtein JD Ammonia-oxidizing bacterial community composition in estuarine and oceanic environments assessed using a functional gene microarray[外文期刊] 2007(10)in P;Jensen MM;Lavik G Linking crenarchaeal and bacterial nitrification to anammox in the Black Sea[外文期刊] 2007(17)36.Herfort L;Sehouten S;Abbas B Variations in spatial and temporal distribution of Archaea in the North Sea in relation to environmental variables[外文期刊] 2007(03)37.Radajewski S;Ineson P;Parekh NR Stable isotope probing as a tool in microbial ecology[外文期刊] 2000(6770)38.Francis CA;Beman JM;Kuypers MMM New processes and players in the nitrogen cycle:The microbial ecology of anaerobic and archaeal ammonia oxidation[外文期刊] 2007(01)39.Park HD;Wells GF;Bae H Occurrence of ammonia-oxidizing archaea in wastewater treatment plant hioreactors[外文期刊] 2006(08)40.Coolen MJL;Abhas B;van Bleijswijk J Putative ammonia-oxidizing Crenarchaeota in suboxic waters of the Black Sea:A basin-wide ecological study using 16S ribosomal and functional genes and membrane lipids[外文期刊] 2007(04)41.Beman JM;Francis CA Diversity of ammonia-oxidizing archaea and bacteria in the sediments of a hypernutrified subtropical estuary:Bahia del Tobari,Mexico[外文期刊] 2006(12)42.Nakagawa T;Mori K;Kato C Distribution of cold-adapted ammonia-oxidizing microorganisms in the deep-ocean of the northeastern Japan Sea 2007(04)43.He J;Shen J;Zhang L Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices[外文期刊] 2007(09)44.Beman JM;Roberts KJ;Wegley L Distribution and diversity of archaeal ammonia monooxygenase genes associated with corals[外文期刊] 2007(17)45.Steger D;Ettinger-Epstein P;Whalan S Diversity and mode of transmission of ammonia-oxidizing archaea in marine sponges 2008(04)46.Reigstad LJ;Richter A;Daims H Nitrification in terrestrial hot springs of Iceland and Kamchatka [外文期刊] 2008(02)47.Zhang CL;YE Q;Huang ZY Global occurrence of archaeal amoA genes in terrestrial hot springs[外文期刊] 2008(20)48.Weidler GW;Dornmayr-Pfaffenhuemer M;Gerbl FW Communities of Archaea and Bacteria in a subsurface radioactive thermal spring in the Austrian Central Alps,and evidence of ammonia-oxidizing Crenarchaeota[外文期刊] 2007(01)49.Spear JR;Barton HA;Robertson CE Microbial community biofabrics in a geothermal mine adit[外文期刊] 2007(19)50.Santoro AE;Francis CA;de Sieyes NR Shifts in the relative abundance of ammonia-oxidizing bacteria and archaea across physicochemical gradients in a subterranean estuary 2008(04)51.Yakimov MM;La Cono V;Denaro R Primary producing prokaryotic communities of brine,interface and seawater above the halocline of deep anoxic lake L' Atalante,Eastern Mediterranean Sea 2007(08)52.Ingalls AE;Shah SR;Hansman RL Quantifying archaeal community autotrophy in the mesopelagic ocean using natural radiocarbon 2006(17)53.Murray AE;Preston CM;Massana R Seasonal and spatial variability of bacterial and archaeal assemblages in the coastal waters near Anvers Island,Antarctica[外文期刊] 1998(07)54.Murray AE;Blakis A;Massana R A time series assessment of planktonic archaeal variability in the Santa Barbara Channel[外文期刊] 1999(02)55.Caffrey JM;Bano N;Kalanetra K Ammonia oxidation and ammonia-oxidizing bacteria and archaea from estuaries with differing histories of hypoxia[外文期刊] 2007(07)56.Urakawa H;Tajima Y;Numata Y Low temperature decreases the phylogenetic diversity of ammonia-oxidizing archaea and bacteria in aquarium biofiltration systems[外文期刊] 2008(03)57.Arrigo KR Marine microorganisms and global nutrient cycles[外文期刊] 2005(7057)58.Massana R;DeLong EF;Pedros-Alio C A few cosmopolitan phylotypes dominate planktonic archaeal assemblages in widely different oceanic provinces[外文期刊] 2000(05)59.Ochsenreiter T;Selezi D;Quaiser A Diversity and abundance of Crenarchaeota in terrestrialhabitats studied by 16S RNA surveys and real time PCR[外文期刊] 2003(09)60.Berg IA;Kockelkorn D;Buckel W A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in archaea[外文期刊] 2007(5857)61.Ouverney CC;Fuhrman JA Marine planktonic archaea take up amino acids[外文期刊] 2000(11)62.Herndl GJ;Reinthaler T;Teira E Contribution of Archaea to total prokaryotic production in the deep Atlantic Ocean[外文期刊] 2005(05)63.Béjà O;Koonin EV;Aravind L Bacterial rhodopsin:Evidence for a new type of phototrophy 200064.Jiao NZ;Feng FY;Wei B Proteorhodopsin-A new path for biological utilization of light energy in the sea[外文期刊] 2006(08)65.Walker A;Parkhill J Single-cell genomics 2008(03)66.Yool A;Martin AP;Fernandez C The significance of nitrification for oceanic new production[外文期刊] 2007(7147)67.焦念志;王荣海洋初级生产力的结构 1993(04)68.Ward BB;O'Mullan GD Community level analysis:Genetic and biogeochemical approaches to investigate community composition and function in aerobic ammonia oxidation[外文期刊] 200569.Azam F;Malfatti F Microbial structuring of marine ecosystems[外文期刊] 2007(10)1.贺纪正.张丽梅.HE Ji-Zheng.ZHANG Li-Mei氨氧化微生物生态学与氮循环研究进展[期刊论文]-生态学报2009,29(1)2.陈熙.张明.郭怡雯.Chen Xi.Zhang Ming.Guo Yiwen氨氧化古细菌(AOA)的研究进展[期刊论文]-上海化工2009,34(2)3.宋亚娜.林智敏.林捷.SONG Ya-Na.LIN Zhi-Min.LIN Jie不同品种水稻土壤氨氧化细菌和氨氧化古菌群落结构组成[期刊论文]-中国生态农业学报2009,17(6)4.郭建华.彭永臻.GUO Jianhua.PENG Yongzhen异养硝化、厌氧氨氧化及古菌氨氧化与新的氮循环[期刊论文]-环境科学学报2008,28(8)1.郑风荣.陈皓文中国海洋微生物学2009年研究进展[期刊论文]-广西科学院学报 2011(4)2.马婷.赵大勇.曾巾.燕文明.姜翠玲.黄睿.王猛氨氧化古菌生态学及其在湖泊生态系统中的研究进展[期刊论文]-化学与生物工程 2011(10)本文链接:/Periodical_zrkxjz200904002.aspx。
