心型脂肪酸结合蛋白校准品产品技术要求中生北控
游离脂肪酸测定试剂盒(ACS-ACOD法)产品技术要求中生北控

游离脂肪酸测定试剂盒(ACS-ACOD法)适用范围:本试剂用于体外定量测定人血清中游离脂肪酸的浓度。
1.1规格液体双剂型试剂1(R1):40mL×1,试剂2(R2):10mL×1;试剂1(R1):60mL×1,试剂2(R2):15mL×1。
质控品(选配):2个水平:1mL×2; 3mL×2; 1mL×6; 3mL×6。
1.2规格划分说明根据净含量划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体和质控品液体(选配)组成。
1.3.1 试剂1(R1)液体:磷酸缓冲液(pH =6.98) 67mmol/L辅酶A 0.5mmol/L ATP 3 mmol/L乙酰辅酶A合成酶(ACS)≥200U/LTOOS 1m mol/LMgCl2mm 2ol/L1.3.2 试剂2(R2)液体:磷酸缓冲液(pH =6.98)67mmol/L4-氨基安替吡啉0.5mmol/L乙酰辅酶A氧化酶(ACOD)≥5000U/L过氧化物酶(POD) ≥6000U/L1.3.3 质控品(选配):PBS缓冲液基质油酸钠定值范围:水平1 :0.3~0.9mmol/L;水平2:0.9~3.0mmol/L (每批定值)2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
c) 质控品为无色或浅黄色透明溶液,无混浊、无未溶解物,外包装完整无破损。
2.2 试剂空白吸光度在波长546nm(520nm~560nm)(光径1cm)处,试剂空白吸光度(A)应≤1.000。
2.3 准确度用中生试剂和已上市同类试剂分别测定40个在测定范围内不同浓度的血清样本,计算两组数据的相关系数(r)及测值的相对偏差或绝对偏差,相关系数(r)应≥0.975;在(1.00,3.00] mmol/L区间内,相对偏差应不超过±10%;在[0.05,1.00]mmol/L区间内,绝对偏差应不超过±0.10mmol/L。
脂蛋白a校准品产品技术要求wantaiderui

脂蛋白a校准品产品技术要求wantaiderui脂蛋白a校准品适用范围:本产品与本公司生产的脂蛋白a测定试剂盒(胶乳免疫比浊法)配套使用。
用于临床检验脂蛋白a项目的系统校准。
1.1包装规格1.0mL/瓶×5(5个水平)。
1.2 组成成分脂蛋白a校准品是在人血清中添加重组人源性的脂蛋白a组成的液体。
脂蛋白a校准品的标示值范围:水平1:0mg/L,水平2:120mg/L~180mg/L,水平3:240mg/L~360mg/L,水平4:480mg/L~720mg/L,水平5:800mg/L~1100mg/L,具体浓度见瓶签。
2.1 装量应不低于标示装量。
2.2 外观淡黄色液体。
2.3 瓶内均一性瓶内均一性应≤10%。
2.4 准确度万泰德瑞试剂(万泰德瑞校准品定标)和罗氏或利德曼试剂(罗氏或利德曼校准品定标),同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990。
脂蛋白a在(80,800]mg/L范围内,测定结果的相对偏差应不超过±15%;在[15,80]mg/L范围内,测定结果的绝对偏差应不超过±12mg/L。
2.5 稳定性2.5.1效期稳定性原包装校准品在2℃~8℃条件下贮存,有效期为12个月。
校准品性能应符合2.2、2.3、2.4要求。
2.5.2开瓶稳定性开瓶后校准品在2℃~8℃条件下密闭避光保存,可稳定30天。
校准品性能应符合2.2、2.3、2.4的要求。
2.6 校准品溯源性按照GB/T21415-2008要求,该校准品可溯源至本公司内部工作校准品,与德国罗氏公司及北京利德曼公司系统比对赋值。
心肌标志物质控品产品技术要求北京乐普医疗科技
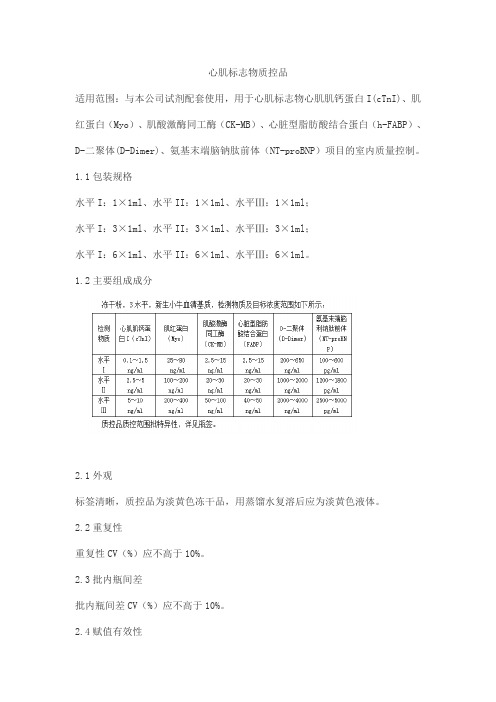
心肌标志物质控品
适用范围:与本公司试剂配套使用,用于心肌标志物心肌肌钙蛋白I(cTnI)、肌红蛋白(Myo)、肌酸激酶同工酶(CK-MB)、心脏型脂肪酸结合蛋白(h-FABP)、D-二聚体(D-Dimer)、氨基末端脑钠肽前体(NT-proBNP)项目的室内质量控制。
1.1包装规格
水平I:1×1ml、水平II:1×1ml、水平Ⅲ:1×1ml;
水平I:3×1ml、水平II:3×1ml、水平Ⅲ:3×1ml;
水平I:6×1ml、水平II:6×1ml、水平Ⅲ:6×1ml。
1.2主要组成成分
2.1外观
标签清晰,质控品为淡黄色冻干品,用蒸馏水复溶后应为淡黄色液体。
2.2重复性
重复性CV(%)应不高于10%。
2.3批内瓶间差
批内瓶间差CV(%)应不高于10%。
2.4赋值有效性
检测结果应在质控范围内。
2.5稳定性
2.5.1复溶稳定性
质控品复溶后在2℃~16℃条件下4h后,产品性能应符合2.1、2.2、2.4规定的要求。
2.5.2效期稳定性
质控品在2℃~8℃的环境中放置18个月后,产品性能应符合2.1、2.2、2.4规定的要求。
多项生化校准品产品技术要求beiaotaikang
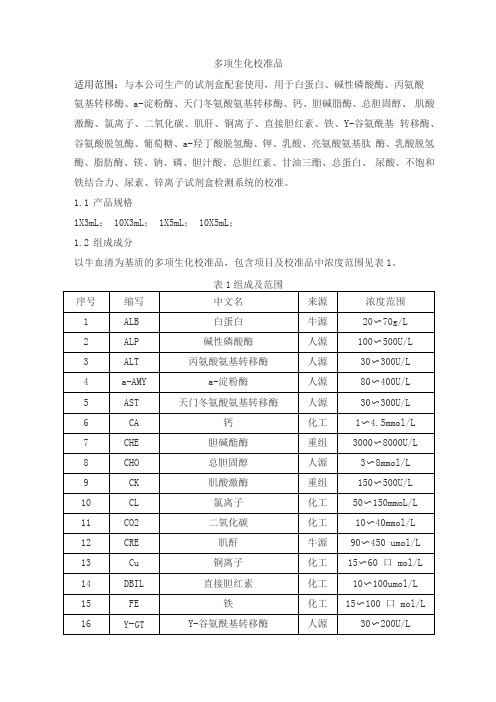
多项生化校准品适用范围:与本公司生产的试剂盒配套使用,用于白蛋白、碱性磷酸酶、丙氨酸氨基转移酶、a-淀粉酶、天门冬氨酸氨基转移酶、钙、胆碱脂酶、总胆固醇、肌酸激酶、氯离子、二氧化碳、肌肝、铜离子、直接胆红素、铁、Y-谷氨酰基转移酶、谷氨酸脱氢酶、葡萄糖、a-羟丁酸脱氢酶、钾、乳酸、亮氨酸氨基肽酶、乳酸脱氢酶、脂肪酶、镁、钠、磷、胆汁酸、总胆红素、甘油三酯、总蛋白、尿酸、不饱和铁结合力、尿素、锌离子试剂盒检测系统的校准。
1.1产品规格1X3mL; 10X3mL; 1X5mL; 10X5mL;1.2组成成分以牛血清为基质的多项生化校准品,包含项目及校准品中浓度范围见表1。
2.1外观冻干品,溶解后为浅黄色或黄色透明液体。
2.2准确度各项目的准确度偏差要求见表2.表2准确度偏差2.3重复性各项目的重复性变异系数要求见表3表3重复性变异系数2.4批内瓶间差各项目批内瓶间差应W5%。
2.5校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,本校准品所含项目中有国家或国际约定参考方法或物质的溯源至选定的参考方法或物质(工作校准品以上的校准等级);无国家或国际约定的参考方法和物质的溯源至工作校准品,工作校准品经与已知有证厂家产品比对测量赋值,具体各测定项目的溯源方法或物质,详见附录A。
O2.6稳定性2.6.1效期稳定性校准品原包装在(2〜8)℃避光保存,有效期为24个月,取失效期的校准品检测其准确度,应符合2.2的要求。
2.6.2复溶稳定性校准品复溶后,在(2〜8)℃下避光密封保存,有效期为2天,取失效期的校准品检测其准确度,应符合2.2的要求;在-20℃下避光密封保存,有效期为14 天,避免重复冻融,取失效期的校准品检测其准确度,应符合2.2的要求。
生化类复合质控品产品技术要求中生北控

生化类复合质控品适用范围:本产品在临床医学上用于临床检验实验室中生化检测项目的室内质量控制,检测临床化学分析仪测定的准确度和精密度。
具体项目为:α1-酸性糖蛋白(AAG)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、碱性磷酸酶(ALP)、α-淀粉酶(AMY)、胰淀粉酶(P-AMY)、载脂蛋白A1(APOA1)、载脂蛋白B (APOB)、抗链球菌溶血素O(ASO)、天门冬氨酸氨基转移酶(AST)、钙(Ca)、C-反应蛋白(CRP)、超敏C-反应蛋白(HS-CRP)、氯(Cl)、胆碱酯酶(CHE)、胆固醇(CHO)、补体C3(C3)、补体C4(C4)、肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、酶法肌酐(CreE)、苦味酸法肌酐(CreK)、重氮盐法直接胆红素(D.Bili)、钒酸盐法直接胆红素(D.Bili)、铁蛋白(Ferritin)、葡萄糖(Glu-GOD)、葡萄糖(Glu-HK)、谷氨酸脱氢酶(GLDH)、γ-谷氨酰基转移酶(GGT)、a-羟丁酸脱氢酶(HBDH)、高密度脂蛋白胆固醇(HDL-C)、结合珠蛋白(HP)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M (IgM)、铁(Iron)、乳酸脱氢酶(LDH)、低密度脂蛋白胆固醇(LDL-C)、锂(Li)、脂肪酶(Lip)、镁(Mg)、磷(P)、钾(K)、前白蛋白(PA)、钠(Na)、重氮盐法总胆红素(T.Bili)、钒酸盐法总胆红素(T.Bili)、总蛋白(TP)、转铁蛋白(TF)、甘油三酯(TG)、尿素(Urea)、尿酸(UA)。
1.1规格冻干粉型5mL×1(水平1);3mL×1(水平1);5mL×1(水平2);3mL×1(水平2);5mL×2(水平1,水平2);5mL×6(水平1,水平2);3mL×2(水平1,水平2);3mL×6(水平1,水平2)。
脂蛋白a校准品产品技术要求北京利德曼

脂蛋白a校准品
适用范围:与北京利德曼生化股份有限公司的脂蛋白a试剂盒配套使用,用于建立系统校准曲线。
1.1 规格:1×1mL。
1.2 组成:在水基质中添加脂蛋白a抗原,Tris缓冲液(50mmol/L,pH=7.5),叠氮钠稳定剂<0.1%,定值范围:(70~130)mg/dl。
2.1 外观:无色至浅黄色澄清液体;标签内容清晰。
2.2 装量:液体试剂的净含量不得低于标示体积。
2.3 溯源性:根据GB/T 21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至脂蛋白a纯品(SunnyLab,纯度≥95%)。
2.4 准确度
用校准品配合试剂检测纯品(SunnyLab),回收率应在85%~115%之间。
2.5 重复性:CV<5%。
2.6 稳定性
2.6.1 效期稳定性:校准品在(2~8)℃条件下保存有效期为18个月。
在效期满后进行检测,其外观、准确度、重复性应符合2.1、2.4、2.5的要求。
2.6.2 开瓶稳定性:校准品第一次开瓶后,在(2~8)℃避免污染,盖紧瓶塞保存14天。
在第15天检测,其外观、准确度、重复性符合2.1、2.4、2.5的要求。
特种蛋白八项校准品产品技术要求zhongshengbeikong

特种蛋白八项校准品适用范围:该产品与本公司相应的免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)、转铁蛋白(TF)、结合珠蛋白(HP)、α1-酸性糖蛋白(AAG)项目试剂盒配套使用,用于临床检验实验室相应项目定量检测的系统校准。
1.1规格液体型1mL×6(6个浓度)1.2规格划分说明根据净含量划分规格。
1.3主要组成成分本产品以人血清为基质,添加了生物源性物质。
主要成分为:IgA抗原含量① 0.00g/L ② 0.40g/L~1.40g/L ③ 1.50g/L~2.70g/L④ 2.80g/L~4.00g/L ⑤ 4.10g/L~5.90g/L ⑥ 6.00g/L~8.50g/L;IgG抗原含量① 0.00g/L ② 4.20g/L~8.70g/L ③ 9.00g/L~17.00g/L④ 17.10g/L~25.70g/L ⑤ 25.80g/L~36.40g/L ⑥ 36.50g/L~50.00g/L;IgM抗原含量① 0.00g/L ② 0.20g/L~0.70g/L ③ 0.75g/L~1.25g/L④ 1.30g/L~2.00g/L ⑤ 2.05g/L~2.75g/L ⑥ 2.80g/L~5.00g/L;C3抗原含量① 0.00g/L ② 0.20g/L~0.80g/L ③ 0.82g/L~1.42g/L④ 1.45g/L~2.15g/L ⑤ 2.18g/L~3.08g/L ⑥ 3.10g/L~4.00g/L;C4抗原含量① 0.00g/L ② 0.04g/L~0.14g/L ③ 0.15g/L~0.26g/L④ 0.27g/L~0.39g/L ⑤ 0.40g/L~0.56g/L ⑥ 0.57g/L~0.80g/L;TF抗原含量① 0.00g/L ② 0.35g/L~1.22g/L ③ 1.24g/L~2.15g/L④ 2.20g/L~3.25g/L ⑤ 3.30g/L~4.60g/L ⑥ 4.65g/L~6.00g/L;HP抗原含量① 0.00g/L ② 0.16g/L~0.60g/L ③ 0.62g/L~1.05g/L④ 1.10g/L~1.60g/L ⑤ 1.65g/L~2.30g/L ⑥ 2.32g/L~3.00g/L;AAG抗原含量① 0.00g/L ② 0.12g/L~0.45g/L ③ 0.46g/L~0.81g/L④ 0.83g/L~1.23g/L ⑤ 1.26g/L~1.70g/L ⑥ 1.75g/L~2.50g/L。
生化多项低值质控品产品技术要求北京世纪沃德生物科技

生化多项低值质控品适用范围:本产品包含项目与本公司生产的试剂盒配套使用,用于50个项目的室内质量控制。
本产品所含项目为:白蛋白、总蛋白、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶、α-淀粉酶、胰淀粉酶、γ-谷氨酰基转移酶、亮氨酸氨基肽酶、乳酸脱氢酶、α-羟丁酸脱氢酶、肌酸激酶、胆碱酯酶、脂肪酶、腺苷脱氨酶、天门冬氨酸氨基转移酶线粒体同工酶、乳酸脱氢酶同工酶1、甘氨酰脯氨酸二肽氨基肽酶、乳酸、总胆汁酸、总胆红素、直接胆红素、胆固醇、甘油三酯、肌酐、尿素、尿酸、葡萄糖、二氧化碳、钙、铁、镁、锌、无机磷、D-3羟丁酸、唾液酸、同型半胱氨酸、磷脂、游离脂肪酸、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肌酸激酶MB同工酶、单胺氧化酶、胰岛素、心脏型脂肪酸结合蛋白、中性粒细胞明胶酶相关脂质运载蛋白、胱抑素C。
1.1包装规格5.0mL×1;5.0mL×6;5.0mL×10;5.0mL×20。
1.2 主要组成成分以人血清为基质的冻干型质控品,约含20mmol/L磷酸盐缓冲液、0.03%防腐剂、5%保护剂、0.15mol/L氯化钠。
具体信息见表1:表1组成及范围质控品质控范围批特异,详见质控品靶值单。
2.1 外观人血清基质质控品,白色至黄色冻干粉,复溶后为无色至黄色澄清液体,目测不得有沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2水分含量水分含量应≤5.0% 。
2.3可接受区间/值检测结果应在各项目质控范围内。
2.4均匀性2.4.1瓶内均匀性)应≤10%。
各项目赋值结果的瓶内变异系数(CV瓶内2.4.2瓶间均匀性各项目赋值结果的瓶间变异系数(CV)应≤10%。
瓶间2.5 稳定性2.5.1效期稳定性原包装质控品在2℃~8℃避光保存,有效期为24个月,稳定期内赋值结果的变化趋势不显著。
2.5.2复溶稳定性游离脂肪酸、单胺氧化酶、中性粒细胞明胶酶相关脂质运载蛋白复溶后质控品在2℃~8℃密封保存24小时,天门冬氨酸氨基转移酶线粒体同工酶、乳酸脱氢酶同工酶1复溶后质控品在2℃~8℃密封保存72小时,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、葡萄糖复溶后质控品在2℃~8℃密封保存5天,α-羟丁酸脱氢酶、腺苷脱氨酶、心脏型脂肪酸结合蛋白复溶后质控品在2℃~8℃密封保存6天,白蛋白、总蛋白、碱性磷酸酶、α-淀粉酶、胰淀粉酶、γ-谷氨酰基转移酶、亮氨酸氨基肽酶、乳酸脱氢酶、肌酸激酶、胆碱酯酶、脂肪酶、甘氨酰脯氨酸二肽氨基肽酶、乳酸、总胆汁酸、总胆红素、直接胆红素、胆固醇、甘油三酯、肌酐、尿素、尿酸、二氧化碳、钙、铁、镁、锌、无机磷、D-3羟丁酸、唾液酸、同型半胱氨酸、磷脂、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肌酸激酶MB同工酶、胰岛素、胱抑素C复溶后质控品在2℃~8℃密封保存7天,稳定期内赋值结果的变化趋势不显著。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
心型脂肪酸结合蛋白校准品
适用范围:本产品与本公司生产的心型脂肪酸结合蛋白测定试剂盒配套使用,用
于临床检验实验室心型脂肪酸结合蛋白项目定量检测的系统校准。
1.1规格
冻干粉型: 1mL×6(6个浓度)
1.2主要组成成分
本产品由以19 mmol/L,pH7.2的三羟甲基氨基甲烷盐酸盐缓冲液为基质,
并添加了心型脂肪酸结合蛋白(重组人源)及2%牛血清白蛋白的冻干粉组成。
校准品定值范围:浓度①: 0.00~0.50 ng/mL;浓度②:0.51~8.00ng/mL;浓
度③:8.01~20.00ng/mL;浓度④:20.01~40.00ng/mL;浓度⑤: 40.01~80.00
ng/mL;浓度⑥: 80.01 ~120.00ng/mL(每批定值,详见值单)。
2.1 外观
本校准品应为浅黄色冻干粉,复溶后应为浅黄色透明溶液,无混浊,无未
溶解物。
2.2 准确度
中生试剂和已上市同类试剂分别测定40个在测定范围内不同浓度的样
本,计算两组数据的相关系数(r)及测值的偏差,要求r≥0.975;
在[2.5,20]ng/mL范围内,绝对偏差应不超过±2.0ng/mL;
在(20,120]ng/mL范围内,相对偏差应不超过±10%。
2.3瓶间差
瓶间差的变异系数(CV)应≤5%。
2.4含水量
含水量应≤5%。
2.5稳定性
2.5.1效期稳定性
原包装校准品在2℃~8℃条件下贮存,有效期为12个月。在有效期满后
3个月内,校准品性能应符合2.1、2.2、2.3的要求。
2.5.2复溶稳定性
复溶后校准品在2℃~8℃条件下密闭避光保存,稳定期为7天。在稳定
期满后1天内,校准品性能应符合2.1、2.2、2.3要求。
2.6 溯源性
校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程, 本
校准品溯源至工作校准品并经与已上市产品比对赋值。
附录A心型脂肪酸结合蛋白校准品溯源说明
1 校准品溯源情况
本公司生产的心型脂肪酸结合蛋白校准品采用同类产品比对赋值。
2 溯源过程
2.1工作校准品赋值
2.1.1赋值系统选择
为了保证赋值系统与研究试剂盒的一致性,在系统的选择上要满足:(1)
检测原理及方法相似;(2)测值具有可比性或权威性。具体要求如下:
2.1.1.1 检测原理及方法:本公司试剂盒采用的胶乳免疫比浊法,主要成份为羊
抗人H-FABP抗体包被胶乳颗粒,人血清样本中的H-FABP与试剂中适量的特异性
抗体结合,形成不溶性的免疫复合物,使反应液吸光度改变,在抗体量一定的条
件下,吸光度的改变与人血清样本中的H-FABP浓度成正相关,进行市场产品调
研后,Randox公司的H-FABP试剂盒检测原理及检测方法与本公司产品接近。
2.1.1.2 Randox公司的H-FABP试剂盒是国际上第一个上市销售的检测H-FABP
的产品,并且通过CE认证,测值具有权威性,所以选定该产品为本公司校准品
赋值系统。
2.1.2初赋值
采用Randox公司的 H-FABP试剂盒及其校准品、全自动生化分析仪作为
赋值系统,测定中生H-FABP工作校准品,取其测定均值作为初赋值。
2.1.3调值
在全自动生化分析仪上,参考《EP9-A2: 用患者样本进行方法对比及偏
差评估》的实验方法,采用中生 H-FABP试剂盒和中生 H-FABP工作校准品(初
赋值),与Randox公司的 H-FABP试剂盒及配套校准品同时测定一组临床血清
样品,进行对比相关性试验,根据得到的相关方程,调整中生 H-FABP工作校准
品的值。使其校准中生H-FABP试剂盒后,测定上述血清样品,测值与赋值系统
的相关系数不小于0.975,在[2.5,20]ng/mL范围内,绝对偏差应不超过±
2.0ng/mL;在(20,120]ng/mL范围内,相对偏差应不超过±10%。
2.1.4赋值有效性验证
在全自动生化分析仪上,采用中生H-FABP试剂盒和中生H-FABP工作校准
品(调值后),与Randox公司的H-FABP试剂盒及配套校准品同时测定一组临床
血清样品,进行对比相关性试验,相关系数应不小于0.975,在[2.5,20]ng/mL
范围内,绝对偏差应不超过±2.0ng/mL;在(20,120]ng/mL范围内,相对偏
差应不超过±10%,则认为 H-FABP工作校准品赋值有效。
2.2 校准品赋值
2.2.1初赋值
采用中生H-FABP试剂盒、工作校准品、全自动生化分析仪作为赋值系统,
对中生H-FABP校准品进行初赋值。
2.2.2调值
在全自动生化分析仪上,采用中生H-FABP试剂盒和中生H-FABP校准品(初
赋值),与中生H-FABP试剂盒及工作校准品测定一组临床血清样品,进行对比
相关性试验,根据得到的相关方程,调整中生H-FABP校准品的值。
2.2.3赋值有效性验证
在全自动生化分析仪上,采用中生H-FABP试剂盒和中生H-FABP校准品(调
值后),与中生H-FABP试剂盒及工作校准品测定一组临床血清样品,进行对比
相关性试验,相关系数应不小于0.98,在[2.5,20]ng/mL范围内,绝对偏差
应不超过±2.0ng/mL;在(20,120]ng/mL范围内,相对偏差应不超过±8%,
则认为H-FABP校准品赋值有效。
2.2.4赋值后验证
在全自动生化分析仪上,采用本公司H-FABP测定试剂盒和已赋值的
H-FABP校准品,进行试剂盒准确度实验,应符合准确度指标要求。
3 校准品原料说明
本校准品中主要原料为H-FABP抗原,其来源为大肠杆菌表达的人
H-FABP-3,纯度不低于98%。
4 溯源图
