(完整word版)单质氧化物酸碱盐的相互转化关系
单质、氧化物、酸、碱、盐之间的转化关系

影响电解质溶液导电能力的主要因素 : 单位体积溶液中离子数目的多少和离子所带电荷数 的多少。
物质的分类:
强电解质 混合物 物质 纯净物 化合物 弱电解质 单质 电解质
强酸:HCl、HNO3、 H2SO4等
强碱:KOH、NaOH、 Ca(OH)2、Ba(OH)2等 多数盐: NaNO3、 NaCl、BaSO4等 弱酸: CH3COOH 、 H3PO4 、H2CO3等 弱碱:NH3•H2O等 水 非电解质:CO2、SO2、NH3、蔗糖、酒精
单质、氧化物、酸、碱、盐之间的转化关系
实验现象 盐 酸 灯 很 亮 灯 稍 暗 灯
Hale Waihona Puke 原因分析NaOH溶液 NaCl溶液 醋酸溶液 氨 水
泡
亮 了
全部 电离
部分 电离
溶液 中存 在自 由移 动的 离子
在相同条件下(同温同浓度)
在溶液的体积、浓度以及溶液中阴(或阳)离子所带的电荷数 都相同的情况下,导电能力强的溶液里能够自由移动的离子数目 一定比导电能力弱的溶液里能够自由移动的离子数目多。 灯泡亮暗←溶液的导电性不同←单位体积溶液里自由移动的 离子的数目不同(在溶液的体积、浓度以及溶液中阴(或阳) 离子所带的电荷数都相同的情况下)←电解质电离程度不同 ←电解质有强弱之分←电解质物质的结构不同
四单质、氧化物、酸、碱、盐的相互关系

四单质、氧化物、酸、碱、盐的相互关系.txt爱情是彩色气球,无论颜色如何严厉,经不起针尖轻轻一刺。
一流的爱人,既能让女人爱一辈子,又能一辈子爱一个女人!四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl。
酸碱盐物质转化关系图
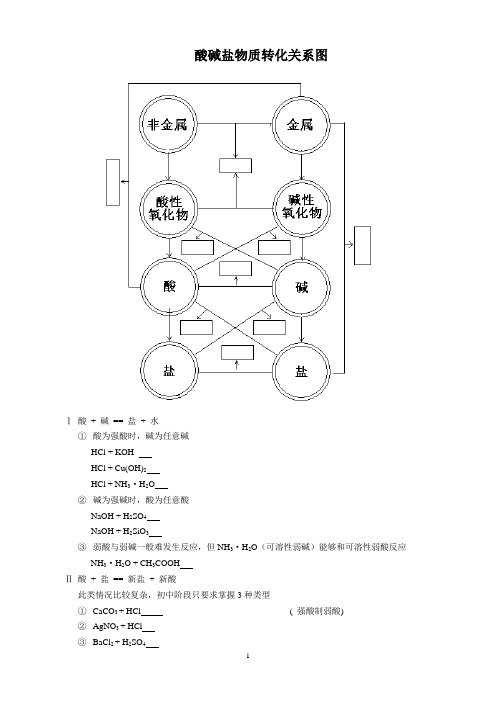
酸碱盐物质转化关系图
Ⅰ酸+ 碱== 盐+ 水
①酸为强酸时,碱为任意碱
HCl + KOH
HCl + Cu(OH)2
HCl + NH3·H2O
②碱为强碱时,酸为任意酸
NaOH + H2SO4
NaOH + H2SiO3
③弱酸与弱碱一般难发生反应,但NH3·H2O(可溶性弱碱)能够和可溶性弱酸反应
NH3·H2O + CH3COOH
Ⅱ酸+ 盐== 新盐+ 新酸
此类情况比较复杂,初中阶段只要求掌握3种类型
①CaCO3 + HCl ( 强酸制弱酸)
②AgNO3 + HCl
③BaCl2 + H2SO4
Ⅲ碱+ 盐== 新盐+ 新碱
反应条件:反应物均能溶于水,产物应有沉淀或气体生成
①NaOH + CuSO4
②NaOH + NH4Cl
Ⅳ盐+ 盐== 新盐+ 新盐
反应条件:反应物均能溶于水,产物至少有一种沉淀
①AgNO3 + NaCl
②BaCl2 + CuSO4
酸、碱、盐、氧化物、单质之间的转化关系
例:用七种方法制取MgCl2
Ⅰ.Mg + Cl2 ==== MgCl2①
Ⅱ.MgO + HCl ==== MgCl2 + H2O ②
Ⅲ.Mg(OH)2 +2HCl ==== MgCl2 +2H2O ④
Ⅳ.MgCO3+2HCl === MgCl2 +H2O+CO2↑⑥
Ⅴ.MgSO4 + BaCl2 === MgCl2 + BaSO4↓⑦
Ⅵ.Mg + CuCl2 ==== MgCl2 + Cu ⑧
Ⅶ.Mg + 2HCl ==== MgCl2 + H2↑⑨。
单质氧化物酸碱盐之间的相互关系.ppt

C.稀硫酸 D.二氧化碳
(2011.咸宁市)现有氧化铁、稀硫酸、氢 氧化钠溶液、氯化钡溶液和碳酸钾溶液五 种物质,在常温下它们两两相互发生的化 学反应有 ( )
A.4个 B.5个 C.6个 D.7个
(2012·德阳)下列各组物质在溶液中能 大量共存且形成无色溶液的是 ( ) A.NaCl 、 BaCl2 、 Na2CO3 B.KNO3 、 HCl 、 CaCl2 C.H2SO4 、 FeCl3 、 NaNO3 D.NaOH 、 HNO3、 NH4NO3
(2)复分解反应中的“换”与置换反应 中的“换”含义不同。前者是两种化合物 成分的互换(AB+CD=AD+CB),后者 是单质的元素“取代”化合物中的某一元 素(A+BC=B+AC)。
(3)复分解反应通常发生在:酸+金属氧 化物;酸+碱;酸+盐;碱+盐;盐+盐反应 中。中和反应是酸和碱作用生成盐和水的反应, 显然,中和反应属于复分解反应。
实验内容实验ຫໍສະໝຸດ 象①+②有白色沉淀生成
②+④
有白色沉淀生成
①+③
有气泡冒出
(2011.桂林市)下列物质之间的转化能 够实现的是 ( )
(2009.广州)我国古代纺织常用氢氧
化钾作漂洗的洗涤剂。生产方法是将生
石灰与水、草木灰(主要成分是碳酸钾)
按一定比例混合,经搅拌、过滤等一系
列工序制得氢氧化钾。写出有关反应的
(4)复分解反应中各元素的化合价 反应前后均不变。
(5)理解复分解反应考虑问题要全面。即 从反应物、生成物、反应发生的途径三个方面 去判断。如:2NaOH+CO2=Na2CO3+H2O,此 反应尽管反应物、生成物都是两种化合物,但 生成的两种化合物并不是反应物相互交换成分 的结果,所以该反应不是复分解反应。
酸、碱、盐、氧化物的概念及转化关系

酸、碱、盐、氧化物的概念及转化关系
【答案】 (1)②H2SO4(或HNO3) ③NaOH(或KOH) ⑥ Na2SO4(或K2CO3或Na2SO3或NaNO3或NH4NO3) (2)2NaOH+CO2===Na2CO3+H2O (3)稀盐酸 大理石(或石灰石) 将气体通入澄清 石灰水中,若变浑浊,即可证明是CO2
常见的酸有 H2SO4、HNO3、HCl;碱有 NaOH、 KOH、Ba(OH)2、Ca(OH)2;盐有 NaCl、Na2SO4、Na2CO3、 NaNO3、Na2SO3、NH4NO3 等。酸、碱、盐、氧化物之 间可以相互转化,如:C O 2(少量)+2Na O H ===Na 2C O 3 +H2O。实验室制备 O2 常利用 H2O2 在催化剂作用下的 分解反应 2H2O2=M=n=O==22H2O+O2↑,制备 CO2 常利用
二、酸的分类
H2SO4
含氧酸
HCl
无氧酸
HNO3 H2CO3
一元酸 二元酸
酸、碱、盐、氧化物的概念及转化关系
三、盐的分类
Na2SO4 KHSO4
NaCl NaHCO3
含氧酸盐 无氧酸盐
钠盐 酸式盐
酸、碱、盐、氧化物的概念及转化关系 四、酸、碱、盐、氧化物之间的转化关系
酸、碱、盐、氧化物的概念及转化关系 四、典型例题
酸、碱、盐、氧化物的概念及转化关系
物质 类别
化学 式
酸
①HCl ②____
碱
③______ ④Ba(OH)2
单质 氧化物 酸 碱 盐之间的相互关系

单质氧化物酸碱盐之间的相互关系
1.纵向(2条):表示了各类物质之间相互转化(衍生)的关系
例1:Na →Na2O →NaOH →NaCl
例2:C →CO2→H2CO3→CaCO3
例3:Cu →CuO →Cu(OH)2→CuSO4
横向(10条):表示了各类物质之间相互反应的关系
㈠金属+ 非金属→盐(无氧盐)㈡碱性氧化物+ 酸性氧化物→盐(含氧盐)
㈢碱性氧化物+ 酸→盐+ 水
㈣酸性氧化物+ 碱→盐+ 水
㈤碱+ 酸→盐+ 水
㈥碱+ 盐→碱+ 盐
㈦酸+ 盐→酸+ 盐
㈧盐+ 盐→盐+ 盐
㈨金属+ 盐→金属+ 盐
㈩金属+ 酸→盐+ 氢气
3、表示了各类物质的主要化学性质
碱性氧化物的主要化学性质有3条
酸性氧化物的主要化学性质有3 条
碱的主要化学性质3条
酸的主要化学性质4条
盐的主要化学性质4条
4、表示了各类物质的可能制法
如:从图看盐有十种可能的制法
练习:
写出制取ZnSO4的所有可能制法,用化学方程式表示
写出制取MgCl2的所有可能制法,用化学方程式表示。
单质氧化物酸碱盐的关系
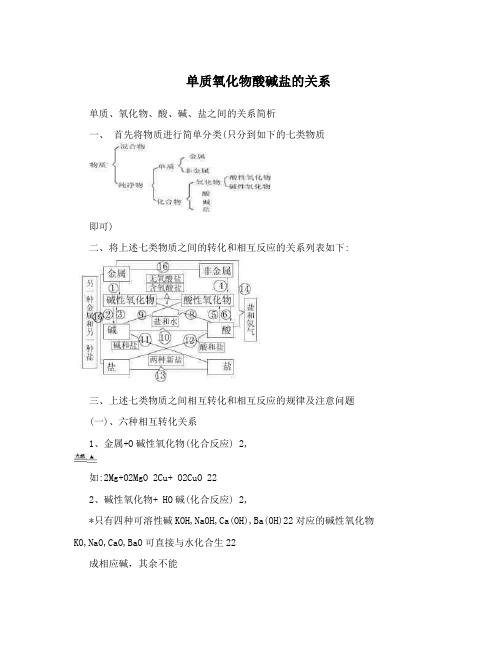
单质氧化物酸碱盐的关系单质、氧化物、酸、碱、盐之间的关系简析一、首先将物质进行简单分类(只分到如下的七类物质即可)二、将上述七类物质之间的转化和相互反应的关系列表如下:三、上述七类物质之间相互转化和相互反应的规律及注意问题(一)、六种相互转化关系1、金属+O碱性氧化物(化合反应) 2,如:2Mg+O2MgO 2Cu+ O2CuO 222、碱性氧化物+ HO碱(化合反应) 2,*只有四种可溶性碱KOH,NaOH,Ca(OH),Ba(OH)22对应的碱性氧化物KO,NaO,CaO,BaO可直接与水化合生22成相应碱,其余不能如:NaO+HO==2NaOH CaO+HO==Ca(OH) 2222故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)是微溶碱外,其余都易溶。
23、碱碱性氧化物+水(分解反应) ,a、不溶性碱受热才能发生分解反应((((b、反应前后元素的化合价不变(特别注意金属元素的化合价)如:2Fe(OH)FeO+ HO 3232Cu(OH)CuO+HO 224、非金属+O酸性氧化物(化合反应) 2,如:C+ O COS+OSO22 225、酸性氧化物+HO酸(含氧酸)(化合反应) 2,* a除SiO外,其余酸性氧化物一般都能直接与水2化合生成相应酸b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)如:CO+ HO==HCO SO+ HO== HSO 22 233224故:酸性氧化物溶于水时得到的都是相应酸的溶液。
6、酸酸性氧化物+水(分解反应) ,* a、仅有含氧酸才能分解b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)如:HSO HO+ SO?HCO HO+ CO? 2423 2322写出下列几种含氧酸的酸酐:HSOHNO_____ HPO_____ HSO____ 24______ 33423(二)十个相互反应的关系(关系表中有四个横向、四个交叉、两个远距离关系,共十个)7、碱性氧化物+酸性氧化物含氧酸盐(化合反应) ,如:CaO+ CO== CaCOCaO+SiO==CaSiO 23 238、碱性氧化物+酸盐+水(复分解反应) ,如:CuO+ 2HCl==CuCl+ HO FeO+3 2223HSO==Fe(SO)+3HO 2424329、酸性氧化物+碱盐+水(不是基本反应类型) ,* a、参加反应的碱必须可溶b、注意生成的盐的化学式的书写如:CO+ Ca(OH)== CaCO?+HO 2232SO+2NaOH==NaSO+HO 2232SiO+2NaOH==NaSiO+HO 2232SO+2NaOH== NaSO+ 2HO 3242,10、碱+酸盐+水(复分解反应)*酸跟碱作用生成盐和水的反应叫______反应。
高中化学方程式单质、氧化物、酸、碱、盐之间的关系

高中化学方程式单质、氧化物、酸、碱、盐之间的关系高中化学方程式单质、氧化物、酸、碱、盐之间的关系高中化学方程式单质、氧化物、酸、碱、盐的关系整理了高中化学方程式大全,将化学方程式分类汇总,内容有:化学方程式反应现象总结、酸碱盐的化学方程式、氧化还原反应方程式、分解反应方程式、物质与氧气的反应方程式、离子反应方程式和置换反应方程式等。
单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑ 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑ 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑ 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑ 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg 1 2 3 4 下一页尾页化学平衡中的思想方法之二──极限思维主要思想:按方程式的系数极限的转化为反应物或生成物(即一边倒),特别注意极值是否可取一、解决取值范围的问题例1.一定条件下,在反应2SO2 (g) +O2(g) 2SO3(g)平衡体系中:n(SO2) =2.0 mol/L, n(O2) = 0.8 mol/L,n(SO3)=2.4 mol/L ,则SO2 的起始浓度的范围为( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单质、氧化物、酸、碱、盐的相互转化关系
一、金属
1、金属+氧气→金属氧化物:
例如:2Mg + O2===2MgO 2Cu + O2===2CuO
2、金属+酸→盐+H2 :
酸一般指盐酸、稀硫酸,金属指金属活动顺序中H以前的金属
例:Fe + H2SO4 == Fe SO4 + H2 Zn + 2HCl ===ZnCl2 + H2
3、金属+盐→另一种金属+另一种盐
盐必须是可溶于水的,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼
例如:Fe + Cu SO4 ==== Cu + Fe SO4Cu + 2AgNO3 ==== 2Ag + Cu
二、非金属
1、非金属单质+O2→非金属氧化物例如:2H2 + O2 ===2H2O
2、非金属单质+金属氧化物→金属+非金属氧化物
非金属单质指:碳和氢气,金属氧化物一般指CuO 、Fe2O3
例如C + 2CuO===2Cu + CO2
三、金属氧化物
1、金属氧化物+水→碱
金属氧化物指Na2O、K2O、CaO、BaO
例如:CaO + H2O===Ca( OH)2 Na2O+ H2O==2NaOH
2、金属氧化物+酸→盐+水例如:Fe2O3 + 6HCl===2FeCl3 + 3 H2O
3、金属氧化物(Fe2O3、CuO)和CO、H2、C的反应
例如:3CO + Fe2O3===2Fe + 3CO2
四、非金属氧化物:
1、非金属氧化物+水→酸
非金属氧化物指CO2、SO2、SO3
例:CO2+ H2O == H2 CO3SO2 + H2O=== H2 SO3
2、非金属氧化物+可溶性碱→盐+水非金属氧化物指CO2、SO2、SO3
例如:CO2 + Ca( OH)2 ===CaCO3 + H2O SO2 +2NaOH=== Na2SO3 + H2O
五、酸
1、酸+金属→盐+H2
酸一般指盐酸、稀硫酸,金属指金属活动性顺序中H以前的金属
例如:Mg + H2SO4 == MgSO4 + H22Al + 6HCl===2AlCl3 + 3 H2
2、酸+金属氧化物→盐+水
例如:CuO + H2SO4 == CuSO4 + H2O 3、酸+碱→盐+水例如:NaOH + HCl ===NaCl + H2O
4、酸+盐→另一种酸+另一种盐生成物中要有沉淀或气体和水
例如:CaCO3 + 2HCl===CaCl2 +H2O + CO2HCl+AgNO3====AgCl + HNO3 H2SO4 + BaCl2 ===BaSO4 + 2HCl
六、碱
可溶性碱有NaOH、KOH、Ca(OH)2 、Ba(OH)2、
不溶性碱Cu(OH)2蓝色固体Fe(OH)3红褐色固体
1、可溶性碱+非金属氧化物→盐+水非金属氧化物指CO
2、SO2、SO3
例如:CO2 + 2NaOH====Na2CO3 + H2O
2、碱+酸→盐+水
例如:Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
3、可溶性碱+可溶性盐→另一种碱+另一种盐
要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀
例如:Ca(OH)2 + Na2CO3 == CaCO3 + 2 Na OH
七、盐
1、盐+金属→另一种盐+另一种金属
盐须是可溶于水,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼2Al + 3CuSO4 ==3Cu + Al2 (SO4)3
2、盐+酸→另一种盐+另一种酸生成物中要有沉淀或气体和水
例如:Na2CO3 + 2HCl===2NaCl + CO2 + H2O
3、可溶性碱+可溶性盐→另一种碱+另一种盐
要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀
例如:CuSO4 +2 Na OH==== Na2 SO4 + Cu(OH)2
4、盐+盐→新盐1+新盐2、
要求:反应的盐都必须溶于水,生成物中至少一种是沉淀
例如:Na2CO3 + CaCl2 ==== CaCO3 + 2NaCl
练习:用六种不同的方法制取MgCl2
Mg + HCl===
MgO + HCl===
Mg(OH)2 + HCl===
Mg CO3+ HCl===
MgSO4 + BaCl2===
Mg + CuCl2===。
